乳腺癌组织中STING和CD68的表达及其临床意义
刘弘飞,胡金龙,彭俊斌,胡知齐
(1.蚌埠医科大学 研究生院,安徽 蚌埠233030;2.安徽省第二人民医院 普外科,安徽 合肥230041)
最新WHO全球癌症流行病学调查研究显示[1],乳腺癌已取代肺癌成为全球最高发的癌症,并且是导致女性病人癌症因素死亡人数最多的恶性肿瘤,需引起临床医生的高度重视。肿瘤微环境(TME)与乳腺癌发生、发展密切相关,其中,肿瘤相关巨噬细胞(TAMs)浸润是乳腺癌免疫微环境改变的重要组成部分,白细胞分化抗原分子68(CD68)被认为是TAMs活化、浸润的主要标志物之一,研究乳腺癌TAMs浸润情况及可能的调控手段,对于乳腺癌诊断和治疗具有积极意义[2]。干扰素基因刺激因子(STING)是cGAS-STING信号通路的核心调节分子,近年来,关于其在恶性肿瘤免疫微环境中发挥调节作用的相关研究报道越来越多,其表达与泛肿瘤预后及免疫治疗响应性密切相关[3]。因此,STING信号通路能够逐渐成为研发TME免疫调节剂的热门靶点[4]。目前,关于cGAS-STING信号通路是否参与调控乳腺癌TAMs浸润鲜有文献报道。因此,我们通过免疫组织化学(IHC)检测乳腺癌及其癌旁组织中cGAS-STING信号通路关键蛋白STING和TAMs主要标志物CD68的表达,分析这两种蛋白的表达与病人临床病理参数之间的关系,结合癌症基因组图谱(TCGA)数据库进行分析,探讨STING与CD68表达、巨噬细胞浸润相关性,为临床诊疗提供参考。现作报道。
1 材料与方法
1.1材料
本研究用于IHC实验的主要试剂包括:无水乙醇、二甲苯、包埋石蜡、中性树脂,均购自中国国药集团;苏木素购自美国Sigma公司;anti-STING抗体、山羊抗兔二抗均购自美国CST公司;重组anti-CD68抗体购自英国Abcam公司。DAB辣根过氧化物酶显色试剂盒购自中国碧云天公司。
1.2方法
1.2.1 临床资料 收集2014年7月至2018年10月在安徽省第二人民医院普通外科住院接受乳腺癌改良根治术的乳腺癌病人的临床资料。纳入标准:经病理检查证实为乳腺癌者;能够获取完整的临床、病理、组织样本资料者。排除标准:资料不全者;合并其他恶性肿瘤者;术前行新辅助治疗者。经筛选,共入组83例,均为女性,年龄25~79岁,其中,参考NCCN 乳腺癌指南[5],肿瘤TNM分期:Ⅰ期5例,Ⅱ期64例,Ⅲ期14例;分子分型:LuminaA型26例,LuminaB型34例,人表皮生长因子受体-2(HER-2)阳性8例,三阴性乳腺癌(TNBC)15例。所有入组病人均签署知情同意书,本研究经医院伦理委员会批准。
1.2.2 IHC 采用SP法。常规进行包埋、脱蜡等工作并阻断过氧化物酶进行封闭;滴加经稀释的一抗(STING与CD68,稀释比例均为1∶1 000),后于4 ℃湿性环境中孵育过夜。PBS冲洗、吸干后滴加HRP标记的山羊抗兔二抗,37 ℃孵育20 min。再次PBS冲洗、吸干后滴加新鲜配制的DAB显色液。再进行复染、脱水、封片及拍照镜检。镜下见STING蛋白和CD68蛋白在乳腺癌组织中主要定位于细胞质,呈棕黄色颗粒。
1.2.3 IHC结果判定 IHC结果需综合着色深度和阳性细胞数比率来评价。着色深度评价标准如下:基本不着色,0分;黄色,1分;棕黄色,2分;棕褐色,3分。阳性细胞数比率评价标准如下:随机选取5个视野观察并记录阳性细胞数占总细胞数的比率,取其平均值,≤5%,0分;>5%~25%,1分;>25%~50%,2分;>50%~75%,3分;>75%,4分;着色深度分数×阳性细胞数比率为最终得分,≥1为阳性,<1为阴性。
1.2.4 随访资料 所有本组病人术后常规进行门诊随访,以病人术后出院日期为随访起始时间,截至本文投稿时间,随访2~5年不等。按STING表达水平进行分组,比较各组内生存指标差异。所关注生存指标为总生存期(OS),指从术后随访开始至因任何原因引起死亡的时间,对于失访者将最后一次随访时间计为死亡时间,按月计。
1.2.5 生物信息学分析 为进一步研究cGAS-STING信号通路与TAMs浸润的关系,进行生物信息学分析。首先,通过TCGA数据库(https://cancergenome.nih.gov/)下载BRCA临床数据和相应的基因组mRNA芯片表达谱数据。然后,采用LI等[6]在线数据处理系统 (https://cistrome.shinyapps.io/timer/)进行STING表达与巨噬细胞浸润相关性等数据分析。
1.3统计学方法
采用χ2检验、t检验和相关分析。
2 结果
2.1乳腺癌组织及癌旁组织中STING蛋白和CD68蛋白的表达情况
纳入本组研究的83例乳腺癌病人,其癌组织中STING蛋白阳性表达为20例(20/83,24.1%),癌旁组织中为33例(33/83,39.7%),2组间阳性表达率差异有统计学意义(χ2=4.68,P<0.05),癌组织低于癌旁组织。癌组织中CD68阳性表达为58例(58/83,69.8%),癌旁组织中为32例(32/83,38.5%),2组间阳性表达率差异有统计学意义(χ2=16.41,P<0.01),癌组织高于癌旁组织(见图1)。

2.2乳腺癌组织中STING蛋白和CD68蛋白表达与病人临床病理参数的关系
纳入本组研究的83例乳腺癌病人,其STING蛋白阳性表达与其HER-2阳性率、Lumina分型之间有相关性(P<0.05);与雌激素受体(ER)阳性率、孕激素受体(PR)阳性率、TNM分期、淋巴结转移之间无相关性(P>0.05)。CD68蛋白阳性表达情况与其Lumina分型、TNM分期、淋巴结转移呈现显著相关关系(P<0.05);与ER阳性率、PR阳性率、HER-2阳性率之间无相关性(P>0.05)(见表1)。

表1 乳腺癌病人临床病理参数与STING、CD68蛋白阳性表达之间的关系(n)
2.3乳腺癌组织中STING蛋白和CD68蛋白表达情况的相关性分析
应用Kappa一致性检验对本组数据进行分析,其结果显示,本组研究资料中,STING蛋白与CD68蛋白的表达呈正相关关系(Kappa=0.241,P<0.01)。应用TIMER在线数据库针对TGCA数据库进行分析,STING蛋白与CD68蛋白的表达呈明显正相关关系(r=0.636,P<0.01)。
2.4STING蛋白表达与乳腺癌TME免疫细胞浸润及巨噬细胞标志物的关系
应用TIMER在线数据库针对TGCA数据库进行分析。STING表达与乳腺癌及其各亚型的免疫微环境中巨噬细胞、B细胞、CD4+T淋巴细胞、CD8+T淋巴细胞、树突状细胞浸润情况普遍具有正相关性,说明cGAS信号通路深度参与乳腺癌免疫微环境调控。其中,TGCA乳腺癌整体队列(1 095例)STING表达水平与巨噬细胞浸润呈正相关关系(P<0.01);各分子亚型中,LuminaA+B型乳腺癌病人,STING表达水平与巨噬细胞浸润呈正相关关系(P<0.05),TNBC病人STING表达水平与巨噬细胞浸润呈正相关关系(P<0.01),HER-2阳性病人STING表达水平与巨噬细胞浸润呈无明显相关性(P>0.05)(见表2)。

表2 STING蛋白表达与乳腺癌TME免疫细胞浸润间的相关系数(TIMER分析)
再进一步分析STING表达与乳腺癌中巨噬细胞亚型浸润的相关性,采用巨噬细胞标志物进行分类,TAMs以CD68、CCL2、IL10标识,M1型巨噬细胞以NOS2、IRF5、PTGS2标识、M2型巨噬细胞以CD163、VSIG4、MS4A4A标识,分别比较STING表达与各标志物的相关性。TGCA数据库整体乳腺癌队列,STING表达与各标志物呈正相关关系(P<0.05),LuminaA+B型乳腺癌病人,STING表达与各标志物呈正相关关系(P<0.05),TNBC病人、HER-2阳性病人,STING表达与各标志物无明显相关性(见表3)。
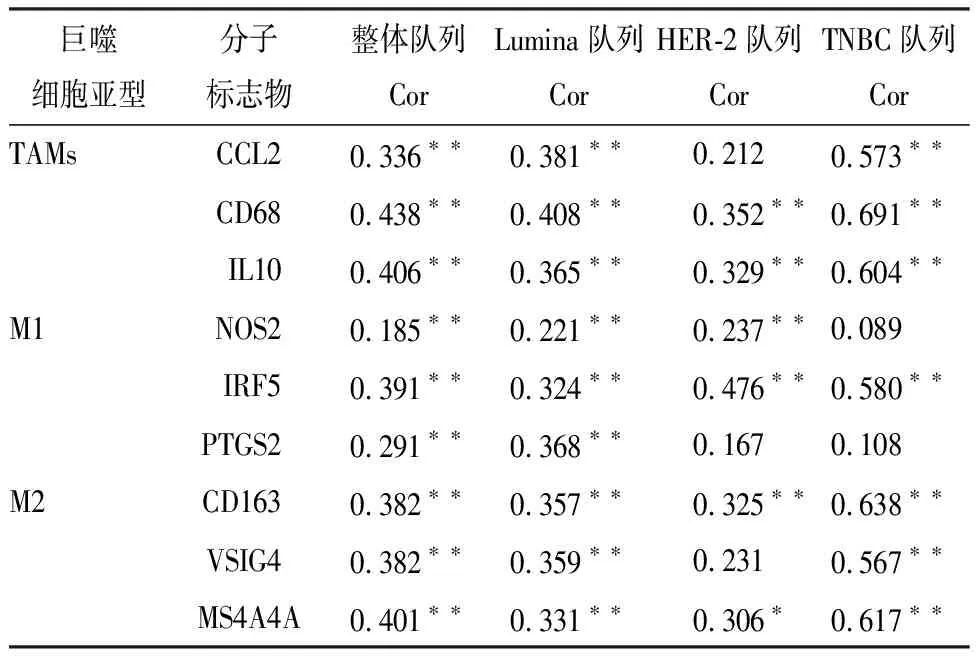
表3 STING蛋白表达与乳腺癌TME中各类巨噬细胞标志物的相关系数(r)
2.5病人随访情况
对83例乳腺癌病人术后进行密切随访,所有病人失访2例,存活53例,死亡28例,其中因乳腺癌死亡25例;复发46,未复发37例。全组病人中位OS为25.5个月,其中,STING高表达组中位OS为42个月(95%CI:34.263~49.458),STING低表达组中位OS为19个月(95%CI:17.614~23.683)。2组间差异有统计学意义(χ2=6.25,P<0.05)。
3 讨论
乳腺癌是女性最常见和最容易导致癌症相关死亡的恶性肿瘤之一[1],国内外临床诊疗指南对于乳腺癌病人进行TNM分期和分子分型有助于其整体治疗方案的选择和预后的判断[5,7]。但是在实际临床工作过程中却存在一定的局限性,特别是随着以免疫检查点抑制剂(ICIs)为代表的肿瘤免疫治疗的发现和兴起,为调节机体免疫功能正常化,能够更加准确地进行免疫微环境分类以及如何研发新的治疗方法提高免疫治疗效果将会是新的难题[8]。
TME与恶性肿瘤免疫分型及ICIs响应性密切相关,检测及评估TME有助于指导病人进行恶性肿瘤的精准治疗[9]。TAMs是TME重要的组成部分,一般以CD68为重要的标志物,其表达与乳腺癌等恶性肿瘤的进展及不良预后密切相关[10]。本研究中,乳腺癌病人癌组织中CD68阳性表达率高于癌旁组织,且其表达情况与病人的TNM分期、分子分型、淋巴结转移等临床指标相关,这与国内外相关研究结果基本一致,反映出TAMs作为乳腺癌病人预后评估指标及提高免疫治疗效果的干预指标的可行性。
TAMs在肿瘤组织内充当着“多面手”的角色,根据功能表型的不同,TAMs在肿瘤早期可分化为M1型发挥吞噬、识别肿瘤细胞的作用,肿瘤进展期也可分化为M2型分泌大量细胞因子,促进乳腺癌进展,帮助肿瘤细胞获得耐药性[11]。也有观点认为先天性免疫系统功能缺失,在肿瘤早期形成阶段,导致癌细胞基因突变累积及DNA受损修复机制的缺失,可能与TAMs早期浸润、识别相关[12]。而cGAS-STING作为经典的先天性免疫应答信号通路,被证实与肿瘤发生、发展有着密切的联系。其核心调节分子是存在于细胞质内的STING,在肿瘤细胞发生的早期,自身DNA损伤出现核泄漏时,发挥类似于“哨兵”的识别作用,并激活下游通路,产生Ⅰ型干扰素(INF-β),达到募集并激活免疫细胞、驱化多种催化因子表达的作用,进行免疫调节。多种肿瘤组织内STING蛋白处于低表达状态,可能与其参与免疫抑制及免疫逃逸相关[13]。
本研究中,乳腺癌组织中的STING蛋白阳性表达低于癌旁组织,其表达水平与病人整体预后密切相关,高表达STING的病人整体生存率显著高于低表达组,可能与STING发挥免疫识别作用有关。为了进一步分析STING信号通路对于免疫微环境的影响,课题组结合TGCA数据库进行生物信息分析,发现在乳腺癌中,STING表达水平与几乎各类免疫细胞浸润都有关系,是进行免疫微环境调控的理想靶点。并且,其表达水平与巨噬细胞浸润密切尤为相关,在不同分子表型的乳腺癌中STING的表达与巨噬细胞的浸润及分化呈现出明显的差异,在特定类型的乳腺癌,如TNBC、HER-2阳性乳腺癌组织中,STING蛋白水平表达甚至能够与TAMs是否发生M1/M2型极化密切相关。这些研究结果均反映出STING信号通路的活化可能深度参与肿瘤微环境中TAMs的浸润及极化。
STING激动剂的研发是免疫治疗领域研究的热点,多种核苷酸类药物和非核苷酸类药物被开发作为免疫治疗、增敏药物或免疫佐剂,能够发挥很好的抗肿瘤和协同抗肿瘤效果[4]。但是,目前关于STING激动剂是否能够通过调控TAMs浸润及M1/M2型巨噬细胞极化而发挥免疫调节作用鲜有报道。TAMs已经被证实与癌症进展,特别是早期TME改变密切相关[14],但其功能调控极其复杂,难以为免疫调节提供理想的靶点[15]。虽然cGAS-STING信号通路不是TAMs的专属调控通路,但本研究通过生物信息分析、IHC及临床病理分析,充分验证了STING信号通路参与TAMs调控的可能性,以期为后续STING激动剂应用于乳腺癌,特别是以TAMs为目标的,免疫微环境调控提供一定的理论和实践支持,相关干预试验工作有尝试研究的价值。
综上所述,本研究通过生物信息分析、IHC、临床病理分析等多种方法,研究了cGAS-STING信号通路可能参与肿瘤相关局势细胞的浸润及极化,STING蛋白及CD68蛋白的表达对于评价肿瘤免疫学分型及指导乳腺癌治疗和预后判断均具有一定的参考价值。但本研究样本量较小,为回顾性分析,证据等级较低,需要进行后续随机对照研究或大样本调查获得更高的临床证据支持。

