基于藻类生长潜力评估调水对藻类生长的影响
薛立阳,赵恕轲,胡俊杰,裴国凤,张 烨①
(1.中南民族大学生命科学学院,湖北 武汉 430074;2.山东省调水工程运行维护中心,山东 济南 250199)
中国人均水资源较为短缺,加上水资源分配不均,以及城市化进一步发展,工业和居民用水与日俱增[1],调水是解决水资源分配不均的有效方法。同时也有研究表明,调水能有效降低受水水体的氮磷等营养盐负荷,显著改善藻类聚集的现象,缓解水体富营养化状况[2]。但调水也引起了一系列生态问题,包括影响了河岸缓冲带的生物多样性[3],上游饮水渠道藻类大量增殖[4],发生突发性水污染[5]、河流水华[6]等问题。许多模型被用于评估调水的生态影响,MIKE3水动力模型与碳酸盐平衡的耦合被用于预测调水引起的pH值变化[7],环境流体动力学代码被用于评估调水过程中湍流对浮游植物生长的影响[8],流域模型 (HSPF)、水库模型(CE-QUAL-W2)和河流模型(EFDC)的集成建模系统在模拟调水对湿地水质的影响上得到运用[9]。受到模型数据输入的正确性和模型复杂度的影响[2],调水工程中环境因子的复杂动态变化使模型预测存在误差。浮游藻类是水生生态系统的重要初级生产者,生命周期较短,能够在短时间内对所处的环境变化做出快速响应[10],利用藻类生长情况对调水情况做出预测极具潜力。有研究通过模拟云南程海湖调水过程中的藻类生物量和群落结构成功评价了调水可行性[2]。也有研究利用藻类相关参数评价了调水对太湖水体的影响[11]。目前,针对调水对受水水体产生的影响还缺乏系统的研究,水生态评价指标体系尚不完善。
作为调水线路的重要组成部分,水库承载着饮水、防洪、灌溉多种重要功能[12],水库的水生态健康状况受到广泛关注。峡山水库是山东省内最大的水库,是胶东地区重要的水源地,承载着潍坊的供水任务。降水和地表径流是水体主要来源,水质复杂多变[13]。棘洪滩水库是山东省青岛市的饮用水供水水库,水质常年保持较优水准[14]。作为饮用水供水水库,其水质的变化成为关注的重点。目前尚无应用藻类生长潜力系统评估调水对受水水体生态系统影响的研究,而估算调水周期内供、受水水库水质的变化趋势,监测水体营养状况,有利于保障水库的生态安全。因此,笔者探讨了由峡山水库(供水水库)向棘洪滩水库(受水水库)调水过程中受水水库的理化因子和藻类群落结构变化,并开展藻类生长潜力试验,探究调水对受水水库浮游藻类密度和群落结构的影响,为受水水体生态系统的可持续化管理提供科学参考。
1 材料与方法
1.1 样品采集与理化因子测定
棘洪滩水库(120°20′~120°21′ N, 36°33′~36°39′ E)坝长14.2 m,设计库容量为1.46亿m3,年水位平均值维持在11.02~13.23 m之间。峡山水库(119°41′~119°46′ N, 36°31′~36°52′ E)的流域面积为4 210 km2,水库总库容14.5亿m3。2021年峡山水库在夏、秋和冬季向棘洪滩水库调水,调水量占比达到棘洪滩水库总库容的50%以上。笔者分别在2021年8月、10月、11月及12月于棘洪滩水库和峡山水库采集出水口水样5 L,每个样点重复采样2次。采用温度计、手持式pH仪(中国雷磁PHB-4)、电导率仪(中国雷磁DDB-303A)、溶氧仪(中国雷磁JPB-607)测定水体温度、pH值、电导率(EC)和溶解氧(DO)浓度。部分水样添加硫酸至pH值为1~2,常温保存,用于测定总氮(TN)、总磷(TP)、总可溶性氮(TDN)、总可溶性磷(TDP)、可溶性活性磷(SRP)和Ca2+浓度,实验方法参照文献[15]。
1.2 藻类生长潜力实验
由于每次调水的周期较长(约60~90 d),供、受水体的温度波动范围较宽,将不同季节的实验处理组设置为同一培养条件,具体实验方法[16]如下:分别在2021年8月、11月及12月于水库采集出水口水样,经100 μm孔径筛绢滤去大型浮游动物,将150 mL处理水样分别置于250 mL三角烧瓶中,并将峡山水库与棘洪滩水库水样按照体积比1∶9、3∶7和5∶5混合,分别作为10%、30%和50%处理组,未混合的峡山水库和棘洪滩水库水样作为对照组。所有处理组在(25±1) ℃的恒温光照培养箱中进行培养[17],[光]照度5 000 lx,光暗比14∶10,培养周期20 d,第1和20天为培养初期和末期。3 h人工摇动1次,每3 d取样1次,每个三角烧瓶取15 mL水样,以3 000 r·min-1离心(离心半径10 cm),浓缩体积至2 mL,将上清液返还至原三角烧瓶中。将底部藻液混匀,取0.1 mL藻液在光学显微镜下利用浮游藻类计数框进行计数和鉴定,剩余藻液返还至原三角烧瓶中。浮游藻类鉴定参考《中国淡水藻类:系统、分类及生态》[18],计数参考《淡水浮游生物研究方法》[19]。
1.3 数据处理和分析
采用Origin 2023和SPSS 25.0软件进行数据的统计与分析,采用one way-ANOVA方法对数据进行显著性分析,采用最小显著差异法(LSD)检验各组间的差异显著性。
2 结果
2.1 调水期间水库理化因子的变化
调水期间受水水库ρ(TN)和ρ(TP)均值分别为1.66和0.033 mg·L-1,低于供水水水库均值(4.28和0.078 mg·L-1)。受水水库ρ(TP)和ρ(TN)分别为0.026~0.041和1.33~2.10 mg·L-1(表1)。供水水库的ρ(TP)在0.034~0.100 mg·L-1之间波动,并在11月达峰值;ρ(TN)处于1.53~6.77 mg·L-1之间,于11月达峰值,至12月降至5.52 mg·L-1,但仍处于较高水平。调水结束时,受水水库TN、TP浓度恢复至调水前的水平。调水期间受水水库ρ(DO)由调水初期的7.4 mg·L-1最高升至9.4 mg·L-1;pH值持续下降,由8.28降至7.51;ρ(Ca2+)由22.3 mg·L-1不断上升至182 mg·L-1。

表1 调水期间供水和受水水库的理化因子
2.2 调水期间藻类细胞密度的变化
在夏季模拟实验中,供水和受水水体藻类原始密度相近,两者生长曲线无显著差异(P>0.05)(图1)。但出现混合处理组比对照组峰值提前的现象,由12提前至8 d。将对照组的实际藻类密度峰值按照混合比例计算,得到混合藻类密度理论估算峰值,与实际混合藻类密度峰值对比(图2),结果表明几种不同比例混合处理组的实际藻类密度均低于理论估算值(约10%)。

图1 不同季节实验组浮游藻类生长曲线
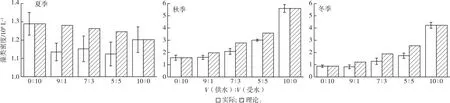
图2 不同季节实验组理论估算值与实际藻类密度峰值的差异
秋季供水和受水水库初始藻类密度分别为1.2×108和7.25×107L-1,供水水库的初始藻类密度高于受水水库(图1)。培养过程中,供水水体藻类密度峰值为5.6×108L-1,峰值时间出现于第16天。受水水体藻类密度峰值为1.57×108L-1,峰值时间出现于第8天。相对受水水体,对照组供水水体藻类密度峰值约为受水水体的3.5倍,且峰值时间出现延后现象。与夏季结果相似,混合处理组的实际藻类密度峰值比理论估算值低16%~24%(图2)。此外,处理组中混合比例为10%和30%的藻类密度峰值出现时间与受水水体的对照组相同,均为第8天,而处理组混合比例为50%的藻类密度峰值时间出现在第12天。
冬季供水水体初始藻类密度为2×107L-1,受水水体初始藻类密度为2.37×106L-1(图1)。相对夏秋两季,冬季水体藻类密度均有所下降。对照组的藻类密度峰值时间均出现在第16天并维持至第20天,供受水水体藻类密度峰值分别为4.22×108和8.8×107L-1,供水水体藻类密度峰值是受水水体的5倍左右。除10%处理组的藻类密度峰值时间与对照组相同外,其他处理组的藻类密度峰值均提前至第12天并维持至第20天。随着混合比例的增加,藻类密度峰值呈上升趋势。与夏秋季相似,混合组的实际混合藻类密度低于理论估算值(约为31%~32%),其下降比例高于秋季(图2),表明在调水周期内受水水体藻类密度受到供水水体藻类密度的影响,但实际藻类密度峰值均低于理论值,藻类生长受到一定程度的抑制。
2.3 调水期间藻类群落结构的变化
夏、秋和冬季供水和受水水体的浮游藻类均存在一些共同的主要优势种类,但不同季节的群落结构存在差异(表2)。
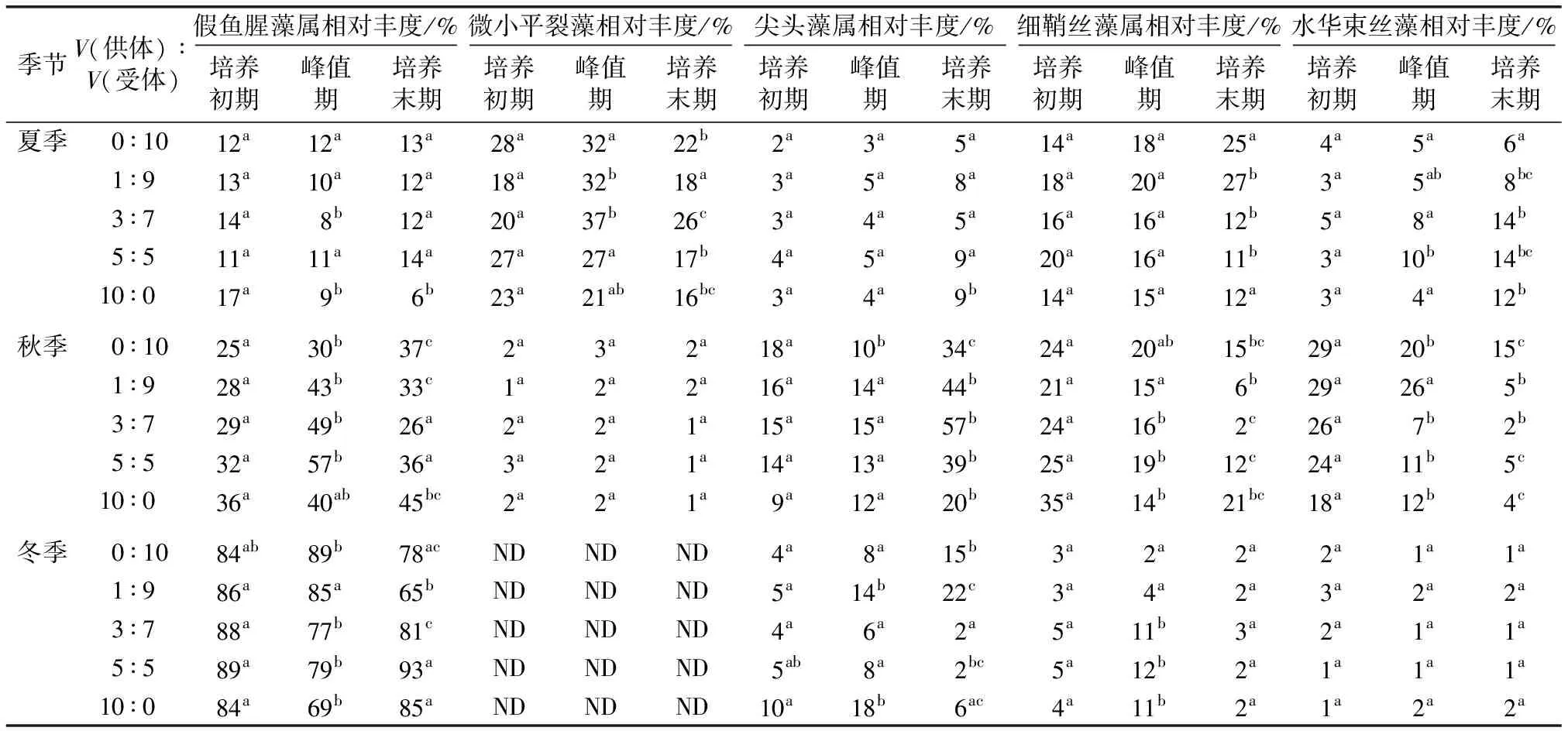
表2 不同季节实验组主要优势种类的相对丰度变化
供水水体夏季的微小平裂藻相对丰度最高,为23%;秋、冬季的假鱼腥藻属相对丰度最高,分别为40%和84%。受水水体中夏季微小平裂藻的相对丰度最高(27%),秋季水华束丝藻的相对丰度最高(29%),冬季假鱼腥藻属占绝对优势(84%)。假鱼腥藻属是受水和供水水体不同季节的共同优势类群,且随夏、秋、冬季的更替其相对丰度逐渐提高,由夏季的12%提高至秋季的25%,并在冬季最高达到84%。同一季节假鱼腥藻属在供水水体的相对丰度均高于受水水体。
夏季受水和供水水体对照组的藻类群落结构变化存在差异(表2)。受水水体对照组中相对丰度最高的优势藻种发生了变化,由微小平裂藻转变为细鞘丝藻属,而供水水体相对丰度最高的优势种始终为微小平裂藻。10%混合处理组的藻类群落结构变化与受水对照组相似,表现为由相对丰度最高的微小平裂藻转变为细鞘丝藻属,其他种类的相对丰度变化不大,而30%和50%混合处理组则与供水水体的对照组相似,微小平裂藻仍然是相对丰度最高的优势种,水华束丝藻的相对丰度逐渐增加,细鞘丝藻属逐渐下降。秋季受水水体对照组相对丰度最高的优势种由水华束丝藻转变为假鱼腥藻属,且尖头藻属的相对丰度由18%增加到培养末期的34%。供水水体对照组始终为假鱼腥藻属占主要优势,且尖头藻属的相对丰度由9%增至20%。所有混合处理组由相对丰度最高的假鱼腥藻属转为尖头藻属。冬季受水和供水水体对照组假鱼腥藻属的相对丰度均为84%,为绝对优势种。随着培养时间的延长,假鱼腥藻属的相对丰度在受水水体与10%处理组中逐渐减少,而在供水水体、30%与50%处理组中有所增加。以上结果表明,随调水比例增加,受水水体的主要优势种类相对丰度显著增加,明显受到供水水体优势种生长的影响。
3 讨论
3.1 调水期间对受水水库营养状况的影响
在外源氮磷输入的情况下,沉积物能够有效缓解水体氮磷浓度变化[20]。水体中OH-与Fe3+、Ca2+等金属离子竞争PO43-[20],受水水库持续下降的pH值将削弱OH-的竞争能力,使更多的金属磷进入沉积物而保持水体磷含量的相对稳定。此外,Ca2+浓度升高能提高受水水库沉积物缓冲磷的能力[20],Ca2+浓度近乎数量级的提升使形成磷酸钙所需PO43-浓度降低,Ca2+浓度升高使更多的磷进入沉积物。Ca2+与水体中丰富的含碳无机盐-碳酸氢盐反应生成Ca(HCO3)2,随后转化为CaCO3,并释放出CO2[21],这将使湖泊水体的pH值不断下降。在缺氧条件下,NH4+和溶解性活性磷将加速从沉积物向水体释放,而溶解性有机氮和磷的矿化速率将会降低[22],受水水库中DO浓度的升高可能导致其更容易成为“汇”而非“源”,这对于水库缓冲因高浓度营养水体进入而产生的冲击具有重要意义。
3.2 调水对受水水库浮游藻类生物量影响
温度和营养盐被认为是影响藻类生长的关键因子[23-24]。夏季试验结果显示,供水和受水水库的浮游藻类密度接近,虽然供受水库氮磷浓度存在差异,但较高的温度可能对藻类的生物量起促进作用(表1)。温度升高将加快水体的物质循环,提高藻类的新陈代谢速率[25-26],进而导致藻类大量繁殖。此外,氮磷等营养盐可利用形式的差别也会影响藻类的生物量[27],供水水库较高的氮磷浓度可能与汛期相关,大量非藻类可利用形式的氮磷汇入湖泊,使藻类生物量短时间仍旧保持之前的水平。研究发现,夏季处理组的浮游藻类密度峰值时间提前,使得培养末期处理组的浮游藻类密度均低于对照组。浮游藻类密度峰值时间提前,表明藻类生长由于不同水体的混合而得到促进,但处理组比对照组的浮游藻类细胞密度峰值反而有所下降。
为了进一步分析不同水体混合之后对藻类的生物量带来的影响,假设不同水体按比例混合之后导致了营养盐浓度的线性变化,并由此导致藻类生物量的线性变化,营养盐浓度与藻类生物量的线性相关在部分文献[28]中得到了证实。利用对照组浮游藻类密度峰值随混合比例的线性变化值作为处理组的理论估算值,与处理组的实际浮游藻类密度峰值进行对比。结果表明,夏季至冬季处理组的浮游藻类密度峰值均低于理论估算值,且随季节后移而降低。有研究认为,生物之间的竞争会消耗额外的营养物质用于生长繁殖之外的生命活动,例如产毒藻类会在与其他藻类竞争的过程中产生毒素以维持其优势地位[29]。可能是由于秋冬季产毒藻类假鱼腥藻属和尖头藻属的优势增加导致竞争加剧,使浮游藻类密度峰值相比理论值下降。由此推测不同水体的混合将会导致藻类潜在的竞争加剧,竞争强度可能与浮游藻类的群落结构相关,从而表现为部分优势种在培养过程中被演替和浮游藻类密度峰值时间提前,从而出现藻类的实际密度峰值比理论值低的现象,且由于营养物质的大量消耗,衰减发生得更快。调水过程中藻类的竞争将会加剧,一定程度上会降低受水水库藻类水华发生的概率。这与太湖利用调水缓解水体富营养化的研究结果[11]相似。
来自数百个湖泊的数据分析结果表明,氮磷浓度将显著影响叶绿素浓度[30],藻类生长与氮磷浓度密切相关。在秋冬季的试验中,供受水库之间氮磷浓度的差异可能是初始浮游藻类密度存在差异的主要原因。随着混合比例的增加,处理组的营养盐浓度增加,浮游藻类密度峰值升高,表明营养盐仍是影响藻类生长的主要因子。供受水体之间的营养盐浓度差距仍然是影响调水过程中藻类生长的主要因素。利用优质水源调水改善水生态环境的方法被认为是可行的[2,11]。但由于居民和工业用水的增加,部分水质较差的水源地可能进入调水线路。考虑到不同水体营养状态的差异,调水可能增加藻类水华发生的风险,受水水体的生态安全评估和预警就显得十分重要。
3.3 调水对受水水库浮游藻类群落结构的影响
浮游藻类的群落结构与环境因子密切相关,能够反映当前水体的健康状况[31]。供受水库不同季节的浮游藻类群落结构具有一定的相似度,这可能与供受水库之间的调水和季节变化相关。受水水库属于调水型水库,内部水体交流频繁,浮游藻类的群落结构受到供水水体影响[31]。不同混合比例对受水水体的浮游藻类群落结构产生的影响不同,混合比例在10%以下的处理组的浮游藻类群落结构变化趋势与受水水体对照组相似,而混合比例超过30%的处理组则与供水水体对照组相似。虽然秋季和冬季的供、受水水体浮游藻类密度存在差异,但混合比例为10%处理组浮游藻类密度峰值与受水水体对照组相似,混合比例超过30%的处理组浮游藻类密度峰值则比受水水体对照组高。外来水体对受水水体浮游藻类群落结构的影响存在一定的限度,这与SONG等[2]的研究结果类似,但比例超过30%的调水将明显影响受水水体的藻类群落结构。考虑到调水对受水水体浮游藻类的影响,部分产毒藻株可能对居民用水安全和受水水体的水生态环境具有一定的负面作用,浮游藻类的群落结构也应作为调水期间持续监测的重要生物指标。
总体来看,供受水库整体的藻类群落结构的主要优势种由微小平裂藻转变至假鱼腥藻属。假鱼腥藻属对氮的需求较高,生物量随TN浓度的升高而升高[32]。供水水库TN浓度持续升高可能是其占据优势的主要原因。环境温度低于平裂藻生长的最佳温度也可能是其丧失优势地位的原因[33]。虽然受水水库TN浓度在调水期间保持较低水平,但供水水库持续的调水可能是受水水库假鱼腥藻属占据主要优势的原因。在冬季的试验结果中,假鱼腥藻属的优势地位在混合比例低于10%时得到削弱,而在混合比例超过30%时维持其优势地位。即使调水导致受水水体假鱼腥藻属占据主要优势,且在冬季占据绝对优势,但因调水期间受水水体TN浓度保持相对稳定,调水结束后可能丧失优势地位。实验结果显示,调水量控制在10%以内会将削弱假鱼腥藻属的优势地位,但可能增加尖头藻属的优势。秋季的试验结果显示,尖头藻属的优势可能由于调水而增加。当混合比例达到30%时,其在培养末期相对丰度达到57%。尖头藻属对磷要求较低,具有较高的碱性磷酸酶活性,在低磷营养条件下能够成为优势种[34],这可能是培养末期营养耗尽时尖头藻属仍能够占据主要优势的原因。值得注意的是,尖头藻属和假鱼腥藻属可能释放毒素和异味物质[34-35],这可能对水体和居民用水健康产生一定的影响。此外,由于不同季节调水期野外水体的实际温度存在一定差异,而室内培养参考了藻类生长潜力实验的标准方法[16],将不同季节的实验处理均设置为适合大多数藻类生长的最适温度[17],此温度虽然凸显了藻类生长的潜力,但是忽略了不同季节调水之间的温度差异对藻类生长的影响,所以该实验的室内培养结果只能在某种程度上反映单次调水后受水水体藻类生长和群落结构的变化趋势。故今后在类似研究中需要完善和利用更合理的实验设计。
4 结论
调水期间,在高营养水体输入情况下受水水库氮磷营养盐浓度保持相对稳定。供受水水体的混合使浮游藻类密度峰值时间提前,而秋季供受水水体混合使峰值时间延后;随着供受水水体混合比例的增加,夏季浮游藻类密度峰值有所下降,而秋季和冬季则有所增加。供受水水体混合使实际浮游藻类密度峰值低于理论估算值,最高达到31%。受水水体的浮游藻类群落结构受供水水体影响,供受水水体的混合使主要优势藻种发生改变,夏季混合增加了水华束丝藻的相对丰度,并在秋季成为受水水体的主要优势藻种。随着供水水体假鱼腥藻属相对丰度的不断增加,假鱼腥藻属成为冬季受水水体的绝对优势藻种。因此,受水水体在接受外来高营养水体时具有一定的缓冲作用。虽然供水水体的营养盐浓度是影响受水水体浮游藻类的生长的主要因素,且能影响受水水体浮游藻类群落结构,但调水加剧了藻类的潜在竞争,这将在一定程度上减少藻类水华发生的概率。该研究有助于了解复杂调水背景下高营养水体的输入对受水水体的理化因子和浮游藻类生长的影响,为科学管理和调水决策提供理论支撑。未来还需进一步优化实验条件,将更多藻类生长指标纳入研究内容,并考虑多种因素对浮游藻类生长的影响。

