山茶油干预的阿尔茨海默病小鼠尿液代谢组学分析
王瑞锋,周 宁,陈 龙,刘 通,郭彭莉,张冰贤,张振凯,曾梦楠,熊维政,郑晓珂,3,冯卫生,3,*
(1.河南中医药大学药学院,河南 郑州 450046;2.河南绿达山茶油股份有限公司,河南 信阳 465550;3.河南省中药开发工程技术研究中心,河南 郑州 450046)
阿尔茨海默病(Alzheimer’s disease,AD)是一种进行性发展的神经退行性疾病,起病隐匿,多发于老年前期和老年中期,临床上主要表现为认知功能障碍、行为改变和心理症状[1]。到2050年,预计将会有1.52亿 人受到痴呆症的影响,严重干扰了人们的日常生活,带来了巨大的公共健康隐患[2]。AD的病理学特征主要为β-淀粉样蛋白(amyloidβ-protein,Aβ)细胞外沉积形成淀粉样斑块以及淀粉样斑块诱导的下游Tau蛋白过度磷酸化导致神经纤维缠结[3]。此外,Aβ沉积还会导致免疫系统激活引起促炎症细胞因子分泌,趋化因子、活性氧、兴奋性氨基酸等神经毒素增多,导致神经元损伤和神经退行性病变。AD的具体发病机制仍不清楚,目前被批准用于治疗AD的药物仅能控制症状,而不能改变疾病进程,且具有头晕、头痛、便秘、高血压等副作用[4]。研究表明,与痴呆相关的病理变化在临床症状出现之前很长一段时间就已经开始发生,因此寻找新的药物,在神经退行性过程发生之前进行预防和干预,将成为未来研究的重点[5]。
山茶油是从山茶科(Theaceae)油茶(Camellia oleiferaAbel.)树种子压榨获得,是药用价值较高的食品保健油,在中国有很长的生产和发展历史。先秦古书《山海经》中记载“员木,南方油食也”;《本草纲目拾遗》中记载“茶油可润肠、清胃、解毒、杀菌”;研究表明,山茶油含有丰富的不饱和脂肪酸、酚类、黄酮类、儿茶素、角鲨烯等活性成分,有“东方橄榄油”和“长寿油”之称[6]。山茶油中所含的油酸等不饱和脂肪酸可以减少AD小鼠脑组织中Aβ产生,抑制Aβ异常积累引起的淀粉样斑块沉积[7];多酚和黄酮类化合物可以增强学习、记忆和神经认知功能,起到改善AD症状的作用[8]。课题组前期研究也发现[9],山茶油可作为营养食品调节脂质代谢,影响微生物-肠道-大脑轴,促进肠道菌群相互作用,调节Aβ25-35小鼠肠道菌群失衡,减轻小鼠大脑中的神经元损伤,减少淀粉样蛋白和Tau蛋白的数量,增强小鼠记忆和认知能力。
代谢组学是系统生物学的重要组成部分,可通过研究生物体在受到外界干预后,细胞、组织、器官中低分子质量内源性代谢物的差异变化,富集和构建代谢通路,从而探讨外界干预与内在代谢物变化的联系[10]。AD发病机制复杂,系统性的分析方法更适合于全面整体地评价山茶油对AD患者的干预作用。已有研究表明,在AD患者尿液中检测出一些生物标志物如氧化损伤相关代谢物、单胺类代谢物等可能与AD早期病理变化相关。且尿液代谢物检测作为一种简单、无创的研究手段,方便被用于AD早期疾病诊断[11-12]。因此,本研究基于超高效液相色谱-四极杆飞行时间质谱(ultra-high performance liquid chromatography-quadrupole time-of-flight mass spectrometry,UPLC-Q/TOF-MS)技术,对山茶油干预后的AD小鼠进行尿液代谢组学分析,鉴定山茶油治疗后小鼠体内代谢物变化情况,并基于差异标志物构建相关的代谢网络图,进而探讨山茶油对AD的营养保健作用和治疗潜力,以期为日常食用山茶油干预AD发展提供参考。
1 材料与方法
1.1 动物、材料与试剂
雄性昆明小鼠(KM;49 d)购自北京维塔星生物科技有限公司,共50 只。实验环境保证恒温((25±2)℃)、相对湿度(60±10)%,光照、黑暗循环12 h,实验期间小鼠可自由获得食物和水。所有程序均按照《河南中医药大学实验动物护理与使用指南》进行,所有实验均经河南中医药大学动物伦理委员会批准,批准代码为DWLL2018080003,于2018年8月15日授予,有效期5 a。
山茶油购自河南绿达山茶油股份有限公司。
盐酸多奈哌齐片 中国重庆植恩药业有限公司;Aβ25-35肽 生工生物工程(上海)股份有限公司;甲醇、乙腈、甲酸(均为LC/MS级)美国Thermo Fisher Scientific公司。
1.2 仪器与设备
maXis HD Q/TOF四极杆飞行时间质谱仪 德国Bruker公司;Ultimate 3000高效液相色谱仪 美国Dionex公司;Advantage A10超纯水仪 德国Sartorius公司;5810R高速冷冻离心机 德国Eppendorf公司;SK-1快速混匀器 常州国宇仪器制造有限公司;BCD 206TAS低温冰箱 青岛海尔公司;SB-5200DTD超声波清洗机宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 分组、造模与给药
将50 只小鼠随机分为正常对照组、模型组、阳性药组(10 mg/(kgmb·d))、山茶油组(0.5 mL/(kgmb·d))。Aβ25-35肽在37 ℃蒸馏水(1 mg/mL)中孵育7 d,在实验前立即用无菌生理盐水稀释至最终质量浓度。除正常对照组外,其余各组小鼠海马内注射Aβ25-35,对照组小鼠海马内注射等量生理盐水。阳性药组和山茶油组的小鼠注射干预后第15天,分别开始给予盐酸多奈哌齐片和山茶油灌胃,连续给药28 d,正常对照组和模型组均给予等量生理盐水灌胃。
1.3.2 尿液样本的采集与处理
最后一次给药后,将小鼠置于代谢笼中,收集各组小鼠12 h尿液,置于-80 ℃保存。待UPLC-Q/TOFMS分析,将尿样在室温下解冻,3 800 r/min、4 ℃离心10 min,取上清液300 μL与3 倍体积乙腈混合加入离心管中,沉淀蛋白质。涡旋1 min后,在4 ℃、12 000 r/min离心10 min,取上清液1 mL置于进样小瓶中,放于4 ℃冰箱中备用。质量控制(quality control,QC)样本为分别从各样本中吸取30 μL混合而成[13]。实验序列中每间隔10 个样本运行一次QC样本,用于评估UPLC-MS系统的稳定性。
1.3.3 UPLC-Q/TOF-MS检测条件
采用AcclaimTMRSLC 120 C18色谱柱(2.2 μm,2.1 mm×100 mm)进行色谱分离。流动相为溶剂A(甲酸水溶液,0.1%)和溶剂C(乙腈),梯度洗脱(0~5 min,95%~85% A,5%~15% C;5~8 min,85%~60% A,15%~40% C;8~18 min,60%~30% A,40%~70% C;18~20 min,30%~10% A,70%~90% C;2 0~2 5 min,10%~9 5% A,90%~5% C)。柱温箱设置为40 ℃,流速为0.3 mL/min。质谱分析采用四极杆飞行时间质谱,在正、负离子模式下进行扫描。扫描范围:m/z50~1 500,扫描速率:1.0 Hz,雾化器气体压力:2.0 bar,干燥气(N2)流量:8 L/min,去溶剂化温度:230 ℃,毛细管电压:3 500 V和3 200 V(正、负离子模式)。实时校正液(甲酸钠)流速:52 μL/h。
1.4 数据处理与统计分析
将UPLC-Q/TOF-MS 采集到的原始数据导入Profile Analysis软件中进行峰匹配、降噪、归一化、修正缺失数据等预处理后,得到Bucket表格。将表格数据导入SIMCA-P14.1软件中进行无监督的主成分分析(principal component analysis,PCA)和有监督的正交偏最小二乘判别分析(orthogonal partial least squares-discrimination analysis,OPLS-DA),得出相应的得分图。通过得分图比较模型组和给药组之间的差异,筛选差异代谢物(变量投影重要性(variable importance in the projection,VIP)>3、P<0.05)。利用HMDB(https://hmdb.ca)、MassBank(https://massbank.eu)、MetaboAnalyst(https://www.metaboanalyst.ca)在线数据库鉴定、筛选潜在生物标志物。通过Compass Quant Analysis软件(4.8.0版本)对潜在的生物标志物进行半定量分析,Mev软件(4.9.0版本)进行热图聚类分析。最后,使用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库(http://www.genome.jp/kegg/)对潜在生物标志物进行代谢通路富集并构建代谢通路网络。
2 结果与分析
2.1 AD小鼠尿液代谢物谱图分析
将小鼠尿液样本进行UPLC-Q/TOF-MS分析后,得到在样品正、负离子模式下的基峰离子流色谱图,如图1所示,分离度良好。其中,正离子模式下检测到199 个化合物,负离子模式下检测到181 个化合物(正离子模式下33 个获得命名,负离子模式下15 个获得命名)。

图1 小鼠尿液样品正(A)、负(B)离子模式下的基峰强度色谱图Fig.1 Base peak intensity chromatograms of mouse urine samples in the positive (A) and negative (B) modes
2.2 AD小鼠尿液样本PCA
将UPLC-Q/TOF-MS获得的小鼠各组数据进行预处理和PCA,得到PCA得分图。如图2A、B所示,正常对照组、模型组小鼠尿液样本点各自聚为一类,彼此显著分离,说明小鼠在注射Aβ25-35肽后体内代谢轮廓显著变化;如图2C、D所示,与模型组相比,阳性药组样本点明显接近正常对照组样本点,说明AD模型建立成功。如图2E、F所示,在给予山茶油后,小鼠尿液样本点更接近正常对照组样本点区域,说明山茶油对AD小鼠体内代谢紊乱有明显的回调作用。


图2 小鼠尿液样本PCA得分图Fig.2 PCA score plots of mouse urine samples
2.3 AD小鼠尿样本潜在生物标志物鉴定
对模型组和给药组进行OPLS-DA,结果显示模型组和山茶油组样本点显著分离。得到相应的OPLS-DA得分图、置换检验结果图以及S-plot载荷图(图3),置换检验结果中横坐标表示与模型的相似度,纵坐标表示和越接近于1,表明模型拟合程度越高,区分能力越好。该模型,说明模型区分能力较好,模型组和山茶油组之间的组间差异信息较多。较接近于1,表明模型具有良好的预测能力。小于0,说明模型没有出现过拟合。在S-plot载荷图中标记为红色且明显远离原点的点,代表潜在代谢物,基于设定的参数VIP>3、P<0.05,使用HMBD、MassBank和KEGG数据库,结合标志物的保留时间、质荷比、二级碎片等鉴定得到内源性生物标志物,模型组与给药组得到48 个生物标志物(正离子模式下33 个,负离子模式下15 个),如表1所示。

表1 模型组和山茶油组潜在生物标志物及其相关信息Table 1 Information of potential biomarkers from the model and camellia oil groups

图3 模型组和山茶油给药组样本的OPLS-DA得分图、置换检验图和S-plot载荷图Fig.3 OPLS-DA score plots,permutation test plots and S-plot loading plots for the model and camellia oil groups
2.4 AD小鼠尿液样本潜在生物标志物聚类分析
对筛选得出的生物标志物进行相对定量和热图聚类分析,如图4所示,与模型组相比,山茶油组中多数标志物表现出一定程度上的回调,说明山茶油对AD小鼠体内代谢紊乱有一定的回调作用。聚类结果显示,正常对照组和给药组聚为一类,再次验证PCA的结果,即山茶油对AD大鼠体内代谢的紊乱具有改善作用。
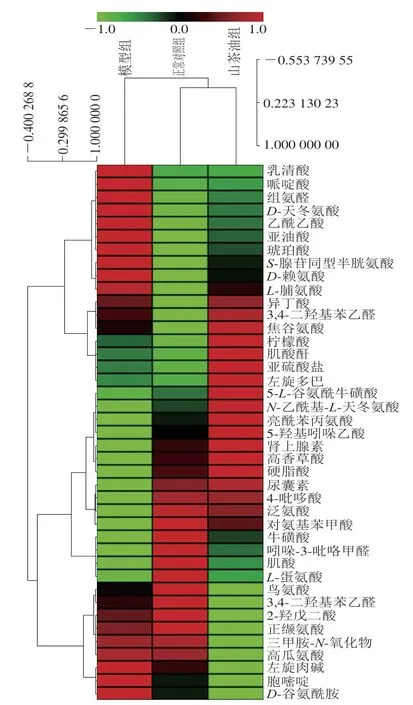
图4 潜在生物标志物在模型组和山茶油组样本中的热图Fig.4 Heatmap of potential biomarkers in the model and camellia oil groups
2.5 AD小鼠尿液样本代谢通路富集分析与代谢网络构建
对表1中的所有生物标志物进行KEGG代谢通路富集分析,得到了5 条显著受干扰的代谢途径:牛磺酸和次牛磺酸代谢,三羧酸循环,精氨酸和脯氨酸代谢,半胱氨酸和蛋氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢。构建了与山茶油干预作用相关的代谢通路网络图,如图5所示。
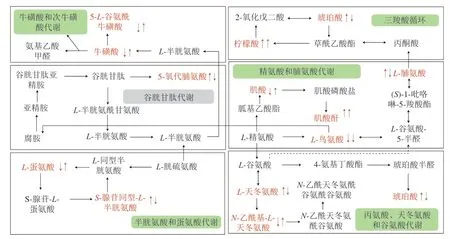
图5 AD小鼠体内的代谢网络图Fig.5 Metabolic network in AD mice
3 讨论
山茶油是一种通过压榨提取的中国传统食用油,含有丰富的不饱和脂肪酸,已被证实对AD患者神经系统有良好的保护作用[14]。本研究基于代谢组学技术,对山茶油干预后的AD小鼠尿液样本进行分析,综合结果发现山茶油主要是通过干预牛磺酸和次牛磺酸代谢,三羧酸循环,精氨酸和脯氨酸代谢,半胱氨酸和蛋氨酸代谢,丙氨酸、天冬氨酸和谷氨酸等代谢通路,改善AD小鼠体内代谢的紊乱状态。谷氨酸是哺乳动物神经系统中重要的兴奋性神经递质,AD患者皮层神经元外存在过量的谷氨酸会引起兴奋毒性,导致神经元死亡[15]。牛磺酸是中枢神经系统中广泛分布的内源性氨基酸,被认为是大脑发育的重要营养因子[16]。牛磺酸可通过激活γ-氨基丁酸和甘氨酸受体,抑制Aβ诱导的谷氨酸水平升高所引起的兴奋性毒性[17]。在本研究中,与正常对照组相比,牛磺酸在模型组下调,给予山茶油干预后,小鼠尿液中牛磺酸及其代谢物含量显著升高,说明山茶油可通过调节牛磺酸和次牛磺酸代谢,降低兴奋性毒性,从而缓解Aβ引起的神经损伤,改善AD症状。
柠檬酸是线粒体三羧酸循环中的重要中间产物。线粒体功能障碍和脑葡萄糖代谢减退被认为是引发AD的重要影响因素之一,淀粉样前体蛋白及其裂解产物的异常积累会抑制各种线粒体酶活性,破坏线粒体电子传递链功能,影响能量供应,导致神经元细胞运转异常[18-19]。本实验中,与正常对照组相比,AD小鼠体内柠檬酸含量减少,提示AD小鼠体内三羧酸循环过程紊乱,体内能量代谢受到抑制。本实验中,给予山茶油后,柠檬酸含量明显增加,说明山茶油可通过调节三羧酸循环调节机体能量代谢,减轻神经元细胞损伤。
肌酸和肌酸酐是精氨酸和脯氨酸代谢通路中的重要化合物。肌酸是肌酸酐的唯一前体,肌酸转化为肌酸酐是一个不可逆的过程,在人体内,肌酸酐一般不被代谢而直接由尿液排出体外[20]。肌酸与中枢神经系统的能量供应有关,二磷酸腺苷(adenosine diphosphate,ADP)通过接受磷酸肌酸的磷酸基团合成三磷酸腺苷(adenosine triphosphate,ATP),维持大脑在快速周转时ATP的稳态以及较低的ADP浓度,进而提高认知功能[21]。肌酸还具有抗氧化作用,线粒体是氧化应激诱导损伤的主要部位,Aβ的低聚物通过激活NADPH氧化酶诱导皮质神经元产生活性氧,进而诱发神经损伤[22]。肌酸在进入线粒体与ATP结合提供能量过程中可以清除线粒体中的自由基,减少活性氧产生,产生抗氧化作用,减轻神经损伤。本研究中,与正常对照组相比,AD小鼠尿液中肌酸含量下调,给予山茶油后,小鼠尿液中肌酸水平显著升高,说明山茶油可以通过干预精氨酸和脯氨酸代谢,影响大脑能量供应,减少线粒体中活性氧产生,减轻AD损伤。
S-腺苷同型半胱氨酸(S-adenosylhomocysteine,SAH)是半胱氨酸和蛋氨酸代谢中的重要代谢物。SAH在SAH水解酶的催化下分解为同型半胱氨酸和腺苷。研究表明,同型半胱氨酸含量升高抑制SAH水解酶活性,导致早期AD患者血浆和脑脊液中SAH含量显著升高。SAH是大多数甲基转移酶的有效抑制剂,可以通过抑制儿茶酚O-甲基转移酶和苯乙醇胺N-甲基转移酶的活性影响认知功能[23]。另有研究表明,二十二碳六烯酸(docosahexaenoic acid,DHA)可以预防淀粉样蛋白积累引起的氧化应激和学习能力丧失,但DHA在脑组织中不能合成,需要通过血脑屏障从血液和外周组织向脑组织转运;SAH可以通过抑制肝脏中磷脂酰乙醇胺N-甲基转移酶的活性,减少红细胞DHA从肝脏向外周组织和血浆转运,从而降低脑内DHA浓度,造成认知能力损伤[24-26]。本研究中,与正常对照组相比,AD小鼠尿液中SAH含量上调,在给予山茶油之后,小鼠尿液中SAH含量显著降低,推测山茶油可以通过干预半胱氨酸和蛋氨酸代谢,改善AD引起的记忆认知功能损伤。
N-乙酰基-L-天冬氨酸(N-acetyl-L-aspartic acid,NAA)在人体内主要集中在神经元细胞的细胞质中,是人脑中含量第二丰富的氨基酸[27]。NAA被认为是AD早期的潜在生物标志物,NAA含量与神经元密度以及完整性密切相关[28]。此外,脑内NAA被天冬氨酸酯酶水解产生足够高浓度的天冬氨酸和乙酸,乙酸进一步合成乙酰辅酶A,产生的乙酰辅酶A可参与脑细胞线粒体中的能量供应,满足神经元之间信息传递的需要[29-30]。本实验中,与正常对照组相比,AD小鼠尿液中NAA含量下调,山茶油干预后的小鼠尿液NAA水平显著提高,提示山茶油可以调节天冬氨酸代谢,增加小鼠体内NAA含量,增强大脑中能量供应,改善AD症状。
4 结论
本研究以尿液代谢组学为研究手段,探讨了山茶油对AD的干预作用。基于差异代谢物的筛选及相关代谢通路的富集,发现山茶油可通过调节牛磺酸和次牛磺酸代谢,三羧酸循环,精氨酸和脯氨酸代谢,半胱氨酸和蛋氨酸代谢,丙氨酸、天冬氨酸和谷氨酸等代谢通路,促进能量代谢、减轻氧化损伤。本研究为日常食用山茶油防治AD提供了数据支撑。

