林麝肠道中乳酸菌的分离筛选及益生特性
訾 静,王 琰,李亮亮,张 琨,万 一,*
(1.陕西省微生物研究所,陕西 西安 710043;2.陕西省科学院,秦岭天然产物工程中心,陕西 西安 710043;3.西安理工大学理学院,陕西 西安 710054)
林麝是珍贵的野生药用资源动物,已被列为国家一级重点保护野生动物[1]。随着人类对生态环境的破坏及对林麝的过度捕杀,野麝资源濒临灭绝,人工养麝是保护野生麝资源的有效途径,因此,做好圈养麝的疾病防治十分重要[2]。在林麝养殖群体中,高发病率和死亡率的化脓性疾病和肠炎性疾病一直是人工养殖规模扩大的重要制约因素[3]。通过对患有化脓病林麝个体的脓液进行病原菌分离鉴定,发现死亡个体体内脓液病原菌主要包括化脓隐秘杆菌、铜绿假单胞菌、大肠杆菌等,尤其是化脓隐秘杆菌阳性检出率高达60%以上[4-5]。抗生素经常被用来治疗这类疾病。然而,抗生素的过度使用可能会导致动物肠道微生物组产生耐药性[6]。因此,本研究通过从健康的林麝肠道中分离乳酸菌用于开发益生菌制剂,以期预防疾病和改善林麝健康状况。
乳酸菌可以显著改善动物胃肠道的微生物群落生态系统平衡,能够产生抑菌物质(如有机酸、细菌素等)和抗菌活性而被广泛用于食品工业,用于改善动物和人类健康[7-8]。根据前人研究报道,从健康动物肠道中分离出的乳酸菌能抑制多种致病菌的生长,包括产肠毒素大肠杆菌、福氏志贺菌、鼠伤寒沙门氏菌和单核细胞增生李斯特菌等[9-10]。乳酸菌是否能作为益生菌,需要根据现有益生菌选择标准和评价规程对其进行安全性评估,包括对胃肠道环境的酸耐受性和胆盐耐受性;可黏附定植于肠道上皮;对常见病原菌具有一定的抑制能力;对抗生素的耐药性以及不能携带可转移的耐药基因等[11]。
目前国内外关于林麝肠道中乳酸菌分离及益生特性的报道较少,仅有四川农业大学Luo Yan等[12]从健康林麝粪便中分离乳酸菌,进行耐酸耐胆盐、抗生素耐药性及抑菌活性研究。针对林麝肠道中乳酸菌的菌体表面特性、抗药性基因型分析以及生长特性的研究鲜见报道。本研究从健康林麝粪便中分离鉴定乳酸菌,以商品化副干酪乳酪杆菌(Lacticaseibacillus paracasei)L22为阳性对照,测试分离株的耐酸和耐胆盐、抗菌活性、自聚集和疏水性、抗生素敏感性,进一步对筛选的分离株进行抗性基因分析和生长曲线测定。另外,本研究检测了分离株对一株化脓隐秘杆菌(Arcanobacterium pyogenes)LSN3(从林麝肠道化脓样本中分离,GenBank登录号OQ179914)的拮抗活性,以期筛选出具有良好抗菌活性的菌株,为开发适合林麝专用的益生菌制剂提供理论基础和可靠的菌株来源。
1 材料与方法
1.1 材料与试剂
本研究所用的新鲜健康林麝粪便均在陕西凤县林麝繁育中心采集。共收集55 头不同年龄的林麝粪便样品,麝龄为0.5~10.5 岁。
金黄色葡萄球菌(Staphylococcus saureus)ATCC 25923、大肠杆菌(Escherichia coli)ATCC 25922、铜绿假单胞菌(Pseudomonas aeruginosa)PAO1、肠炎沙门氏菌(Salmonella enterica)ATCC 13076均购自中国微生物菌种保藏管理委员会普通微生物中心;化脓隐秘杆菌(A.pyogenes)LSN3、商品化副干酪乳酪杆菌(Lacticaseibacillus paracasei)L22由本实验室分离保存。
改良MRS培养基:在MRS肉汤培养基础上,添加质量分数0.05%半胱氨酸盐酸盐和质量分数0.4% LiCl。
MRS肉汤培养基 北京奥博星生物技术有限公司;牛胆盐 上海麦克林生化科技有限公司;抗生素药敏试纸杭州滨和微生物试剂有限公司;细菌基因组DNA快速提取试剂盒 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
1510型分光光度计 赛默飞世尔科技有限公司;1580R高速冷冻离心机 基因科技(上海)有限公司;LDZM-80KCS-II型全自动灭菌锅 上海申安医疗器械厂;SW-CJ超净工作台 上海新苗医疗器械制造有限公司;GHP-9080型隔水式培养箱 上海一恒科学仪器有限公司;T100型聚合酶链式反应(polymerase chain reaction,PCR)仪 伯乐生命医学产品(上海)有限公司。
1.3 方法
1.3.1 菌株培养、纯化及分离
取健康林麝的新鲜粪便5 g接种于改良MRS液体培养基中,振荡混匀,37 ℃静置培养24 h。将富集菌液用无菌生理盐水稀释,分别吸取100 µL稀释梯度为10-4、10-5和10-6的稀释液涂布于改良MRS固体平板,37 ℃培养24~48 h至长出单菌落,挑选具有乳酸菌形态的单菌落,连续转接于改良MRS固体培养基中划线培养3 次后,挑取纯的单菌落于MRS培养基上,37 ℃培养24 h,培养物进行革兰氏染色和过氧化氢酶反应测定。将纯化后的菌株加入体积分数30%的灭菌甘油中,于-80 ℃保藏备用。
1.3.2 16S rDNA基因扩增及序列分析
取甘油菌20 µL 接种至9 mL MRS 肉汤培养基中充分活化,取1 mL 菌液6 000×g离心5 min,收集菌体,根据细菌DNA 提取试剂盒方法提取菌体DNA。以提取的DNA 为模板,利用PCR 技术扩增16S rDNA序列,选用16S rDNA通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-TACGGTTACCTTGTTACGACTT-3’)进行PCR扩增。反应体系为50 µL:2×TaqMaster Mix (Dye Plus)25 µL、上下游引物各1.5 µL、DNA模板(20 ng/µL)2.0 µL,ddH2O补足50 µL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,进行34 个循环;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测,送至生工生物工程(上海)股份有限公司进行测序。所得序列提交GenBank进行BLAST比对分析,并下载相似性最高的模式菌株序列,利用MEGA 6.0软件进行多序列对比,构建Neighbor-Joining系统发育树(No.of Bootstrap Replications=1 000),初步确定菌株分类地位。
1.3.3 菌株耐酸和耐胆盐能力测定
耐酸和耐胆盐测定参照Manzoor等[13]方法。将活化后的菌液(108CFU/mL)按体积分数3%的接种量接种于MRS肉汤培养基中,37 ℃培养24 h后,6 000×g离心5 min,收集菌体,用灭菌的磷酸盐缓冲液(phosphate buffered saline,PBS)(0.1 mol/L、pH 7.2)将菌体洗涤2 次后重悬于PBS中。取1 mL菌悬液分别接种至9 mL的MRS培养基(用1 mol/L的盐酸调节pH值分别为2、3和4;或者加入牛胆盐分别至质量分数为0.5%和1.0%),37 ℃培养4 h,分别在0 h和4 h用平板计数法测定活菌数,存活率计算公式如下:
式中:N0和Nt分别代表菌株处理前(0 h)和处理后(4 h)的菌落数。
1.3.4 菌株上清液抑菌能力测定
菌株上清液对致病菌的抑制作用采用牛津杯法[14]。取甘油菌接种于MRS肉汤培养基中37 ℃培养16 h,10 000×g离心10 min,上清液经滤膜(0.22 μm)过滤收集。病原菌选取大肠埃希氏杆菌(E.coli)ATCC 25922、金黄色葡萄球菌(S.saureus)ATCC 25923、铜绿假单胞菌(P.aeruginosa)PAO1、肠炎沙门氏菌(S.enterica)ATCC 13076和化脓隐秘杆菌(A.pyogenes)LSN3,在平板底部倾倒薄层水琼脂,将致病菌分别接种于LB液体培养基中37 ℃培养16 h,取0.1 mL的菌液(108CFU/mL)涂布于LB固体培养基表面。在平板中均匀地放置灭菌的牛津杯,吸取0.1 mL待测菌上清液于牛津杯中,室温静置3~5 h,然后37 ℃培养24 h,测量抑菌圈大小。
1.3.5 菌株自聚集能力测定
菌株自聚集能力的测定参考Polak-Berecka等[15]方法。将活化后的菌液(108CFU/mL)接种至MRS肉汤培养基中,37 ℃培养16 h,6 000×g离心10 min,沉淀用无菌PBS(pH 7.2)洗涤2 次后重悬于无菌PBS中,调整菌悬液的OD600在0.50±0.05范围内。吸取4 mL已调整OD600的菌悬液加入试管中,静置于室温下6 h测定该菌悬液的OD600。自聚集率计算公式如下:
式中:OD0为0 h的OD600值;OD1为静置6 h的OD600值。
1.3.6 菌株表面疏水性测定
采用Crow等[16]描述的方法,以氯仿为有机溶剂测定菌株表面疏水性。将活化后的菌液(108CFU/mL)接种至MRS肉汤培养基中,37 ℃培养16 h,6 000×g离心10 min,沉淀用无菌PBS(pH 7.2)洗涤2 次后重悬于无菌PBS中,调整菌悬液的OD600在0.50±0.05范围内。吸取3 mL已调整OD600的菌悬液与1 mL氯仿涡旋混合30 s,停顿10 s后振荡30 s,并于室温静置30 min。取上层水相,以PBS为空白对照,在波长600 nm处测量OD值。表面疏水率计算公式如下:
式中:OD0为0 h的吸光度;OD1为静置30 min后的OD600值。
1.3.7 菌株对抗生素耐药性测定
分离株对抗生素的耐药性检测采用药敏纸片琼脂扩散法[17]。取9 种抗生素包括哌拉西林(100 µg)、氨苄西林(10 µg)、头孢曲松(30 µg)、链霉素(10 µg)、四环素(30 µg)、氯霉素(30 µg)、红霉素(15 µg)、环丙沙星(5 µg)和万古霉素(30 µg)。吸取0.1 mL菌悬液(108CFU/mL)涂布到MRS琼脂培养基表面,待完全吸收后,将药敏纸片贴放表面,于37 ℃培养24 h,然后测量并记录抑菌圈直径。根据抑菌圈直径大小将每个分离株的耐药性分为耐药(R)、敏感(S)或中介(I),评价标准参照美国临床与实验室标准协会(2014年)进行[18]。
1.3.8 乳酸菌抗药性的基因型分析
根据文献报道的乳酸菌常见抗生素抗性基因特异性引物,对筛选出的6 株乳酸菌的抗药性基因:环丙沙星抗性基因gyrA、parC;万古霉素抗性基因vanE、vanA、vanX;链霉素抗性基因ant6、aadA和aadE进行PCR扩增并分析,所使用的引物序列及退火温度见表1。PCR产物经1%琼脂糖凝胶电泳检测。

表1 抗药性基因特异性引物及PCR条件Table 1 Specific primers and PCR conditions for amplification of antibiotic resistance genes
1.3.9 菌株生长曲线测定
将活化后的菌液(108CFU/mL)按体积分数1%接种量接种于50 mL MRS肉汤液体培养基中,37 ℃静置培养24 h,每隔2 h取样测定发酵液的OD600。以培养时间为横坐标,OD600为纵坐标绘制生长曲线。同时测定24 h后的菌液pH值。
1.4 数据分析
采用GraphPad Prism 8.0软件进行单因素方差分析(One-way ANOVA),P<0.05表示差异显著。全部实验均重复3 次,结果用表示。
2 结果与分析
2.1 分离菌株的形态和鉴定结果
从健康林麝粪便样品中分离菌株,经纯化后在MRS培养基上菌落形态呈白色且表面光滑。经革兰氏染色后,得到12 株革兰氏阳性菌,所有菌株过氧化氢酶反应均呈阴性。菌株经过16S rDNA序列测序后,提交NCBI进行BLAST比对,申请基因登录号(表2)。使用MEGA 6.0软件对菌株16S rDNA序列和模式株序列进行多序列比对,构建系统发育进化树见图1。结果表明,12 株菌经序列比对可明确分为6 种,其中SX129、SX130、SX137、SX140和SX141与植物乳植杆菌(L.plantarum)亲缘关系最近;SX115、SX61和SX142与屎肠球菌(Enterococcus faecium)亲缘关系最近;SX45、SX100、SX78和SX131分别与耐久肠球菌(E.durans)、肠膜明串珠菌(Leuconostoc mesenteroides)、乳酸片球菌(Pediococcus acidilactici)和短乳杆菌(L.brevis)的亲缘关系最近,序列相似性均高于99%。
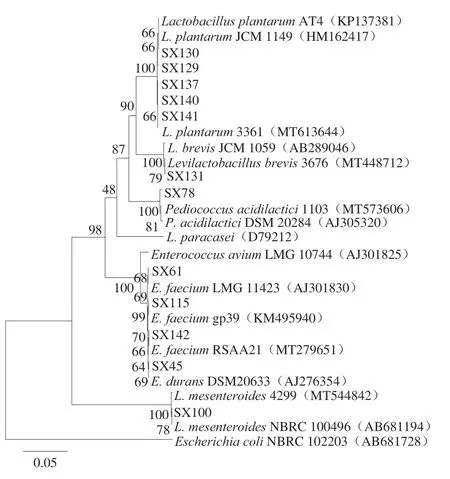
图1 基于菌株16S rDNA序列构建的系统进化树Fig.1 Phylogenetic tree of strains based on the 16S rDNA gene sequences
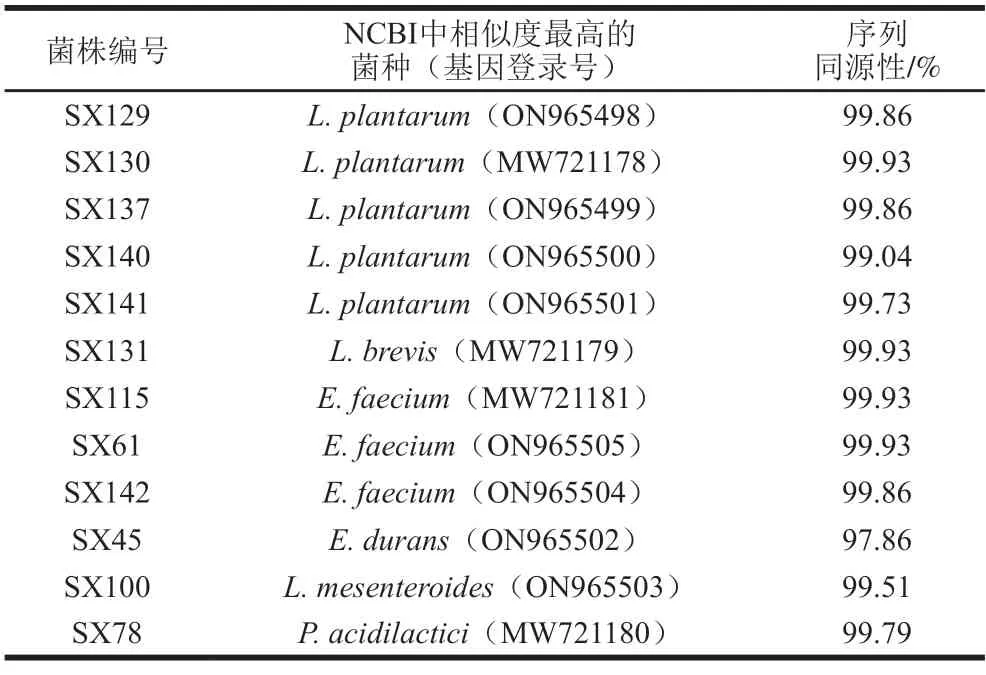
表2 筛选出的12 株乳酸菌属16S rDNA序列相似性比对Table 2 Similarity analysis of bacterial 16S rDNA sequences of12 lactic acid bacterial isolates
2.2 菌株耐酸和耐胆盐能力
12 株乳酸菌在不同pH值条件下的存活率结果见图2A。随着pH值的降低,菌株的存活率也随之降低。所有菌株均能在pH 4条件下生长,5 株植物乳植杆菌和1 株乳酸片球菌存活率达88.5%以上;在pH 3条件下,该6 株菌存活率达84%以上;在pH 2条件下,仅6 株菌存活率在33%~37%之间,其余均在30%以下。所有菌株在pH 4和pH 3(除SX100以外)条件下,存活率与对照菌相比无显著性差异,在pH 2条件下,有2 株菌(SX61和SX78)存活率与对照菌相比有显著性差异(P<0.05)。

图2 不同条件下乳酸菌株的存活率Fig.2 Survival rates of lactic acid bacterial strains under different conditions
12 株乳酸菌在不同胆盐环境中的存活率结果见图2B。所有菌株能耐受质量分数0.5%和1.0%的胆盐环境。在质量分数0.5%胆盐环境中,5 株植物乳植杆菌和1 株乳酸片球菌存活率在87%以上。所有菌株中SX140存活率最高,达91.3%,SX61存活率最低为81.2%。在质量分数1.0%胆盐环境中,有6 株菌的存活率在80%以上,其中植物乳植杆菌存活率较高,在86.0%~89.5%之间,SX45存活率最低,为70%。所有菌株在质量分数0.5%胆盐环境中,存活率与对照菌相比无显著性差异(P>0.05),在质量分数1.0%胆盐环境中,4 株菌(SX78、SX100、SX142和SX45)存活率与对照菌相比有显著性差异(P<0.05)。
2.3 菌株上清液抑菌能力
12 株乳酸菌对常见病原菌的抑菌活性检测结果见表3。5 株植物乳植杆菌和乳酸片球菌对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌和肠炎沙门氏菌表现出较好的拮抗活性(抑菌圈直径17.20~20.19 mm),对化脓隐秘杆菌LSN 3 的抑菌活性(抑菌圈直径14.23~15.53 mm)优于对照菌株L22(抑菌圈直径10.05 mm)。其他6 株分离菌对铜绿假单胞菌和大肠杆菌的抑菌圈直径为12.88~14.98 mm,对肠炎沙门氏菌、金黄色葡萄球菌和化脓隐秘杆菌的抑菌圈直径为9.05~12.46 mm。
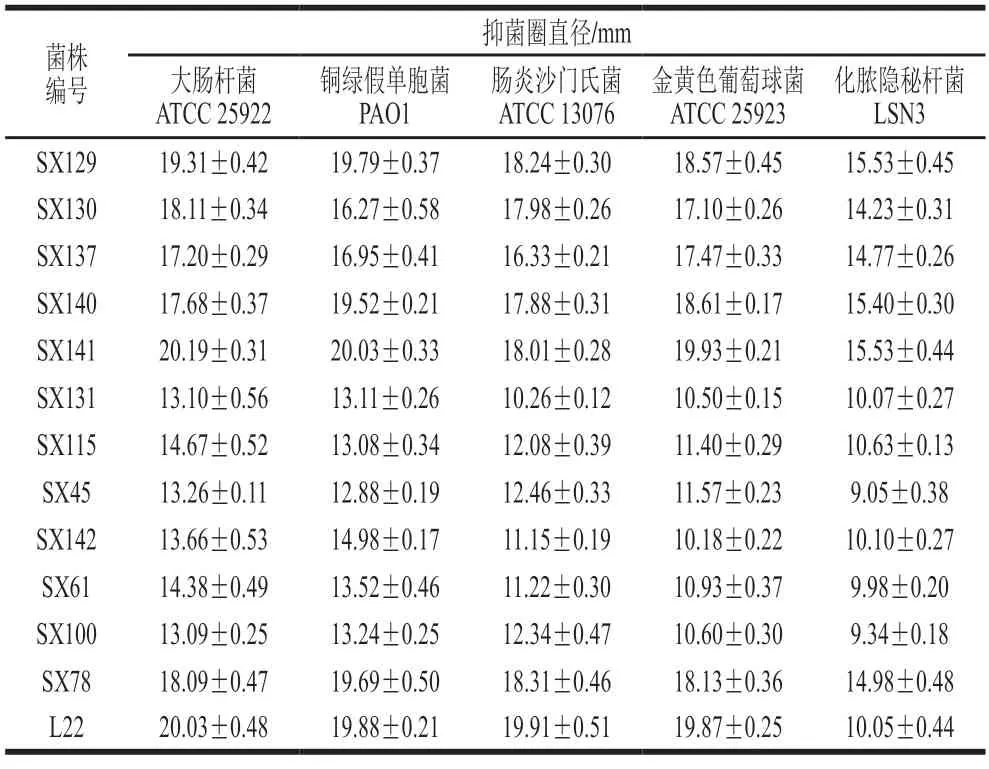
表3 12 株乳酸菌对病原指示菌抑菌活性测定Table 3 Inhibitory activities of 12 lactic acid bacterial isolates against pathogenic indicators
2.4 菌株自聚集能力和表面疏水性
12 株乳酸菌自聚集性以及对氯仿的表面疏水性检测结果如图3所示。9 株分离株自聚集率在50.9%~56.8%之间,其中5 株植物乳植杆菌和1 株乳酸片球菌自聚集率在53.1%~56.2%之间;其余3 株菌自聚集率在39.1%~48.9%之间。所有分离株自聚集能力与对照菌相比无显著性差异(P>0.05),表现出与对照菌相当的自聚集性。12 株分离株中有7 株表面疏水率在52.4%~56.0%之间,其中植物乳植杆菌和乳酸片球菌表面疏水率在52.9%~ 56.0%之间。表面疏水率最高的是SX140(56.0%),最低的是SX100(25.9%),3 株菌(SX131、SX45和SX100)表面疏水性与对照菌相比差异显著(P<0.05)。
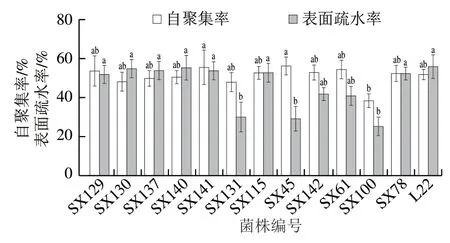
图3 12 株乳酸菌的自聚集率和表面疏水率Fig.3 Auto-aggregation capacity and surface hydrophobicity of12 lactic acid bacterial strains
2.5 菌株对抗生素耐药性
12 株乳酸菌对9 种常用抗生素的耐药性检测结果见表4。所有菌株对链霉素耐药,11 株菌对环丙沙星耐药,9 株菌对万古霉素耐药。植物乳植杆菌和乳酸片球菌分别对6 种和5 种抗生素敏感或中度耐药。有4 株菌对哌拉西林耐药。耐久肠球菌对9 种抗生素耐药,对头孢曲松和红霉素中度耐药。
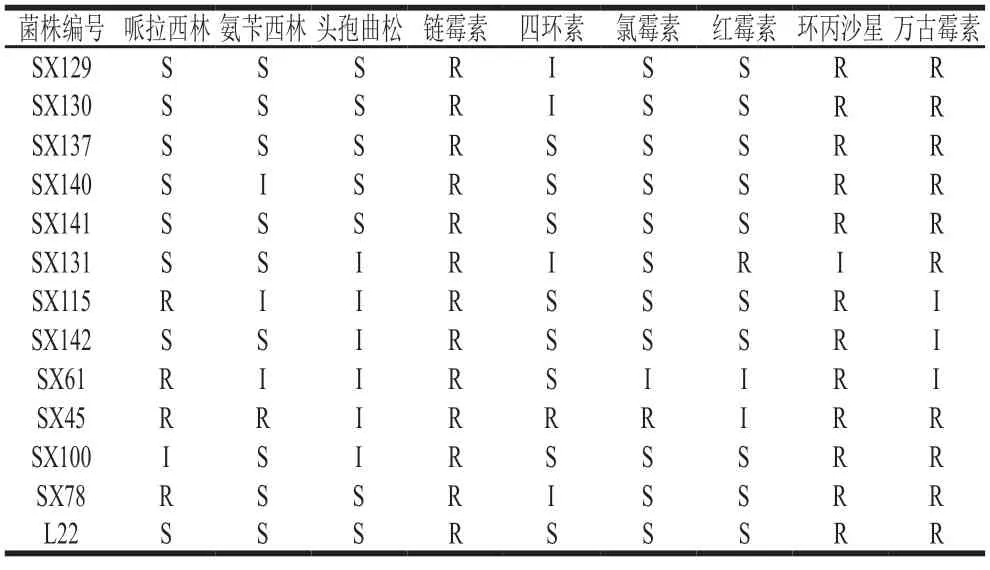
表4 12 株乳酸菌对不同抗生素的敏感性Table 4 Susceptibility of 12 lactic acid bacterial strains to different antibiotics
2.6 乳酸菌抗药性的基因型分析
根据特异性引物利用PCR技术对筛选获得的6 株乳酸菌的抗生素抗性基因进行分析,虽然所有菌株表现为环丙沙星和链霉素抗性,但这些菌株都不携带这两种抗生素的抗性基因。6 株乳酸菌中均检测出对万古霉素的抗药性基因vanX,琼脂糖凝胶电泳结果见图4。

图4 PCR扩增植物乳植杆菌和乳酸片球菌中万古霉素的抗药性基因vanXFig.4 Agarose gel electrophoresis of PCR amplified vanX gene from selected L.plantarum and P.acidilactici isolates
2.7 菌株生长曲线
根据益生特性实验结果,对益生潜力最大的6 株菌的生长曲线进行测定,结果见图5。5 株植物乳植杆菌生长情况相似,培养基OD600值皆于接种后4 h快速上升,进入对数生长期。接种后10 h进入细菌生长稳定期,24 h后的OD600达9.0~9.7。乳酸片球菌SX78在接种4 h后进入对数生长期,培养至12 h后进入生长稳定期,24 h后的OD600达7.1。
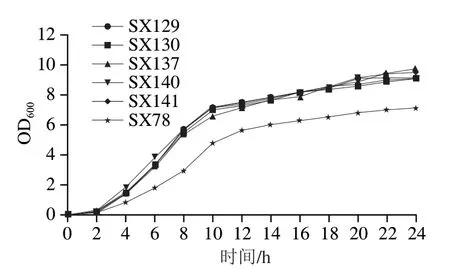
图5 植物乳植杆菌和乳酸片球菌生长曲线Fig.5 Growth curves of the selected L.plantarum and P.acidilactici isolates
3 讨论
本研究从林麝粪便样品中筛选获得12 株乳酸菌,通过细胞个体形态特征和16S rDNA序列分析鉴定,包括4 个属、6 个种,其中植物乳植杆菌5 株,屎肠球菌3 株,乳酸片球菌、肠膜明串珠菌、耐久肠球菌和短乳杆菌各1 株,随后对分离株进行体外益生性能评价,包括耐受性、抗病原菌活性、抗生素敏感性和菌体表面特性(菌体自聚集能力和表面疏水性)。
潜在益生菌的重要标准之一是能适应胃肠道中的苛刻环境(胃酸的低pH值以及小肠胆盐形成的高渗透压环境),这迫使益生菌必须具有耐酸和耐胆盐能力才能在肠道中存活[25]。许多研究认为pH 2~3是研究益生菌菌株耐酸性的最适pH值[26]。动物胆汁浓度是不恒定和不可预测的,往往随着饮食的改变而改变,一般选择胆盐质量分数在0.3%~1.0%范围内[27]。结合Luo Yan等[12]对林麝乳酸菌的研究报道,本研究采用pH 2、3和4考察菌株的耐酸能力,采用胆盐质量分数0.5%和1.0%作为考察菌株耐胆盐的指标。结果表明,所有乳酸菌对低pH值(pH 3和pH 4)和胆盐(0.5%和1.0%)均具有良好的耐受性,表现出不同的存活率,说明乳酸菌的耐受能力具有菌株特异性[28]。植物乳植杆菌和乳酸片球菌在pH 3的环境中,存活率分别最高达90.5%和89.5%。在质量分数1.0%胆盐环境中,存活率分别最高达89.5%和73.5%,高于之前报道的乳酸菌在相同条件下的存活率[12,25,28-29]。所有分离株在pH 2的环境下存活率大幅下降,这与前人报道的“许多益生菌在pH 2或更低的条件下,菌株的存活率显著下降”这一结果[29]相似。
体外对致病菌的抗菌活性被认为是益生菌的重要益生特性。本研究评价12 株乳酸菌对常见肠道病原菌的抑菌活性。植物乳植杆菌和乳酸片球菌上清液对5 种病原菌均表现出抗菌作用,其中对大肠杆菌、肠炎沙门氏菌、金黄色葡萄球菌和铜绿假单胞菌的抑菌性(抑菌圈直径>16 mm)优于先前的报道[12,25,30]。短乳杆菌、肠球菌和肠膜明串珠菌对病原菌的抗菌活性较弱,或者无抑菌活性。所有的菌株上清液被中和后(pH 6),抗菌活性大幅降低(数据没有列出),说明分离株的抑制特性主要归因于有机酸的产生。本研究首次报道了植物乳植杆菌和乳酸片球菌对林麝源化脓隐秘杆菌具有一定程度的抑制作用,抑制效果优于其他菌株,这可能与其发酵pH值有关。植物乳植杆菌和乳酸片球菌在培养24 h后pH值在3.8~3.9,其他几株分离株pH值在4.0~4.5。Luo Yan等[12]研究报道乳酸菌的抑菌活性与其发酵pH值有关,其发酵pH值越低,抑菌活性越强。
细菌的黏附能力被认为是益生菌选择的重要标准[31]。尽管在本研究中没有直接探究乳酸菌对上皮细胞的黏附能力,但通过自聚集能力和疏水特性来间接评估其黏附能力。益生菌的自聚集能力影响其对肠上皮细胞的黏附[32]。本研究测定植物乳植杆菌、肠球菌和乳酸片球菌在6 h后,自聚集率达到了50.9%~56.8%,与之前报道的结果[10]相似。疏水性使得益生菌与宿主上皮细胞之间的相互作用增加[31]。本研究通过与氯仿的相互作用模拟黏附于肠上皮细胞的能力。参照Lu Youyou等[33]报道对疏水性程度的划分标准,12 株分离菌中有7 株表面疏水率在52.4%~56.0%之间,表明它们可能具有较高的黏附性,这是菌株能够发挥其潜在功能的重要前提。其中植物乳植杆菌的疏水率最高达56%,其次为屎肠球菌(53.5%)和乳酸片球菌(52.9%),这与之前文献报道乳酸菌的疏水率在60%[33]结果相似。结合自聚集能力评估结果,推断植物乳植杆菌、屎肠球菌和乳酸片球菌可能具有较高的黏附活性,易黏附于肠道细胞发挥益生作用。
益生菌的一个重要安全要求就是不可携带可转移抗性基因,因此益生菌的候选菌株必须鉴定其抗生素敏感性,并有必要进行抗性基因的测定和可转移性分析[34]。本研究评价了12 株乳酸菌对9 种抗生素的耐药性。大部分菌株表现出对链霉素、环丙沙星和万古霉素高耐药性,这与之前报道的结果[10,29]相似。4 株肠球菌对6 种抗生素的敏感性存在较大差异,说明肠球菌对抗菌药物的敏感性具有种属依赖性[12]。先前研究表明,屎肠球菌对万古霉素具有高耐药性[12],但本研究测试的3 株屎肠球菌对万古霉素呈现中度耐药。结合体外益生菌评价实验的结果,本研究筛选出具有良好益生潜力的5 株植物乳植杆菌和1 株乳酸片球菌作为益生菌候选菌株,进一步对这6 株乳酸菌进行抗药性基因分析。结果发现,抗性表型与基因型差异很大,尽管菌株表现出对环丙沙星和链霉素的抗性,但是没有扩增到环丙沙星和链霉素的抗性基因,说明这些乳酸菌表现出的抗性属于固有抗性,其抗性产生可能与细胞膜对该抗生素的低渗透性有关[30,33],一般这类抗性是安全的,不发生基因转移。此外,筛选出的6 株乳酸菌均检测出万古霉素抗性基因vanX,这与之前报道的vanX基因广泛存在于乳酸菌中结论一致[35]。有研究表明,vanX基因负责编码蛋白D,D-二肽酶,导致肽聚糖前体的合成终止于D-丙氨酸-D-乳酸而不是D-丙氨酸-D-丙氨酸,从而消除药物靶点[36]。这种耐药性通常是染色体编码的,被认为是固有耐药,它们的基因已经被证明是不可转移的[37]。
此外,对筛选出的6 株乳酸菌在MRS肉汤培养基中的生长曲线进行测定。结果表明,乳酸菌在接种4 h进入对数生长期,10~12 h后进入稳定期,这与前人报道[38]基本一致。值得注意的是,本实验测定的植物乳植杆菌和乳酸片球菌在培养24 h后的OD600分别达9.0和7.1左右,高于文献报道的从其他动物肠道中分离的乳酸菌生长OD600值(3.0~4.0)[39-40],这可能和菌株来源不同有关,说明林麝肠道中的植物乳植杆菌和乳酸片球菌具有快速生长的特点。
4 结论
本研究从林麝粪便中分离筛选出12 株乳酸菌,采用16S rDNA测序对乳酸菌进行种水平鉴定。以现有的商品化益生菌作为对照,通过耐酸耐胆盐能力、抗生素敏感性、拮抗活性、自聚集能力和细胞表面疏水性等益生特性研究,筛选出5 株植物乳植杆菌和1 株乳酸片球菌,它们具有较好的益生特性和快速生长的特点,但还需要进一步的体内研究证实其应用潜力。本研究揭示了从林麝肠道中收集的乳酸菌分离株的益生特性,为研制出能够充分适应林麝肠道环境、改善林麝健康状况的益生菌制剂提拱了可靠的菌种来源。

