胰激肽原酶肠溶片联合羟苯磺酸钙治疗糖尿病周围神经病变的效果分析
夏 虹
(常州市金坛第一人民医院内分泌科,江苏 常州 213200)
糖尿病周围神经病变(DPN)是糖尿病并发症中的常见类型,发病率高达50%~70%,以肢体疼痛、麻木、感觉减退、跟腱及肌腱反射减弱为主要特征,可累及运动及感觉神经,若未及时治疗可增加致残率,使患者的生活质量急剧下降[1]。对于DPN,目前临床仍以药物治疗为主。羟苯磺酸钙具有抗炎、抗氧化、保护血管、改善微循环的作用,是DPN 常用的治疗药物,但单独应用效果欠佳[2]。胰激肽原酶肠溶片是一种血管舒张剂,在扩张血管、改善组织血流灌注、增加神经营养因子等方面作用显著[3]。本研究选择2021 年3 月至2023 年3 月收治的90 例DPN 患者为研究对象,探讨胰激肽原酶肠溶片联合羟苯磺酸钙治疗本病的效果,现报道如下。
1 资料与方法
1.1 一般资料
选择90 例DPN 患者为研究对象,受试者纳入时间2021 年3 月至2023 年3 月。纳入标准:所有患者均符合《糖尿病周围神经病变体检标准化教程》[4]中DPN 的诊断标准;无药物过敏史;肝肾功能正常;临床资料完整;知晓用药方案后表示自愿配合。排除标准:肾功能衰竭;合并严重心脑血管疾病;合并精神心理疾病;处于妊娠期或哺乳期;凝血功能异常;合并恶性肿瘤;有用药禁忌;并发糖尿病足溃疡;治疗依从性差。受试者分组方式以用药方案为依据,各45 例,其中对照组中男24 例,女21 例,年龄35 ~72 岁,均值(50.65±7.28)岁;体重48 ~87 kg,均值(61.24±3.72)kg;糖尿病病程2 ~15 年,均值(7.68±2.34)年;DPN 病程0.5 ~7年,均值(3.42±0.76)年。研究组中男25 例,女20例,年龄34 ~73 岁,均值(50.42±7.33)岁;体重45 ~85 kg,均值(61.35±3.68)kg;糖尿病病程2 ~16年,均值(7.74±2.25)年;DPN 病程0.5 ~6 年,均值(3.39±0.57)年。在上述资料方面两组之间差异无统计学意义(P>0.05)。
1.2 方法
所有患者均给予饮食运动干预,同时口服降糖药物或注射胰岛素,控制血糖水平。对照组患者在此基础上口服羟苯磺酸钙胶囊(上海朝晖药业有限公司,国药准字H20030088,规格0.5 g/s)治疗,每次2 粒,每日3 次。研究组患者在对照组基础上联合口服胰激肽原酶肠溶片(常州千红生化制药股份有限公司,国药准字H19993089,规格120 U/s)治疗,每次1 片,每日3 次。两组均连续治疗2 个月。
1.3 观察指标
1.3.1 治疗效果 疗效评价标准[5]:显效,治疗后临床症状完全消失,患者触觉及温度觉显著好转或已恢复正常,神经传导速度恢复正常或提升5 m/s 以上;有效,治疗后临床症状显著缓解,患者触觉及温度觉有所好转,神经传导速度提升3 ~5 m/s;无效,未达到上述标准;总有效率=(显效例数+有效例数)/总例数×100%。
1.3.2 症状评分 采用密歇根糖尿病周围神经病变评分法(MDNS)及多伦多临床评分系统(TCSS)评估治疗前后患者临床症状的严重程度,MDNS分值范围0 ~45分,TCSS 总分19 分,二者评分越低表示症状越轻[6]。
1.3.3 神经传导速度 治疗前后采用NDI-092 型肌电图/诱发电位仪检测患者正中神经与腓总神经的运动传导速度(MNCV)及感觉传导速度(SNCV)。
1.3.4 血清学指标 治疗前后采集患者空腹状态下外周静脉血5 mL,离心后分离血清、血浆,检测仪器选择雅培C8000 型全自动生化分析仪,白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)采用酶联免疫吸附法测定,超敏C 反应蛋白(Hs-CRP)采用速率散射比浊法测定,丙二醛(MDA)采用硫代巴比妥酸法测定,超氧化物歧化酶(SOD)采用黄嘌呤氧化酶法测定。
1.3.5 用药安全性 记录患者用药后恶心呕吐、头晕等不良反应的发生情况。
1.4 统计学方法
2 结果
2.1 两组治疗效果对比
在治疗总有效率方面,研究组95.56%较对照组80.00%高,组间相比差异显著(P<0.05)。详见表1。
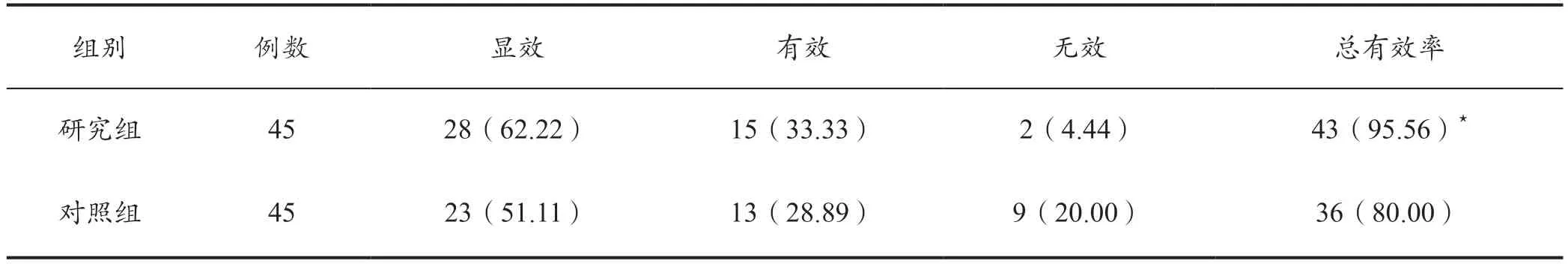
表1 两组治疗效果对比[例(%)]
2.2 两组治疗前后TCSS 评分、MDNS 评分对比
治疗前,两组TCSS 评分、MDNS 评分差异不明显(P>0.05)。治疗后,两组的TCSS 评分、MDNS 评分较治疗前均明显降低,且相比于对照组,研究组降低更为显著(P<0.05)。详见表2。
表2 两组治疗前后TCSS 评分、MDNS 评分对比(分,±s)
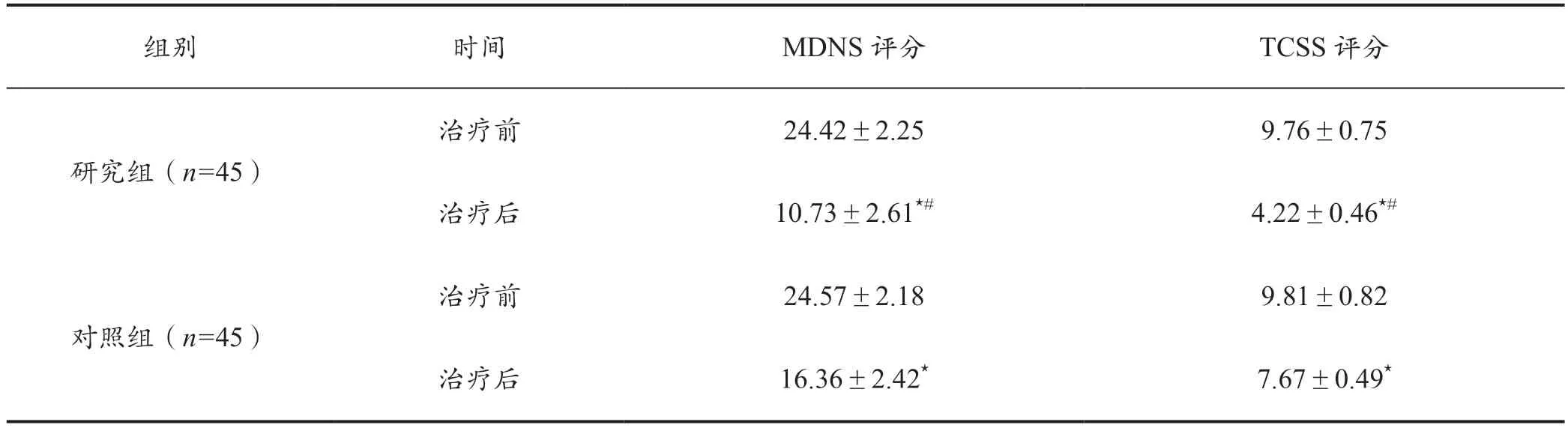
表2 两组治疗前后TCSS 评分、MDNS 评分对比(分,±s)
注:组内比较,⋆P <0.05;组间比较,#P <0.05。
组别 时间 MDNS 评分 TCSS 评分研究组(n=45)对照组(n=45)治疗前 24.42±2.25 9.76±0.75治疗后 10.73±2.61⋆# 4.22±0.46⋆#治疗前 24.57±2.18 9.81±0.82治疗后 16.36±2.42⋆ 7.67±0.49⋆
2.3 两组治疗前后神经传导速度对比
治疗前,两组正中神经与腓总神经的MNCV、SNCV 差异不明显(P>0.05)。治疗后,两组正中神经与腓总神经的MNCV、SNCV 较治疗前均明显升高,且相比于对照组研究组升高更为显著(P<0.05)。详见表3。
表3 两组治疗前后神经传导速度对比(m/s,±s)

表3 两组治疗前后神经传导速度对比(m/s,±s)
注:组内比较,⋆P <0.05;组间比较,#P <0.05。
正中神经 腓总神经组别 时间MNCV SNCV MNCV SNCV研究组(n=45)对照组(n=45)治疗前 41.57±3.83 40.73±4.45 31.21±3.53 31.47±3.56治疗后 52.34±5.21⋆# 51.12±4.28⋆# 40.46±4.42⋆# 44.28±4.79⋆#治疗前 41.69±4.08 40.47±4.55 31.25±3.39 31.32±3.58治疗后 47.54±4.53⋆ 46.18±4.26⋆ 35.82±4.57⋆ 37.41±4.13⋆
2.4 两组治疗前后氧化应激指标及炎性因子水平对比
治疗前,两组SOD、MDA、TNF-α、IL-6、hs-CRP水平差异不明显(P>0.05)。治疗后,两组各氧化应激指标与炎性因子水平较治疗前均明显改善,且相比于对照组研究组改善更为显著(P<0.05)。详见表4。
表4 两组治疗前后氧化应激指标及炎性因子水平对比(±s)
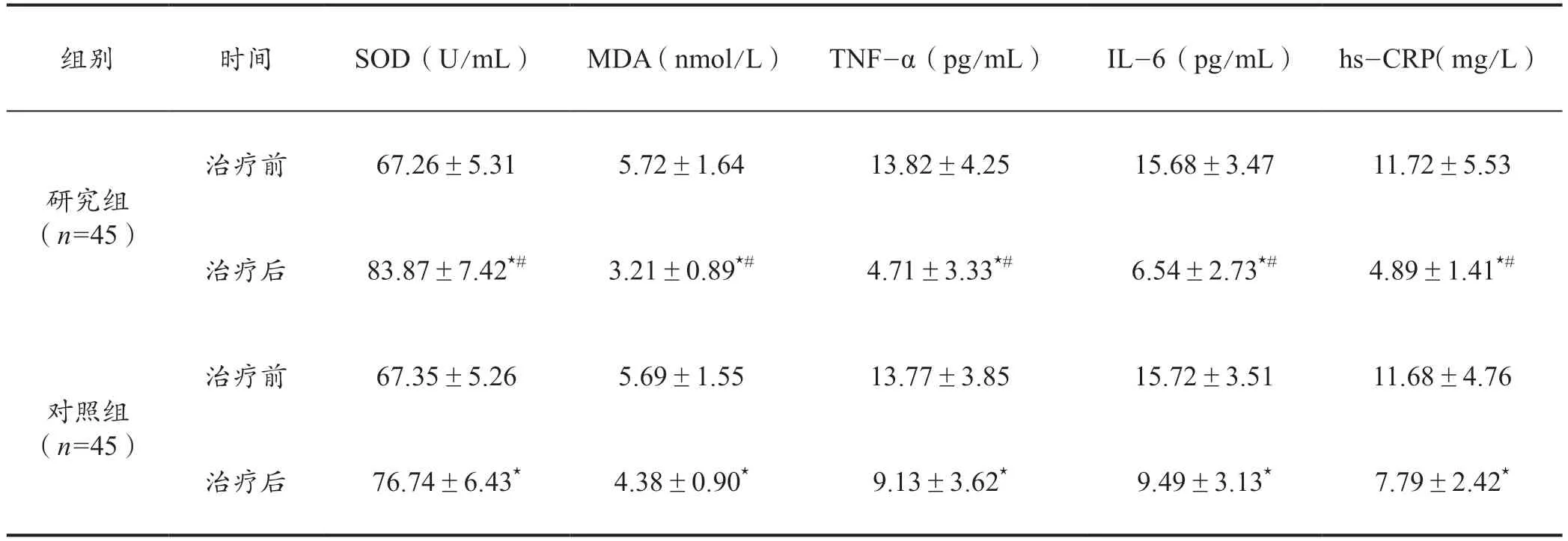
表4 两组治疗前后氧化应激指标及炎性因子水平对比(±s)
注:组间比较,⋆P <0.05;组间比较,#P <0.05。
组别 时间 SOD(U/mL) MDA(nmol/L) TNF-α(pg/mL) IL-6(pg/mL) hs-CRP(mg/L)研究组(n=45)对照组(n=45)治疗前 67.26±5.31 5.72±1.64 13.82±4.25 15.68±3.47 11.72±5.53治疗后 83.87±7.42⋆# 3.21±0.89⋆# 4.71±3.33⋆# 6.54±2.73⋆# 4.89±1.41⋆#治疗前 67.35±5.26 5.69±1.55 13.77±3.85 15.72±3.51 11.68±4.76治疗后 76.74±6.43⋆ 4.38±0.90⋆ 9.13±3.62⋆ 9.49±3.13⋆ 7.79±2.42⋆
2.5 两组用药安全性对比
在不良反应发生率方面,两组之间差异无统计学意义(P>0.05)。详见表5。

表5 两组不良反应发生率对比[例(%)]
3 讨论
DPN 的发病机制目前尚未完全明确,但大多学者均认为与氧化应激损伤、机体炎症、微血管病变、血流动力学改变及神经营养因子减少等多种因素有关,因此常以营养神经、改善微循环、控制血糖水平为主要治疗原则[7]。氧化应激被认为是DPN 的主要病理基础,不仅可损伤神经细胞及血管,还可促进血栓形成,导致肢端血氧供应不足而造成运动、感觉障碍,促进病情进展[8]。羟苯磺酸钙可有效改善血管通透性,增强血管壁抵抗力,抑制血小板聚集,减轻血管内皮损伤,改善血管功能,另外还可抗氧化、抑制炎症反应,在各类血管性疾病中的治疗效果已被临床认可,但在DPN 的治疗中单独使用该药治疗效果经常难以满足临床预期[9-10]。胰激肽原酶肠溶片可降解激肽原,释放出激肽,从而松弛血管平滑肌,通过抑制磷脂酶A2 促进前列腺素的分泌,抑制血小板聚集,从而发挥扩张血管、改善微循环的作用。另外,胰激肽原酶还可激活纤溶酶原,对特定的神经元分布、成长及功能产生影响,改善血流动力学及神经营养因子不足的情况[11]。胰激肽原酶肠溶片与羟苯磺酸钙联合应用可充分发挥各自优势,协同提高DPN 的治疗效果,改善神经传导速度,控制病情进展。
本研究结果显示,在治疗总有效率方面,研究组95.56%较对照组80.00%高,组间相比差异显著(P<0.05);治疗后,两组的MDNS 评分与TCSS 评分较治疗前均明显降低,且相比于对照组,研究组降低更为显著(P<0.05);治疗后,两组正中神经与腓总神经的MNCV、SNCV 较治疗前均明显升高,且相比于对照组,研究组升高更为显著(P<0.05);治疗后,两组各氧化应激指标与炎性因子水平较治疗前均明显改善,且相比于对照组,研究组改善更为显著(P<0.05);在不良反应发生率方面,两组比较差异无统计学意义(P>0.05)。可见,在DPN 的治疗中联合应用胰激肽原酶肠溶片与羟苯磺酸钙可有效改善患者的临床症状与神经传导速度,减轻机体的氧化应激及炎症反应,提升治疗效果,对病情控制具有积极意义,且治疗安全性高。

