肠道菌群通过去乙酰化酶3激活单磷酸腺苷活化的蛋白激酶/雷帕霉素信号通路对脓毒症心肌炎和心肌细胞线粒体损伤的影响
林爽 翟京宇 罗彬
脓毒症心肌炎是由脓毒症引起的心肌炎症反应,可造成严重的心肌功能损伤,其特征是左心室射血分数降低和左心室扩张受限[1-4]。研究表明,线粒体损伤与脓毒症心肌炎密切相关[5]。去乙酰化酶3(SIRT3)主要表达于线粒体,其调控的单磷酸腺苷活化的蛋白激酶(AMPK)/雷帕霉素(mTOR)信号通路不仅可改善线粒体损伤,也能修复脓毒症中的炎症损伤[6-7]。但在脓毒症心肌炎中,SIRT3调控的AMPK/mTOR信号通路对线粒体损伤的调控作用尚不清楚。实验表明,肠道粪菌移植(FMT)是改善脓毒症心肌炎的一种有效工具[8],该治疗可减轻脓毒症中的炎症反应和氧化损伤[9],表明其在治疗脓毒症方面具有很大的潜力。然而,肠道菌群对脓毒症心肌炎和心肌细胞线粒体损伤的具体调控作用并不清楚。本研究探讨正常肠道FMT对脓毒症心肌炎和心肌细胞线粒体损伤的改善作用与机制。
材料与方法
1.材料:10周龄的雄性SD大鼠40只(219.5g~242.8g)购于新疆医科大学第四附属医院实验动物中心。SIRT3、AMPK、mTOR、磷酸化AMPK(p-AMPK)、磷酸化mTOR(p-mTOR)、NOD样受体热蛋白结构域相关蛋白3(NLRP3)、IL-1β、磷酸甘油醛脱氢酶(GAPDH)的一抗和辣根过氧化物酶(HRP)标记的山羊抗兔二抗均购自于英国Abcam公司;SIRT3的抑制剂3-TYP(HY-108331)购于美国MCE公司;IL-1β、IL-6、肿瘤坏死因子(TNF)-α的ELISA试剂盒均购于上海碧云天生物科技有限公司。
2.方法
(1)分组及手术方式:40只SD大鼠在控温环境(21 ℃~23 ℃)进行饲养,12 h光/12 h暗交替循环,并自由摄取标准鼠粮和自来水。将其随机分为盲肠结扎穿孔术(CLP)建立的脓毒症模型组(CLP组)、假手术对照组(sham组)、FMT治疗组(CLP+FMT组)及FMT联合SIRT3抑制剂(3-TYP)治疗组(CLP+FMT+3-TYP组),每组各10只。所有大鼠均接受腹腔注射4%戊巴比妥(0.2 ml/kg)麻醉,CLP组大鼠在手术剖腹后,先用不可吸收的缝线在第一个盲肠上进行结扎,再用50 ml注射器针制造两对小孔,部分肠内内容物被挤出,返回腹腔,伤口闭合。sham组大鼠进行开腹和闭腹术,未行CLP。在无菌环境下收集大鼠正常粪便标本,粪便标本用0.9%生理盐水均匀化(200 mg/ml),然后以2 000 rpm转速离心10 min后收集上清液作为正常菌群菌液。CLP+FMT组大鼠在CLP术前30 min用灭菌导管经肛门插入深约5 cm后缓慢注入5 ml上述方法收集的菌液,然后将大鼠倒置3~5 min,其余步骤同CLP组,并在CLP术后1~8天,每天继续注入菌液1次。CLP+FMT+3-TYP组同CLP+FMT组的操作并在术后立即尾静脉注射3-TYP(30 mg/kg),且在CLP术后1~8天,每天注射1次3-TYP(30 mg/kg)。8天后收集所有大鼠新鲜血液和心肌组织,并用福尔马林固定心肌组织,用于石蜡切片和电镜观察。新鲜的心肌组织保存于-80 ℃冰箱中。本实验所有大鼠的研究均经过新疆医科大学第四附属医院伦理委员会审批通过。
(2)HE染色:采用HE染色观察sham组和CLP组大鼠心肌组织的病理变化,包括形态变化和炎性细胞浸润情况。
(3)ELISA:采用ELISA法对4组大鼠血液中IL-1β、IL-6、TNF-α的水平进行检测。
(4)Western blot:将大鼠新鲜心肌组织匀浆后取总蛋白,采用Western blot检测IL-1β、NLRP3、SIRT3、AMPK、p-AMPK、mTOR及p-mTOR的表达水平。
(5)透射电镜:使用HT7700日立显微镜对大鼠心肌组织进行透射电镜检测。大鼠新鲜心肌组织剪碎经胰酶消化后,以1 500 rpm离心5 min。用4%多聚甲醛孵育后固定于聚醋酸甲基乙烯脂-镍网上。1 min后,滴加1%磷钨酸溶液10 μl,静置1 min,然后用滤纸将多余的液体从网边缘吸去。得到的样品在室温空气中干燥10 min,最后用透射电镜观察心肌细胞线粒体形态。
(6)流式细胞术:用胰酶消化4组大鼠的心肌组织,以1 500 rpm离心5 min,在0.5 ml细胞培养液中重悬,然后用10 nmol/L荧光阳离子染料TMRM在37 ℃下培养30 min。采用流式细胞仪检测荧光水平,分析各组大鼠心肌细胞的线粒体膜电位变化。
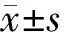
结 果
1.脓毒症心肌炎大鼠模型建立情况:与sham组比较,CLP组大鼠心肌组织出现显著的炎性细胞浸润,且心肌组织IL-1β[(11.27±2.02)比(1.00±0.03)]和NLRP3[(5.59±0.58)比(1.00±0.01)]表达水平均显著升高(P<0.05),表明CLP诱导的脓毒症心肌炎大鼠模型建立成功。见图1。
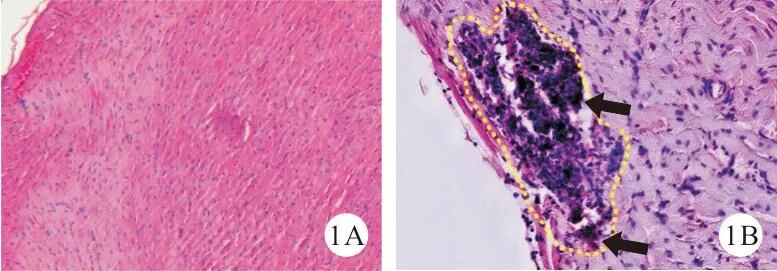
图1 sham组和CLP组大鼠心肌组织(A:sham组;B:CLP组,箭头所示为炎性细胞;HE染色,×200)
2.4组大鼠心肌组织与血液中相关指标比较:与sham组比较,CLP组、CLP+FMT组、CLP+FMT+3-TYP组心肌组织SIRT3和p-mTOR表达水平均显著降低,而心肌组织p-AMPK和血液中IL-1β、IL-6及TNF-α表达水平均显著增加(P<0.05)。与CLP组比较,CLP+FMT组心肌组织SIRT3和p-mTOR的表达水平均显著增加,而心肌组织p-AMPK和血液中IL-1β、IL-6及TNF-α表达水平均显著降低(P<0.05)。与CLP+FMT组比较,CLP+FMT+3-TYP组心肌组织SIRT3和p-mTOR的表达水平均显著降低,而心肌组织中p-AMPK和血液中IL-1β、IL-6及TNF-α表达水平均显著增加(P<0.05)。见表1。
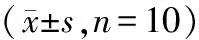
表1 4组大鼠心肌组织与血液中相关指标比较
3.4组大鼠心肌细胞线粒体损伤情况比较:sham组、CLP组、CLP+FMT组与CLP+FMT+3-TYP组大鼠红/绿荧光强度比值分别为0.24±0.04、0.07±0.01、0.19±0.03、0.10±0.02,4组间比较差异有统计学意义(F=86.335,P=0.021)。与sham组比较,CLP组心肌细胞线粒体发生肿胀、线粒体膜发生了严重裂解,而且线粒体膜电位的红/绿荧光强度比值显著下降;与CLP组比较,CLP+FMT组心肌细胞线粒体也发生了肿胀但线粒体膜是完整的,且线粒体膜电位的红/绿荧光强度比值显著增加;与CLP+FMT组比较,CLP+FMT+3-TYP组中心肌细胞线粒体发生膨胀和线粒体膜的完整性降低,且线粒体膜电位的红/绿荧光强度比值显著下降(P<0.05)。见图2。
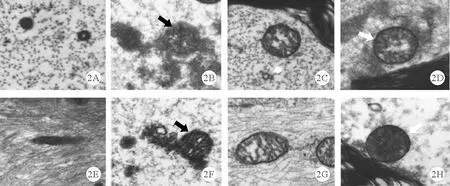
图2 4组大鼠心肌组织线粒体损伤情况(A、E:sham组;B、F:CLP组;C、G:CLP+FMT组;D、H:CLP+FMT+3-TYP组;A、B、C、D:横截面;E、F、G、H:纵切面;黑色箭头:线粒体膜破裂;白色箭头:线粒体膜少量破裂;×10 000)
讨 论
本文采用CLP建立脓毒症心肌炎大鼠模型,观察到CLP可显著诱导大鼠脓毒症心肌炎和心肌细胞的线粒体损伤,而FMT治疗对线粒体损伤和心肌炎有明显的改善作用。此外,正常肠道菌群的治疗作用依赖于SIRT3激活的AMPK/mTOR信号通路,而抑制SIRT3后导致AMPK/mTOR信号通路失活可减弱肠道菌群对线粒体功能和心肌炎的改善作用。因此,正常肠道菌群可通过SIRT3激活AMPK/mTOR信号通路对脓毒症心肌炎和心肌细胞线粒体损伤均有改善作用。症心肌炎和线粒体损伤。
已知SIRT3可通过减少氧化损伤和炎症反应,对线粒体损伤起保护作用[10],且SIRT3通过增加AMPK/mTOR介导的自噬对脓毒症诱导的肾损伤起改善作用[11]。本研究结果发现CLP术后SIRT3表达降低,提示SIRT3可能在此过程中扮演重要角色。研究证实,SIRT3的激活尤其是对下游信号AMPK/mTOR的激活促进了细胞自噬[12]。本研究同样证实上调SIRT3可显著促进AMPK/mTOR信号轴激活,且当抑制SIRT3后p-mTOR水平显著降低,表明SIRT3也可能对脓毒症导致的心脏功能损伤有修复作用,这些作用伴随着p-AMPK上调和p-mTOR下调。这些结果强调了在脓毒症心肌炎模型中,干预SIRT3从而调控AMPK/mTOR信号通路对炎症和线粒体损伤改善作用的重要性。
细胞线粒体损伤由mTOR作为主要途径进行调节[13]。在有害刺激下,维持心功能正常的关键因素是维持细胞能量和代谢稳定。而mTOR信号被认为是代谢应激条件下细胞能量的主要调节因子,因其可通过抑制ATP消耗的合成代谢通路和激活分解代谢通路来建立ATP稳态[14]。本研究使用肠道菌群治疗模型大鼠,观察到正常肠道FMT可明显激活AMPK/mTOR信号通路,并显著减少心肌组织中NLRP3和IL-1β及血液中炎症因子水平,此外我们通过透射电镜平台观察到正常肠道FMT可显著保护线粒体膜并防止其破裂。而当使用SIRT3特异性抑制剂后肠道菌群对线粒体的保护作用和对促炎反应的抑制作用均显著减弱。Zhao等[11]的研究也表明,SIRT3对线粒体具有保护作用,当敲除SIRT3后脓毒症明显加重,而当重新激活AMPK/mTOR信号通路后SIRT3的保护作用显著恢复,该研究支持了我们的结果。基于此,本实验表明,正常肠道FMT可改善脓毒症心肌炎和减缓线粒体损伤,其关键机制是SIRT3-AMPK/mTOR通路激活。本研究存在一些局限性:首先,对动物模型分离的心肌组织和心肌组织酶解后的细胞进行了分析,但缺乏具体的体外细胞实验结果的验证;其次,样本数量仍较少,需进一步扩大样本进行体内外研究。
综上所述,肠道菌群通过SIRT3激活AMPK/mTOR信号通路改善脓毒症心肌炎和心肌细胞线粒体损伤。肠道菌群可能是极具潜力的脓毒症心肌炎和线粒体损伤的保护策略,SIRT3-AMPK/mTOR信号轴是潜在抑制脓毒症心肌损伤、炎症反应和线粒体损伤的关键治疗靶点。

