绵羊肺炎支原体小鼠感染模型的建立
杜改梅,王 月,茅慧华,雷卫强,储岳峰,刘茂军,3,4*
(1.金陵科技学院动物科学与食品工程学院,南京 210038;2.中国农业科学院兰州兽医研究所/兰州大学动物医学与生物安全学院/动物疫病防控全国重点实验室,兰州 730000;3.江苏省农业科学院兽医研究所,农业农村部兽用生物制品工程技术重点实验室,南京 210014;4.兽用生物制品(泰州)国泰技术创新中心,泰州 225300)
绵羊肺炎支原体(Mycoplasmaovipneumoniae,Mo)是引起绵羊和山羊支原体肺炎的主要病原体之一,该病呈全球性流行,不同年龄的羊均可感染,羔羊最易感,发病率高达90%[1-2]。羊感染后病变主要在肺组织,剖解可见肺尖叶、心叶有实变区[3-4],主要临床表现为咳嗽、流涕、呼吸困难、生长发育迟缓、消瘦等,这给养殖业造成巨大经济损失,严重威胁着养羊业的健康快速发展。目前,该病主要通过疫苗免疫和药物进行防治。疫苗研究国内外虽有较多报道,但由于Mo分离株之间存在高度基因多态性,致使菌株间毒力和免疫原性差异较大,使疫苗的交叉保护力不理想[5]。药物防治主要以抗生素为主,其虽具有一定疗效,但不能从根源上消除感染,疾病容易复发,且易产生细菌耐药性和药物残留等[6],给生态环境、人类和动物健康造成严重危害。目前在Mo致病机制、免疫机制等方面也尚未得到明确的结论。阐明该病的致病机理,研制出有效预防该病的疫苗和治疗用新型药物是该病防控的关键。而稳定的感染动物模型是疫苗评估和药物疗效反应的基础保障,也是研究阐明病原体和宿主相互作用机制的必要平台。
实验用Mo阴性羊筛选困难,Mo人工感染羊发病模型难建立,现虽已有较多羊发病模型的研究报道[7-10],但研究结果差异较大,不同品种羊对绵羊肺炎支原体易感性不同[11],致使后续研究进展缓慢,且实验羊成本高和饲养条件等诸多因素均阻碍了绵羊肺炎支原体致病和免疫机制的研究以及疫苗和药物的研发。小鼠是应用最为广泛的一种实验动物,其成本低,饲养方便,是建立病理模型较常用的实验动物,具有较好的稳定性,且易于标准化。而目前尚未见绵羊肺炎支原体小鼠发病模型的相关研究报道。因此,本研究通过体外分离培养Mo,感染小鼠,通过分析感染小鼠肺病变特点、肺组织抗原载量、血清抗体水平,筛选出绵羊肺炎支原体感染小鼠方法,为绵羊肺炎支原体感染模型的建立提供新思路和新方法,为今后该病的致病机理、免疫机制和防治策略等研究奠定重要基础。
1 材料与方法
1.1 材料
病料样品来自于某羊场疑似绵羊支原体肺炎的病羊肺组织,酶标二抗(Goat anti-mouse IgG-HRP)购自BETHYL。SPF健康BALB/c小鼠购于江宁区青龙山动物繁殖场。
1.2 分离培养
将肺组织病样用支原体培养基清洗3~5次,培养基组成:MEM培养基55 mL、1.7%水解乳蛋白Hank′s缓冲液35 mL、25%酵母液2 mL、健康马血清10 mL、青霉素200 IU·mL-1、0.4%酚红0.18 mL。然后将肺组织置于培养液中用无菌剪刀在超净工作台剪碎为1 mm3小碎块,再用移液器反复吹打,使组织块尽量破裂,用0.45 μm微孔过滤器过滤,将滤液放置于37 ℃恒温培养箱中静置培养,每天观察记录培养基颜色变化情况和清澈度情况。连续培养5~7 d后观察有无支原体生长。变黄的菌液保存于-20 ℃备用。
1.3 分离培养物的PCR鉴定
采用PCR方法对本研究分离培养的病原菌进行分子生物学鉴定,具体方法为:取分离培养的变黄菌液5 mL,10 000 r·min-1离心20 min,用1 mL灭菌双蒸水将沉淀吹吸混匀,使用天根DNA提取试剂盒提取DNA进行Mo PCR检测,同时以双蒸水为DNA模板做阴性对照。参照GenBank中公布的HSP70基因序列,使用Primer 6.0软件设计扩增引物,上游引物序列:5′-ATGAAAGGAAAACAT-AATATGGC-3′,下游引物序列:5′-TTAGTTTTGTTTGATTTCAGCAT-3′,由南京擎科生物科技有限公司合成。PCR反应体系为20 μL:2×Rapid Taq Master Mix 10 μL,上下游引物各1 μL,DNA模板4 μL,ddH2O 4 μL。PCR扩增反应程序:95 ℃预变性5 min;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,共32个循环;72 ℃ 10 min。将PCR产物进行1.6%琼脂凝胶电泳检测,观察凝胶电泳成像结果,拍照。将PCR扩增条带回收进行序列测定。
1.4 感染菌液制备及含量测定
将鉴定为Mo的分离培养病原菌进行传代培养,连续传5代后,将新鲜培养物用于小鼠攻毒试验;同时,采用颜色变化单位(CCU)测定培养物浓度。方法为将传代菌液以1∶10接种于支原体培养基中,依次10倍倍比稀释10个梯度浓度,每次设4个平行重复,同时设置阴性对照,置于37 ℃恒温培养箱中静置培养,每天观察记录,连续培养10 d后,最终以管中颜色不再变化为止,且对照无变化,不再发生颜色变化的稀释倍数为菌液CCU。
1.5 动物试验
随机将60只8周龄的SPF健康BALB/c雄性小鼠(22 g±2 g)分为对照组、Mo感染组1、感染组2、感染组3和感染组4(n=12),所有小鼠自由饮水和采食,适应饲养一周后进行试验。小鼠感染Mo的详细试验方案见表1。
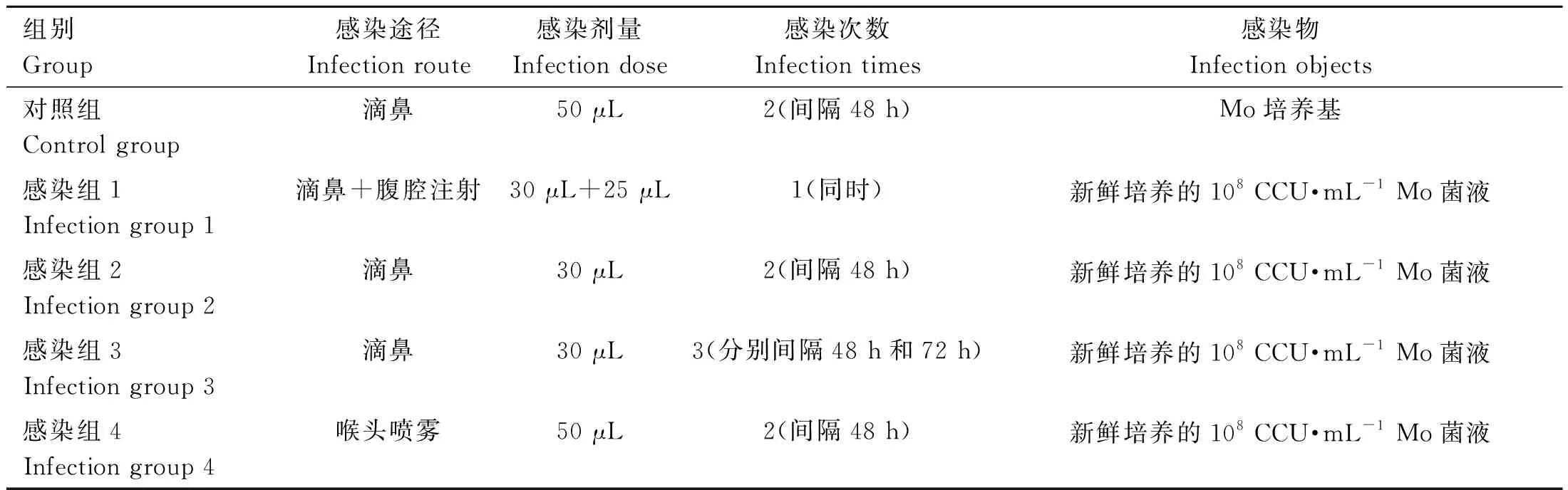
表1 小鼠感染绵羊肺炎支原体(Mo)的试验方案(n=12)Table 1 Experiment scheme of mice Mycoplasma ovipneumoniae (Mo) infection (n=12)
攻毒后每天观察小鼠的临床表现,分别在攻毒后第0、7和14 天禁食称量小鼠体重。试验第14天眼球采血并分离血清,乙醚麻醉后处死,剖检观察肺病理变化并进行病理评分[12],将肺病变评定为0~5分(无病变计为0分,出现病变记为1分,病变面积每超过20%累加1分)。HE染色进行肺组织病理学检查。qPCR检测小鼠肺组织中Mo载量(DNA拷贝数),间接ELISA检测血清中Mo IgG抗体水平。称量小鼠脾和肝质量,计算脏器系数。
1.6 肺组织病理组织学检查(HE染色)
将小鼠肺组织进行组织固定,常规脱水、石蜡包埋、切片和HE染色后,光镜下观察组织病理学改变,并对其病理损伤程度进行评分。形态改变根据轻重标记为“1分”“2分”“3分”“4分”,分别表示轻微、轻度、中度、重度,无病变标记为“0分”。
1.7 Mo DNA拷贝数检测
Mo感染后第14天,采集小鼠肺组织并称重,加裂解液研磨,采用动物组织DNA提取试剂盒(购自天恩泽生物技术有限公司)提取DNA。测定Mo全菌DNA标准品浓度,计算拷贝数,采用标准曲线法通过qPCR检测肺组织中Mo DNA拷贝数[13]。用灭菌双蒸水将Mo全菌DNA标准品进行10倍倍比稀释,101~108copies·μL-1。将标准品稀释物和待测样品DNA各取1 μL作为qPCR反应模板,同时以水做阴性对照。qPCR使用的引物Mo F:5′-ATGTTGACCACGGAAAAACC-3′,Mo R:5′-GG-CATAGTGACGCTTGTCTG-3′。qPCR反应体系为20 μL:2×Taq Pro Universal SYBR qPCR Master Mix 10 μL,上下游引物各0.5 μL,DNA模板2 μL,ddH2O 7.0 μL。qPCR扩增反应程序:95 ℃预变性5 min;95 ℃ 30 s,60 ℃ 30 s,共38个循环;60 ℃收集荧光信号,根据标准曲线计算得到每个待测样品的Mo DNA拷贝数。
1.8 血清Mo抗体检测方法
小鼠眼球采血,3 000 r·min-1离心15 min,分离血清。采用间接ELISA方法检测血清中Mo lgG抗体水平,参考文献[14]方法改进建立,将待检血清按1∶50稀释,HRP-山羊抗小鼠IgG按1∶4 000稀释,一抗和二抗作用时间均为37 ℃ 60 min,底物显色10 min,酶标仪检测OD450 nm值。PBS空白孔中以PBS缓冲液替代样品,阴性对照孔中以阴性小鼠血清替代样品。
1.9 统计学处理

2 结 果
2.1 分离培养和PCR鉴定
从肺组织中分离培养的菌株在培养基中37 ℃恒温培养5 d后,1∶10和1∶20稀释接种培养的培养基颜色均由红色变为黄色,且清亮不浑浊,阴性对照瓶培养基颜色仍为红色,没有发生变化。采用PCR方法从分离培养的菌液中扩增出一条与预期目的基因片段大小相符的DNA条带,大小约为1 815 bp,对照组没有条带(图1)。PCR扩增条带回收进行了测序分析,由测序结果可知,扩增条带的基因序列与Mo代表株NCTC10151(GenBank: LR215028.1)序列相似性为98.3%,表明分离菌株为绵羊肺炎支原体,命名为NJ01株。

M. DNA相对分子质量标准;1和2. 分离培养物;3. 空白对照M. DNA marker; 1 and 2. Isolated strain; 3. Blank control图1 绵羊肺炎支原体PCR鉴定Fig.1 PCR identification of Mycoplasma ovipneumoniae
2.2 小鼠临床表现
感染Mo后小鼠临床表现异样,Mo感染组1在感染后第6天出现被毛粗乱,但没有呼吸异常现象;感染组2和组4的小鼠在感染后第4天出现被毛粗乱和严重扎堆现象(图2),第13天因呼吸困难而各死亡1只,剖检发现肺严重充血和出血。感染组3小鼠第5天出现被毛粗乱,第8天1只小鼠呼吸加快。
2.3 Mo对小鼠体重的影响
从图3得知,对照组小鼠体重呈逐渐上升趋势,其它组小鼠体重在接种后第7天出现下降趋势,Mo感染组3和组4小鼠体重分别比对照组显著降低5.4%(P<0.05)和6.1%(P<0.05);第14天时各组小鼠体重呈逐渐上升趋势,但Mo感染组小鼠体重均显著低于对照组,感染组2和组4分别比对照组显著降低17.2%(P<0.05)和21.6%(P<0.05),且感染组2和组4显著低于感染组1和组3,这表明给小鼠攻毒Mo会影响其生长性能,使生长缓慢,2次滴鼻和喉头喷雾感染影响显著。
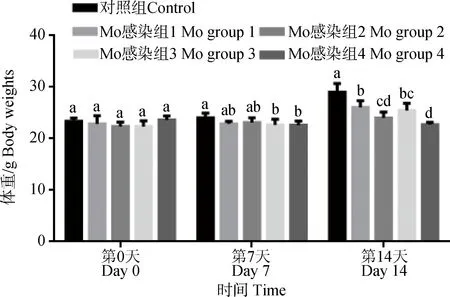
不同日龄点间差异用字母表示,字母不同表示差异显著(P<0.05)Means not sharing common letter differ significantly (P<0.05)图3 Mo感染对小鼠体重的影响(n=12)Fig.3 The effect of Mo infection on body weight of mice(n=12)
2.4 小鼠肺剖检病变观察及病理评分
对照组小鼠未见异常表现和肺病变。Mo感染组小鼠肺部出现不同程度的充血、出血和实变(箭头),其中Mo感染组2和组4小鼠肺部实变和出血严重,感染组1和组3有轻微出血和实变(图4)。Mo感染组1、组2、组3和组4的小鼠肺病变平均评分分别为2.0、3.5、2.5和3.3,其中Mo感染组2和组4均显著高于感染组1(P<0.05)和组3(P<0.05)(图5),这表明连续2次滴鼻或喉头喷雾攻毒均可以使小鼠感染并出现肺部严重病变。
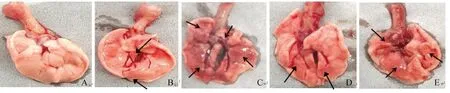
A. 对照小鼠肺;B~E. Mo感染组1~4小鼠肺A. Lung of control group mice, B-E. Lung of mice in Mo infected group 1-4图4 Mo感染后第14天小鼠肺病理变化Fig.4 Pathological anatomy of lung in mice on the 14th day post infection with Mo
2.5 小鼠肺组织病理组织学检查
如图6所示,对照组小鼠肺组织结构正常、完整,肺泡未见萎缩、塌陷,肺泡间隔未见明显充血、水肿及炎细胞浸润,各级支气管未见明显病理变化,标记为0分;Mo感染组1小鼠肺支气管/血管周围可见轻微炎细胞浸润,标记为1分,表示轻微;Mo感染组2小鼠肺可见轻微间质性肺炎,肺泡间隔增宽,其内可见少量单核细胞为主的炎细胞浸润,支气管管腔有轻度渗出及少量脱落支气管上皮细胞,标记为3分,表示中度;Mo感染组3小鼠肺可见轻度间质性肺炎,肺泡内可见以单核细胞为主的炎细胞浸润,标记为2分,表示轻度;Mo感染组4小鼠肺可见中度间质性肺炎,肺泡间隔增宽,其内可见以单核细胞为主的炎细胞浸润,支气管管腔内可见轻微渗出及少量脱落的支气管上皮细胞,标记为4分,表示重度。
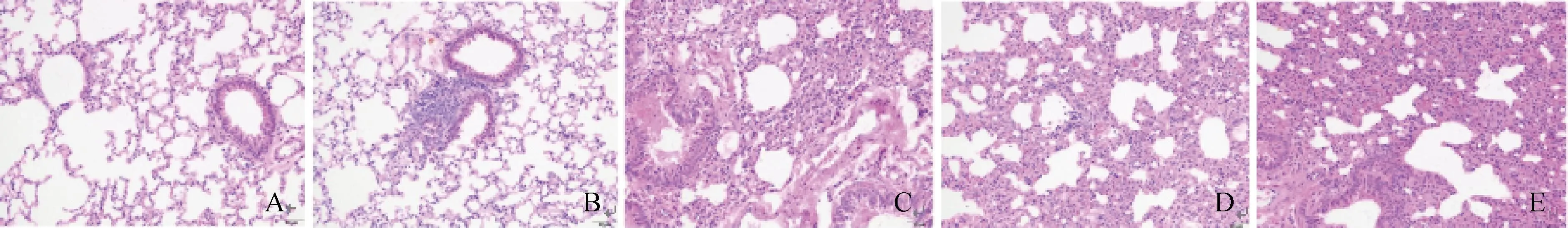
A. 对照小鼠肺组织;B~E. 依次为Mo感染组1-4小鼠肺组织A. Lung tissues of control group mice; B-E. Lung tissues of mice in Mo infected group 1-4图6 Mo感染第14天小鼠肺组织病理学检查(HE染色,200×)Fig.6 Histopathological examination of lung in mice on the 14th day post infection with Mo (HE staining,200×)
2.6 qPCR检测小鼠肺组织中Mo DNA拷贝数
根据标准曲线换算得到Mo感染组小鼠肺组织中Mo载量。由图7可知,对照组没有检测到Mo,Mo感染组1小鼠肺脏组织中DNA拷贝数为102.56拷贝·g-1;感染组3为103.21拷贝·g-1,且显著高于组1(P<0.05);Mo感染组2和组4的小鼠肺组织中Mo DNA拷贝数分别为103.84拷贝·g-1和103.77拷贝·g-1,均显著高于Mo感染组1(P<0.05)和组3(P<0.05)。这表明连续2次滴鼻或喷雾攻毒Mo可以使小鼠肺脏组织中Mo载量明显升高。
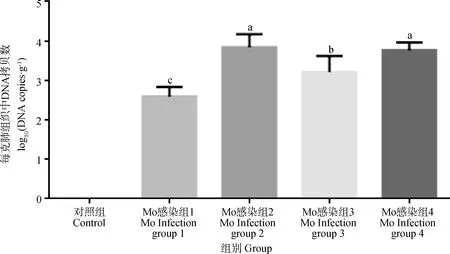
图7 Mo感染组小鼠肺组织中Mo拷贝数DNA(n=12)Fig.7 Mo DNA copy number of mice lung tissues in Mo infected groups(n=12)
2.7 Mo对小鼠血清中Mo IgG抗体水平的影响
图8结果显示,Mo IgG ELISA检测小鼠血清的OD450 nm平均值,对照组为0.11,Mo感染组1为0.63,显著高于对照组(P<0.05),但显著低于其它三个感染组(P<0.05);Mo感染组2为1.05,显著高于对照组(P<0.05)、感染组1(P<0.05)和组3(P<0.05);Mo感染组3为0.81,感染组4为0.99,并显著高于对照组(P<0.05)和感染组1(P<0.05),提示4个感染组小鼠均不同程度感染了Mo。
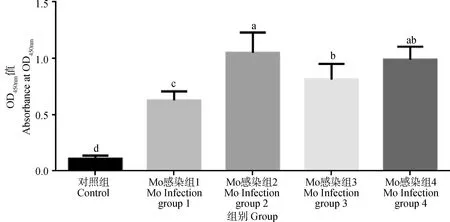
图8 小鼠血清中Mo抗体水平(n=12)Fig.8 Mo antibody secretion levels in mouse serum in infected and control groups(n=12)
2.8 Mo对小鼠脏器系数的影响
Mo感染组小鼠的肝和脾均出现不同程度的肿大,对照组小鼠脏器未观察到病变。由图9可知,感染组1小鼠肝脏系数比对照组和感染组4分别显著升高17.27%(P<0.05)和15.34%(P<0.05);感染组1和组3的小鼠脾分别比对照组显著增加70.70%(P<0.05)和69.70%(P<0.05),比感染组2分别显著增加65.05%(P<0.05)和64.08%(P<0.05)。这表明2次滴鼻或喉头喷雾感染后小鼠肝和脾严重肿大。

图9 Mo对小鼠脏器系数的影响(n=12)Fig.9 Effect of Mo on relative weights of organs in infected and control groups(n=12)
3 讨 论
绵羊肺炎支原体感染导致羊生长性能和免疫力低下,易继发细菌或病毒出现混合感染,导致死亡,给养羊业造成重大经济损失[15]。动物感染模型是研究疫病发病机制、研发有效治疗药物和疫苗的关键和保障条件。人工感染动物模型的建立受菌株、动物品种、感染途径和剂量等多种因素的影响[16-17]。多数动物支原体菌株致病力较弱,即使是临床分离株也不易导致本动物发病。而羊的品种较多,不同品种对绵羊肺炎支原体的易感性不同[18-19]。已有研究报道,将盘羊和巴什拜的杂交羊经鼻腔滴注和气管注射Mo,结果杂交羊比巴氏拜羊对Mo较易感[20];给不同品种羊人工感染Mo,结果白山羊病变明显,死亡率高,且羔羊易感染性更高[8]。同时,感染方式在感染模型的建立中至关重要,主要有肌内注射、腹腔注射、皮下注射、滴鼻、滴眼等方式[21-22]。为了提高感染模型的稳定性,同时降低试验费用,探索研究小鼠的发病模型不仅可以为实验操作提供便利,还为该病的防治研究工作提供重要保障。
小鼠是研究免疫和疫苗的有价值的常用实验动物模型,其来源广泛、易于饲养、价格低、操作简便易行,广泛用于细菌学研究,且野生鼠类极易感染鼠类呼吸道支原体病,大鼠和小鼠感染不同支原体后均出现明显的炎性症状和典型的病理变化[23-25]。有报道,烟熏过的小鼠鼻滴攻毒肺炎支原体感染率可高达93%[26]。因此,推测小鼠是绵羊肺炎支原体感染动物模型的理想选择,但到目前为止尚未见相关报道。本研究选择小鼠为感染对象,通过滴鼻或喉头喷雾途径,感染不同剂量的Mo,结果发现连续2次滴鼻或喉头喷雾攻毒,攻毒后第13天,小鼠出现气喘,呼吸困难而死亡。本研究小鼠仅通过感染绵羊肺炎支原体而出现发病表现,没有采用烟熏等其它途径,这样更能排除发病的非绵羊肺炎支原体感染原因。
羔羊感染绵羊肺炎支原体后,体温升高,出现咳嗽、流鼻涕等轻微症状,血清中Mo抗体上升为阳性,剖检时见肺的病变显著,颜色由红色至灰色不等,肺出现不同程度的坏死[27]。本研究小鼠感染绵羊肺炎支原体后第14天剖检发现肺部严重出血和实变,与文献报道的支原体感染病变相近。
目前用于检测绵羊肺炎支原体的实验室技术较多,如PCR技术、间接ELISA、细菌分离培养等[28-29]。支原体感染小鼠模型病原体多以检测组织中病原体载量为依据,烟熏并感染肺炎支原体后小鼠组织中病原体拷贝数显著高于单独感染组77%[26]。本文采用qPCR检测到小鼠感染后第14天,4个感染组肺组织中均有Mo病原,且Mo载量高达103.84拷贝·g-1,而对照组没有检测到该病原;感染组血清Mo IgG水平显著高于对照组,肝和脾严重肿大。本研究表明,小鼠Mo感染模型实验操作方法简便,不仅可靠稳定,安全性高,而且与实验羊相比,在人力和经济上具有更低成本效益,符合动物试验中减少、替代和优化的“3R”原则,本研究为该病病原生物学特性研究、疫苗和药物研发等提供了重要基础保障。
4 结 论
滴鼻或喉头喷雾攻毒Mo均可以引起小鼠发病,以间隔48 h滴鼻或喉头喷雾两次感染发病严重,肺剖检显示严重出血和实变,肺组织病理学检查呈重度,可见中度间质性肺炎,肺泡内可见以单核细胞为主的炎细胞浸润,支气管管腔内可见轻微渗出及少量脱落的支气管上皮细胞,临床表现、病理变化和病变评分相一致;肺Mo载量达103.84拷贝·g-1,与阳性血清抗体检测结果也一致。这些结果表明应用报道的方法成功建立了Mo小鼠感染动物模型。

