基于猪流行性腹泻病毒GⅡb亚型重组荧光病毒中和抗体检测方法的建立
林莉莉,张梦迪,朱琳琳,马海龙,孙 琪,何启盖,张梦佳*,李文涛,4*
(1.华中农业大学动物医学院,武汉 430070;2.农业微生物资源发掘与利用全国重点实验室,武汉 430070;3.农业农村部兽用诊断制剂创制重点实验室,武汉 430070;4.湖北洪山实验室,武汉 430070)
猪流行性腹泻(porcine epidemic diarrhea, PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)引起的一种急性、高度接触性的肠道传染病,导致感染仔猪发生严重腹泻而死亡,造成了严重的经济损失。PEDV是直径为95~190 nm,具有“花冠样”形态的单股正链RNA病毒[1],其基因组大小约28 kb,属于α冠状病毒属[2]。PEDV有7个开放阅读框[3]:ORF1a、ORF1b和ORF2~6[4]。ORF1a和ORF1b基因编码非结构蛋白,ORF2和ORF4~6基因编码4种结构蛋白:刺突(S)蛋白、包膜(E)蛋白、膜(M)蛋白和核衣壳(N)蛋白,ORF3基因编码辅助蛋白ORF3[2]。
目前,疫苗免疫是PED防控的有效手段,但近几年PED再次出现了暴发流行的趋势,其主要原因是疫苗和实际流行株之间的抗原性、遗传和系统发育(GⅠvsGⅡ)差异较大,致使PEDV现有疫苗免疫保护效力降低[5-6]。因此,开发一款针对现流行PEDV临床毒株的有效疫苗至关重要[7]。反向遗传技术(reverse genetics, RG)能快速拯救已知基因序列的病毒,是一种获取病毒的有效工具。随着分子工具和基因组测序的发展,反向遗传学在20世纪70年代末得以发展,特别是随着一些先进的技术、特殊的载体和策略的出现[8],冠状病毒反向遗传学系统也已成功建立[9]。此外,利用反向遗传技术可构建工具病毒,如将荧光蛋白或荧光素酶基因插入病毒,并随着病毒复制稳定表达,为相关研究提供有力工具。
PEDV有多种血清学检测方法,包括酶联免疫吸附试验(ELISA)、荧光微球免疫分析法、间接免疫荧光试验(indirect immunofluorescence assay, IFA)、病毒中和试验(virus neutralization test, VNT)和免疫层析检测方法。ELISA为最常见的血清学检测方法,主要用于血清、牛奶、初乳、口腔液和肉汁等多种样品的抗体检测。PEDV的ELISA检测方法中,抗原主要使用S、M、N和E四种结构蛋白。S蛋白含有多个能够诱导机体产生中和抗体的中和表位,其中大多数位于S1区,因此S1蛋白可取代全长S蛋白作为抗原[10-11]。此外,相较于全病毒蛋白抗原[12]和原核表达的蛋白抗原[13],真核表达系统表达的蛋白抗原具有更好的敏感性和特异性[14]。VNT是检测PEDV特异性中和抗体应用最广泛的血清学检验方法。目前常见的测定方式为细胞病变效应(CPE)测定[15]和荧光焦点中和试验(fluorescent focus neutralization assay, FFN)[16-17],但二者均在依赖胰酶感染的Vero细胞进行,故均存在血清蛋白成分对胰酶活性的干扰现象,致使试验操作复杂和结果不稳定。
本研究基于当前流行的GⅡb毒株建立了PEDV的反向遗传操作系统,成功拯救出携带EGFP基因的重组工具病毒。利用荧光工具病毒筛选到一株Huh7.10亚克隆细胞,可有效支持PEDV在无外源添加胰酶条件下有效感染和复制。最终利用荧光工具病毒与Huh7.10细胞系建立了稳定可靠的中和抗体检测方法,为疫苗免疫效果的评估和精准防控提供了技术支持手段。
1 材料与方法
1.1 细胞、病毒和菌株
细胞:Vero-CCL81细胞、Huh7细胞、ST细胞、293 T细胞、稳定表达鼠肝炎病毒MHV-A59受体Ceacam1a的细胞系Vero-CCM1a由本实验室制备并保存。
毒株:PEDV-GDU毒株(GenBank登录号KU985230)由本实验室分离、保存;重组病毒mPEDV由本实验室制备并保存。
菌株:质粒构建所用的感受态大肠杆菌DH10β由本实验室制备及保存。靶向PEDV-S1蛋白不同表位具有中和活性的单克隆抗体PEDV-Ab1/2/3由本实验室制备及保存。
1.2 质粒与主要试剂
pUC57克隆载体和携带EGFP基因的pEGFP-N1质粒由本实验室保存。体外转录试剂盒购自Thermo Fisher Scientific公司;37%多聚甲醛及Triton-X100均为Sigma公司产品;PVDF膜购自Millipore公司;增强型Western化学发光检测试剂Super Signal West Pico Luminal Kit为Pierce公司产品;HRP标记的羊抗猪IgG二抗(ANT085)购自武汉安特捷生物技术有限公司(AntGene)。
1.3 携带EGFP重组PEDV-GDU病毒的构建、拯救与鉴定
1.3.1 感染性克隆质粒pUC57-PEDV-GDU-dORF3-EGFP的构建 利用ORF1b-BglⅡ-F和3′UTR-PacⅠ-R(表1)引物对扩增PEDV-GDU毒株的ORF1b-3′UTR基因片段,通过限制性核酸内切酶BglⅡ和PacⅠ将ORF1b-3′UTR基因片段与pUC57载体质粒进行在37 ℃酶切3 h,获得目的基因和载体片段,再使用T4 DNA Ligase 25 ℃连接1 h,获取中间质粒1(pUC57-PEDV-GDU-ORF1b-3′UTR)。利用5′UTR-BamHⅠ-F和ORF1a-BglⅡ-R(表1)引物对扩增5′UTR-ORF1a基因片段,使用BamHⅠ和BglⅡ将5′UTR-ORF1a基因片段克隆至中间质粒1获得中间质粒2(pUC57-PEDV-GDU-5′UTR-3′UTR)。以pEGFP-N1为模板,扩增EGFP基因片段,以中间质粒2为模板,扩增载体片段;使用2×MultiF Seamless Assembly Mix将线性化载体与EGFP进行50 ℃连接15 min,连接产物转化DH10β感受态细胞,最终得到感染性克隆质粒pUC57-PEDV-GDU-dORF3-EGFP(图1)。
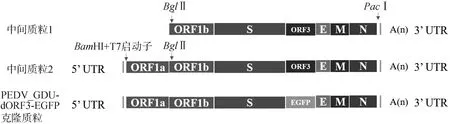
图1 携带EGFP标签重组PEDV-GDU病毒穿梭质粒的构建策略Fig.1 Schematic representation of the construction of shuttle plasmid carrying PEDV-GDU genome with EGFP gene
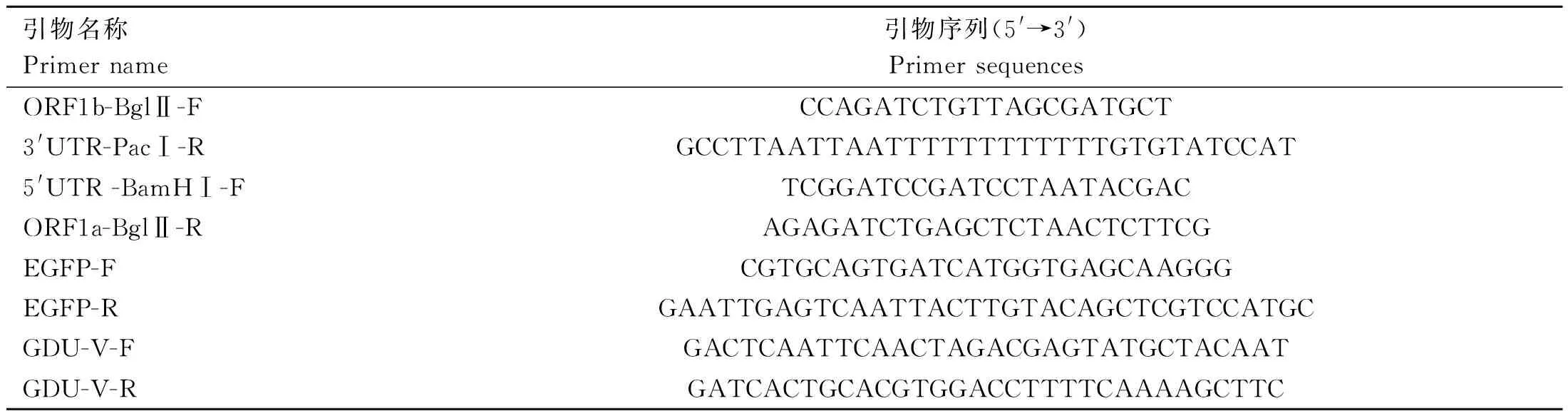
表1 引物序列表Table 1 Primers information
1.3.2 重组荧光病毒rPEDV-GDU-dORF3-EGFP的拯救 根据文献[18]描述方法进行重组荧光病毒rPEDV-GDU-dORF3-EGFP拯救。将pUC57-PEDV-GDU-dORF3-EGFP克隆质粒用SmaⅠ进行单酶切获得线性化质粒,随后使用Ambion mMesseage mMachine T7 kit试剂盒进行体外转录获取转录本。将mPEDV感染Vero-CCM1a细胞,在感染4 h后通过胰酶消化获取细胞悬液,随后通过电转将转录本电转(450 V,50 μF)至mPEDV孵育感染4 h的Vero-CCM1a细胞悬液中,随后迅速将细胞悬液铺到长满单层的Vero-CCL81细胞上,置于37 ℃培养4 h后洗涤细胞,然后加入含有10 μg·mL-1胰蛋白酶的细胞培养基,观察细胞病变情况和荧光表达情况,并通过噬斑纯化得到重组荧光病毒rPEDV-GDU-dORF3-EGFP。
1.3.3 重组荧光病毒rPEDV-GDU-dORF3-EGFP的鉴定 在24孔板中接种Vero-CCL81细胞,当细胞融合度达到100%,用PBS洗板2次,将0.1 MOI的rPEDV-GDU-dORF3-EGFP与PEDV-GDU感染细胞,在感染36 h后,使用倒置荧光显微镜观察细胞病变及绿色荧光。在观察到典型PEDV细胞病变及绿色荧光之后,收取细胞样品进行间接免疫荧光试验。4%多聚甲醛室温固定15 min,Triton-x100室温透化15 min;含3% BSA的PBS于37 ℃封闭2 h;加入2 μg·mL-1抗PEDV-S1蛋白的单克隆抗体,37 ℃孵育1 h;加入稀释比为1∶400的Alexa-594标记的羊抗人IgG二抗,37 ℃孵育45 min;加入适量 DAPI室温避光染色8 min;在倒置荧光显微镜下观察荧光并拍照记录。
1.4 不同代次重组荧光病毒稳定性观察与半数细胞培养物感染量(TCID50)测定
接种Vero-CCL81细胞于96孔板中,待细胞铺满至单层时,将不同代次(P5、P10、P15、P20、P30、P40)的rPEDV-GDU-dORF3-EGFP用病毒维持液进行稀释度为10-1~10-9的倍比稀释,再将各个稀释度的病毒液加入96孔板,100 μL·孔-1,每组8个重复,并设置空白细胞对照,于37 ℃ 5% CO2细胞培养箱培养。12 h后观察10-1稀释度下不同代次重组荧光病毒的绿色荧光信号;36~48 h后观察并记录每个梯度绿色荧光的阳性孔数。试验重复三次,按Reed-Muench两氏法计算TCID50。
1.5 重组荧光病毒与亲本毒株生物学特性
IFA:接种 Vero-CCL81细胞于24孔板中,以MOI=0.1分别感染rPEDV-GDU-dORF3-EGFP与PEDV-GDU,并设置空白对照,37 ℃ 5% CO2细胞培养箱培养24 h后收取细胞样品进行间接免疫荧光试验,具体步骤参照“1.3.3”,通过倒置荧光显微镜观察并记录rPEDV-GDU-dORF3-EGFP与PEDV-GDU在Vero-CCL81细胞上产生的细胞病变与S蛋白的表达情况。
蛋白质免疫印迹(WB):接种 Vero-CCL81细胞于6孔板中,以MOI=0.1分别感染rPEDV-GDU-dORF3-EGFP与PEDV-GDU,在感染后24 h使用含1%蛋白酶抑制剂的RIPA裂解液裂解细胞收取细胞样品,加入SDS Buffer 95 ℃孵育10 min,随后将样品经SDS-PAGE电泳分离蛋白,并转印至PVDF 膜,5%脱脂牛奶室温孵育2 h,PEDV-S1单克隆抗体室温孵育1 h,二抗anti-human-IgG-HRP室温孵育50 min后化学发光显色检测分析二者S蛋白的表达量差异。
一步生长曲线:将 Vero-CCL81 细胞接种12孔板,按照病毒感染数MOI为0.1分别感染rPEDV-GDU-dORF3-EGFP与PEDV-GDU,37 ℃孵育2 h后,PBS 洗涤 2 次,加入病毒维持液继续培养。分别于第6、12、18、24、30、36、42和48小时收取细胞样品,保存于-80 ℃,反复冻融三次后,测定各个时间点的TCID50,用GraphPad Prism 8绘制病毒的生长曲线。
1.6 重组荧光病毒的细胞嗜性试验及细胞亚克隆
在24孔板中分别接种Vero-CCL81、293T、ST、Huh7细胞,当细胞融合度达到100%时,按照每孔0.01 MOI分别在不含胰酶和含有胰酶的条件下感染重组荧光病毒,感染24 h后,用倒置荧光显微镜进行观察和拍照记录。将感染比例最多的细胞消化进行细胞计数后,按照1个细胞·孔-1的密度稀释接种至96 孔板培养,待细胞长满孔后扩大培养,通过rPEDV-GDU-dORF3-EGFP感染试验筛选最好的一株细胞克隆进行后续试验。
1.7 基于Huh7.10细胞和重组荧光病毒的中和试验的初步建立与评估
1.7.1 基于Huh7.10细胞和重组荧光病毒的中和试验的初步建立 将Huh7.10细胞与Vero-CCL81细胞接种 96 孔板中,待生长至100%融合后进行中和试验。用病毒维持液(Huh7.10,DMEM;Vero-CCL81,含15 μg·mL-1胰酶的DMEM)将PEDV-Ab1/2/3按照连续2倍倍比稀释至256倍,随后与200 TCID50重组荧光病毒混合,37 ℃孵育1 h后接种细胞,37 ℃吸附2 h,37 ℃、5%CO2培养箱培养48~72 h,观察病毒绿色荧光蛋白的表达,根据绿色荧光蛋白的表达情况计算中和抗体效价。同时设病毒对照和正常细胞对照,病毒对照设置200 TCID50、20 TCID50、2 TCID50、0.2 TCID504个不同浓度。每份单克隆抗体重复3孔。其中Vero-CCL81细胞需PBS洗涤细胞2次后,再加入病毒维持液。
1.7.2 临床猪源血清的收集、间接ELISA检测及中和抗体的检测评估 将临床猪源血清56 ℃灭活30 min,过滤除菌。在包被板中加入100 μL·孔-1的0.1 μg·mL-1的PEDV-S1真核蛋白,室温孵育4 h;加入100 μL·孔-1的10%脱脂奶,4 ℃封闭过夜;加入100 μL·孔-1的灭活血清(1∶200稀释),25 ℃孵育1 h;按照100 μL·孔-1加入羊抗猪IgG-HRP抗体(1∶12 000稀释),37 ℃孵育45 min;50 μL·孔-1酶和50 μL·孔-1加入底物,避光反应10 min后加入终止液,通过酶标仪测定样品的OD630 nm值。同时,利用所初步建立的方法对灭活血清进行中和抗体检测。根据绿色荧光蛋白的表达情况计算中和效价,最终比对在Huh7.10细胞和Vero-CCL81细胞的中和试验结果。
1.7.3 间接ELISA与病毒中和试验的相关性 各猪源血清的中和效价与其相应的ELISAP/N值,利用 Graphad prism 8.0 软件开展相关性分析,对在Huh7.10细胞上的中和试验进行评估。
2 结 果
2.1 携带EGFP重组PEDV-GDU病毒的拯救与鉴定
将克隆质粒pUC57-PEDV-GDU-dORF3-EGFP的转录本电转至感染mPEDV的Vero-CCM1a细胞中,在电转后36 h,观察到Vero-CCL81细胞出现典型的合胞体病变,与PEDV-GDU毒株产生的细胞病变相似,且在荧光显微镜下能观察到特异性的绿色荧光信号(图2),初步证明成功拯救该病毒,收获上清为P1代,命名为rPEDV-GDU-dORF3-EGFP。
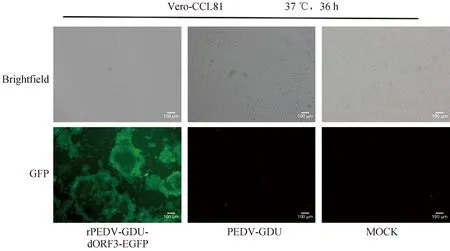
图2 拯救病毒感染Vero-CCL81细胞产生的细胞病变及荧光观察(标尺=100 μm)Fig.2 Observation of the CPE and fluorescence of Vero-CCL81 cells infected with rescued virus (bar=100 μm)
为了进一步鉴定拯救的重组病毒,将重组荧光病毒及亲本病毒感染Vero-CCL81细胞后,利用PEDV-GDU-S1单克隆抗体进行IFA。结果如图3所示,在rPEDV-GDU-dORF3-EGFP感染的细胞中EGFP及Spike蛋白均正常表达,说明成功拯救rPEDV-GDU-dORF3-EGFP。
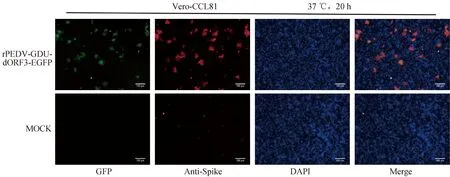
图3 拯救重组病毒感染Vero-CCL81细胞 IFA验证(标尺=100 μm)Fig.3 Detection of recombinant PEDV in Vero-CCL81 cells by IFA (bar=100 μm)
2.2 不同代次重组荧光病毒稳定性观察与TCID50测定
将重组荧光病毒在Vero-CCL81细胞上进行连续传代,分析其病毒感染时荧光蛋白表达的稳定性。结果显示,不同代次重组荧光病毒感染Vero-CCL81细胞后均表达绿色荧光,且随着代次的增加,荧光信号增强,说明该荧光病毒对细胞的适应性增强(图4A)。进一步测定不同代次重组荧光病毒的滴度,发现随着传代次数的增加病毒滴度也不断增加(图4B),与病毒稳定性试验结果一致,表明重组荧光病毒能稳定增殖并表达绿色荧光蛋白EGFP,可作为稳定的工具病毒。
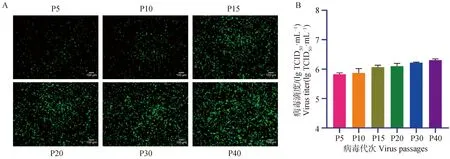
图4 不同代次重组荧光病毒感染Vero-CCL81细胞的荧光图(A,标尺=100 μm)及病毒滴度(B)Fig.4 Fluorescence images (A, bar=100 μm) and virus titers (B) of Vero-CCL81 cells infected by recombinant fluorescent PEDVs of different passages
2.3 重组荧光病毒与亲本毒株生物学特性对比
为了评估ORF3基因的缺失和EGFP基因的插入对PEDV入侵、复制和S蛋白表达有无影响,将重组荧光病毒与亲本病毒分别以0.1 MOI感染Vero-CCL81细胞,进行IFA、Western blot和一步生长曲线试验。IFA结果显示,亲本病毒和重组荧光病毒在相同的接毒剂量和感染时间下,重组荧光病毒的荧光信号能完全指示病毒的感染情况(图5A)。Western blot结果显示,利用PEDV-S1单克隆抗体在二者的细胞样品中均检测到150 ku左右的特异性条带,且大小及表达量均无明显差异(图5B)。此外,生长曲线结果显示,二者在Vero-CCL81细胞中表现相似的生长曲线,均在感染后36 h病毒滴度达到峰值,随后病毒的滴度逐渐降低(图5C)。以上结果表明,重组荧光病毒与亲本病毒生物学特性无显著差异。
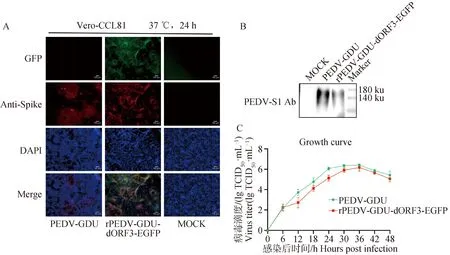
A.IFA试验(标尺=100 μm);B. Western blot;C.生长曲线A.IFA (scale bar=100 μm); B. Western blot; C. Growth curve图5 拯救重组病毒与亲本病毒感染Vero-CCL81细胞IFA、 Western blot及生长曲线Fig.5 IFA, Western blot and growth curve of Vero-CCL81 cells infected with recombinant PEDVs and parental virus
2.4 重组荧光病毒的细胞嗜性
为筛选在不添加胰酶条件下可有效支持PEDV感染和复制的细胞系,进行了重组荧光病毒的细胞嗜性试验。结果显示,重组荧光病毒在添加胰酶的条件下均能成功感染四种细胞,但在不添加胰酶的条件下均不能感染Vero-CCL81、ST和293 T细胞,仅Huh7细胞能在不添加胰酶的情况下被成功感染(图6)。为了筛选一株感染性能更好的细胞,通过对Huh7细胞进行亚克隆,筛选了一株感染效率最高的Huh7.10细胞。
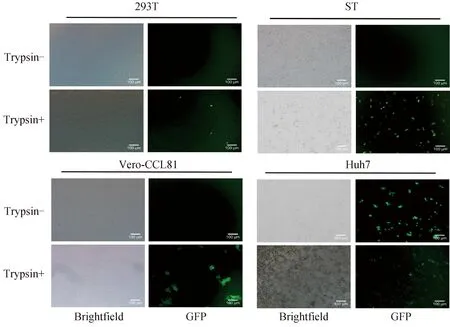
图6 拯救重组病毒感染不同细胞的胰蛋白酶依赖性(标尺=100 μm)Fig.6 Trypsin dependence of recombinant PEDVs infection in different cells (bar=100 μm)
2.5 基于Huh7.10细胞和重组荧光病毒的中和试验的初步建立与评估
为初步建立重组荧光病毒在Huh7.10细胞上的中和试验方法,本研究将表达的3株具有中和活性的PEDV单克隆抗体和重组荧光病毒在Huh7.10细胞和Vero-CCL81细胞进行中和试验,于试验后48 h利用荧光显微镜观察荧光表达情况,并计算#Ab1、#Ab2、#Ab3的中和效价。结果显示,3株中和抗体在Vero-CCL81细胞(图7A)和Huh7.10细胞(图7B)上测得的中和效价一致,#Ab1、#Ab2和#Ab3的中和效价分别是1∶32、1∶2和1∶8。这些结果说明基于Huh7.10细胞和重组荧光病毒的中和试验能准确评估PEDV单克隆抗体的中和效价,该方法成功初步建立。
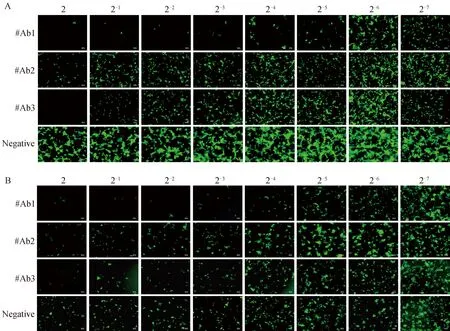
A.在Vero-CCL81中的中和抗体效价测定;B.在Huh7.10中的中和抗体效价测定A. Neutralization test results of PEDV neutralizing antibodies in Vero-CCL81 cells; B. Neutralization test results of PEDV neutralizing antibodies in Huh7.10 cells图7 3株PEDV中和抗体中和试验结果图(标尺=100 μm)Fig.7 Neutralization test results of 3 strains of PEDV neutralizing antibodies (scale bar=100 μm)
2.6 基于Huh7.10细胞和重组荧光病毒的血清中和试验的评估
为评估上述中和试验方法是否能稳定检测临床血清中和抗体水平,作者收集了36份临床猪源血清,利用实验室建立的基于PEDV-S1蛋白的间接ELISA方法对收集的血清进行检测,并对比在Huh7.10细胞和Vero-CCL81细胞上的中和抗体检测结果,最后对所得数据进行分析,当样品值与阴性值比(P/N)≥2.1时判为阳性。试验结果如表2所示,首先,ELISA抗体阴性的血清在Vero-CCL81细胞上的呈现有中和效价(1∶4),但在Huh7.10细胞没有;其次,在Vero-CCL81细胞上ELISA检测结果阳性血清中和效价高于Huh7.10细胞,但在Huh7.10细胞与Vero-CCL81细胞上血清中和抗体效价评估趋势一致。

表2 猪源血清中和效价及ELISA P/N值Table 2 Neutralizing antibody titer and ELISA P/N value
2.7 间接 ELISA 与病毒中和试验的相关性
将各猪源血清的中和效价与其相应的ELISA 检测的P/N值开展相关性分析。结果显示(图8):在Huh7.10细胞上的相关性直线方程(y=0.051 54x+0.186 0)与在Vero-CCL81细胞上的相关性直线方程(y=0.050 01x+0.724 0)的回归系数相近,说明二者对血清中和效价的整体评判结果基本一致。但在Huh7.10细胞上的R2值(0.978 7)远远高于在Vero-CCL81细胞上的R2值(0.739 6),表明在Huh7.10细胞上进行血清中和抗体效价评估结果更为准确可靠。
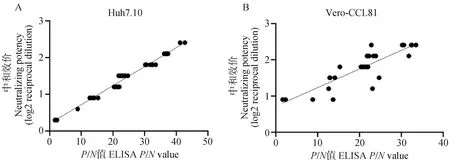
A.猪源血清中和抗体在Huh7.10细胞上相关性分析;B. 猪源血清中和抗体在Vero-CCL81细胞上相关性分析。中和效价(Y轴)为log2(1/中和效价)、 ELISA值(X轴)为P/N值A. Correlation analysis of porcine-derived serum neutralizing antibody on Huh7.10 cells; B. Correlation analysis of porcine-derived serum neutralizing antibody on Vero-CCL81 cells. The neutralizing potency (Y-axis) is log2 (1/neutralizing titer) and the ELISA value (X-axis) is the P/N value 图8 猪源血清P/N值与病毒中和抗体效价之间的关系Fig.8 Relationship between swine serum P/N value and viral neutralizing antibody titer
3 讨 论
反向遗传学技术是通过构建RNA病毒的cDNA感染性分子克隆,在DNA水平上对RNA病毒进行体外操作,从而研究该病毒基因结构和功能[19],加速了人们对病毒的认识。有研究人员利用该技术将外源报告基因如绿色荧光蛋白和荧光素酶等插入病毒基因组中,重建含有标记的工具病毒,用于病毒组织细胞嗜性和抗病毒药物筛选等研究,比如拯救的报告病毒用于追踪嗜神经病毒在体外的感染情况和在体内的分布[20-21]。靶向RNA重组技术考虑到冠状病毒全长cDNA克隆的复杂性,克服了ORF1ab(复制酶基因)部分基因片段不稳定的问题,所以通常这种技术利用病毒全长RNA(通常通过感染)和病毒RNA片段之间在细胞内的重组,最终拯救出目标病毒,这有利于快速构建冠状病毒的目标感染性克隆载体质粒[22]。本研究利用基于RNA定向重组技术,成功构建了携带荧光报告基因的感染性克隆质粒,并在体外成功拯救了能够稳定表达绿色荧光蛋白的PEDV-GDU重组病毒,且该重组病毒生物学特性与亲本病毒基本一致。并且建立的PEDV-GDU毒株的反向遗传操作平台可为PED新型疫苗候选毒株的快速制备提供有力的工具。
PEDV经典中和试验在Vero细胞上进行,Vero细胞来源于非洲绿猴的肾上皮细胞[23],在1988年首次报道了PEDV成功在该细胞上的体外增殖[24],并且该细胞现在广泛应用于PEDV的研究。在PEDV经典中和试验中,病毒的感染严格依赖外源胰酶的添加,但胰酶与待检血清之间存在矛盾:血清中和胰酶的作用及胰酶切割降解血清中和抗体的作用,导致中和抗体评估不准确。所以亟需筛选一株能支持PEDV在无胰酶条件下感染和复制的细胞系,用于PEDV中和抗体研究。因此,本研究根据相关研究人员关于传统和新建立的细胞系的研究结果[25-26],选择Vero-CCL81、ST、293 T和Huh7四种均能被PEDV感染的细胞系进行目的细胞的筛选,其中Vero-CCL81细胞作为阳性对照;ST细胞是猪睾丸细胞,常用于腹泻冠状病毒研究[26-27];Huh7细胞是人肝癌细胞,是包括SARS-COV-2在内冠状病毒的常用细胞模型[28];293 T细胞是人胚胎肾细胞,作为人源细胞的对照。最终利用拯救的PEDV-GDU荧光病毒筛选到一株Huh7.10细胞系,该细胞可支持PEDV在无外源胰蛋白酶条件下进行高效感染和复制,并基于此建立了一种新型PEDV中和试验。
有研究表明,PEDV-S1 IgG-ELISA与病毒中和试验有高度相关性[10]。因此,为了对新型PEDV中和试验进行评估,本研究通过PEDV-S1 ELISA试验进行临床猪源血清抗体检测,并在Huh7.10 细胞和Vero-CCL81细胞上进行血清中和抗体水平测定比较,最终进行相关性分析。结果显示,新型PEDV中和抗体效价评价方法与S1-ELISA的试验结果的关联性优于经典方法。这可能主要与冠状病毒入侵靶细胞依赖的各种宿主细胞蛋白酶水解病毒 S 蛋白的作用有关(例如Furin、胰蛋白酶和TMPRSS2)[29-30]。经典方法中,外源添加的胰酶与血清中的蛋白作用,减少有效作用的胰酶含量,从而影响病毒的入侵,此外,高浓度的胰酶还能降解血清中的抗体,从而导致中和抗体的测定不准确。在Huh7.10细胞中,由于细胞表达大量的宿主蛋白酶[31],能替代胰蛋白酶的作用,使得PEDV在不添加胰酶的条件下能有效地感染和复制,因此利用该系统能更准确地评估血清中的中和抗体。同样,以前被使用的FFN是将PEDV感染Vero细胞后,通过染色手段观察荧光,从而评估血清中和抗体水平[16]。虽然该方法相较于经典CPE方法能更快和更准确地进行血清中和抗体检测分析,但其仍存在外源胰酶的添加导致试验结果不稳定的问题。所以本研究在Huh7.10细胞上建立的新型PEDV中和试验方法同样优于FFN,是一种耗时短、操作简便、准确性高、重复性好的新型PEDV中和试验方法。
PED主要导致新生仔猪腹泻的高感染率和高死亡率,预防和控制PEDV感染的主要策略是对易感动物进行疫苗接种[32]。传统PEDV的分离方法分离率低,不能顺利获取流行毒株,并且对疫苗接种后诱导的中和抗体水平检测的传统方法不能稳定评估免疫效果,故无法有效地解决当前防控PEDV变异毒株所导致腹泻的难题。本研究基于RNA定向重组技术建立了PEDV-GDU的反向遗传操作系统,构建并拯救PEDV-GDU荧光病毒,为筛选能有效增殖病毒且不依赖外源胰酶添加的细胞系和新型PEDV中和试验方法的建立提供一种快速有效的工具,此外,利用该平台能够加快研制与PEDV流行毒株匹配疫苗毒株的制备进程,并对免疫后效果进行有效评估,符合当前防控PED防控的迫切需求。
4 结 论
本研究基于RNA定向重组技术建立了PEDV-GDU反向遗传操作系统,成功拯救了携带EGFP基因的重组工具病毒,并利用荧光工具病毒筛选到一株Huh7.10亚克隆细胞,该细胞可有效支持PEDV在无外源添加胰蛋白酶条件下有效感染和复制,最后,利用荧光工具病毒与Huh7.10细胞系建立了优于传统方法且稳定可靠的中和抗体检测方法。

