牦牛六个多能性相关转录因子OSKMNL的克隆和多顺反子慢病毒载体的构建
黄显朋,邢嘉仪,白媛媛,姜雨婷,麻志伟,付 伟,2,兰道亮,2*
(1.西南民族大学畜牧兽医学院,成都 610041;2.青藏高原动物遗传资源保护与利用教育部/四川省重点实验室,成都 610041)
胚胎干细胞是从哺乳动物内细胞团分离得到的具有无限增殖和发育多能性的细胞[1]。但胚胎干细胞涉及伦理性问题,因此需要另一种方法获得具有胚胎干细胞类似功能的细胞。在体细胞核移植和细胞融合的基础上,有研究者猜测可能是胚胎干细胞的某些因子诱导了体细胞的多能性[2]。而研究发现,转录因子Oct4、Sox2、Klf4、c-Myc、Nanog、Lin28(OSKMNL)对胚胎干细胞多能性维持具有重要作用[2-3]。基于这些理论,Takahashi和Yamanaka[2]将Oct4、Sox2、Klf4、c-Myc四种转录因子导入成年小鼠的成纤维细胞中,成功诱导出了胚胎干细胞样的细胞,并命名为诱导多能干细胞(induced pluripotent stem cells, iPSC)。2007年Yu等[4]也通过Oct4、Sox2、Nanog、Lin28诱导出人iPSC。iPSC与胚胎干细胞相似,具有无限的自我更新和增殖能力,能够分化成3个生殖层的所有细胞类型[2,4]。近年来,科学家们基于OSKM这4个转录因子已成功将小鼠[2]、猪[5-6]、犬[7]、山羊[8-9]、牛[10]等动物的体细胞重编程为iPSC。但在诱导大型家畜时,有研究发现OSKM四个因子无法诱导产生iPSC或产生的iPSC不能稳定传代[11-12]。特别是在诱导反刍动物iPSC时,更多的研究是在OSKM四个因子的基础上添加额外的因子,比如Nanog和Lin28[13-14]。另外,外源基因的来源对诱导效率也有影响。在诱导过程中使用异源基因比使用本源动物的基因诱导效率低[15-17],并且使用本源动物的基因可以获得较为理想的多能性状态[6]。可能不同物种基因氨基酸序列的不同导致蛋白质空间结构差异,进而影响诱导效率[18]。
牦牛作为科学研究中重要的生物模型,能够生活在缺氧、寒冷、环境恶劣的高海拔地区,是我国优良的遗传资源,同时也是我国高寒牧民主要的经济来源,为牧民提供肉、乳、皮等基本生活资料[19]。由于牦牛生产体系不健全,畜群结构不合理,缺乏对优良品种的保护和利用,我国的牦牛出现繁殖率低、繁殖周期长、体重减小、抗病力弱等退化表现[20-21]。iPSC由于其来源广泛,可以由任何细胞产生,并且不会涉及伦理性问题,使其在人类疾病治疗、药物开发、再生医学研究等领域具有独特的优越性[22-23]。不仅如此,iPSC还可以为转基因育种和转基因家畜提供宝贵的工具,对于我国良种家畜的推广和畜牧业经济效益的提高以及遗传资源的保护具有积极的作用[24-25]。传统的保护动物遗传资源的方法有活体保存、冷冻技术、基因文库保存、分子遗传标记等[26],iPSC的冻存也是保护动物遗传资源的方法之一。另外,iPSC还可以在体外诱导分化为生殖细胞或作为体细胞克隆技术中的核供体,与基因编辑结合,用于生产生产性能优良、抗病力强的转基因动物,加速动物品种改良[25]。当前还没有关于牦牛iPSC的相关研究,研究牦牛iPSC或许对牦牛品种改良和遗传资源保护具有积极作用。
本研究克隆了牦牛Oct4、Sox2、Klf4、c-Myc、Nanog、Lin28(OSKMNL)六种转录因子,将OSM和KNL分别插入两个慢病毒载体,构建了FUW-teto-OSM-EGFP和FUW-teto-KNL-mCherry两种多顺反子慢病毒载体,并将得到的病毒感染牦牛成纤维细胞进行验证。为后续利用OSKMNL将牦牛体细胞重编程为iPSC奠定基础。
1 材料与方法
1.1 材料
Trizol(北京全式金生物科技有限公司,ET111-01-V2)、反转录试剂盒(成都蓉为基因生物科技有限公司,A502-02)、TaKaRa LA Taq with GC Buffer(宝日医生物技术有限公司,RR02AG)、胶回收试剂盒(OMEGA,D2500-01)、pMD19-T载体(宝日医生物技术有限公司,6013)、DH5α感受态细胞(天根生化科技有限公司,CB101)、质粒提取试剂盒(天根生化科技有限公司,DP103)、FUW-tetO-MCS(武汉淼灵生物科技有限公司,P48786)、PSPAX2(成都传世科为生物技术有限公司,Trans1-52)、PMD2.G(成都传世科为生物技术有限公司,Trans1-53)、3~5月龄牦牛胎儿由西南民族大学畜牧兽医学院付伟老师赠送。
1.2 方法
1.2.1 总RNA提取和反转录 从-80 ℃取出牦牛胎儿,剪刀剪开牦牛胎儿腹壁,从两侧取出白色米粒状的生殖嵴组织,液氮研磨后用Trizol提取组织总RNA,经微量核酸蛋白测定仪检测RNA的浓度和质量,经PCR鉴定后,采用反转录试剂盒合成cDNA,-20 ℃保存备用。
1.2.2 引物的设计和合成 根据GenBank报道的牛、瘤牛、水牛、猪、山羊、绵羊、小鼠的Oct4、Sox2、Klf4、c-Myc、Nanog、Lin28基因序列,经多序列比对,发现它们的编码区两端保守,参照NCBI中牛的Oct4、Sox2、Klf4、c-Myc、Nanog、Lin28基因序列设计克隆引物(表1),慢病毒表达载体引物根据2A肽序列和基因序列设计(表2),引物由北京擎科生物技术股份有限公司合成。

表1 基因引物信息Table 1 Primers information of genes
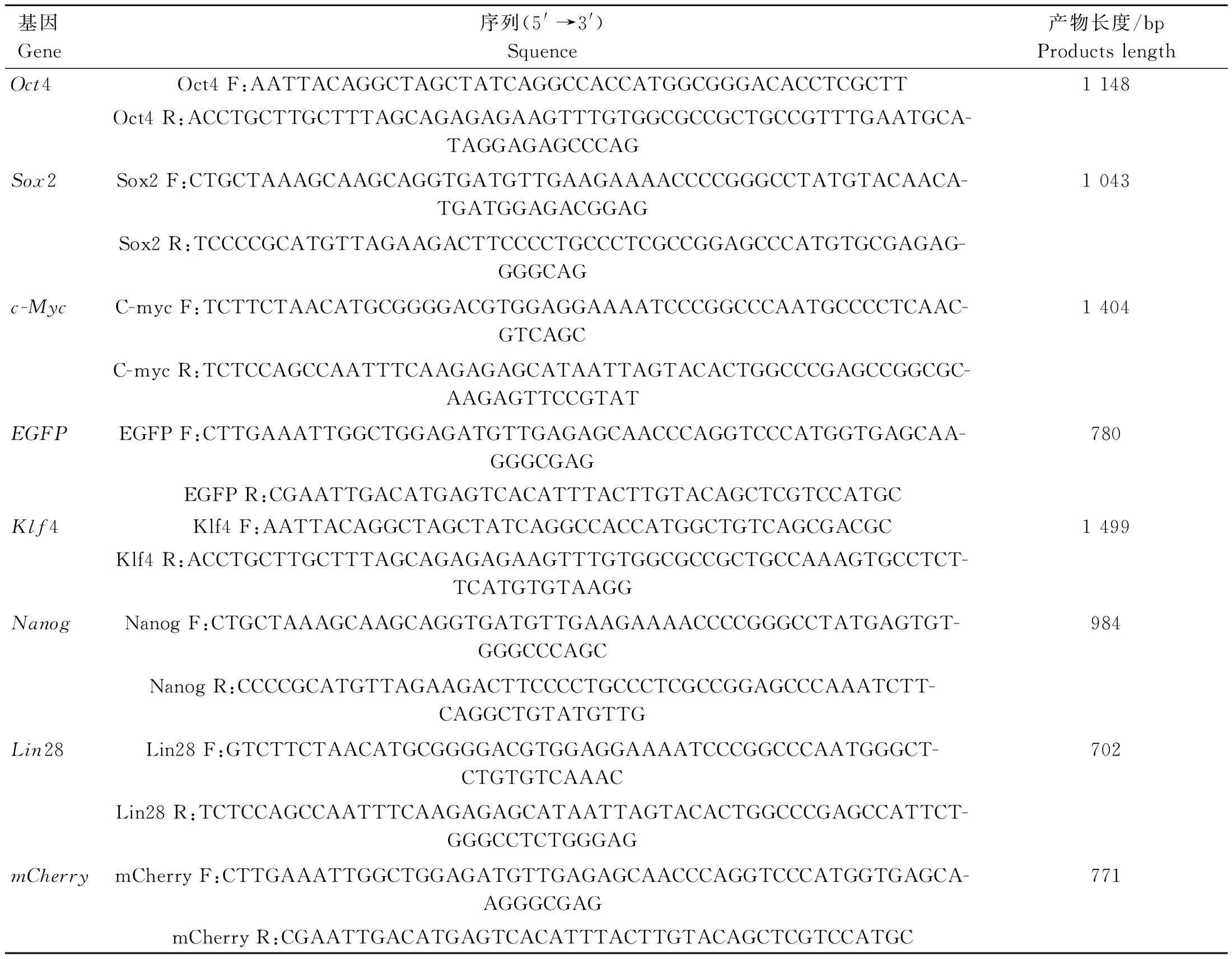
表2 表达载体引物信息Table 2 Primers information of expression vectors
1.2.3 牦牛OSKMNL基因的克隆 以上述cDNA为模板,用各基因的上下游引物进行PCR扩增。反应体系和程序按照 LA Taq with GC Buffer试剂盒说明书进行。PCR产物经切胶回收后与pMD19-T载体连接,转化DH5α感受态细胞,37 ℃培养12~16 h,挑取单菌落扩大培养,经菌液PCR鉴定后,将阳性菌液送至上海生工生物工程股份有限公司测序。
1.2.4 牦牛OSKMNL基因的序列分析 测序结果用SnapGene进行多序列比对,DNASTAR进行序列拼接得到OSKMNL基因序列。使用NCBI的BLAST比对核苷酸和氨基酸序列,进化树由MEGA7中的邻接法构建,蛋白质结构域通过生物在线分析软件SMART预测。
1.2.5 慢病毒载体FUW-teto-OSM-EGFP和FUW-teto-KNL-mCherry的构建 质粒FUW-TETO-MCS、pCMV-mCherry-MCS-Neo、FUW-EGFP分别转化DH5α感受态细胞,挑单菌落扩大培养并提质粒,-20 ℃保存备用。分别用表2的引物扩增出Oct4、Sox2、Klf4、c-Myc、Nanog、Lin28、EGFP、mCherry基因,用1%的琼脂糖凝胶分离后胶回收,-20 ℃保存备用。质粒FUW-TETO-MCS用BamH Ⅰ和XbaⅠ双酶切后胶回收,-20 ℃保存备用。按照无缝克隆试剂盒说明书连接FUW-teto-OSM-EGFP慢病毒载体,FUW-TETO-MCS、Oct4、Sox2、c-Myc、EGFP按照摩尔比1∶1∶1∶1∶1加入反应体系,50 ℃连接30 min。
FUW-teto-KNL-mCherry载体与前面一样进行连接。将连接产物转化感受态细胞,37 ℃培养12~16 h,挑取单菌落扩增并进行PCR检测,将阳性菌液送上海生工生物工程股份有限公司测序。
1.2.6 慢病毒载体的包装 转染前1 d,将293 T细胞传代到10 cm皿,待细胞密度达到70%~90%,将培养基换为Opti-MEM,准备6只管,分别加入1.5 mL Opti-MEM培养基,向前3管分别加入质粒FUW-teto-OSM-EGFP和FUW-teto-KNL-mCherry和FUW-M2rtTA,每管再加入包装质粒PSPAX2、PMD2.G,比例为4∶3∶1。另外3管加入lipo2000,室温孵育5 min。然后将两管溶液混合,室温孵育20 min,均匀滴加到293T细胞中。培养6 h后换取正常培养基。收集48 和72 h的细胞上清液,离心、过滤、浓缩、分装后,-80 ℃保存。
1.2.7 慢病毒感染293T细胞 感染前1 d取生长状态良好的细胞接种六孔板,第2天进行病毒感染。试验分为感染病毒组和空白对照组。分别取FUW-teto-OSM-EGFP、FUW-teto-KNL-mCherry和FUW-M2rtTA三种病毒各10 μL,混合后感染293T细胞,并加入8 μg·mL-1的polybrene,24 h后换液。72 h后荧光显微镜下观察荧光表达情况。
1.2.8 慢病毒感染牦牛成纤维细胞 按“1.2.7”的方法感染牦牛成纤维细胞,72 h后观察荧光表达情况。并提取感染72 h后成纤维细胞的总RNA,反转录为cDNA后,用RT-PCR检测外源OSKMNL基因的表达。
2 结 果
2.1 牦牛OSKMNL基因PCR扩增结果
以牦牛胎儿生殖嵴组织cDNA为模板,用RT-PCR扩增牦牛OSKMNL基因,经1%琼脂糖凝胶电泳检测,结果显示牦牛OSKMNL基因编码区大小分别为1 083、963、1 434、1 320、903、618 bp(图1)。
A. Oct4; B. Sox2; C. Klf4; D. c-Myc; E. Nanog; F. Lin28。M. DNA相对分子质量标准; 1. PCR产物A. Oct4; B. Sox2; C.Klf4; D. c-Myc; E. Nanog; F. Lin28. M. 2000 Marker; 1. PCR product图1 基因PCR结果Fig.1 PCR results of desired genes
2.2 牦牛OSKMNL菌液PCR结果
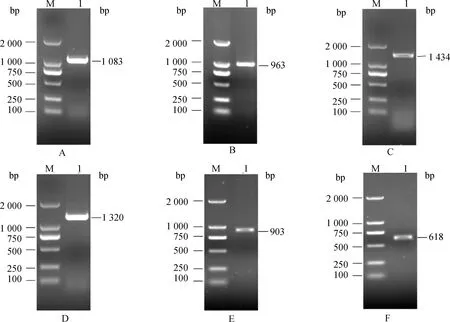
挑取疑似阳性的菌落到液体培养基扩大培养12 h,吸取1 μL菌液进行PCR验证,挑取的菌落都得到了一条清晰的条带(图2)。
A. Oct4; B. Sox2; C. Klf4; D. c-Myc; E. Nanog; F. Lin28。M.DNA相对分子质量标准;1~4.菌液PCR产物A. Oct4; B. Sox2; C. Klf4; D. c-Myc; E. Nanog; F. Lin28. M.2000 Marker;1-4.Bacteria solution PCR products图2 菌液PCR结果Fig.2 PCR results of bacteria solution
2.3 牦牛OSKMNL基因的序列
将测序结果用DNASTAR拼接得到牦牛OSKMNL基因的序列(图3)。

A.Oct4; B.Sox2; C.Klf4; D.c-Myc; E.Nanog; F.Lin28图3 牦牛OSKMNL基因序列信息Fig.3 Sequence information of yak OSKMNL genes
2.4 牦牛OSKMNL基因的序列分析和进化树构建
将拼接得到的序列与黄牛、瘤牛、水牛、猪、山羊、绵羊、狗、猫、小鼠进行比对,结果显示牦牛OSKMNL核苷酸序列与黄牛的同源性在99%以上。牦牛OSKMNL氨基酸序列与黄牛的同源性在99%以上,其中Sox2、Klf4、c-Myc与黄牛的同源性为100%。与其它物种的同源性见图4。进化树结果显示牦牛与黄牛、瘤牛、水牛的亲缘关系最近,与小鼠的亲缘关系最远(图4)。
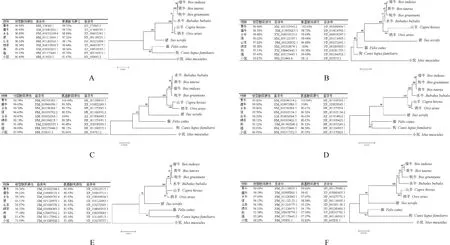
A. Oct4; B. Sox2; C. Klf4; D. c-Myc; E. Nanog; F. Lin28图4 牦牛OSKMNL基因同源性分析和进化树图谱Fig.4 Homology analysis and phylogenetic tree of yak OSKMNL genes
2.5 牦牛OSKMNL基因的蛋白结构预测
用生物在线分析软件SMART对牦牛OSKMNL基因的蛋白结构进行预测,发现牦牛Oct4具有1个POU结构域和1个HOX结构域,以及3个低重复序列。Sox2含有1个HMG结构域和3个低重复序列。Klf4含有3个Znf-C2H2结构以及4个低重复序列。c-Myc含有1个Pfam结构和1个HLH结构,以及1个低重复序列。Nanog含有1个HOX结构和2个低重复序列。Lin28含有1个CSP结构和2个Znf-C2H2结构,以及1个低重复序列(图5)。
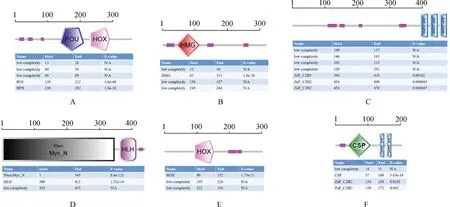
A. Oct4; B. Sox2; C. Klf4; D. c-Myc; E. Nanog; F. Lin28图5 牦牛各基因蛋白结构预测Fig.5 Proteins structure prediction of each gene in yak
2.6 慢病毒载体FUW-teto-OSM-EGFP和FUW-teto-KNL-mCherry的构建
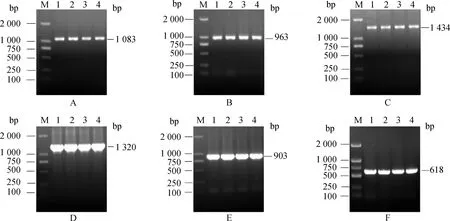
以上试验克隆得到了牦牛OSKMNL这6个特异性基因,以3个基因为一组构建了包含Oct4、Sox2、c-Myc三个基因的FUW-teto-OSM-EGFP质粒和包含Klf4、Nanog、Lin28三个基因的FUW-teto-KNL-mCherry质粒,将构建好的质粒转化感受态细胞,每个质粒挑取5个菌落做PCR验证,都得到了一条清晰的条带(图6、图7)。

M.DNA相对分子质量标准;1~5.FUW-teto-OSM-EGFP菌液PCR结果(4 317 bp);6~10.FUW-teto-KNL-mCherry菌液PCR结果(3 897 bp)M. 10 000 Marker;1-5. Result of FUW-teto-OSM-EGFP bacteria solution PCR(4 317 bp);6-10.Result of FUW-teto-KNL-mCherry bacteria solution PCR(3 897 bp)图6 慢病毒载体PCR结果Fig.6 PCR results of lentiviral vectors
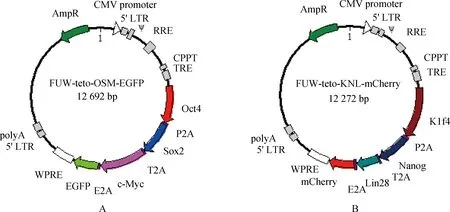
A. FUW-teto-OSM-EGFP;B. FUW-teto-KNL-mCherry图7 慢病毒载体结构Fig.7 The structure of lentiviral vectors
2.7 慢病毒包装
利用lipo2000将构建的FUW-teto-OSM-EGFP和FUW-teto-KNL-mCherry质粒和包装质粒转染293T细胞,72 h后在荧光显微镜下看到绿色和红色荧光表达,证明质粒转染成功(图8)。
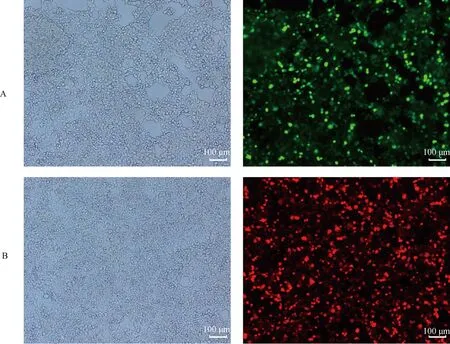
A.FUW-teto-OSM-EGFP载体;B.FUW-teto-KNL-mCherry载体A.FUW-teto-OSM-EGFP vector;B.FUW-teto-KNL-mCherry vector图8 慢病毒载体转染结果Fig.8 Transfection results of lentiviral vectors
2.8 慢病毒感染293T细胞
将包装好的慢病毒感染293T细胞,72 h后在荧光显微镜下可以看到慢病毒感染组发绿色和红色荧光,空白对照组没有荧光(图9)。说明包装的病毒具有感染活力。
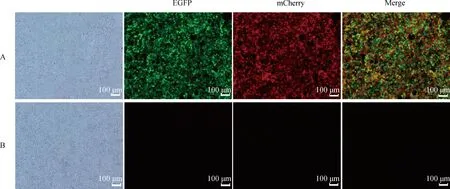
A.试验组;B.对照组A.Experimental group; B. Control group图9 感染后293T细胞荧光蛋白表达Fig.9 Expression of fluorescent proteins in infected 293T cells
2.9 慢病毒感染牦牛成纤维细胞
将慢病毒感染牦牛成纤维细胞,72 h后可以看到感染病毒的成纤维细胞发绿色和红色荧光,而空白对照组不发荧光(图10)。RT-PCR结果显示,试验组有预期大小的条带,对照组没有条带(图11)。以上结果说明成功构建了FUW-teto-OSM-EGFP和FUW-teto-KNL-mCherry两个慢病毒载体,并能感染牦牛成纤维细胞。

A.试验组;B.对照组A. Experimental group; B.Control group图10 感染后牦牛成纤维细胞荧光蛋白表达Fig.10 Expression of fluorescent proteins in infected BEFs
3 讨 论
家畜多能干细胞的分离、培养和建系对家畜的品种改良和资源保护具有积极作用,但在大型家畜中建立干细胞系难度较大。诱导多能干细胞的产生使得建系困难的家畜建立干细胞系成为可能。目前多种动物已成功建立iPSC。尤其是猪iPSC已成功用于产生嵌合体猪[27]和克隆猪[28],这为家畜诱导多能干细胞用于动物品种改良和种质资源保护提供了有利的证据。本研究针对牦牛6个多能性相关转录因子OSKMNL进行了克隆、蛋白结构分析与慢病毒载体构建,推动多能性相关转录因子OSKMNL在牦牛干细胞中的应用,以及为后续研究牦牛iPSC做准备。
研究表明,多能性相关因子Oct4、Sox2、Klf4、c-Myc、Nanog、Lin28在多能干细胞中表达,比如胚胎干细胞(ESC)、原始生殖细胞(PGC)等,它们对多能干细胞的维持和调节起着重要作用[29-30]。本研究从牦牛胎儿生殖嵴组织克隆了牦牛OSKMNL基因,并对其基因序列进行分析,发现不同物种间OSKMNL基因在进化上是保守的,这与以前的研究结果相同[13,31-32]。然后用SMART在线分析软件对OSKMNL的蛋白结构域进行分析,发现牦牛OSKMNL基因都含有该基因家族所特有的相应蛋白功能的结构,比如POU结构域、HOX结构域、HMG结构域、Znf-C2H2结构域、HLH结构域、CSP结构域等。POU结构域、HOX结构域和HMG结构域都是DNA结合结构域。含有这3个结构域的Oct4、Sox2、Nanog是多能干细胞维持的核心因子,它们常常单独或协同调控下游靶基因的表达。研究表明,在干细胞中Oct4有623个靶位点,Sox2有1 279个靶位点,而Oct4和Sox2共同的靶位点有404个,Oct4、Sox2和Nanog共同的靶位点是353个[33]。Znf-C2H2结构域不仅可以结合DNA,还可以结合RNA和蛋白质。它和基因的转录、翻译、mRNA的运输、蛋白结构的形成等相关[34]。而含有Znf-C2H2结构域的Klf4对干细胞的自我更新具有重要作用[35]。HLH结构域是c-Myc的主要功能区,含有一个环和两个螺旋,较大的螺旋含有DNA结合区域,可以和E-box结构结合,调控基因的表达,与干细胞的自我更新和谱系分化能力有关[36]。当敲除干细胞中的c-Myc时可以明显看到蛋白质和核酸合成减少,细胞出现停滞状态[37]。CSP结构域是一种RNA结合结构域,含有这种结构域的Lin28可以通过抑制let-7 microRNA并影响mRNA翻译,从而调节哺乳动物胚胎干细胞的自我更新[38]。对牦牛OSKMNL基因序列和蛋白结构的分析,为后续研究OSKMNL基因在牦牛干细胞中的作用提供了一定的理论基础。
以往的研究表明,在对原代细胞进行转基因操作时,其转染效率低下[39-40]。选择合适的转染方法是成功将外源基因导入原代细胞的关键。慢病毒载体凭借其高效的转染效率和稳定表达外源基因现已广泛用于基因转导研究和基因治疗[41-42]。本研究以慢病毒载体FUW为基本骨架,构建了包含牦牛6个多能性相关转录因子的慢病毒载体FUW-teto-OSM-EGFP和FUW-teto-KNL-mCherry。另外,本研究构建的两个载体包含绿色荧光蛋白和红色荧光蛋白,后续感染细胞时能实时观察病毒的感染情况。慢病毒的构建为后续诱导牦牛iPSC的研究做了相应的准备。
4 结 论
本研究成功克隆了牦牛的6个多能性相关转录因子OSKMNL;构建了分别携带牦牛3个转录因子的慢病毒载体FUW-teto-OSM-EGFP和FUW-teto-KNL-mCherry;包装的慢病毒能感染牦牛成纤维细胞。有利于推动多能性相关转录因子OSKMNL在牦牛干细胞中的应用,也为后续研究牦牛iPSC做了准备。

