血清miRNA-199a-5p、α-1-B-糖蛋白反义RNA1 水平与脑胶质瘤患者术后复发的关系
单永双,万学锋,王晓英
驻马店市中心医院神经外科,河南 驻马店 463000
脑胶质瘤是常见的颅内恶性肿瘤之一,发生于神经外胚层衍化而来的胶质细胞,具有较高的发病率,占所有颅内肿瘤的35.26%~60.96%[1]。手术切除是脑胶质瘤的主要治疗方法[2],但因脑胶质瘤多呈浸润性生长,术后仍有较高的复发率,这是患者预后较差的主要原因[3]。临床实践表明,脑胶质瘤通常会在术后短期内复发,复发后的治疗效果较差,患者生存率较低[4]。因此,评估脑胶质瘤的复发风险,并采取积极的预防措施,对于延缓脑胶质瘤患者术后复发,延长患者生存期具有重要意义。既往研究表明,不具备蛋白质编码能力的长链非编码RNA(long non-coding RNA,lncRNA)参与肿瘤的发生发展过程,可作为多种肿瘤(包括脑胶质瘤)的潜在生物标志物[5]。α-1-B-糖蛋白反义RNA1(alpha-1-B glycoprotein antisense RNA 1,A1BG-AS1)是位于染色体19q13.43 的lncRNA,目前已被证实在肝癌及乳腺癌的发生发展过程中具有重要的调控作用[6-7]。沈风彪等[8]研究表明,血清外泌体中A1BG-AS1 水平升高与脑胶质瘤的发生有关,但并未探究该指标是否与脑胶质瘤的术后复发有关。微小RNA(microRNA,miRNA)是内源性非编码RNA,参与乳腺癌、肝癌等多种肿瘤的发生发展过程[9]。miRNA-199a-5p 是一种miRNA,属于成熟的非编码RNA。李曾仕等[10]研究证实,miRNA-199a-5p 可通过调控盘状结构域受体家族成员1(discoidin domain receptor family,member 1,DDR1)的表达抑制人脑胶质瘤细胞增殖和迁移,因此推测其可能与脑胶质瘤患者的术后复发存在一定相关性。基于此,本研究探讨血清miRNA-199a-5p、A1BG-AS1 水平脑胶质瘤患者与术后复发的关系,现报道如下。
1 资料与方法
1.1 一般资料
收集2018 年3 月至2020 年4 月于驻马店市中心医院接受手术治疗的脑胶质瘤患者的病历资料。纳入标准:①符合《脑胶质瘤诊疗指南(2022版)》[11]中脑胶质瘤的诊断标准,经病理检查确诊为脑胶质瘤;②年龄>18 岁;③单发肿瘤;④临床资料完整。排除标准:①合并其他恶性肿瘤;②合并严重并发症;③合并全身严重感染;④合并内分泌系统、免疫系统及代谢疾病。依据纳入和排除标准,本研究共纳入94 例脑胶质瘤患者,作为研究组。另选取同期于驻马店市中心医院进行体检的84 例健康体检者作为对照组。研究组中,男61例,女33 例;年龄20~68 岁,平均(44.68±11.90)岁;组织学分级:Ⅰ级17 例,Ⅱ级29 例,Ⅲ级28 例,Ⅳ级20 例;肿瘤位置:小脑幕上58 例,小脑幕下36例;肿瘤直径1.5~4.1 cm,平均(3.98±0.57)cm。对照组中,男55 例,女29 例;年龄19~67 岁,平均(45.03±11.21)岁。两组受试者的年龄和性别比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审批通过,所有患者均知情同意。
1.2 检测方法
1.2.1 血清miRNA-199a-5p 水平检测 研究组患者于治疗前、对照组受试者于体检当日清晨采集静脉血约5 ml,2500 r/min 离心10 min,离心半径为10 cm,取上层血清置于-80 ℃冰箱中保存待检。应用RNA 提取试剂盒提取总RNA,然后采用紫外分光光度计检测吸光度,计算RNA 浓度。将RNA 反转录为单链互补DNA(complementary DNA,cDNA),以cDNA 为模板进行聚合酶链反应(polymerase chain reaction,PCR)。反应条件:95 ℃30 s;95 ℃1 min,72 ℃1 min,60 ℃30 s,共35 个循环。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,采用2-ΔΔCt法计算miRNA-199a-5p 水平。
1.2.2 血清A1BG-AS1 水平检测 ①外泌体制备:取上述处理好的血清样本,解冻后在4 ℃条件下3000 r/min 离心15 mim,去除细胞及细胞碎片,然后加入1/4 体积的ExoQuick 溶液,混合后在4 ℃条件下孵育30 min,1500 r/min 离心30 min,收集含有外泌体的颗粒用于RNA 提取。②定量检测:采用miRNeasy Serum/Plasma Kit 从外泌体中提取总RNA,采用分光光度计检测吸光度,计算RNA 浓度,反转录合成cDNA,然后进行PCR。反应条件:95 ℃30 s;95 ℃1 min,72 ℃1 min,60 ℃30 s,共35 个循环。以GAPDH为内参,采用2-ΔΔCt法计算A1BG-AS1 水平。
1.3 观察指标
①比较两组受试者的血清miRNA-199a-5p、A1BG-AS1 水平。②术后所有脑胶质瘤患者均随访2 年,依据是否复发分为复发组(n=71)和非复发组(n=23),比较两组患者的血清miRNA-199a-5p、A1BG-AS1 水平。③分析血清miRNA-199a-5p、A1BG-AS1 水平与脑胶质瘤患者术后复发的相关性。④分析血清miRNA-199a-5p、A1BG-AS1 单独及联合检测对脑胶质瘤患者术后复发的评估价值。
1.4 统计学方法
采用SPSS 22.0 软件对数据进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Spearman 相关分析法进行相关性分析;绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC),分析血清miRNA-199a-5p、A1BG-AS1 单独及联合检测对脑胶质瘤患者术后复发的评估价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 研究组与对照组血清miRNA-199a-5p、A1BG-AS1 水平的比较
研究组患者血清miRNA-199a-5p 水平明显低于对照组,血清A1BG-AS1 水平明显高于对照组,差异均有统计学意义(P<0.01)。(表1)
表1 研究组与对照组血清miRNA-199a-5p、A1BG-AS1 水平的比较(±s)
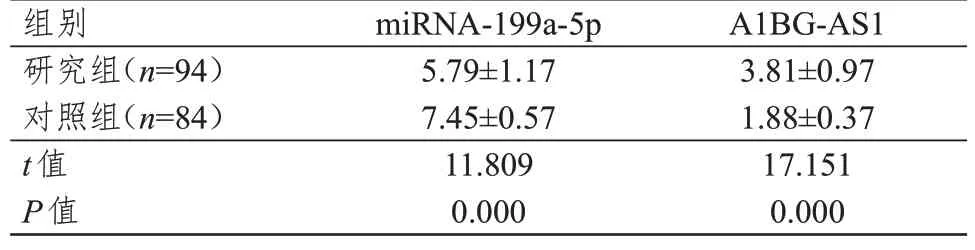
表1 研究组与对照组血清miRNA-199a-5p、A1BG-AS1 水平的比较(±s)
组别研究组(n=94)对照组(n=84)t值P值miRNA-199a-5p 5.79±1.17 7.45±0.57 11.809 0.000 A1BG-AS1 3.81±0.97 1.88±0.37 17.151 0.000
2.2 复发组与非复发组患者血清miRNA-199a-5p、A1BG-AS1 水平的比较
复发组患者血清miRNA-199a-5p 水平低于非复发组,血清A1BG-AS1 水平高于非复发组,差异均有统计学意义(P<0.05)。(表2)
表2 复发组与非复发组患者血清miRNA-199a-5p、A1BGAS1 水平的比较(±s)
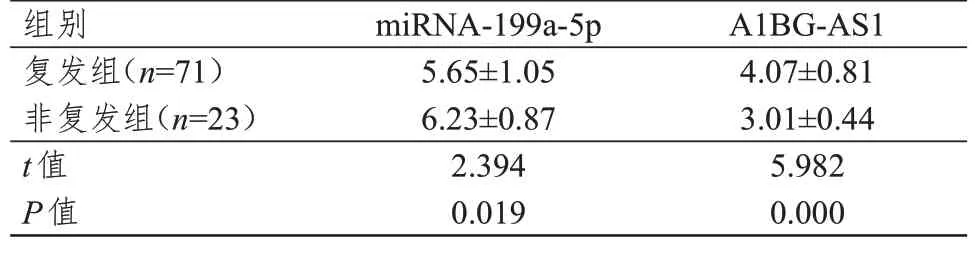
表2 复发组与非复发组患者血清miRNA-199a-5p、A1BGAS1 水平的比较(±s)
组别复发组(n=71)非复发组(n=23)t值P值miRNA-199a-5p 5.65±1.05 6.23±0.87 2.394 0.019 A1BG-AS1 4.07±0.81 3.01±0.44 5.982 0.000
2.3 血清miRNA-199a-5p、A1BG-AS1 水平与脑胶质瘤患者术后复发的相关性
Spearman 相关分析结果显示,血清miRNA-199a-5p 水平与脑胶质瘤患者术后复发呈负相关(r=-0.382,P<0.05),血清A1BG-AS1 水平与脑胶质瘤患者术后复发呈正相关(r=0.423,P<0.05)。
2.4 血清miRNA-199a-5p、A1BG-AS1 单独及联合检测对脑胶质瘤患者术后复发的评估价值
ROC 曲线显示,血清miRNA-199a-5p、A1BGAS1 联合检测评估脑胶质瘤患者术后复发的AUC和灵敏度均高于二者单独检测。(表3、图1)
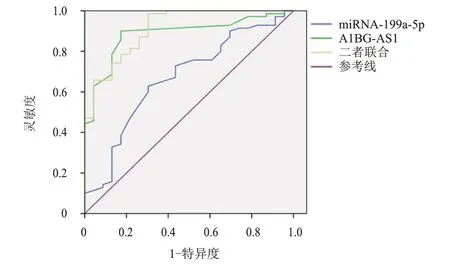
图1 血清miRNA-199a-5p、A1BG-AS1单独及联合检测评估脑胶质瘤患者术后复发的ROC曲线
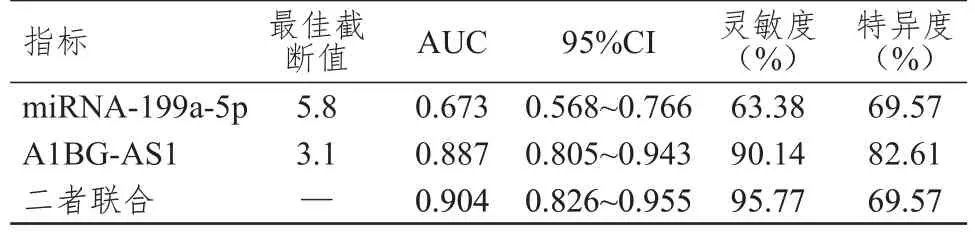
表3 血清miRNA-199a-5p、A1BG-AS1 单独及联合检测对脑胶质瘤患者术后复发的评估价值
3 讨论
脑胶质瘤的主要临床特点是浸润性生长,因此肿瘤组织与周围正常组织分界不清,肿瘤组织释放的溶解性物质及毒素会损害周围正常组织,因此其恶性程度较高,患者预后不佳[12]。显微镜下手术切除是脑胶质瘤的主要治疗方法,但术后短期内复发率较高,会对颅内多个脑叶造成侵犯,导致脑内转移,从而加速病情进展[13]。因此,早期评估脑胶质瘤的复发风险是临床研究的重点。影像学技术在脑胶质瘤的诊断、治疗方案评估及预后分析中发挥重要作用,尤其是影像组学技术的应用,可以为脑胶质瘤的预后评估提供丰富的信息,但影像学数据的读取存在一定的主观性,对诊断医师的经验及专业度要求极高[14]。因此,寻求更加快速、灵敏的生物学指标成为临床研究的主要方向。
miRNA-199a-5p 作为一种miRNA,参与调控多种肿瘤的发生发展过程。彭靓等[15]研究表明,卵巢癌转移组患者miRNA-199a-5p 表达水平低于卵巢癌原发组,提示miRNA-199a-5p 参与调控卵巢癌的疾病进展。周京涛等[16]研究表明,上调miRNA-199a-5p 的表达能够抑制肝癌细胞增殖、侵袭及上皮-间充质转化过程。马素刚等[17]研究证实,miRNA-199a-5p 在甲状腺乳头状癌中低表达。李爱丽等[18]研究发现,miRNA-199a-5p 在宫颈癌患者宫颈癌组织及血清中的表达均明显上调。以上研究表明,miRNA-199a-5p 可参与多种肿瘤的发生发展过程,但其在不同肿瘤中发挥不同的生物学作用。闫兆月等[19]探讨了miRNA-199a-5p 对人脑胶质瘤细胞增殖和迁移的影响,结果表明,miRNA-199a-5p 可通过下调DDR1 的表达抑制脑胶质瘤细胞的增殖和迁移。因此,笔者推测miRNA-199a-5p可能与脑胶质瘤患者术后复发存在一定的相关性。A1BG-AS1 是新发现的lncRNA,与肿瘤进展密切相关。目前关于A1BG-AS1 在肿瘤中的研究多集中于肝癌,曾雅莉和唐静[20]的研究证实,原发性肝癌患者血浆外泌体A1BG-AS1 呈低表达,且其表达可能与患者的临床特征及预后有关。现阶段关于脑胶质瘤中miRNA-199a-5p、A1BG-AS1 表达情况的研究较少,且尚无相关研究报道其是否与脑胶质瘤患者的术后复发有关。
本研究结果显示,研究组患者血清miRNA-199a-5p 水平低于对照组,血清A1BG-AS1 水平高于对照组,说明miRNA-199a-5p、A1BG-AS1 参与脑胶质瘤的发生过程,与沈风彪等[8]研究结果一致。推测可能的机制是,A1BG-AS1/miRNA-485-5p/脂阀结构蛋白1(flotillin 1,FLOT1)和A1BG-AS1/miRNA-216a-5p 信号通路参与调控脑胶质瘤的发生过程,miRNA-199a-5p 可能通过激活Janus 激酶(Janus kinase,JAK)/信号转导及转录激活因子3(signal transduction and activator of transcription 3,STAT3)信号通路参与脑胶质瘤的发生过程[21],但两种机制均仍需证实。本研究结果还显示,复发组患者血清miRNA-199a-5p 水平低于非复发组,血清A1BG-AS1 水平高于非复发组,提示miRNA-199a-5p、A1BG-AS1 参与了脑胶质瘤的术后复发过程。这可能是因为,miRNA-199a-5p 可通过下调DDR1 的表达抑制脑胶质瘤细胞增殖和迁移,因此miRNA-199a-5p 水平越高,术后复发的可能性就越小;A1BG-AS1 可通过与miRNA-485-5p 相互作用促进脑胶质瘤细胞增殖、迁移,因此其水平越高,术后复发的可能性就越大。进一步的相关性分析显示,血清miRNA-199a-5p 水平与脑胶质瘤患者术后复发呈负相关,血清A1BG-AS1 水平与脑胶质瘤患者术后复发呈正相关。ROC 曲线显示,miRNA-199a-5p、A1BG-AS1 单独及联合检测评估脑胶质瘤患者术后复发的AUC 分别为0.673、0.887、0.904,灵敏度分别为63.38%、90.14%、95.77%,特异度分别为69.57%、82.61%、69.57%。说明血清miRNA-199a-5p、A1BG-AS1 对脑胶质瘤患者术后复发具有一定的评估价值,且二者联合检测的评估价值更高。
综上所述,脑胶质瘤患者血清miRNA-199a-5p水平降低,血清A1BG-AS1 水平升高,且其表达水平与脑胶质瘤患者术后复发有关,联合检测对术后复发具有较好的评估价值,可为临床治疗方案的制订提供一定的参考依据。

