超声、糖类抗原125Ⅱ、糖类抗原153Ⅱ联合检查对乳腺癌的诊断价值△
王琼,彭红玲,贺敏
萍乡市妇幼保健院超声科,江西 萍乡 337000
乳腺癌源于乳腺上皮细胞恶性增生,是女性最常见的恶性肿瘤。据统计,全球范围内乳腺癌发病例数占女性全部恶性肿瘤的30%,且其发病率和病死率均呈逐年升高趋势[1-2]。在中国,乳腺癌的发病率和病死率均居女性全部恶性肿瘤首位,患者的生存期与肿瘤分期密切相关[3]。目前,乳腺癌的诊断依赖于肿瘤标志物、影像学和病理学检查,其治疗方法及预后与病理类型、肿瘤大小、淋巴结转移情况、TNM 分期、激素受体状态等临床特征密切相关[4]。临床主要采取影像学检查和细针穿刺活检诊断乳腺癌,但影像学检查有时不能准确地鉴别乳腺肿块的良恶性,细针穿刺活检需要在病变部位进行穿刺,会给患者带来一定的创伤,并且可能因穿刺部位不准确而导致诊断结果不准确[5]。肿瘤标志物是肿瘤细胞增殖过程中分泌的一些特异性蛋白质片段,存在于血液中,可提示肿瘤进展情况,其中糖类抗原125(carbohydrate antigen 125,CA125)、糖类抗原153(carbohydrate antigen 153,CA153)在乳腺癌中异常表达[4,6]。超声检查可以显示乳腺肿瘤组织、周围组织及血管情况,有助于发现微小病灶,从而判断肿瘤的生长情况[7]。乳腺影像报告和数据系统(breast imaging- reporting and data system,BIRADS)主要用于对乳腺肿块进行分类,可以帮助医师判断肿块性质,以指导临床诊疗。本研究探讨超声、CA125Ⅱ、CA153Ⅱ联合检查对乳腺癌的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2019 年1 月至2022 年12 月于萍乡市妇幼保健院进行诊治的BI-RADS分级4级及以上的乳腺疾病患者。纳入标准:①女性,BI-RADS分级4级及以上[8];②首次诊治;③年龄>18 岁;④临床资料完整;⑤依从性较好。排除标准:①合并其他恶性肿瘤;②合并其他脏器功能障碍;③合并自身免疫疾病。依据纳入和排除标准,本研究共纳入93 例BIRADS 分级4 级及以上患者,年龄30~85 岁,平均(48.57±10.26)岁;病程1~7年,平均(3.34±2.16)年;体重指数21.49~26.73 kg/m2,平均(23.86±1.79)kg/m2;已婚76 例,未婚17 例;已育86 例,未育7 例;病灶位置:左乳51例,右乳39例,双乳3例。本研究经医院伦理委员会审批通过,所有患者均知情同意。
1.2 检查方法
1.2.1 超声检查 患者取仰卧位,双臂越过头顶,采用GE LOGIC E9 彩色超声诊断仪进行检查。记录乳腺肿块的边界、形态、钙化灶、毛刺征、血管征、内部回声、纵横比和血流信号等[9]。
1.2.2 CA125Ⅱ、CA153Ⅱ检测 采集患者空腹静脉血5 ml,离心后分离血清,采用全自动免疫分析仪检测血清CA125Ⅱ、CA153Ⅱ水平。CA125Ⅱ>35 U/ml为阳性,CA153Ⅱ>25 U/ml为阳性[10]。
1.3 观察指标
①比较不同超声征象乳腺疾病患者的乳腺BI-RADS 分级。②比较乳腺良性疾病和乳腺癌患者的CA125 Ⅱ、CA153 Ⅱ水平。③分析超声、CA125Ⅱ、CA153Ⅱ单独及联合检查对乳腺癌的诊断价值。联合检查时,任意一项阳性即判定为阳性。
1.4 统计学方法
采用SPSS 22.0 软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;等级资料的比较采用秩和检验;符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验;采用Kappa 检验进行一致性分析;绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curvr,AUC),分析超声、CA125Ⅱ、CA153Ⅱ单独及联合检查对乳腺癌的诊断价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 病理检查结果
经病理检查,93 例患者中,乳腺癌患者85 例(非特殊型浸润性癌46 例,浸润性导管癌34 例,浸润性小叶癌2 例,黏液腺癌3 例),乳腺良性疾病患者8 例(乳腺腺病1 例,乳腺纤维腺瘤4 例,乳腺导管内乳头状瘤3 例)。
2.2 不同超声征象乳腺疾病患者BI-RADS 分级的比较
不同肿块形态、钙化灶、毛刺征、内部回声、血管征、纵横比乳腺疾病患者的BI-RADS 分级比较,差异均有统计学意义(P<0.05)。(表1)

表1 不同超声征象乳腺疾病患者BI-RADS 分级的比较
2.3 CA125Ⅱ、CA153Ⅱ水平的比较
乳腺癌患者的CA125Ⅱ、CA153Ⅱ水平均明显高于乳腺良性疾病患者,差异均有统计学意义(P<0.01)。(表2)
表2 乳腺良性疾病和乳腺癌患者CA125Ⅱ、CA153Ⅱ水平的比较(U/ml,±s)

表2 乳腺良性疾病和乳腺癌患者CA125Ⅱ、CA153Ⅱ水平的比较(U/ml,±s)
疾病类型乳腺良性疾病(n=8)乳腺癌(n=85)t值P值CA125Ⅱ17.76±4.86 28.45±8.89 3.343<0.01 CA153Ⅱ11.12±3.75 18.54±5.89 3.487<0.01
2.4 超声、CA125Ⅱ、CA153Ⅱ单独及联合检查诊断乳腺癌的结果与病理检查结果的一致性
超声、CA125Ⅱ、CA153Ⅱ联合检查诊断乳腺癌的结果与病理检查结果的一致性Kappa 值为0.708,高于三者单独检查的0.472、0.430、0.411。(表3)
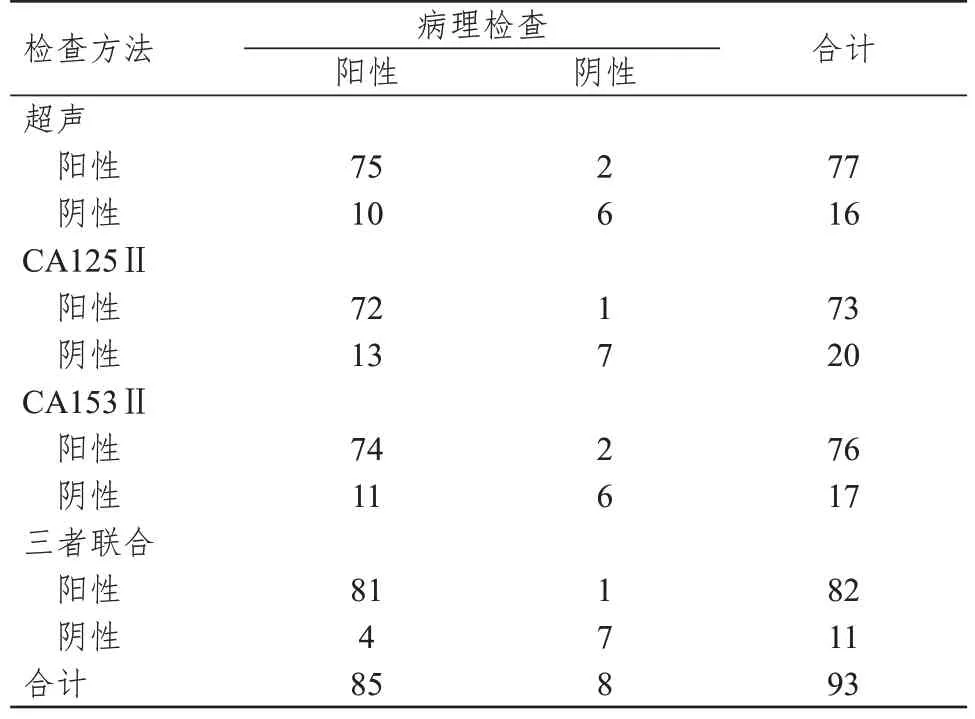
表3 超声、CA125Ⅱ、CA153Ⅱ单独及联合检查诊断乳腺癌的结果与病理检查结果的对照
2.5 超声、CA125Ⅱ、CA153Ⅱ单独及联合检查对乳腺癌的诊断价值
ROC 曲线显示,超声、CA125Ⅱ、CA153Ⅱ联合检查诊断乳腺癌的AUC 为0.908,高于三者单独检查的0.804、0.855、0.799;超声、CA125Ⅱ、CA153Ⅱ联合检查诊断乳腺癌的灵敏度为0.941,高于三者单独检查的0.859、0.835、0.847。(图1、表4)

图1 超声、CA125Ⅱ、CA153Ⅱ单独及联合检查诊断乳腺癌的ROC曲线

表4 超声、CA125Ⅱ、CA153Ⅱ单独及联合检查对乳腺癌的诊断价值
3 讨论
乳腺癌作为常见的恶性肿瘤,发病因素较多,其发生与工作生活环境、饮食习惯等密切相关,早诊断早治疗是降低乳腺癌患者病死率的重要方式。目前,乳腺癌的临床筛查和诊断方法主要包括影像学检查、病理学检查和血清肿瘤标志物检测。影像学检查具有操作简单方便、无辐射、无创伤、费用低等优点,可以用于诊断乳腺癌并判定腋窝淋巴结转移情况[11]。但是一些早期乳腺癌患者超声征象不明显,超声检查容易漏诊或误诊,影响治疗。随着医疗科技的发展,肿瘤标志物的研究越来越深入,人们发现某些肿瘤标志物会在某些恶性肿瘤患者体内高表达并具有一定的特异性,具有较高的诊断效能[12-14]。
本研究结果显示,不同肿块形态、钙化灶、毛刺征、内部回声、血管征、纵横比乳腺疾病患者的BI-RADS 分级比较,差异均有统计学意义(P<0.05)。表明不同超声征象乳腺疾病患者的BI-RADS 分级不同。本研究还发现,乳腺癌患者的CA125Ⅱ、CA153Ⅱ水平均明显高于乳腺良性疾病患者,差异均有统计学意义(P<0.01)。表明乳腺癌患者中CA125Ⅱ、CA153Ⅱ水平均较高。超声、CA125Ⅱ、CA153Ⅱ联合检查诊断乳腺癌的结果与病理检查结果的一致性Kappa 值为0.708,高于三者单独检查的0.472、0.430、0.411。ROC 曲线显示,超声、CA125Ⅱ、CA153Ⅱ联合检查诊断乳腺癌的AUC 为0.908,高于三者单独检查的0.804、0.855、0.799;超声、CA125Ⅱ、CA153Ⅱ联合检查诊断乳腺癌的灵敏度为0.941,高于三者单独检查的0.859、0.835、0.847。表明超声、CA125Ⅱ、CA153Ⅱ联合检查对乳腺癌具有较高的诊断价值。CA125Ⅱ是来源于胚胎发育期体腔上皮细胞的糖蛋白,有研究发现,乳腺癌患者的血清CA125Ⅱ高表达,可用来诊断乳腺癌及评价预后[15-16]。CA153Ⅱ是一种糖蛋白,最早在乳腺中被发现,对乳腺癌具有较高的诊断价值[17]。乳腺癌患者的肿瘤细胞可以突破腺泡基底膜,并向周围组织浸润,因此超声征象显示出形态不规则、边缘毛刺征、微小钙化灶、内部回声不均匀、内部可见血管征等,可与乳腺良性肿瘤进行区分[18]。有研究发现,血清CA153Ⅱ、CA125Ⅱ等多项肿瘤标志物联合检测诊断乳腺癌的准确度高于单独检测,与本研究结果一致[19]。
综上所述,乳腺癌患者中CA125Ⅱ、CA153Ⅱ表达均升高,超声、CA125Ⅱ、CA153Ⅱ联合检查对乳腺癌具有较高的诊断价值。但本研究存在一定的不足,纳入的乳腺良性疾病患者较少,因此可能会对结果造成一定的影响,后续将纳入更多患者进一步验证本研究结果。

