不锈钢在盐酸介质中的耐腐蚀性能研究现状及展望*
梁东光,张君阳,陈芳芳,田文明,程法嵩
(1.北华航天工业学院 材料工程学院, 河北 廊坊 065000;2.中国航发贵州黎阳航空动力有限公司工程技术部,贵阳 550014)
0 前 言
不锈钢是一种具有优异耐蚀性、良好成型性、广泛相容性的金属材料,能够在很宽的温度范围内保持强度和韧性,且全寿命成本较低,因而被广泛用于石油化工、电力、水处理等领域[1-3]。材料在上述领域应用时,常面临富含盐酸或产生富含盐酸副产物的环境。例如,在炼油过程中,常减压塔冷凝系统中会不断凝结出盐酸并引发盐酸露点腐蚀[4]。虽然不锈钢表面有一层保护性很强的钝化膜/氧化膜,但氯离子和氢离子均会造成钝化膜层的弱化、减薄甚至局部破坏,进而导致点蚀、晶间腐蚀、应力腐蚀等局部腐蚀的发生发展,最终造成不锈钢壳体或管道的腐蚀穿孔,甚至会发生爆炸[5-6]。研究不锈钢在含盐酸介质中的腐蚀特性和规律,对于预测设备服役寿命、安全裕度,进而改进设备设计制造具有重要的理论和工程意义。
不锈钢在盐酸介质中的腐蚀行为较为复杂,影响因素较多且存在交互作用,造成不同研究人员所得数据离散性较大,对不锈钢在盐酸介质中的钝化性能、钝化膜动态溶解/再生行为,以及钝化膜最终的破坏机理难以形成共识[1]。本研究对不锈钢在盐酸介质中的腐蚀研究方法、耐盐酸腐蚀的机理及影响因素进行了综述,提出了耐盐酸腐蚀不锈钢的选材原则及发展方向,以期推动不锈钢的应用研究向更深入更细致的方向发展。
1 不锈钢在盐酸介质中的腐蚀研究方法
1.1 挂片法或浸泡法
挂片法或浸泡法是最常用的不锈钢耐盐酸腐蚀的测试方法之一,该类方法对设备要求低,操作相对简便,在不影响生产的情况下可将试片置于工作环境中,结果可直观反映含盐酸介质工况对不锈钢耐蚀性的影响[7-9]。模拟试样采用挂片或全浸腐蚀后,可采取增重/失重法定量计算不锈钢的腐蚀速度或评估腐蚀程度,但质(重)量法只适用于不锈钢在高温高浓度盐酸中发生的均匀腐蚀,对于腐蚀非常轻微的宏观腐蚀或点蚀等局部腐蚀则不适用[7]。经盐酸腐蚀后的试样也可以通过目视判断宏观腐蚀损伤程度,并借助坐标纸计算腐蚀面积百分比用于评估腐蚀等级。对于在盐酸中发生点蚀等局部腐蚀的情形,还可以借助孔深仪测量最大点蚀深度,用于评价点蚀严重程度。随着光学测量、精密电机及图像识别技术的进步,三维显微镜、激光共聚焦显微镜被应用于测量不锈钢在盐酸介质中的局部腐蚀深度、腐蚀面积并自动识别腐蚀区域面积百分比,甚至可以测量某些局部腐蚀(如点蚀)的损伤体积,可以便捷、准确地定量评价腐蚀损伤,可用于挂片或浸泡后的腐蚀速率或腐蚀程度判定[5-6]。
1.2 电化学测试方法
研究不锈钢在盐酸介质中的腐蚀行为,电化学测量技术一直占有很大比重,也是最便捷、最直观、最易于定量分析的一类方法,其中动电位极化法(包括循环伏安法)、电化学阻抗谱(EIS)以及Mott-Schottky测试是最常用的表征不锈钢在盐酸中腐蚀特性的方法[10-13]。
动电位极化法为评价不锈钢在盐酸介质中的局部腐蚀敏感性及再钝化能力提供了依据,可以直观测量并得到不锈钢的自腐蚀电位、自腐蚀电流密度、钝化电位、过钝化(钝化膜破裂)电位、再钝化电位、钝化电位区宽度及维钝电流密度等热力学及动力信息,可判断不锈钢在盐酸介质中的钝/活化转变条件,是最常用的电化学测量方法[10]。EIS 是一种以小振幅正弦波电压为激励信号的无损电化学测量方法,其Nyquist 及Bode 图可定性或半定量地评价钝化膜耐蚀性及电化学反应阻力,结合合理的等效电路可以对不锈钢在盐酸中的钝化膜特性及电化学反应行为进行定量分析,判断电化学反应阻力的主要来源[12-13]。不锈钢在盐酸介质中的耐蚀性与其钝化膜特性密切相关,钝化膜中存在缺陷,并分布着空间电荷层和电压降,膜中缺陷的特征(密度及类型等)是外加极化电位的函数,可用Mott-Schottky 测试研究钝化膜的半导体性质,Mott-Schottky 曲线斜率的绝对值越大,表明钝化膜内的缺陷密度越低,缺陷扩散的速率就越低,钝化膜则越稳定[13-14]。但不锈钢在盐酸介质中的电化学腐蚀行为较为复杂,电化学测量结果可能与不锈钢在盐酸中长期服役后的实际腐蚀数据难以匹配,但能够准确反映不锈钢钢种、影响因素对耐蚀性的相对影响,因此仍被广泛用于研究不锈钢在盐酸介质中的腐蚀行为。
1.3 不锈钢表面特性研究方法
腐蚀往往起源于微小的表面缺陷及其他电化学性质不均匀的部位,可以采用扫描电镜(SEM)、透射电镜(TEM)、原子力显微镜(AFM)等显微分析技术研究不锈钢中组织缺陷(非金属夹杂、碳化物、硫化物、晶界)诱发腐蚀萌生的信息,揭示不锈钢在盐酸中腐蚀发生的机理[15-17]。随着开尔文探针力显微镜(KPFM)、扫描电化学显微镜(SECM)、电化学扫描隧道显微镜(ECSTM)、微区阻抗谱(LEIS)、扫描振荡电极(SVET)等微区电化学技术的发展,可以针对不锈钢在盐酸介质中的钝化膜结构及破裂再生行为展开研究,揭示局部腐蚀发生发展的主控因素及机理[18-21]。Ye 等[22]利用SECM 监测了不锈钢表面的电流分布,原位观察了单个蚀孔的萌生行为。Cheng 等[23]利用KPFM 及微区电化学技术研究了双相不锈钢的钝化特性及点蚀萌生行为,发现铁素体及奥氏体的同时存在促进了双相不锈钢钝化膜的生长及稳定,当钝化膜局部破裂时产生pA 级的反应电流,当破裂部位发展为点蚀时则增加为nA 级,且点蚀中心的电流密度比周围的高。Li 等[24]利用AFM 原位观察了纳米晶不锈钢的钝化膜生长与破坏行为,发现纳米晶不锈钢有比传统粗晶更快的修复速度。以上技术由于具有极高的分辨率,研究钝化膜破坏及点蚀形核时具有明显优势,加深了人们对不锈钢腐蚀起源的认识。
不锈钢在盐酸介质中的腐蚀溶解速度远低于普通钢材,这主要是其表面钝化膜(或氧化膜/吸附层)与环境的隔绝作用,因而X射线光电子能谱(XPS)、俄歇电子能谱(AES)或表面增强拉曼光谱(SERS)等表面分析技术常用于表征不锈钢的钝化膜特性[25-28]。XPS 能够获得钝化膜中金属离子的价态、氧化物或氢氧化物的结构及类型,可以对钝化膜的组成及结构进行研究;AES 能够获得钝化膜表层准确的元素分布信息,可用于推测钝化膜的化学组成;SERS 与XPS 的功能类似,可以得到膜层表面的化合物、官能团及成键信息;结合氩离子刻蚀等技术,可以获得钝化膜中金属元素、化合物种类、含量及结构沿深度剖面的分布信息[18,25]。
2 不锈钢耐盐酸腐蚀的机理
不锈钢含有铁素体、马氏体及奥氏体等各种组织,不同组织的不锈钢其元素组成和含量不同。但是,不锈钢中的耐蚀合金元素主要为Cr,Cr 的氧化物及氢氧化物在大多数水基环境中具有较高的热力学稳定性及较低的化学反应速率,这是不锈钢钝化能力得以维持的重要原因[3,29-30]。有研究者通过Ar+离子刻蚀及XPS 研究了奥氏体不锈钢在酸性水溶液中的钝化膜特性,提出了三层结构模型:即钝化膜最外层为金属氢氧化物层,中间层为致密氧化物层,内层为紧挨着金属基体Ni 元素富集层形成的羟基氧化物层[18]。也有学者认为,在盐酸介质中,不锈钢钝化膜应为更简单的双层膜结构,即富含铁铬氧化物的内阻挡层和外部氢氧化物层,其中Cr2O3及Cr(OH)3是 钝 化膜中最有效的耐蚀 成分,图1 所示为基于XPS 结果提出的钝化膜双层模型中氢氧化物及氧化物的分布模型[31]。由于合金元素在氧化物中的扩散系数不同,且各种氧化物的溶解能力也不同,会造成金属元素在不锈钢基体及钝化膜中的分布存在明显差异。图2 所示为根据XPS 测试得到的合金元素在金属基体及钝化膜中的分布百分比[32](基于XPS+Ar+离子刻蚀获得),Cr、Mo 等合金元素在钝化膜中的富集有利于增强钝化膜的稳定性及耐蚀能力。有学者通过旋转圆盘电极测试发现,Cr元素在钝化膜中的富集主要源于氧化物中富Fe化合物的选择性溶解(富Cr 化合物溶解很慢),而Cr 离子(原子)在氧化膜中的高扩散系数只起到辅助作用[6,31]。

图1 基于XPS提出的不锈钢钝化膜外层氢氧化物内层氧化物分布模型[31]
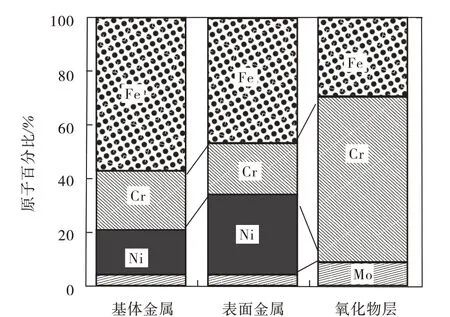
图2 在0.1 mol/L HCl+0.4 mol/L NaCl溶液中含Mo不锈钢基体及钝化膜中合金元素原子百分比
在盐酸中不锈钢钝化膜的生成过程是很快的,一般几毫秒至几秒就可以生成氢氧化物或氧化物层,溶液中的溶解氧以及水分子都可以与不锈钢中的金属离子(原子)直接反应成膜,但膜层的进一步有序化并达到稳定厚度则是一个相对较慢的过程,通常需要几小时至几天不等[18-21]。有学者根据XPS 测试结果认为,不锈钢中的金属元素首先与水在不锈钢表面生成互不关联的氢氧化物团簇,此后氢氧化物沿平面二维生长形成连续膜层并进一步去质子化形成内层氧化物。不锈钢的初生钝化膜为一层无定型结构的金属氧化物膜层,随着时间延长逐渐增厚并晶体化[18,22]。有学者报道钝化膜的晶体化程度及晶体类型与其中的Cr 含量有关,当Cr 原子百分比达到24%时则为无定型结构,当Cr 原子百分比低于10%时则为尖晶石结构。图3 所示为ECSTM 获得的钝化膜原子分布图,证明了较高极化电位下钝化膜中存在晶体结构,由于研究手段的限制及结果重现性的不足,有关钝化膜晶体结构的研究仍存在争议[33]。一般认为不锈钢钝化膜中的金属氧化物多为体心立方结构(钝化膜因为外延生长的缘故具有与基体金属类似的晶格类型),这与1/8 原则(即不锈钢中Cr 原子百分比达到12.5%时耐蚀性开始显著提升)是相符的,在体心立方晶体中,每个原子有8 个相邻的原子,当Cr 原子百分比达到12.5%时,就有50%的Cr 原子至少与一个Cr 原子相邻从而形成Cr元素的连续网状结构。此外,根据渗透理论,Cr 在氧化物晶体中的扩散系数大于Fe 元素,会在氧化物层中富集,促进富Cr 氧化物的生成,在膜层中形成连续的Cr 氧化物从而增强钝化膜的稳定性[31]。

图3 Fe-18Cr-13Ni不锈钢在0.5 M H2SO4溶液中形成的钝化膜表层形貌ECSTM 测试图[33]
不锈钢上的钝化膜在盐酸介质中处于不断溶解再生长的动态平衡中,加之钝化膜厚度很薄,初始成膜反应速度很快[34],因此为研究钝化膜在盐酸中的生长动力学带来了困难。图4 为TEM 获得的奥氏体不锈钢针尖试样表面的钝化膜厚度及形貌图,钝化膜厚度仅为1~4 nm。学者们基于钝化膜很薄但存在较大欧姆电压降的试验现象,提出了多种不锈钢在酸性溶液中的钝化膜生长模型,包括电场加速离子传输模型以及界面(金属/氧化物界面或氧化物/电解液界面)电荷转移模型,二者均能解释部分试验结果[31-33]。基于钝化膜为半导体膜的基本物理特性而发展起来的点缺陷模型,经过四代发展,充分解释了不锈钢在酸性水溶液中的生长破坏行为。点缺陷模型认为,钝化膜基本结构为含有点缺陷的致密层(内层或阻挡层)以及相对疏松多孔的表面层。致密层中的点缺陷包括氧空位、阳离子空位及间隙阳离子,点缺陷的种类及密度(数量)受合金元素及腐蚀介质的共同影响。在浓度梯度及电场的共同作用下,点缺陷不断在金属/阻挡层界面产生并向钝化膜表面迁移(扩散),并在阻挡层/表面层界面湮灭(被反应掉)[16,35]。溶液中的OH-离子、水合氧分子、甚至氧离子会与点缺陷结合生成不溶或难溶化合物,钝化膜就会向金属基体方向生长,钝化膜特别是阻挡层的增厚会增大点缺陷的扩散阻力,最终钝化膜就会达到溶解再生的平衡,厚度基本不变。如果金属离子空位在阻挡层表面持续聚集或溶液中的阴离子占据氧空位与金属离子形成可溶化合物,就会造成钝化膜的溶解破坏,如在盐酸中H+及Cl-等侵蚀性离子与点缺陷结合就会造成钝化膜的持续溶解,并增大膜层中缺陷的密度及扩散流量,最终导致钝化膜阻挡层的减薄乃至破裂[11,16,35]。

图4 0.1 M NaOH溶液中-0.65 V(SCE)预极化2 h后奥氏体不锈钢针尖试样钝化膜的TEM图像[34]
以上关于钝化膜结构及生长特性的成果主要通过XPS、AES、SERS 以及TEM 等手段获得,但这些方法都属于非原位的间接测试手段,对于钝化膜在盐酸中实时的溶解再生行为及结构变化,无法进行原位监测。在以上测试过程中,不锈钢难免要暴露在空气中且不锈钢基体与水蒸气、氧气的反应速度极快,会造成钝化膜的污染,无法获得钝化膜在盐酸中的实际特征,因此不同研究者的结果重现性较差,探索不锈钢钝化膜实时原位的研究手段是重要的发展方向,但原位的研究方法如SECM、ECSTM、LEIS、原位AFM 等均需要借助(镀膜)扫描探针,盐酸介质往往会腐蚀探针并造成数据失真,限制了相关技术的应用[18,35]。
3 不锈钢钝化膜在盐酸中的破坏及影响因素
3.1 不锈钢钝化膜的溶解破坏
无论是在空气还是水基溶液中,不锈钢表面自然生成的钝化膜主要由氢氧化物外层及氧化物内层构成,膜层中含有一定数量的点缺陷,如游离金属正离子、氧离子空位等。当不锈钢与盐酸介质接触时,溶液中的Cl-会与钝化膜中的游离金属正离子(主要为Fe2+/Fe3+)结合成可溶金属氯化物,该反应会持续降低钝化膜中游离金属正离子的浓度,造成金属基体中的金属离子不断脱出晶格并向钝化膜内扩散。此外,Cl-的电活性较强,会在浓度梯度与电场的共同作用下占据钝化膜表面的O2-或OH-离子空位(或直接替代O2-及OH-离子),这一反应显著降低金属离子与O2-的键合能,并导致Cl-向钝化膜内部持续扩散[1-4,6-9]。Cl-离子与Cr及Fe等成键生成的金属氯化物多为可溶物会造成钝化膜的持续溶解,并产生新的阴离子空位继续被Cl-占据,最终导致钝化膜的局部减薄或破裂。关于Cl-对不锈钢钝化膜的破坏作用与机理,文献中已报道很多,这里不再赘述。事实上,H+对不锈钢钝化膜的破坏作用同样不能忽略,由于Fe、Cr、Ni等金属的氧化物及氢氧化物多为离子型化合物,在盐酸介质中具有较高的电离倾向,而H+与O2-及OH-的亲和能很大,易与金属氧化物及氢氧化物反应生成水及游离金属离子,显著加速钝化膜的溶解破坏[10-13]。因此,有报道称H+对Cl-的反应活性具有极大的促进作用,在Cl-浓度相同时,H+的存在可以成倍增加Cl-的侵蚀性,导致不锈钢钝化膜更快、更多地产生局部溶解破裂,且H+是典型的阴极去极化剂,当不锈钢表面一旦产生局部腐蚀,H+就能不断消耗电子维持局部腐蚀的活化发展[11]。H+和Cl-的相互促进作用,是加速不锈钢钝化膜破裂产生局部腐蚀的主要原因。
3.2 不锈钢钝化膜在盐酸中稳定性的影响因素
Cr是不锈钢中最重要的耐蚀性元素,虽然Cr本身的溶解能力强于Fe,但其氧化物Cr2O3、CrO3及氢氧化物Cr(OH)3等与盐酸的反应能力显著弱于Fe的氧化物及氢氧化物,形成可溶性Cr盐的过程较慢,因此随着Cr含量的提升,钝化膜的稳定性显著增加,Cr元素还会在钝化膜中富集,形成连续的Cr氧化物网络,不锈钢耐盐酸腐蚀的能力因此提高。Cr元素含量的升高还会促进钝化膜的有序化并有效减少游离Fe2+、Fe3+等点缺陷的密度,延缓Cl-向钝化膜内部的渗透。此外,Cr金属新鲜表面的反应活性很高,与H2O及溶解氧接触瞬间就能直接生成氢氧化物或氧化物,这些特性都有利于钝化膜在盐酸中保持稳定性[18-19,32]。
Mo 的作用机理相对复杂,是一种少量加入就能显著增强不锈钢耐盐酸腐蚀性能的合金元素,Mo 也是在钝化膜中发生富集的主要合金元素之一。XPS 测试表明:Mo 的+2 价、+3 价、+4价、+5 价及+6 价的化合物在不锈钢钝化膜中均能检测到[31]。Mo 对钝化膜的增强机理较为复杂,但基本可分为两种观点:一种认为Mo与Cl-形成了可溶性的Mo-Cl-O 络合物,干扰了Cl-与Fe 及Cr 的反应,并降低了钝化膜中Cl-的浓度,同时可溶性Mo-Cl-O 络合物的存在降低了膜层/溶液界面处游离Cl-的浓度,降低了其反应活度;另一种认为Cl-与Mo 生成了多种不溶或难溶化合物,包 括MoCl2、MoCl3、MoOCl、MoOCl2及MoO2Cl等,特别是β-MoCl2为一种典型的不溶钼氯化物,它在钝化膜中的存在可以起到屏蔽Cl-渗透的作用,以上难溶化合物特别是β-MoCl2的存在已被XPS检测所证实[31-32]。通过与Cl-形成难溶化合物,Mo 可以显著降低钝化膜中Cl-的含量。有研究发现,同种不锈钢在加入3%左右的Mo 后,钝化膜中Cl-浓度会降低至少50%,有效降低钝化膜的溶解速度和破裂可能性[32]。在较高的阳极电位下,Mo 还会以钼酸盐的形式存在,钼酸盐吸附于金属或氧化物表面,可以改变钝化膜的可透过性,阻碍Cl-及OH-向屏蔽层氧化物的渗透,有效增强钝化膜的耐腐蚀稳定性。此外,Mo 元素的存在会显著降低Fe2+、Fe3+等游离阳离子点缺陷在钝化膜中的密度,可有效提升钝化膜的稳定性。Mo 还可以在钝化膜中占据部分Cr3+在晶格中的位置,从而降低钝化膜中Cr元素的含量,并部分替代Cr元素的作用[18,32-34]。
Ni元素也具有增强不锈钢抗局部腐蚀性能的作用,与Fe和Cr相比,Ni更难被氧化,因此在不锈钢氧化物/金属界面上会富集一层金属Ni,在N元素存在时,会生成NiN(尚存争议),从而增强不锈钢的抗点蚀能力。也有XPS测试表明,Ni主要以Ni(OH)2存在于钝化膜中。Ni元素还能促进不锈钢钝化膜的有序化,从而降低膜层内的点缺陷密度[18-20,31]。虽然N在Fe基体中的固溶度非常低,但也是一种可以提升不锈钢耐蚀性的元素,特别是和Mo元素配合时效果更显著。
很多研究者认为,N增强抗腐蚀性能的作用是由于N元素在金属/氧化物界面的富集及金属氮化物的形成,但由于N在不锈钢中的固溶度太低,从热力学及动力学上看氮化物均难以形成。XPS测试结果表明,N并未参与到钝化膜的成膜过程中,对钝化膜的化学组成影响也很小,N的主要作用体现在钝化膜破裂后点蚀发展过程中,金属溶解后留下的N 元素会富集在蚀孔内部形成或NH3,从而升高蚀孔内部的pH值,使萌生的点蚀孔易于再钝化[31-32]。图5显示了合金元素对酸性含Cl-介质中不锈钢恒电位极化行为的影响,Mo及N 的加入不但显著升高了不锈钢的点蚀电位,同时显著降低了亚稳态点蚀的形核数量[31]。
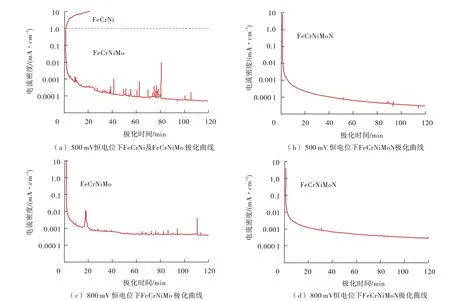
图5 不同成分不锈钢在0.1 M HCl+0.4 M NaCl溶液中不同电位下的恒电位极化曲线图[31]
W是近年来发展起来的不锈钢添加元素,其作用与Mo非常类似,但W的+6价化合物比Mo的+6价化合物更加稳定,同样可以增强不锈钢的耐盐酸性能[36]。而C、S、P、O等元素作为降低不锈钢耐蚀性的元素,其作用主要是形成杂质相,消耗致钝合金元素。无论是阴极性还是阳极性夹杂物都会降低不锈钢在盐酸中的耐蚀性能,一是因为二次相引发局部电化学不均匀性,加速钝化膜薄弱部位与基体金属的局部溶解;二是部分二次相(MnS)不具备钝化能力,在盐酸中直接溶解形成腐蚀坑引发局部腐蚀持续发展[1,6-9]。当然,不锈钢基体中的其他缺陷(晶界、微孔等)往往也会在钝化膜上形成缺陷,造成耐盐酸性能的降低。
环境因素同样是不锈钢在盐酸介质中服役寿命的决定性因素。盐酸浓度(包括pH 值)是最重要的参数,盐酸浓度升高意味着Cl-及H+数量更多,与金属氧化物及氢氧化物的反应能力更强,会更快更多地占据O2+及OH-离子空位并形成可溶氯化物,钝化膜破裂的概率更高速度更快,更易引发局部腐蚀溶解。同时,H+是盐酸介质中主要的阴极去极化剂,盐酸浓度的升高,提供了更多地H+,局部腐蚀中阴极去极化反应更加剧烈,更容易维持局部腐蚀阴阳极间的电化学差异,导致腐蚀速度快且不易钝化[4-6]。有报道称,随着盐酸浓度的升高,不锈钢的腐蚀形式会逐渐由局部腐蚀转变为均匀腐蚀[18]。盐酸介质的腐蚀性随温度的升高单调增强,温度升高Cl-、H+等离子的反应活性增强,各类粒子及点缺陷的扩散系数也会随温度升高而增大,这些都会加剧钝化膜的溶解破裂,高温下再生的钝化膜中空位及游离离子的密度也会大大增加,从而降低膜层稳定性,导致局部腐蚀的萌生发展。
不锈钢处于盐酸中为了保持稳定钝化,其电位经常要处于的稳定钝化区,理论上来说,只要不锈钢处于该电位区就能保持钝化,但钝化区电位有高有低,也会对钝化膜结构及耐蚀性能产生影响。更高的极化电位下可以生成更厚的钝化膜,如FeCrNiMo 不锈钢在盐酸中钝化膜厚度会由-75 mV(SCE)时的1.2 nm增加到800 mV(SCE)时的2.2 nm。更高的极化电位还会促进Cr(OH)3向Cr2O3转变,如氢氧化物中Cr3+的原子百分比会由-75 mV 时的47%降低到800 mV时的18%,而氧化物中的Cr3+原子百分比则由27%增加到38%,Fe2+、Fe3+的浓度也相应增加[31-32]。此外,电位的增加会显著增加钝化膜中点缺陷的密度,降低钝化膜中的总Cr占比,升高总Fe占比。高极化电位还会造成更多的Cl-渗透进钝化膜,图6所示为不同电位下不同成分不锈钢钝化膜中的Cl-浓度,可以看出,高极化电位下钝化膜中Cl-浓度更高,这主要是由于高极化电位下钝化膜中的电场强度更大,会加速游离金属离子向溶液方向扩散,而Cl-则加速向钝化膜内部扩散,以上因素都不利于钝化膜稳定性。因此,在盐酸中,高极化电位下生成的钝化膜厚度更厚,但点缺陷密度和Cl-含量都更高,总体来说,在钝化电位区,不锈钢的耐蚀性能是随极化电位的升高而逐渐降低的。
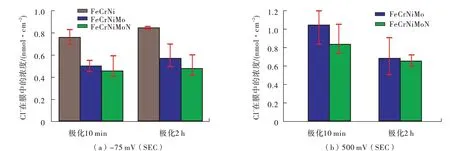
图6 不锈钢在0.1 M HCl+0.4 M NaCl溶液中不同电位下钝化膜中Cl-浓度[31]
4 耐盐酸腐蚀不锈钢的发展方向及选材
耐盐酸腐蚀不锈钢主要的发展方向是提高其耐酸性及耐Cl-侵蚀的能力,可以在生产工艺上进行升级优化。冶炼过程中降低C、O、S、P 等有害元素的含量,且最好是协同降低以上元素在不锈钢中的含量,阻止或有效减缓非金属夹杂(或沉淀第二相)的形成,减少对致钝元素的局部消耗,消除局部腐蚀敏感点。对于铁素体及马氏体不锈钢,其在盐酸中的耐蚀性能低于奥氏体及双相不锈钢,应用于盐酸环境中时,还应降低N 元素的含量[1,37],将Cr、Mo、Ni 及W 等致钝合金元素的含量提升至固溶体溶解量上限,充分发挥各致钝元素间的协同效用,有效提升钝化膜的致密性及稳定性。对于奥氏体及双相不锈钢还可以增加N 元素的含量至固溶体溶解量上限,N 可部分替代Ni 元素保证奥氏体的稳定并显著增强不锈钢的耐蚀性能[37-38]。此外可以发展稀土元素不锈钢,进一步提升钢种的耐盐酸腐蚀性能。
用于盐酸环境中的不锈钢,应进行合适的热处理改善其耐蚀性,如对奥氏体不锈钢进行充分的固溶热处理或稳定化热处理。对于轧制不锈钢,应进行合理且充分的轧制,以便充分破碎钢中的二次相,并促进其均匀分布,以便降低不锈钢的电化学不均一性[1,28]。此外还可以对不锈钢的表面进行离子注入处理或表面纳米化处理,可以进一步提升不锈钢的耐盐酸腐蚀性能,同时降低综合成本。如采用离子氮化的方法强化奥氏体及双相不锈钢,可以明显提升不锈钢对盐酸的耐受性;而表面纳米化后的不锈钢其表面夹杂相粉碎充分,晶界密度大,更有利于致钝元素扩散到基体表面修复钝化膜,因此往往表现出更好的耐腐蚀能力[14-15]。
在盐酸环境工作的不锈钢进行选材时,首先,应当选择低碳不锈钢或超低碳不锈钢,如选取304L 或316L 等,与同牌号的不锈钢相比,低碳不锈钢的耐盐酸腐蚀性能更加出色,服役稳定性更好,往往用于安全性及稳定性要求更高的场合;其次,应当选取含Mo 不锈钢,前面的章节已经充分论述了Mo 对钝化膜稳定性的促进作用及机理,所以服役于盐酸介质中的部件应选取含Mo 的奥氏体不锈钢及双相不锈钢,还可选取高合金含量的超级奥氏体及超级双相不锈钢,以便充分发挥多种致钝元素的协同作用,充分强化钝化膜的耐盐酸性能。如果环境介质中盐酸含量较低(低于10%)温度也较低(35 ℃以下),可以考虑选取成本较低的超级铁素体不锈钢及超级马氏体不锈钢,但对于不易检查维护、可靠性要求又高的设备,建议采用耐蚀性最好的超级奥氏体及超级双相不锈钢。
5 结束语
不锈钢在盐酸中耐蚀性的测试方法主要包括挂片法、浸泡法以及电化学测试等方法,挂片及浸泡法可模拟实际环境,对设备要求低,但测试周期较长;电化学法测试简便快捷,但结果与实际腐蚀数据存在偏差,仅适用于评价材料、环境的相对耐蚀性或腐蚀性。不锈钢钝化膜物化特性的研究方法主要集中于XPS、KPFM、TEM 等方法,并发现在盐酸介质中不锈钢钝化膜主要由外层多孔的金属氢氧化物层及内部致密的金属氧化物层构成,在盐酸介质中会受到H+及Cl-的双重侵蚀而产生局部减薄及破裂并引发局部腐蚀。随着溶液介质中盐酸浓度及温度的升高,溶液腐蚀性增强,钝化膜溶解破坏会更加迅速。不锈钢在盐酸中能保持较慢的腐蚀速率得益于钝化膜中Cr、Mo 等耐蚀合金元素的富集,致钝合金元素能够显著降低Cl-对钝化膜的渗透侵蚀。如果要增强不锈钢在盐酸介质中的稳定性,在冶炼过程中应尽可能降低C、O、S、P等杂质元素的含量,提升Cr、Ni、Mo 及W 等致钝元素的含量,对于奥氏体不锈钢还可增加N元素含量。进行含盐酸介质的选材时应选取超低碳、高合金含量不锈钢,以保证服役稳定性及寿命。

