包埋固定化小球藻对水中铜离子吸附研究
刘跃福,颜威鹏,林文杰,陈焕槟,许博宇,陈雯洵,林婷婷,方银玲
(韩山师范学院化学与环境工程学院,广东 潮州 521041)
铜作为人类最早使用的金属之一,在制造业、建筑行业和国防军事等领域得到广泛使用.目前,中国已成为全球最大的铜消费国,铜的年消费量由1949 年的1.5 万吨增长到2021 年的1 388.5 万吨,增长46.4 倍,累计消费量为1.9 亿吨[1].采矿、金属冶炼等工业生产活动导致有毒、有害重金属向环境的排放量与日俱增,环境污染日益加剧,严重影响到生态环境安全和人类健康[2].例如,2020 年江西铜业永平铜矿事件中含酸性物质的污水大量泄露,污水中铜含量超出国家标准23 倍,造成严重的国民经济损失.为解决水体中重金属的污染问题,前人开展过很多探索性的研究工作.目前,去除废水铜离子方法有离子交换法、膜分离法和蒸发法等,但这些方法存在操作复杂,运行费用高,在铜离子浓度低时去除效果差,极易造成二次污染等问题[3].吸附法作为一种治理成本低,适用范围广泛的物理处理方法,能够应用于铜污染废水治理,处理效率在很大程度上与吸附剂材料的吸附能力和用于制备的原材料有关[4].市面上高效的吸附剂因销售价格昂贵,制约了这类吸附剂的使用,因此开发高效经济型的吸附剂成为一种迫切需求[4].藻类吸附具有以下优点:一是吸附速度快、可逆性强以及无需能量供应;二是藻类在吸附过程中存在动态的吸附-解吸平衡,将藻类进行固定化后可以通过解吸清洗来对固定化小球藻回收并再次使用;三是藻类在自然界中广泛存在,原材料容易获得;四是与其他吸附剂相比,藻类去除重金属已被证明是更经济实惠且高效的方法,能够高效处理铜离子浓度低于100 mg/L 时的污水[5],藻类对常见重金属离子的亲和性有以下排列顺序:Pb>Fe>Cu>Zn>Mn>Ni>V>Se>As>Co[6],因此利用藻类吸附重金属铜离子是可行高效的.小球藻(Chlorella vulgaris)在自然界中分布广泛,容易获得;小球藻对重金属具有很强的吸附和富集能力,处理效果好,且吸附后不易发生二次污染,因而许多国内外研究人员尝试使用小球藻,作为绿色吸附剂对污染水体进行修复治理.
藻类通常具有个体较小,获取困难且处理之后不易固液分离,同时在吸附过程中易发生流失等特点,一定程度上限制了其在重金属污水处理行业的直接应用.藻类固定化技术是一种细胞固定化方法,它通过将藻类细胞包埋于多孔性聚合物中,提高藻类在水体中的稳定性和耐受性,从而防止藻类流失;提高藻类的环境负荷能力,使其适应多种反应环境,增强其在水质处理中的作用,使得实验操作和固液分离更加容易,还能进行回收重复使用[7].当前已被广泛应用的藻类固定化方法有:包埋法(Entrapment)、吸附法(Adsorption)、交联法(Crosslinking)、共价键法(Covalent bonding). 其中,包埋法的制备过程更为简单易行.包埋法是把藻类封闭在凝胶聚合物所形成的特定空间里,使得藻类细胞与载体之间无约束,机械强度良好,固定化颗粒活性高.对藻类固定化时应达到以下标准:(1)固定化不会对藻类产生毒害作用;(2)成球效果好,包埋后颗粒不易发生破裂,藻类不易流失;(3)细胞和载体间没有束缚;(4)较高的物理强度,稳定的化学性质;(5)固定化流程简单,成本低廉.目前藻类固定化载体的类型主要有无机载体和有机载体.从适用性和经济性上考虑,藻类固定化多采用有机载体.据调查,海藻酸钠(SA)综合性能更为优越,具有较好的利用价值和应用前景.海藻酸钠作为包埋剂除了经济实惠、原料易得及无毒无害之外,还具有传质阻力小、制作简单的特点,同时在工业上的应用较为普遍[8].然而,目前各学者的研究中大多是对于有活性的小球藻活体进行研究探讨,较少涉及到对失活小球藻进行固定化的研究,因此,本研究将失活小球藻粉进行包埋固定化,探究其对重金属铜的吸附能力.
1 实验方法
1.1 实验准备
(1)藻类的预处理
将小球藻粉放入研钵中进行研磨,研磨过后的小球藻粉过200 目筛,干燥后保存备用.
(2)固定化颗粒的制备
将过完筛的小球藻粉置于烧杯中与海藻酸钠混合,加入适量去离子水后,放在磁力加热搅拌器上,插入加热棒将实验温度升至50 ℃后开始搅拌,搅拌均匀后待混合液冷却至室温,将其装入6 号针管注射器,距离液面15 cm 处匀速滴入提前预冷的CaCl2溶液,滴入时保持震荡,即形成3 mm 左右的固定化小球藻颗粒.滴完后在室温条件下固定交联24 h.取出颗粒用去离子水冲洗2-3 次,干燥之后备用.
(3)双环己酮草酰二腙溶液(BCO)的配制
称取0.5 g 的BCO,在烧杯中加20 mL 无水乙醇和20 mL 蒸馏水与BCO 混合,置于60 ℃水浴锅中温热搅拌溶解,溶解完后转移至1 000 mL 的容量瓶中用蒸馏水稀释至刻度线,充分混合后置于阴暗处避光保存.
(4)铜离子模拟废水的配制
称量78.125 mg 的CuSO4·5H2O 晶体溶解在1 000 mL 的容量瓶中,待完全溶解后用去离子水定容至1 000 mL 刻度线,即可获得质量浓度为10 mg/L 铜离子模拟废水,配置完后供实验使用.
1.2 实验具体流程
(1)固定化材料对固定化颗粒制备的影响
本研究通过下列两项因素来判定固定化颗粒的物理性能,从而优化固定化材料配比:
①成球难度:将小球藻与海藻酸钠溶液混合均匀后,装入6 号针管并匀速滴入至CaCl2溶液,根据挤压针筒的难易程度以及固定化小球藻在CaCl2溶液中的成球速度来判定固定化小球藻的成球难度;
②机械性能:小球藻- 海藻酸钠混合液在CaCl2交联24 h 后,通过观察、按压颗粒的方式来判定其粒径大小、粒径形状、软硬程度、易破损程度和CaCl2溶液澄清度,考察出最佳固定化小球藻的机械性能.
(2)固定化小球藻颗粒投放量对吸附Cu2+的影响
对固定化颗粒的投加量实验设置5 个梯度组(1、2、5、10、15 g),将颗粒放入有50 mL 铜离子溶液的250 mL 锥形瓶中,分装五组并贴上标签,放于恒温培养振荡器中,调整仪器转速为120 r/min 并进行1 h 的振荡吸附处理,待吸附结束后过滤掉固定化小球藻颗粒,接着利用紫外分光光度计测定溶液的吸光度,并根据标准曲线计算出铜离子的质量浓度.
(3)反应温度对吸附Cu2+的影响
称取10 g 固定化颗粒放入含有50 ml 重金属铜离子溶液的250 mL 锥形瓶中,分装5 组进行吸附反应,同时将恒温振荡器的环境温度设置为5 个梯度实验,依次为30 ℃、35 ℃、40 ℃、45 ℃、50 ℃,将转速调整为120 r/min 开始振荡吸附1 h,随后将吸附后的溶液过滤,然后使用紫外分光光度计测定吸光度,并在标准曲线上得出铜离子质量浓度.
(4)反应震荡时间对吸附Cu2+的影响
在5 个250 mL 的锥形瓶中分别加入10 g 固定化小球藻,然后分别加入50 mL 质量浓度为10 mg/L 的铜离子模拟废水,设置恒温振荡器温度为35 ℃,转速为120 r/min,在0.5、1、1.5、2、2.5 h 时进行取样,随后将吸附后的溶液过滤,然后使用紫外分光光度计测定吸光度,并在标准曲线上得出铜离子质量浓度.
(5)溶液pH 对吸附Cu2+的影响
设置5 个具有不同的pH 初始值(6、6.5、7、7.5、8)的实验条件,然后在5 个含有50 ml 质量浓度为10 mg/L 的重金属铜离子溶液的锥形瓶(规格250 mL)中各加入10 g 固定化颗粒,放置于转速为120 r/min,温度为35 ℃的恒温振荡器内振荡吸附1.5 h,随后将吸附后的溶液过滤,滤液使用紫外分光光度计测定吸光度,并在标准曲线上得出铜离子质量浓度.
(6)铜离子初始质量浓度对吸附Cu2+的影响
配制5 个不同质量浓度(100、200、300、400、500 mg/L)的铜离子溶液,分别取50 mL 转至250 mL 的锥形瓶中,各自称取10 g 固定化小球藻颗粒放入各锥形瓶中,将溶液pH 值调节为6.5 后放于恒温培养振荡器中,调整仪器转速至120 r/min,完成1.5 h 的振荡吸附处理,待吸附结束后用滤纸过滤掉固定化小球藻颗粒,接着利用紫外分光光度计测定溶液的吸光度,并根据标准曲线计算出铜离子的质量浓度.
1.3 实验指标测定
本研究测定铜离子浓度采用BCO 新铜试剂法. 在pH 为7~9 的Na2B4O7溶液中,BCO 会以烯醇式I 形态与二价铜发生反应,生成蓝色的络合物Cu(BCO)2,形成铜(Ⅱ)-BCO 显色体系.因此在水溶液中可直接用分光光度法测定微量铜(Ⅱ)[9]. 具体操作步骤如下:
(1)绘制标准曲线:取7 支具塞比色管用铜离子溶液润洗后,依次加入0、1.00、2.00、4.00、6.00、8.00、10.0 mL 铜离子标准(10 mg/L)溶液,之后向各份样品中加入5 mL pH 为8.5 的Na2B4O7溶液和10 mL 质量浓度为0.5 g/L 的BCO 溶液,并用去离子水定容至50 mL,摇匀显色55 min 后以蒸馏水作为参比液测得吸光度,并将得到的数据绘制成标准曲线,最终制得铜标准曲线为Y=0.098 6X+0.001(Y 为吸光度,X 为浓度),R2=0.999 9.
(2)样品发色:将吸附完成后的固定化小球取出,用移液管量取5 mL 滤液于50 mL的比色管中并做好标签,向比色管中加入pH 为8.5 的Na2B4O7缓冲溶液5 mL 和浓度为0.5 g/L 的双环己酮草酰二腙溶液10 mL,同时用水稀释到刻度线,摇匀后显色55 min,显色后溶液呈蓝色并与铜离子质量浓度成正比.
(3)分光光度测量:以蒸馏水作为参比液,得到稀释后的溶液铜离子吸光度,根据标准曲线换算得出稀释后的Cu2+浓度,再乘以稀释倍数,从而得到吸附完成后的铜离子质量浓度.
(4)计算固定化小球藻对重金属铜离子的吸附率:
式中:C0------ Cu2+的初始质量浓度(mg/L);
Ct------ 反应t 时刻溶液中Cu2+质量浓度(mg/L);
η ------ Cu2+的去除率(%);
2 实验结果与分析
2.1 固定化材料配比研究
2.1.1 藻粉用量对固定化小球制备的影响
实验过程中,向3 个盛有150 mL 含2% CaCl2和4%海藻酸钠(SA)的溶液中分别加入1 g、0.3 g 和0.1 g 藻粉,观察藻粉用量对固定化小球物理化学性质的影响.图1(A)显示,藻粉用量在1 g 时,固定化的小球呈现膨胀的状态,因内部藻粉填充过多[8],小球表面鼓包且容易破裂,在CaCl2中浸泡交联时藻粉严重泄露.当藻粉用量0.1 g 时,由于球体内部藻粉较少,难以填充固定化小球的一些细洞,小球成球状况与机械性能较差.而当藻粉用量0.3 g 时,小球藻颗粒圆润饱满且藻粉较少泄露.因此选用0.3 g 的配比方案.

图1 藻粉用量对制备固定化小球藻的影响
2.1.2 SA 对制备固定化小球藻的影响
设置4 个质量分数分别为1%、2%、3%和4%的SA 溶液对照实验组,溶液中CaCl2的质量分数为2%,藻粉加入量为0.3 g,观察不同质量分数的SA 对制备固定化小球藻的影响.当SA 质量分数为1%时,固定化小球呈现絮丝状,难以成球型.SA 用量过少时会影响对小球藻的包裹性,造成藻粉泄露,影响对重金属的吸附效果[8];当SA质量分数为2%时,小球开始成型,但是成型效果不佳,形状的粒径不均匀,同时小球质地较软易破裂;当固定化小球SA 质量分数为3%和4%时,固定化小球藻成球完整,具有良好的机械性能.综合考虑到小球的制备难度、成球难度以及机械强度,选择4%作为制备固定化小球藻的SA 质量分数.
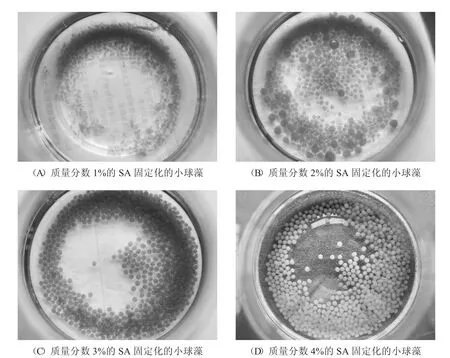
图2 不同质量分数的SA 对制备固定化小球藻的影响
2.1.3 CaCl2用量对固定化小球制备的影响
设置4 个质量分数分别为1%、2%、3%和4%的CaCl2溶液对照实验组,溶液中SA 的质量分数为4%,藻粉加入量为0.3 g,观察不同质量分数的CaCl2对制备固定化小球藻的影响.当CaCl2质量分数为1%时,海藻酸钠-小球藻溶液滴入后慢慢变为不透明的绿色球状,少有融合与黏连现象,同时固定化小球的表面有些许小气泡出现,结构疏松,强度相对较差;当CaCl2质量分数为2%时,小球多为圆球状,粒径与颗粒较为饱满均衡,滴入后由透明的绿色球状转为不透明的绿色球状,有较为良好的强度;当CaCl2质量分数为3%时,小球多为球状,粒径与颗粒较为饱满均衡,滴入后快速变为不透明的绿色球状,但开始出现少量椭球形体,此时机械强度良好;当CaCl2质量分数为4%时,小球形状各异,球形不明显,滴入后快速形成不透明的绿色小球.随着CaCl2质量分数的增大,小球粒径发生变化,强度也有所增大.结合小球经济成本考虑,选择质量分数为2%的CaCl2溶液作为制备最佳固定化小球的浓度.
根据上述实验结果,采用SA 质量分数为4%、150 mL SA 中藻粉投放量为0.3 g、CaCl2质量分数为2%的条件配比用以制备固定化小球.所制备的小球机械性能良好,藻粉泄露情况不明显.
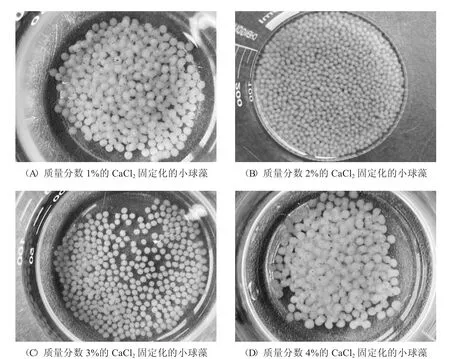
图3 不同浓度的CaCl2 对制备固定化小球藻的影响
2.2 不同条件下对固定化小球藻吸附铜离子效果的影响
在固定化材料配比研究中发现当海藻酸钠质量分数为4%,藻粉投放量0.3 g/150 mL SA,CaCl2质量分数为2%时的固定化配比来制备固定化小球,所制备的小球机械性能良好,藻粉不易泄露,因此将该配比的固定化小球进行单因素影响实验研究,实验结果如表1 所示.

表1 固定化小球藻藻珠投入量、pH、Cu2+初始质量浓度、反应时间、温度对Cu2+去除率的影响
2.2.1 固定化小球藻投放量对吸附Cu2+的影响
根据上述实验所得的最佳配比,制备固定化小球并放入重金属溶液中,保持铜离子初始质量浓度为10 mg/L,反应温度为30 ℃、反应时间为1 h,pH 为6,通过改变固定化小球的投放量来观察固定化小球对重金属铜去除率的变化.
固定化小球藻投加量对去除率的影响如图4 所示.当投放量为1~10 g 时,固定化小球藻投放量与吸附率成正相关关系,吸附率由72.3%升至82.4%.

图4 固定化小球藻的投放量对Cu2+吸附率的影响
投放量为15 g 时,吸附率比10 g 的投放量有略微下降,随着投放的吸附剂量增大,铜离子可吸附点位增多,固定化小球藻对铜的去除率增大,但如果继续增加投放量到一定程度时,吸附剂之间会互相影响,因此会造成吸附率略微降低[9].在兼顾吸附效果和经济效益的前提下,确定最适宜的固定化小球藻投放量为10 g.
2.2.2 反应温度对吸附Cu2+的影响
根据上述实验所得的最佳配比,制备固定化小球并放入重金属溶液中,保持铜离子初始质量浓度为10 mg/L、吸附剂投放量为10 g、pH 为6、反应时间为1 h,通过调节反应温度观察其对Cu2+吸附效率的影响.
如图5 所示,温度变化对固定化小球藻吸附铜离子的影响较小.当温度由30 ℃升至35 ℃时,Cu2+的去除率从80.3%升至84.2%,在35 ℃时吸附效果最好.温度超过35 ℃时,会导致去除率的降低;直至升到50 ℃时,去除率降低至81.7%,主要原因可能是温度的升高破坏了固定化小球藻吸附剂表面的活性区位[10],从而影响到固定化小球藻对重金属离子的吸附能力.但固定化小球藻仍能在较高温度的情况下,保持良好吸附性能.因此固定化小球藻的最佳反应温度应为35 ℃.

图5 反应温度对对Cu2+吸附率的影响
2.2.3 反应震荡时间对吸附Cu2+的影响
根据最佳配比制备固定化小球并放入重金属溶液中,在确定了投放量为10 g 后、保持铜离子初始质量浓度为10 mg/L,温度为35 ℃,pH 为6,通过调整反应震荡时间来观察固定化小球对重金属铜去除率的影响.
如图6 所示,随着反应震荡时间的增加,吸附速率先快后慢,吸附率由76.5%变为80.1%,在1.5 h 时达到最大吸附率为80.1%,并在1.5 h 后反应趋于稳定,后续吸附效果略微降低.因此固定化小球藻对Cu2+吸附可分为2 个阶段:快速吸附阶段与稳定吸附阶段.在反应的前期由于吸附剂表面官能团裸露在外,丰富的活性集团与溶液重金属铜离子发生配位络合作用,传质阻力小并快速进行吸附作用.而在1.5 h 后,吸附剂官能团的表面吸附大都已经饱和,主要官能团大部分已被Cu2+占据,吸附剂达到饱和状态,并与游离的Cu2+产生排斥作用[11].因为固定化小球藻对Cu2+的吸附属于一个可逆的动态平衡过程,在吸附的整个过程中存在着吸附与解吸的过程,在1.5 h 到2.5 h 间Cu2+的去除率有略微减少但是变化很小.考虑吸附率与时间成本的情况下,选取最佳固定化小球藻反应震荡时间为1.5 h.
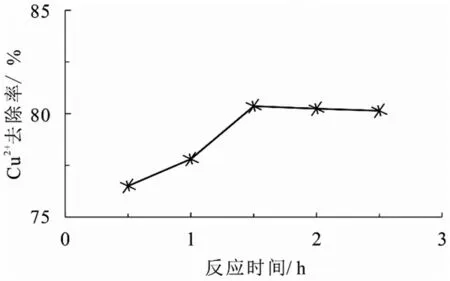
图6 反应震荡时间对吸附Cu2+的影响图
2.2.4 溶液pH 对吸附Cu2+的影响
根据最佳配比制备固定化小球并放入重金属溶液中,在确定了投放量为10 g 后、保持铜离子初始质量浓度为10 mg/L、温度为35 ℃与反应时间为1.5 h,通过调节溶液中的pH 来观察固定化小球对重金属铜去除率的影响.
图7 所示,pH 在6-6.5 的时候,固定化小球藻对重金属铜的去除率上升,在pH=6.5时达到最大值86.7%.但从pH=6.5 开始,提高溶液的pH 会导致吸附率开始下降,甚至低于初始值.这是因为pH 值在6~6.5 范围内升高时,固定化小球藻表面负电荷增多,活性位点可结合更多铜离子,固定化小球藻的吸附率也随之增加.但当pH 值超过适宜范围时,铜离子更多的会与氢氧化物阴离子结合并存在于溶液中[12],使得固定化小球藻表面的活性位点结合的铜离子数量减少,导致重金属铜的去除率降低.可以看出pH 对固定化小球藻去除重金属影响效果显著,在同时考虑吸附率与成本的情况下,选取最佳反应pH 为6.5.
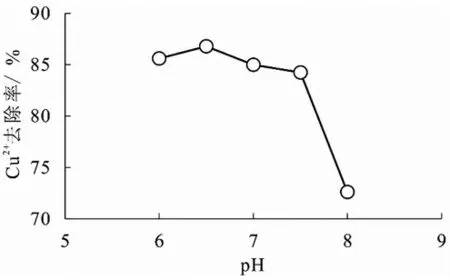
图7 溶液pH 对吸附Cu2+的影响图
2.2.5 铜离子初始质量浓度对吸附Cu2+的影响
根据最佳配比制备固定化小球并放入重金属溶液中,在确定了投放量为10 g 后、保持反应温度为35 ℃、反应时间为1.5 h 与pH=6.5,通过设置不同初始质量浓度(100、200、300、400、500 mg/L)的铜离子溶液来观察固定化小球对重金属铜去除率的变化.
图8 所示,当Cu2+初始质量浓度为400 mg/L 时,去除率为93%,吸附效果为本研究最好.而在初始质量浓度为500 mg/L 时则略微下降到了92.7%,出现这种情况的原因可能是当Cu2+初始质量浓度在100~400 mg/L 时,此时吸附剂上的吸附位点足够多,溶液中的铜离子大部分被吸附,初始浓度的增加会提高吸附剂之间的浓度梯度,促使Cu2+通过浓度梯度驱动力克服与吸附剂之间的传质阻力,固定化小球藻能够通过表面吸附以及离子交换对溶液中的Cu2+持续性去除,导致去除率增大[11].而当初始质量浓度大于400 mg/L 时,继续增大初始浓度使得固定化小球藻表面的吸附位点饱和,静电斥力逐渐占据优势地位,吸附能力趋于饱和,无法继续吸附重金属离子,去除率降低.因此综合考虑上述原因,为使得固定化小球藻充分发挥其吸附效率,应选择400 mg/L 为其最佳反应初始质量浓度.该结果为小球藻运用于治理现实水体中铜离子污染的浓度限定了一个适用的范围.

图8 铜离子初始质量浓度对吸附Cu2+的影响图
3 结 论
本研究以海藻酸钠作为包埋剂,CaCl2作为交联剂来制备固定化小球藻吸附剂,优化机械强度、成球效果,降低制备难度等相关因素.实验结果显示,小球藻固定化吸附剂的最佳包埋条件为:藻粉0.3 g 每150 mL,SA 质量分数4%,氯化钙质量分数2%,制备出的固定化小球藻吸附剂成球完整,机械强度良好.
本研究采用最佳包埋条件的固定化小球作为吸附剂,探究吸附过程中各单因素对Cu2+吸附效果的影响.结果表明,在150 mL 的反应体系中,Cu2+初始质量浓度为400 mg/L,吸附剂投放量为10 g,溶液pH=6.5,反应时间为1.5 h,反应温度为35 ℃时去除率最高可达93%.

