典型卤乙酰胺类消毒副产物对萼花臂尾轮虫的毒性效应
李锦程,徐晓平,2*,陈 涛,秦 璇
1.安徽工程大学建筑工程学院,安徽 芜湖 241000
2.皖江流域退化生态系统的恢复与重建省部协同创新中心,安徽 芜湖 241000
卤乙酰胺(Haloacetamides)是一类新兴含氮消毒副产物,其分子具有很强的极性和亲水性,且挥发性较差,难以去除[1].自2002 年在美国一项饮用水安全调查中被首次检出后,卤乙酰胺陆续在世界各国的饮用水、污水和再生水,甚至在地表水中被检测到,浓度范围一般在0.1~14.0 μg/L 之间[2-5],其中在美国两个湖泊中卤乙酰胺的浓度分别达6.9 和8.3 μg/L[6].我国也有相关报道,粤港澳大湾区的供水管网中检测到的卤乙酰胺浓度为0.41~3.34 μg/L[7],无锡市饮用水厂出水和末梢水中检出卤乙酰胺浓度为0.137~3.288 μg/L[8].资料显示,氯代乙酰胺在检出的卤乙酰胺中占比最大,其次是溴代乙酰胺[9],在中性和酸性条件下,溴代乙酰胺的稳定性大于氯代乙酰胺,其毒性风险更需引起重视[10].
研究表明,卤乙酰胺的毒性远大于含碳消毒副产物且具有“三致”效应[11-12],其可诱导人肾胚细胞产生高含量的活性氧,损坏线粒体正常功能,导致细胞周期阻滞和凋亡[13];还可抑制小鼠胚胎细胞发育,导致流产和胎儿畸形,破坏机体正常能量代谢[14-15].经过暴露,斑马鱼脑组织中卤乙酰胺积累量高于肠和鳃,体内氨基酸代谢出现紊乱,肝脏超氧化物歧化酶和过氧化氢酶水平增加,产生氧化应激[16].何梦婷等[17]还发现,溴乙酰胺可抑制斑马鱼胚胎神经发育相关基因的表达,提高其胚胎脑组织中活性氧水平.然而,关于卤乙酰胺对浮游生物毒性效应的研究较少.
轮虫是水体中常见的浮游生物,主要以水体中的藻类、细菌和有机碎屑等为食,同时又可被枝角类、鱼虾等捕食,在水生态系统物质循环和能量传递过程中发挥重要作用.轮虫普遍具有世代时间短、繁殖快、易于实验室培养、培养成本低和对污染物敏感等特点,常被用来评估污染物的环境毒性和生态风险[18-19].淡水萼花臂尾轮虫(Brachionuscalyciflorus)是开展水生态毒理学研究的模式生物,具有孤雌生殖和有性生殖两种方式,两种生殖方式可交替进行.近年来,利用萼花臂尾轮虫的有性生殖参数和氧化应激指标作为实验终点,开展了多种新污染物毒性效应评价[20-21],但对新兴含氮消毒副产物卤乙酰胺的研究报道较少.鉴于地表水体中存在一定浓度的卤乙酰胺,为探明此类物质对轮虫类重要水生生物的毒性影响,综合评价其潜在的生态风险,采用急性毒性、种群增长、有性生殖和氧化应激指标检测等试验方法,研究了氯乙酰胺、二氯乙酰胺和溴乙酰胺对萼花臂尾轮虫的急慢性毒性效应,以期为正确评价含氮消毒副产物卤乙酰胺的生态风险提供参考.
1 材料与方法
1.1 试验材料
试验所用氯乙酰胺(Chloroacetamide,纯度˃99%)和溴乙酰胺(Bromoacetamide,纯度˃98%)均购于上海阿拉丁试剂有限公司,二氯乙酰胺(Dichloroacetamide,纯度˃98%)购于天津希恩思生化科技有限公司,3 种卤乙酰胺理化性质如表1 所示.氧化应激指标检测生化试剂盒购于北京索莱宝科技有限公司,其余药品购自国药集团,均为分析纯.

表1 氯乙酰胺、二氯乙酰胺和溴乙酰胺的理化性质Table 1 Physical and chemical properties of chloroacetamide,dichloroacetamide and bromoacetamide
受试萼花臂尾轮虫由采自芜湖市镜湖水体沉积物中的休眠卵孵化所得,实验室内经过多代单克隆培养后,种群建立并稳定培养[18].所用轮虫培养基为美国环境保护局(US EPA)配方(EPA 培养基,96 mg NaHCO3、60 mg CaSO4·2H2O、60 mg MgSO4、4 mg KCl、1 L 去离子水)[22],食物为离心收集的斜生四链藻(Tetradesmusobliquus).该藻采用HB-4 培养基在(25±1)℃条件下恒温培养,离心浓缩后置于4 ℃冰箱储存[23].试验正式开始前,将萼花臂尾轮虫置于温度为(25±1)℃培养箱中预培养超过14 d,光暗周期为14 h (光):10 h (暗),每24 h 更换新鲜轮虫培养基,并投喂密度为2.0×106cells/mL 的斜生四链藻,同时去除一部分个体,保持种群处于稳定增长期.
1.2 急性毒性试验
根据多次试验结果,将氯乙酰胺、二氯乙酰胺和溴乙酰胺浓度设置为1、5、10、20、40、80 mg/L 和一组空白对照(仅含有EPA 培养基).试验在(25±1)℃、无光照的恒温培养箱中进行,首先挑选200~300 个轮虫非混交雌体卵,置于50 mL 的玻璃杯中(含30 mL EPA 培养基和密度为2.0×106cells/mL 的斜生四链藻);4 h 后随机挑选10 个大小相近的轮虫幼体放入容量为6 mL 的玻璃杯中,并加入5 mL 测试液(不含食物),每个浓度设置4 个重复;24 h 后对每个玻璃杯中死亡轮虫计数,试验期间不投喂食物.
1.3 种群增长和有性生殖试验
根据急性毒性试验结果和环境检出浓度,3 种卤乙酰胺浓度均设置为10、20 和200 μg/L,另设一组空白对照组,每组设置8 个重复.随机选取3 个龄长小于4 h 且大小相近的轮虫幼体,放入6 mL 玻璃杯中,加入5 mL 的测试液(含密度为2.0×106cells/mL 的斜生四链藻).试验在(25±1)℃、无光照的恒温培养箱中进行,每12 h 悬浮沉积在玻璃杯底部的食物,每24 h更换新鲜的测试液;试验至48 h 后,对每个玻璃杯中存活的轮虫进行计数;96 h 后,对不同种类雌体轮虫进行计数,雌体鉴别方法参考文献[24];168 h 后,对混交雌体携带休眠卵和落入玻璃杯底部的休眠卵进行计数.
2 d 种群增长率(r)计算公式:
式中:Nt和N0分别为试验结束和开始时的轮虫总个数;t为时间,该试验中t取2 d;
4 d 有性生殖参数包括OF/NOF(携卵雌体数/不携卵雌体数)、MF/AF(携卵雌体数中混交雌体数/非混交雌体数)[25]、MR(混交率,种群中混交雌体数/雌体总数)、FR(受精率,轮虫种群中受精的混交雌体数/混交雌体总数);7 d 休眠卵产量为7 d 内轮虫种群所产休眠卵总数[26].
1.4 氧化应激指标检测
3 种卤乙酰胺浓度和空白对照的设置与有性生殖试验中相同.从预培养的试管中随机挑取约10 000 个轮虫放入50 mL 烧杯中,加入25 mL 测试液(不含食物),每个浓度设置4 个重复.试验在(25±1)℃、无光照恒温培养箱中进行,试验期间不投喂食物.暴露12 h 后,用25 μm 的滤网收集轮虫并用EPA 培养基清洗,收集好的轮虫样品保存于-80 ℃冰箱中,待检测用.
将轮虫样品转移至玻璃匀浆器中加入预冷的磷酸缓冲液,0 ℃下冰浴匀浆5 min 后转移至1.5 mL 离心管中,于10 000 g、4 ℃下离心10 min,离心结束后收集上清液用于测定相关酶活性和蛋白含量.选取超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性和还原型谷胱甘肽(GSH)含量作为氧化应激指标,选取丙二醛(MDA)含量来衡量细胞脂质过氧化化水平,同时检测总抗氧化能力(T-AOC).具体检测步骤按照索莱宝生物科技有限公司SOD 试剂盒(BC0170)、CAT 试剂盒(BC0205)、POD 试剂盒(BC0090),GSH 试剂盒(BC1175)、MDA(BC0025)、T-AOC 试剂盒(BC1315)等说明进行.
1.5 数据分析
数据处理、分析和拟合在Excel 2003 和SPSS 17.0软件中完成,绘图在Origin 2023 软件中完成.急性试验中,采用概率单位法(PROBIT,Probability unit)计算3 种卤乙酰胺对轮虫的24 h-LC50(24 h 半数致死浓度).慢性试验中,经正态分布和方差齐性检验后,采用单因素方差分析(One-way ANOVA)和多重比较(LSD test)法,比较处理组与对照组数值之间的差异显著性,设定P<0.05 为显著性水平.
2 结果与分析
2.1 氯乙酰胺、二氯乙酰胺和溴乙酰胺对萼花臂尾轮虫的急性毒性
暴露于10 mg/L 氯乙酰胺、二氯乙酰胺和溴乙酰胺24 h 后,低倍(5 倍)镜下多个轮虫和高倍(20 倍)镜下典型个体体型状况如图1 所示.因轮虫个体较小,低倍镜下无法观察处理组轮虫与对照之间的显著差异;高倍镜下观察发现,3 种卤乙酰胺导致轮虫死亡后体内器官明显萎缩、分解,身体呈透明状,特别是在溴乙酰胺处理组中该特征更显著.暴露于不同浓度氯乙酰胺、二氯乙酰胺和溴乙酰胺中萼花臂尾轮虫24 h 的死亡率和24 h-LC50如图2 所示.由图2 可见,氯乙酰胺、二氯乙酰胺和溴乙酰胺对萼花臂尾轮虫的24 h-LC50分别为12.49、23.12 和2.46 mg/L,测试浓度与死亡率之间呈现明显的剂量-效应关系(R2≥0.87).与对照组相比,不同浓度卤乙酰胺均提高了轮虫的死亡率;而相同浓度下,溴乙酰胺对轮虫致死作用比氯乙酰胺、二氯乙酰胺更明显.暴露于20 mg/L溴乙酰胺的轮虫死亡率为100%,而暴露于80 mg/L(最高浓度)氯乙酰胺、二氯乙酰胺中轮虫死亡率分别为80%和70%.

图1 暴露于10 mg/L 氯乙酰胺、二氯乙酰胺和溴乙酰胺24 h 后的萼花臂尾轮虫体态Fig.1 Morphological changes of Brachionus calyciflorus after exposure to 10 mg/L chloroacetamide,dichloroacetamide and bromoacetamide for 24 h

图2 暴露于不同浓度氯乙酰胺、二氯乙酰胺和溴乙酰胺24 h 后的萼花臂尾轮虫死亡率Fig.2 Mortality of Brachionus calyciflorus after exposure to different concentrations of chloroacetamide,dichloroacetamide and bromoacetamide for 24 h
2.2 氯乙酰胺、二氯乙酰胺和溴乙酰胺对萼花臂尾轮虫2 d 种群增长和有性生殖的影响
不同浓度氯乙酰胺、二氯乙酰胺和溴乙酰胺对萼花臂尾轮虫2 d 种群增长率的影响如图3 所示.由图3 可见,与对照相比,20、200 μg/L 氯乙酰胺和200 μg/L 溴乙酰胺均显著降低了轮虫2 d 种群增长率(P均小于0.05),其他处理组对轮虫的2 d 种群增长率均无显著影响(P均大于0.05).

图3 暴露于不同浓度氯乙酰胺、二氯乙酰胺和溴乙酰胺中萼花臂尾轮虫的2 d 种群增长率Fig.3 Two-day population growth rate of Brachionus calyciflorus exposed to different concentrations of chloroacetamide,dichloroacetamide and bromoacetamide
不同浓度氯乙酰胺、二氯乙酰胺和溴乙酰胺对萼花臂尾轮虫4 d 有性生殖参数的影响如表2 所示.由表2 可见:与对照相比,200 μg/L 氯乙酰胺和20 μg/L 溴乙酰胺均显著提高了轮虫种群的OF/NOF(P均小于0.05),20 μg/L 二氯乙酰胺则显著降低了轮虫种群的OF/NOF (P<0.05);200 μg/L 氯乙酰胺和20 μg/L 溴乙酰胺均显著提高了轮虫种群的MR (P均小于0.05);200 μg/L 二氯乙酰胺和20 μg/L 溴乙酰胺均显著提高了轮虫种群的FR (P均小于0.05);所有处理组对轮虫种群MF/AF 均无显著影响(P均大于0.05).

表2 暴露于不同浓度氯乙酰胺、二氯乙酰胺和溴乙酰胺中萼花臂尾轮虫的4 d 有性生殖参数Table 2 The reproductive parameters of Brachionus calyciflorus in four days exposed to different concentrations of chloroacetamide,dichloroacetamide and bromoacetamide
不同浓度氯乙酰胺、二氯乙酰胺和溴乙酰胺对萼花臂尾轮虫7 d 休眠卵产量的影响如图4 所示.由图4 可见,与对照相比,10、20 和200 μg/L 氯乙酰胺,20 和200 μg/L 二氯乙酰胺以及10、20 μg/L溴乙酰胺均显著增加了轮虫休眠卵产量(P均小于0.05).
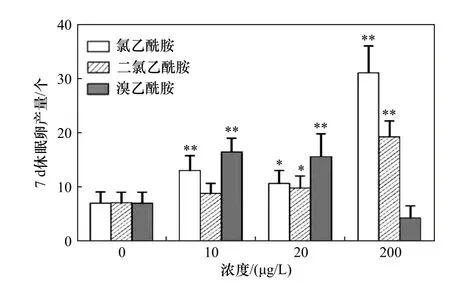
图4 暴露于不同浓度氯乙酰胺、二氯乙酰胺和溴乙酰胺中萼花臂尾轮虫的7 d 休眠卵产量Fig.4 Seven-day resting egg production of Brachionus calyciflorus exposed to different concentrations of chloroacetamide,dichloroacetamide and bromoacetamide
2.3 氯乙酰胺、二氯乙酰胺和溴乙酰胺对萼花臂尾轮虫氧化应激指标的影响
不同浓度氯乙酰胺、二氯乙酰胺和溴乙酰胺对萼花臂尾轮虫氧化应激指标的影响如图5 所示.由图5 可见:与对照组相比,20、200 μg/L 氯乙酰胺和10、20 μg/L 溴乙酰胺均显著提高了萼花臂尾轮虫体内SOD 活性(P均小于0.05);所有处理组均显著提高了轮虫体内CAT 活性(P均小于0.05);10、20 和200 μg/L 氯乙酰胺、20 μg/L 二氯乙酰胺以及200 μg/L溴乙酰胺均显著提高了轮虫体内GSH 含量(P均小于0.05);200 μg/L 二氯乙酰胺、溴乙酰胺均显著降低了轮虫体内POD 活性(P均小于0.05);20 μg/L 氯乙酰胺和二氯乙酰胺均显著提高了轮虫体内的总抗氧化能力水平(P均小于0.05);200 μg/L 氯乙酰胺、二氯乙酰胺和溴乙酰胺均显著增加了轮虫体内的MDA 含量(P均小于0.05),但所有指标均无剂量-效应关系.
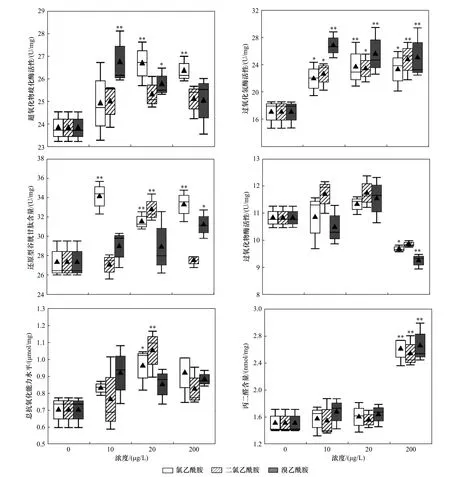
图5 暴露于不同浓度氯乙酰胺、二氯乙酰胺和溴乙酰胺中12 h 后的萼花臂尾轮虫氧化应激指标Fig.5 Oxidative stress biomarkers of Brachionus calyciflorus after exposure to different concentrations of chloroacetamide,dichloroacetamide and bromoacetamide for 12 h
3 讨论
卤乙酰胺是目前饮用水消毒副产物的研究热点之一.在新修订的《生活饮用水卫生标准》(GB 5749-2022)中,三卤甲烷、卤乙酸和溴酸盐等消毒副产物被纳入控制指标并规定了限值,然而却不包括卤乙酰胺类物质.研究显示,卤乙酰胺的细胞毒性和遗传毒性分别是卤乙酸的99 倍和19 倍,急性遗传毒性和慢性细胞毒性分别是卤乙酸的12 倍和142 倍[11],其中,二氯乙酰胺比磺胺甲恶唑对斑马鱼的神经毒性更强[27],毒性风险高于二氯甲烷[12].由于我国地表水源中有机物和溶解性氮含量普遍较高,水厂多采用氯和氯胺的消毒方式,为卤乙酰胺类含氮消毒副产物的产生提供了很大可能,在出厂饮用水和经过长距离的输送管网中均发现一定浓度的该类物质存在[28-29],因此其环境和生态风险值得关注,特别是低剂量、长期暴露对环境生物的影响.
淡水萼花臂尾轮虫可通过快速无性繁殖建立单克隆种群,对重金属、有机化合物和农药等较为敏感,适合用于评价外界物质对淡水生态系统的生态风险,其中污染物对轮虫急性半数致死浓度、轮虫有性生殖参数和抗氧化酶活性等均是良好的实验终点.例如,Snell 等[30]提出的轮虫24 h-LC50标准测试方法简单易行,避免了繁琐的连续培养,已广泛用于评价污染物对轮虫的急性毒性作用[31].研究显示,二氯乙酰胺对大鼠肾细胞和遗传毒性的LC50分别为6 390 和431 mg/L[12],对斑马鱼成鱼的LC50为315 mg/L[32],均大于笔者研究中此类物质对萼花臂尾轮虫的LC50,说明与大鼠肾细胞和斑马鱼成鱼相比,萼花臂尾轮虫对卤乙酰胺类物质更敏感,更适合用作监测此类物质的毒性影响.
研究[33]发现,消毒副产物卤代乙酸的毒性与取代的氯原子数有关,一氯乙酸对小鼠无致癌性,二氯乙酸和三氯乙酸均会增加小鼠肝肿瘤的患病率,且溴代乙酸的毒性大于氯代乙酸.笔者研究中,3 种卤乙酰胺对萼花臂尾轮虫急性毒性呈溴乙酰胺˃氯乙酰胺˃二氯乙酰胺的特征,这与Plewa 等[11]研究此类物质对中国仓鼠卵巢细胞毒性的结论基本一致,表明卤乙酰胺的毒性同样受氯原子数、卤代元素种类的影响.一般情况下,卤素原子数量越多化合物毒性越高,而笔者研究显示,氯乙酰胺对轮虫的急性毒性大于二氯乙酰胺,表明其毒性大小还要视具体受试生物和试验指标而定.此外,3 种卤乙酰胺的试验组浓度与萼花臂尾轮虫24 h 死亡率之间呈现出明显的剂量-效应关系,测试浓度的增大导致轮虫死亡率逐渐上升,20 mg/L 溴乙酰胺导致受试轮虫全部死亡.然而,由于卤乙酰胺类消毒副产物的实际环境浓度较低,一般不会产生致死效应,因此要正确评价低剂量此类物质对轮虫毒性影响,还需进一步开展慢性毒性研究.
种群增长率是最能体现轮虫环境适应能力的综合表现指标,累积反映了多个世代轮虫的存活与繁殖特征改变[34].暴露污染物后轮虫的种群增长率能更好地放大轮虫个体水体上的微小亚致死效应,其改变能直接反映污染物对轮虫种群的毒性结果,被认为是最敏感的毒性实验终点.研究发现,2 d 萼花臂尾轮虫种群增长测试要比7 d 网纹溞(Ceriodaphniadubia)生殖测试对污染物更加敏感,且测试工作量可减少近70%[35],适合用于评价苯酚、五氯苯酚钠和铜等11 种污染物对轮虫慢性毒性影响;同样,氟他胺联合睾酮、溴酸盐和聚苯乙烯微塑料等对萼花臂尾轮虫的慢性毒性测试也证明了2 d 种群增长率是一个敏感的指标[36-38].然而,Janssen 等[39]也曾指出,轮虫3 d 测试得到的种群增长率比2 d 更接近最大值.笔者研究中,除20、200 μg/L 氯乙酰胺和200 μg/L 溴乙酰胺外,其他处理组中的2 d 种群增长率与对照组并均无显著差异,从敏感性角度判断,该指标对评估卤乙酰胺类物质可能并非最佳选择.一般而言,简单易行的实验方法有助于提高实验结果的再现性[21],从此角度来看,该指标仍然不失为一个较好的实验终点,是否最佳选择还要视不同污染物的测试结果确定.此外,标准化程序的建立对提高轮虫种群增长试验结果的可靠性至关重要,而目前国内还未见此类标准.笔者研究表明,20、200 μg/L 氯乙酰胺和200 μg/L 溴乙酰胺存在抑制轮虫种群增长甚至导致种群灭绝的风险,而其他处理组种群数量虽与对照无显著差异,但后续生殖试验证实其种群结构(如雌体类型)已然发生了改变.
单巢纲轮虫(如萼花臂尾轮虫)进行有性生殖是该类生物适应环境变化的重要生存和进化策略,而混交雌体产生是轮虫启动有性生殖的开始.研究[18]表明,温度、食物、光照、pH 和种群密度等改变以及环境毒物胁迫均是诱导轮虫进行有性生殖的外界因素,因此可通过分析轮虫种群混交雌体的比例来评估有性生殖的水平,进而评价污染物对轮虫的不利影响.笔者研究中,200 μg/L 氯乙酰胺和20 μg/L 溴乙酰胺处理组中轮虫种群的OF/NOF 和混交率较对照组均明显升高,表明在这2 个处理组中轮虫已经感知到外界胁迫的压力,开始主动调整生殖策略以适应环境的变化,最终7 d 休眠卵产量的显著提高也进一步验证了轮虫繁殖策略调整的成功.同样,所有处理组的MF/AF 指标均未受到显著影响,携带休眠卵的轮虫(也计为混交雌体)数量的上升是导致这一结果的直接原因,这也再次证实进行有性生殖是轮虫应对此类物质胁迫时的首选生存策略.
经过产生混交雌体、孵化雄虫、成功受精和产卵等一系列过程而形成的休眠卵是轮虫有性生殖的最终产物,对轮虫保种、繁殖和种群扩张等均有重要意义[40].轮虫毒理学研究中,休眠卵产量常被看作是比其他有性生殖参数对污染物更为敏感的指标[31].研究[41]证实,0.001、0.01、1 和10 mg/L 溴酸盐(另一种常见消毒副产物)能显著提高萼花臂尾轮虫的休眠卵产量,而100 和200 mg/L 溴酸盐则显著降低了休眠卵产量.笔者研究中,在9 个处理组中有6 个处理组的休眠卵产量都显著高于对照组,其对测试液的敏感程度明显高于其他有性生殖指标(只有3 个处理组种群的增长率和OF/NOF 以及2 个处理组的混交率和受精率受到显著影响),适合用作评价卤乙酰胺类消毒副产物对萼花臂尾轮虫有性生殖的影响.一般认为,成功受精是轮虫休眠卵形成的关键步骤,但其产量还受到其他环境因素和轮虫种类的影响[42].该研究中,大部分处理组中受精率虽与对照组都无显著差异,但却大多高于对照组,最高上升了97.81%,推测这可能是导致多数处理组休眠卵产量显著高于对照组的直接原因.
在受到内源性或外源性刺激时,轮虫可通过提高体内SOD、CAT、POD 等抗氧化酶的活性和GSH 的含量来减少面临的氧化损伤[43].研究发现,250 μg/L盐酸氟西汀显著提高了轮虫SOD 活性和GSH 含量[44],300 μg/L 0.05 μm 轮胎磨损颗粒显著提高了轮虫SOD和CAT 活性[45],80 μg/L 多溴联苯醚显著提高了轮虫MDA 含量[46].笔者研究中,轮虫受到不同浓度卤乙酰胺胁迫后,抗氧化酶活性和抗氧化剂含量均较对照组有所上升,部分浓度组上升显著,表明轮虫已经启动了氧化应激反应,试图来保护自身免受伤害.然而,部分抗氧化酶活性并未随处理组浓度的增加而发生明显改变,究其原因,除了暴露浓度外,酶活性还可能受到其他因素(如暴露时间等)的影响.值得注意的是,CAT 活性在所有处理组均显著高于对照组,表现最为活跃;而POD 活性在200 μg/L 处理组中均显著下降,呈现出完全不同的响应模式和指标特异性,其内在机理值得进一步研究.
Wang 等[47]发现,阻燃剂四溴二苯醚(BDE-47)可诱导褶皱臂尾轮虫(B.plicatilis)体内过量产生活性氧(ROS),破坏轮虫卵巢超微结构,抑制个体产卵和种群增长.理论上,SOD 等抗氧化酶是轮虫清除ROS 的第一道防线,若该防御机制失效或氧化压力超过耐受阈值时,膜脂过氧化将形成MDA[48].因此,MDA 是氧化伤害后的指标,其含量上升意味着细胞已经受到明显的氧化伤害.笔者研究中,3 种卤乙酰胺10 和20 μg/L 处理组中的MDA 含量与对照组基本一致,而200 μg/L 处理组中的MDA 含量均显著高于对照,表明轮虫抗氧化机制在低浓度组中成功建立,SOD 活性的提高表明抗氧化作用发挥明显,而在高浓度组中SOD 活性提高但产生较高含量的MDA,表明抗氧化机制未见成效.推测可能原因有两方面:一方面是高浓度组过量产生ROS 已经超过抗氧化酶的处理能力,无法被及时清除所致;另一方面是某些抗氧化酶在高浓度组中的含量虽然显著增加,但其作用发挥受到不同程度的抑制.研究[47]表明,轮虫体内过量ROS 会启动激活线粒体和溶酶体等通路,诱导线粒体自噬和细胞凋亡,卤乙酰胺对萼花臂尾轮虫氧化应激毒性作用机制是否与此类似,还需开展进一步研究.
综上,轮虫是水生态系统物质循环和能量传递过程中的关键物种,其种群结构和规模的改变势必影响水生态系统功能的正常发挥.新兴含氮消毒副产物卤乙酰胺自被检出以来,其毒性作用已经引起广泛关注[49].特别地,环境中检出的典型卤乙酰胺——氯乙酰胺、二氯乙酰胺和溴乙酰胺对重要水生生物的毒性影响值得关注.笔者研究表明,氯乙酰胺、二氯乙酰胺和溴乙酰胺对萼花臂尾轮虫的存活、种群增长、有性生殖和氧化应激均有明显毒性作用,长期暴露势必影响轮虫的种群结构和规模,进而影响水生态系统的安全.然而,全面、正确地评价卤乙酰胺的潜在生态风险还需在更多物种范围、更多评价指标层面开展研究工作.
4 结论
a) 3 种卤乙酰胺对萼花臂尾轮虫具有较强的急性毒性,对萼花臂尾轮虫急性毒性呈溴乙酰胺˃氯乙酰胺˃二氯乙酰胺的特征.
b) 20、200 μg/L 氯乙酰胺和200 μg/L 溴乙酰胺均显著降低了萼花臂尾轮虫的2 d 种群增长率.
c) 除MF/AF 外,轮虫4 d 有性生殖参数均受到3 种卤乙酰胺的显著影响,轮虫主动调整生殖策略以适应环境的变化.
d) 10、20 和200 μg/L 氯乙酰胺,20 和200 μg/L 二氯乙酰胺以及10 和20 μg/L 溴乙酰胺均显著增加了轮虫7 d 休眠卵产量,该指标对3 种卤乙酰胺的毒性最敏感,是评价卤乙酰胺对萼花臂尾轮虫有性生殖影响的合适指标.
e) 除200 μg/L 氯乙酰胺、二氯乙酰胺和溴乙酰胺中过氧化物酶活性下降外,其他处理组中轮虫氧化应激指标值普遍上升,表明轮虫已经启动了氧化应激反应保护自身免受伤害;在3 种卤乙酰胺200 μg/L处理组中,轮虫MDA 水平均显著高于对照组,表明受到明显的氧化损伤.

