菊芋(Helianthus tuberosus)对镉、铅、锌复合污染土壤的修复潜力
黄意成,范拴喜,*,李 丹,孙旻涵,张 楠
(1.宝鸡文理学院 地理与环境学院,陕西 宝鸡 721013;2.陕西省灾害监测与机理模拟重点实验室,陕西 宝鸡 721013)
二十世纪以来,土壤重金属污染问题日益加剧,已对人类的健康和生存发展构成了巨大的威胁[1-2]。研究表明,镉、铅会影响玉米的蛋白质含量[3],铅会抑制辣椒幼苗的生长[4],而过量的锌也会破坏小白菜叶绿体结构,并对其光合作用产生影响[5]。最为重要的是,镉、铅、锌等重金属元素可通过食物链被人体摄入,对神经和生理系统产生破坏[6-10]。因此,如何有效地修复与治理镉、铅、锌污染土壤,成为近年来学者研究的热点之一。
目前在诸多修复方法中,植物修复因其低成本、绿色、无二次污染等优点受到广泛关注[11]。研究发现,重金属超富集植物可以将土壤中的一种或多种重金属超量吸收并转移至植株地上部分,将土壤中的重金属“提取”出来,从而达到修复重金属污染土壤的目的[12-13]。迄今为止已发现的重金属超富集植物,如宝山堇菜、印度芥菜、圆锥南芥等,大多数都存在生物量小、生长缓慢、适应力弱等缺陷[14-16],且多数超富集植物仅对单一的重金属污染物表现出超富集性能,而自然界中的重金属往往是以复合形式存在[17]。石慧芳[18]的研究表明,与单一的Cd、Pb、Zn 胁迫相比,Cd、Zn、Pb 复合胁迫会使黑麦草的生物量显著降低。因此,研究超富集植物和潜在超富集植物对复合重金属污染的耐受特性和富集能力,有助于揭示植物修复机理,且能为重金属污染土壤的修复提供理论依据。
菊芋为菊科多年生草本植物,耐寒冷、耐干旱、生物量大、根系发达、再生能力强,适应性广,能够在我国多个省份栽培[19]。菊芋根块含有大量的果糖多聚物,如淀粉、菊糖等,可作为食品及医药领域的原料[20-21],地上部则可作为生物发电的燃料[22],具有一定的经济和能源利用价值。目前国内外对于菊芋的研究主要集中在对它的果糖产品加工、生物能源及化学品提取等方面[23-25],而菊芋在Cd、Pb、Zn 复合胁迫中的耐受性和富集能力方面的研究鲜有报道。
基于前期研究发现菊芋能耐受超量Cd、Pb、Zn复合胁迫及可作为潜在复合重金属超富集植物的基础之上,本研究采用土培盆栽,设置6 种浓度梯度的Cd、Pb、Zn 复合胁迫试验,探索菊芋对Cd、Pb、Zn复合胁迫的耐性和富集特性,并通过原位大田自然污染土壤试验进一步验证菊芋对Cd、Pb、Zn 复合重金属污染土壤的修复能力,为菊芋修复Cd、Pb、Zn复合污染土壤提供可靠的理论依据。
1 材料与方法
1.1 试验时间及地点
本研究于2021 年2~10 月期间进行土培盆栽实验,实验设在校园内闲置育苗钢框架遮雨棚内(四周敞开式)进行,周围无污染源;大田实证性验证试验于2022 年3~9 月在宝鸡市某铅锌冶炼厂周围污染区域进行。
1.2 供试材料
供试植物为白皮菊芋,从当地市场购买。盆栽供试土壤取自于宝鸡市郊区大田0~20 cm 的耕层土壤,取土地块主要种植小麦、玉米及蔬菜等农作物,取土农田周围附近为村庄,无污染源存在。将取回的供试土壤经自然风干,过60 目筛后备用。供试土壤理化性质见表1。

表1 供试土壤理化性质Table 1 Physical and chemical properties of the tested soil
1.3 盆栽试验设计
依据GB/T 15618-1995《土壤环境质量标准》[26]中三级标准限值和宝鸡市某冶炼厂附近土壤重金属实际含量情况,设置1 个对照,6 个复合胁迫梯度,每个梯度设置3 个平行,土培盆栽花盆直径30 cm,高度34 cm。2021 年2 月,根据胁迫梯度(见表2) 称取合适的分析纯Pb(Ac)2· 3H2O、Zn(Ac)2·2H2O 和Cd(Ac)2· 2H2O 用去离子水完全溶解,与供试土壤拌合均匀,充分平衡4 个月备用。2021 年6 月,每盆装12 kg 平衡后的模拟污染土壤供盆栽试验用,每盆选择大小一致的菊芋根块4 块,洗净后均匀栽种,随后定期浇水,保持70%左右的土壤含水量,待菊芋生长到一定时期后按研究方案进行相关指标的测定。

表2 盆栽试验土壤梯度设置Table 2 Soil gradient setting for pot experiment mg/kg
1.4 大田试验设计
在室内模拟盆栽研究的基础上,于2022 年4 月在某冶炼厂围墙以外不同区域选取3 个位置,每个位置划定约3 m2,翻挖平整,清理杂草及植物根系、石块等。将大小一致的菊芋根块,按5 行×5 列种植,行列间距约为25~30 cm,埋置深度为5~8 cm。完全依靠野外条件和环境自然生长,不做任何人为干扰。试验区土壤pH 值为8.56,有机质为17.32 mg/kg,TN 为1.34 g/kg,TP 为0.72 g/kg,速效磷26.67 mg/kg,速效氮40.61 mg/kg,容重为1.20 g/cm3。研究区域Cd、Zn 含量均值都超过了国家土壤环境质量二级标准限值;Pb 含量未超过国家土壤环境质量二级标准限值,但超过了陕西省土壤背景值,详见表3。
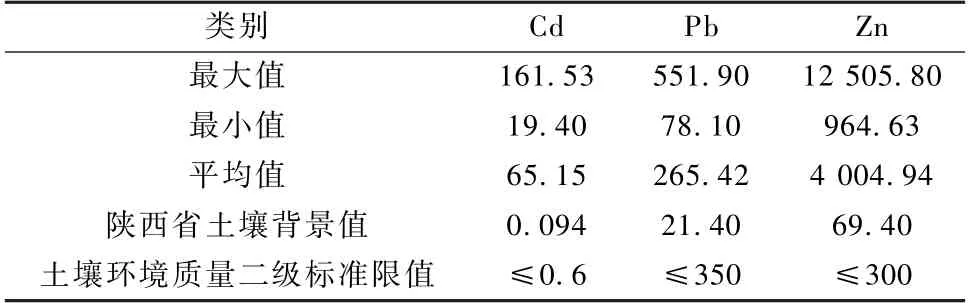
表3 大田试验区域土壤重金属含量Table 3 Heavy metal content in soil in field experiment area mg/kg
1.5 样品采集与测定
土培盆栽中,待菊芋发芽生长两个月后采集植物叶片,采用氮蓝四唑法、愈创木酚法、紫外吸收法[27]测定SOD、POD 和CAT 酶活性。
2021 年9 月下旬采集土培盆栽中的菊芋样本,土培盆栽是全部采集,采集时尽量挖出完整的菊芋块根和毛细根系;2022 年9 月中旬收集大田中的菊芋样本,野外大田试验每个区块随机采集10 株完整的菊芋植株带回实验室。
将采集的菊芋样本分为地上部和地下部,冲洗干净后置于烘箱,105 ℃杀青30 min,在75 ℃下持续烘干至恒重,先进行植物干重的称量,随后分别粉碎、装袋、编号后保存。
本研究中,菊芋的生物量均指干重指标。由于菊芋是块根繁殖,故每株菊芋地上部生物量,即指单一块根生长出的地上部生物量总和。
植物样品采用HNO3-HClO4湿法消解体系消解,利用电感耦合等离子体发射光谱仪(NexION 350 ICP-MS)测定植物样品中的Pb、Zn、Cd 含量。
为保证实验方法的准确性,本研究利用标准参考物质(GBW 008301,中国国家标准物质研究中心)进行质量控制,分析中铅的回收率为96.3%~102.7%,锌的回收率为95.4%~104.6%,镉的回收率为92.6%~106.4%,符合分析质量控制要求。
转移系数(TF)、富集系数(BCF)及去除率参考朱守晶[28]、张云霞等[29]的方法,计算公式如下:
1.6 数据处理
采用Excel 2019 进行数据整理,GraphPad Prism 8 进行绘图,SPSS 25.0 进行方差分析。
2 结果和分析
2.1 Cd、Pb、Zn 复合胁迫下菊芋的生长特征
盆栽实验结果(表4)可知,菊芋的株高和各部位生物量受Cd、Pb、Zn 复合胁迫,均呈现先降低再增加再降低的趋势。较低浓度(Ⅰ处理组)的Cd、Pb、Zn 复合胁迫会在一定程度上抑制菊芋的株高和各部分生物量,未呈现显著性(P>0.05);但随着复合胁迫浓度的增加,重金属离子对菊芋的生长具有一定的促进作用,Ⅱ~Ⅳ处理组菊芋的株高较CK对照组分别增加了11.33%、37.75%、17.00%,均呈现显著性(P<0.05),整株生物量分别增加了1.16%、7.81%(P<0.05)、5.87%;复合胁迫浓度c(Cd)≥60 mg/kg、c(Pb)≥500 mg/kg、c(Zn)≥5 000 mg/kg 时,菊芋由于受重金属毒害加深,其株高、生物量均显著(P<0.05) 降低,株高降低了27.28%,地上部、地下部和整株生物量分别降低了14.20%、18.27%、16.15%。
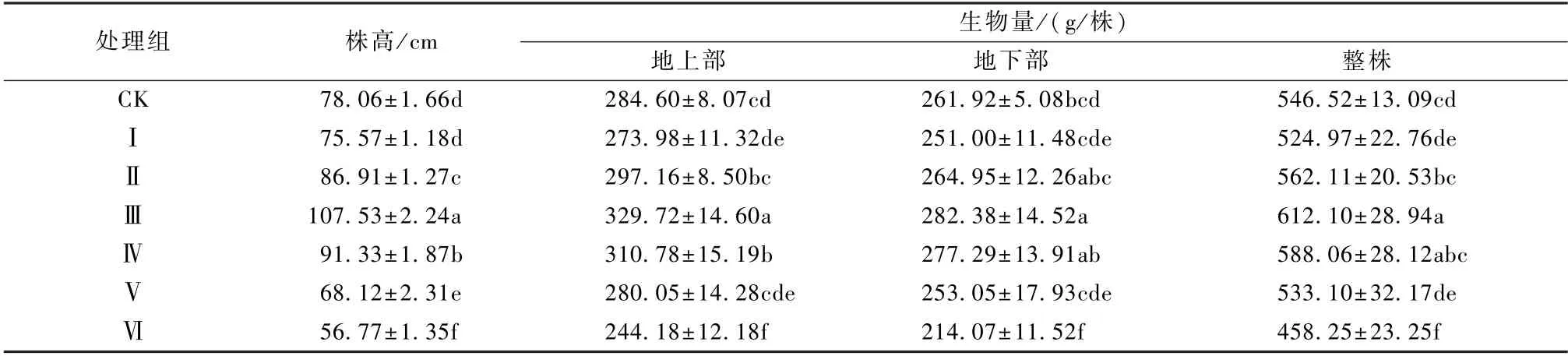
表4 不同处理组菊芋的株长和生物量Table 4 Plant length and biomass of Helianthus tuberosus in different treatment groups
2.2 Cd、Pb、Zn 复合胁迫下菊芋的富集潜力
盆栽实验结果(表5 和图1)可知,随复合重金属胁迫逐渐增强,菊芋地上部(茎叶)和地下部(根部)对Cd、Pb、Zn 的富集量,均显示逐渐升高,较CK对照组,菊芋地上和地下根部Cd、Pb 富集量在Ⅲ~Ⅵ处理组均显示显著差异(P<0.05),菊芋地上和地下根部Zn 富集量在不同处理组中均显示显著差异(P<0.05)。在Ⅵ处理下,菊芋地上部Cd、Pb、Zn 富集量分别达到最大值98.25、585.81、2 668.04 mg/kg,地下部Cd、Pb、Zn 富集量分别达到最大值32.81、124.51、802.30 mg/kg。

图1 不同处理组菊芋Cd、Pb、Zn 积累量Fig.1 Cd,Pb,Zn content of Helianthus tuberosus in different treatment groups
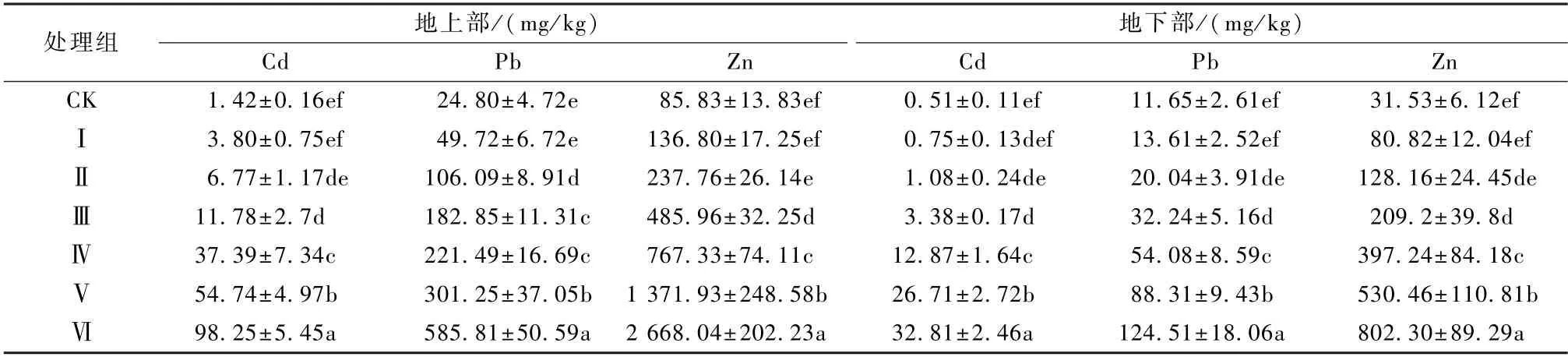
表5 不同处理组菊芋的Cd、Pb、Zn 含量Table 5 Cd,Pb,Zn content of Helianthus tuberosus in different treatment groups
由表6 可知,菊芋对Cd、Pb、Zn 的BCF 分别为1.08~1.79、0.77~1.31、0.44~0.79,TF 分别为2.05~6.27、3.41~5.67、1.69~3.33。各处理下,菊芋对Cd、Pb、Zn 的BCF 未呈现出明显的变化趋势,对三种重金属的富集能力表现为:BCF(Cd)>BCF(Pb)>BCF(Zn)。而TF 呈现先增加再减少再增加的趋势,即:低浓度复合胁迫下(Ⅰ、Ⅱ处理组),TF(Cd)>TF(Pb)>TF(Zn)>1;随着胁迫加剧,菊芋对Cd 的TF 下降幅度较大,TF(Pb)>TF(Cd)>TF(Zn)>1;而高浓度复合胁迫下(Ⅴ、Ⅵ处理组),TF(Pb)>TF(Zn)>TF(Cd)>1。
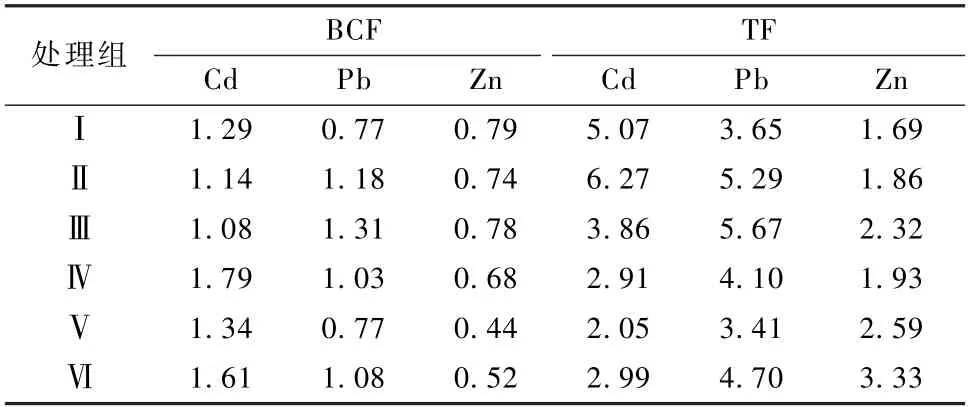
表6 不同处理组菊芋的BCF、TFTable 6 BCF and TF of Helianthus tuberosus in different treatment groups
2.3 Cd、Pb、Zn 复合胁迫下菊芋的响应机理
进入植物体内的重金属离子,会促使活性氧自由基生成,对植物的抗氧化系统产生一定的损坏[30]。为了应对这种损坏,植物会通过调节其体内SOD、CAT、POD 等抗氧化酶活性,来增加抗氧化功能[31],减少重金属胁迫对植物产生的危害。
盆栽实验结果(图2(a))可知,复合重金属胁迫对菊芋SOD 酶活性的影响表现为低促进高抑制,相对于CK 对照组,Ⅰ处理SOD 酶活性显著(P<0.05)提高,Ⅱ~Ⅵ处理SOD 酶活性均显著(P<0.05)降低。在Ⅰ处理时,可能是由于低浓度重金属复合胁迫对菊芋SOD 酶活性具有“刺激”作用,致使其活性上升;Ⅱ~Ⅲ处理中,下降幅度较大,可能是因为植物体内的SOD 酶对Cd、Pb、Zn 复合胁迫具有较强的敏感性,导致胁迫反应滞后;SOD 酶活性在Ⅲ~Ⅵ处理中逐渐上升,可能是由于菊芋体内的活性氧自由基含量随复合胁迫的增加而上升,诱导SOD 酶活性的提高,使菊芋体内清除自由基功能能够正常运行。

图2 不同处理组菊芋的抗氧化酶活性Fig.2 Antioxidant enzyme activities of Helianthus tuberosus in different treatment groups
由图2(b)和(c)可知,不同浓度梯度的Cd、Pb、Zn 复合胁迫提高了菊芋叶片的CAT 和POD 酶活性。与CK 对照组相比,菊芋叶片CAT 酶活性均显著(P<0.05)提升,表现为先升高再降低的趋势;POD 酶含量较CK 对照组均有所上升,除Ⅱ处理外,均差异显著(P<0.05),呈现为逐渐增加的趋势,表明在重金属复合胁迫下,POD 和CAT 酶可能起到一定的协同作用,缓解了由重金属胁迫产生的自由基和H2O2对植物细胞的破坏,保证植物的正常生长。
2.4 菊芋对土壤中Cd、Pb、Zn 的去除率
原位大田实验结果(表7)可知,菊芋的地上部Cd、Pb、Zn 含量的均值分别为125.79、1 075.99、6 896.21 mg/kg,最大值分别为201.08、1 525.46、7 443.66 mg/kg,TF 和BCF 均大于1。

表7 原位大田试验菊芋的生物量、重金属含量、BCF、去除率Table 7 Biomass,heavy metal content,BCF and removal rate of Helianthus tuberosus in field experiment
菊芋是多年生草本植物,根系深度可达2 m,盆栽实验表明,菊芋对Cd、Pb、Zn 具有较高的转运能力,若每生长一茬收获整株植物(地上部和地下部),其对重金属的富集量虽然高,但是其富集量毕竟也是有限的,结合陕西省的气候特征,每年菊芋的地上部可收获二茬,这样可加快菊芋对土壤中重金属的富集效率,故本次试验仅考虑菊芋地上部种植二茬的年去除率。
三个区域共种植75 株菊芋,从每个区域各随机收获10 株菊芋,得出单株菊芋地上部生物量均值为385.34 g,最大值为423.62 g,则9 m2区域的菊芋地上部生物量均值为28.90 kg,最大值为31.77 kg。由此得出1 亩地菊芋的地上部生物量均值大约为2 141.81 kg,1 亩地最大生物量为2 354.51 kg。因此,每亩地种植1 茬菊芋富集转移带走土壤中的Cd、Pb、Zn 的量分别约为269.42~470.90 g、2 304.57~3 591.71 g、14 770.37~17 526.17 g。研究区土壤Cd、Pb、Zn 含量均值分别为65.15、265.42、4 004.94 mg/kg,耕层土壤为0~20 cm,则每亩研究区域耕层土壤所含的重金属Cd、Pb、Zn 分别约为10 429.21 g、42 488.43 g、641 110.80 g。每亩地种植2 茬菊芋对土壤Cd、Pb、Zn 的年去除率分别为5.16%~9.04%、10.84%~16.90%、4.60%~5.46%。
3 讨论
目前,国际上对镉、铅、锌超富集植物的判定标准通常是采用植物地上部分Cd、Pb、Zn 含量分别大于100、1 000、10 000 mg/kg,BCF 和TF 均大于1 等作为参考值[29,32]。Six[33]的研究表明当植物地上部Cd 含量超过5 mg/kg 会对植物的正常生长产生影响,因此部分学者认为,对于植物地上部Cd 含量高于100 mg/kg 这一判定标准过于苛刻,Wenzel 等[34]认为,植物地上部Cd 含量高于50 mg/kg,同时能够富集Pb、Zn 等其他重金属元素,并能够正常生长,则可认定其为Cd 超富集植物。
盆栽试验表明,重金属复合胁迫浓度c(Cd) ≤60 mg/kg、c(Pb) ≤500 mg/kg、c(Zn) ≤5 000 mg/kg 时,菊芋体内抗氧化酶系统被激活,通过对SOD、CAT、POD 酶活性的调节,清除逆境条件下积累的活性氧自由基,减少重金属胁迫对菊芋的危害,保证菊芋正常生长,未表现出明显的中毒症状,表明菊芋对Cd、Pb、Zn 复合胁迫有极强的耐受性。当土壤重金属含量c(Cd)=60 mg/kg、c(Pb)=500 mg/kg、c(Zn)=5 000 mg/kg 时,菊芋地上部Cd、Pb、Zn的最大积累量分别为98.25、585.81、2 668.04 mg/kg,BCF(Cd)和TF(Cd)均大于1,具备Cd超富集植物的基本特征,这与周蜜等[35]的研究结果一致。本研究中,原位大田试验显示菊芋地上部Cd含量可达到125.79 mg/kg,且BCF(Cd)和TF(Cd)值均大于1,因此可判定菊芋是极具潜力的Cd 超富集优势植物;同时,研究显示,菊芋对Pb 和Zn 的富集效果虽未达到超富集植物限值,各处理组中BCF(Zn)均小于1,但BCF(Pb)在Ⅱ~Ⅳ(50 mg/kg≤c(Pb)≤200 mg/kg)处理和Ⅵ(c(Pb) ≥ 500 mg/kg)处理下大于1,菊芋对Pb 和Zn 的转系系数均大于1,也证明了菊芋对Pb 和Zn 具有一定的高富集能力,表明菊芋能够很好的将根部吸收的Pb 和Zn 转移到地上部,菊芋这一特点有利于其在Pb 和Zn 污染土壤的实际修复应用。另外Ⅳ(c(Pb)=200 mg/kg)处理和Ⅴ(c(Pb)=350 mg/kg)处理相比,BCF 显示下降幅度较大,这可能是c(Pb)=200 mg/kg 是菊芋Pb 富集特征的一个临界点。
植物对重金属污染土壤的修复能力主要由植物地上部生物量和其对重金属的吸收转运能力决定,理想的超富集植物应有较大的生物量,能够很好地将根部吸收的重金属转移至地上部[36]。本研究发现,菊芋对土壤中的Cd、Pb、Zn 具有较高的转运能力,能够将吸收的重金属转移并存储在地上部,原位田间试验中,菊芋地上部生物量可达385.34 g,菊芋的地上部Cd、Pb、Zn 含量分别为125.79、1 075.99、6 896.21 mg/kg,满足超富集植物的特点,故在Cd、Pb、Zn 土壤污染修复上具有巨大的潜力。本次原位大田试验种植的菊芋属于自然生长,无人为干涉,因此在实际应用过程中可以通过合理的农艺调控[37]、添加活化剂[38]等强化措施来增加菊芋的生物量以及菊芋对土壤Cd、Pb、Zn 的吸收,提高修复效率。
目前,对植物修复的重点在修复效果上,少有研究关注修复后植物的处理。目前已有的研究提出,植物修复的处理主要通过焚烧法、堆肥法、高温分解法等方法来达到修复植物残体的减量化、无害化[39-40],但此过程中也造成了一定的环境压力。菊芋作为一种能源作物,可通过化学工艺实现菊芋到生物柴油、生物乙醇的转化[41],作为汽车燃料使用。此外,菊芋茎秆中也含有大量的易于发酵的非结构性碳水化合物,可用于生产甲烷,有研究表明[22],当菊芋地上部鲜重达到9~16 t/hm2时,甲烷产量高达3 100~5 400 m3/hm2。因此,菊芋作为一种修复植物,可通过回收其地上部茎秆和地下部根块,实现资源化处理,具有明显的经济效益。但本研究团队更倾向于植物修复后,将收获的富集了大量重金属的植物风干压缩打包送往当地相应的冶炼厂(一般重金属矿盛产区域均有冶炼厂),添加到冶炼原料中,利用冶炼环节将其重金属回收,是较为经济、可行的方案。
4 结论
1)菊芋是一种潜在的Cd 超富集植物,同时对Pb、Zn 具有较好的富集能力。低浓度Cd、Pb、Zn 复合胁迫对菊芋的生长产生促进作用,株长、各部分生物量显著增加,当复合胁迫浓度c(Cd) ≥60 mg/kg、c(Pb)≥500 mg/kg、c(Zn)≥5 000 mg/kg时,抑制植物的生长,但未出现明显的毒害症状。
2)Cd、Pb、Zn 复合胁迫对菊芋体内SOD 酶活性表现为低促进高抑制作用,CAT 和POD 酶活性均为促进作用,具有一定的抗逆性。
3)菊芋对Cd 的BCF 和TF 均大于1,地上部Cd最大富集量可达到125.79 mg/kg,Cd 年去除率为5.16%~9.04%。
4)土培盆栽中,菊芋对Zn、Pb 的TF 均高于1,Zn 的BCF 均低 于1,当50 mg/kg ≤c(Pb)≤200 mg/kg、c(Pb)≥500 mg/kg 时,菊芋对Pb 的BCF 高于1。而原位大田试验中,菊芋对Pb、Zn 的BCF 和TF 均高于1,地上部Pb、Zn 积累量均值分别达到1 075.99、6 896.21 mg/kg,年去除率分别为10.84%~16.90%、4.60%~5.46%。具有较好的Pb、Zn 修复潜力。

