人参不同炮制品蛋白酶解肽对LPS 诱导RAW264.7 细胞的抗炎作用研究
兰 梦,李晶峰,李冬冰,王跃龙,刘 璐,申嘉明,张 辉,*,孙佳明,*
(1.长春中医药大学吉林省人参科学研究院,吉林长春 130117;2.长春中医药大学药学院,吉林长春 130117)
炎症是生物体内外环境受到刺激后,对宿主组织或细胞的损伤或感染的一种自然生理和免疫反应[1-2]。巨噬细胞通过分泌大量促炎介质和促炎细胞因子在许多炎症性疾病的发病机制中起着关键作用[3-5]。巨噬细胞对细菌内毒素脂多糖(LPS)的识别触发一系列信号级联,诱导多种促炎介质和细胞因子的表达,如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)等。目前,LPS 诱导的RAW264.7 巨噬细胞已经被广泛应用于与炎症有关的体外模型研究[6-7]。
人参是五加科人参属植物人参(Panax ginsengC.A.Mey.)的干燥根及根茎,是我国传统名贵中草药[8],富含皂苷类、多糖类、氨基酸及多肽等多种化学成分[9]。现代药理学研究表明,人参具有抗氧化、抗炎等保健功效[10]。生晒参、红参和黑参为人参的主要炮制品[11]。生晒参是由人参晒干或烘干而得;鲜人参蒸制一次晒干后得红参;黑参则是人参经“九蒸九晒”制成[12]。目前,国内对黑参的研究较少。有研究表明,对比生晒参和红参,黑参的抗炎、抗肿瘤等生物活性更强[13]。
越来越多的文献报道从食物中提取的食源性肽具有良好的抗炎活性,陈元蓉等[14]从小麦胚芽中分离得到4 条抗炎活性肽,可降低LPS 诱导的巨噬细胞中NO 及促炎因子的分泌。于笛等[15]研究发现,绿豆寡肽能显著抑制促炎因子水平的上升,并缓解巨噬细胞由LPS 引起的炎症。人参作为药食同源的名贵中药,从中提取的人参多肽已被证实具有抗炎活性。田建明等[16]研究发现人参糖肽通过干预、抑制TNF-α、IL-2 等多种细胞因子的释放进而达到抗炎的作用。氨基酸是构成肽的基本单位,肽的活性与氨基酸的组成、序列和含量有关。据报道,疏水性氨基酸可以增强肽与脂类的相互作用,从而更容易进入靶细胞来发挥抗炎与免疫活性[17]。人参的抗炎活性可能会受到炮制过程中氨基酸成分和含量变化的影响。已有研究表明,人参在炮制过程中氨基酸含量明显降低[18]。但将生晒参、红参和黑参蛋白酶解肽的氨基酸组成及含量的变化与抗炎活性之间的关系进行对比分析的研究还鲜有报道。
本研究筛选出黑参蛋白酶解肽、红参蛋白酶解肽和生晒参蛋白酶解肽中对RAW264.7 细胞增殖作用最强的活性组分,并确定了三者蛋白酶解活性肽中氨基酸的组成和含量以及细胞炎症因子的分泌量。结合多元统计分析,筛选出三者蛋白酶解活性肽中的特征差异氨基酸以及具有抗炎活性的氨基酸。初步探究了人参炮制过程中肽的氨基酸组成及含量变化与其抗炎活性的相关性,为三种原料参的利用提供理论依据。
1 材料与方法
1.1 材料与仪器
人参 市售的五年制鲜人参(产地吉林);碱性蛋白酶(200 U/mg)、脂多糖(lipopolysaccharides,LPS)上海源叶生物科技有限公司;中性蛋白酶(50 U/mg) 上海麦克林生化科技有限公司;胃蛋白酶(3000 U/mg) 北京鼎国昌盛生物技术有限责任公司;小鼠巨噬细胞(RAW264.7) 上海中乔新舟生物科技有限公司;DMEM 高糖培养基、新生胎牛血清 美国Gibco 公司;噻唑蓝(MTT) 美国Amresco公司;二甲基亚砜(DMSO) 天津市光复精细化工研究所;一氧化氮(NO)测定试剂盒 南京建成生物工程研究所;白细胞介素-1β(IL-1β)ELISA 试剂盒 依科赛生物科技有限公司;白细胞介素-6(IL-6)试剂盒、肿瘤坏死因子-α(TNF-α)试剂盒 黄石研科生物科技有限公司;其余试剂均为分析纯。
10 kDa、3 kDa、1 kDa 超滤膜包 密理博公司;HERAEUS HERAcell 150i 二氧化碳培养箱 日本三洋公司;YZ-875 型超净工作台 苏州净化设备厂;CX 23 荧光倒置显微镜 日本奥林巴斯公司;Model680 型酶标仪 日本TAKARA 公司;L-8900型氨基酸自动分析仪 日本日立公司。
1.2 实验方法
1.2.1 人参三种炮制品粗蛋白的制备 取新鲜人参洗净,晒干,可得生晒参[19];人参于蒸锅中蒸制4 h 后晒干可得红参[20];人参于蒸锅中蒸制4 h 后晒干,同样操作反复进行九次,可得黑参[21]。取一定量生晒参、红参、黑参干制品,粉碎,过40 目筛,得人参不同炮制品粉末。分别称取一定量的三种人参炮制品粉末,按1:8 倍量加入蒸馏水,在20 ℃下分别浸提三次,每次12 h,提取液于3600 r/min 离心30 min,取上清液过滤,三次滤液合并得人参三种炮制品粗蛋白溶液[22]。真空冷冻干燥得三种炮制品粗蛋白粉,于-20 ℃保存,备用。
1.2.2 人参三种炮制品粗蛋白分步酶解 选用碱性蛋白酶、中性蛋白酶和胃蛋白酶进行酶解[23]。将三种炮制品粗蛋白粉与蒸馏水混合均匀,料液比为1:12.5(g/mL),加热至95 ℃,保温30 min 后冷却,使蛋白质完全变性。加入质量分数为12%的氢氧化钠水溶液调节pH 至9.5,按5000 U/g 加入一定量的碱性蛋白酶,53 ℃下酶解4 h,得到碱性溶液;使用质量分数为12%的盐酸水溶液调节pH 至6.8,按1500 U/g 加入一定量中性蛋白酶,53 ℃下酶解3 h,得到中性溶液;使用质量分数为12%的盐酸水溶液调节pH 至3.7,按500 U/g 加入胃蛋白酶,53 ℃下酶解4 h,得到酸性溶液。沸水浴灭酶30 min,冷却后得续滤液,分别得生晒参蛋白酶解肽水解液(SGP)、红参蛋白酶解肽水解液(RGP)和黑参蛋白酶解肽水解液(BGP)备用。
1.2.3 超滤膜分离 选用分子截流量为10、3 和1 kDa 的超滤膜,将水解液分为大于10、3~10、1~3 kDa、小于1 kDa 四个组分。分别命名为BGP-1~4、RGP-1~4、SGP-1~4,冻干备用。
1.2.4 人参不同炮制品蛋白酶解肽对小鼠巨噬细胞增殖作用的影响
1.2.4.1 不同超滤组分对RAW264.7 细胞的增殖作用 采用MTT 法测定不同组分对细胞增殖率的影响。将冻存的RAW264.7 细胞复苏,用含10%胎牛血清的DMEM 高糖培养基于37 ℃、5% CO2饱和湿度的培养箱中培养,当细胞长满培养瓶80%~90%时进行传代培养,选取对数生长期细胞用于实验。以每孔4×103个细胞的密度接种于96 孔板中,培养24 h 后模型组与样品组加入150 μL 的1 μg/mL LPS 构建炎症模型,空白对照组不造模只加150 μL含10%胎牛血清的DMEM 高糖培养基。培养24 h后,弃上清。空白对照组加入完全培养基150 μL,模型组加入150 μL 的1 μg/mL LPS,样品组加入浓度为100 μg/mL 的各个组分的人参炮制品蛋白酶解肽溶液150 μL,每组5 个复孔,于37 ℃、5% CO2培养箱中继续培养24 h,每孔加入5 mg/mL 的MTT 10 μL,4 h 后弃去上清液,加入150 μL DMSO,置于酶标仪上振荡5 min,490 nm 波长处检测,根据测得OD 值,计算每组细胞增殖率。独立实验重复三次。
1.2.4.2 不同质量浓度BGP-4、RGP-4、SGP-4 对RAW264.7 细胞增殖率的影响 按1.2.4.1 项下方法,样品组分别加入50、100、200 μg/mL 的BGP-4、RGP-4、SGP-4 溶液150 μL,37 ℃、5% CO2培养24 h,每孔加入5 mg/mL 的MTT 10 μL,培养4 h 后弃上清,加入150 μL DMSO,置于酶标仪上振荡5 min,490 nm 波长处检测OD 值,计算各组细胞增殖率。实验独立重复三次。
1.2.4.3 BGP-4、RGP-4、SGP-4 对RAW264.7 细胞NO 分泌量及炎症因子释放的影响 参照1.2.4.1 项下方法将细胞接种于96 孔板中,置于37 ℃、5% CO2培养箱中培养24 h;模型组和样品组加入LPS 处理,于培养箱中继续培养24 h。样品组加入50、100、200 μg/mL 的样品溶液150 μL,每组5 个复孔。于37 ℃、5% CO2条件下培养24 h 后,取上清液,按照NO 试剂盒说明书测定NO 分泌量。根据试剂盒说明书使用ELISA 试剂盒检测炎症因子TNF-α、IL-6、IL-1β的分泌量。实验独立重复三次。
1.2.5 三种蛋白酶解肽氨基酸组成分析 取小于1 kDa 组分的黑参、红参、生晒参蛋白酶解肽冻干粉50 mg 置于水解管中,加入15 mL 6 mol/L 的盐酸,抽真空后110 ℃水解24 h,用氨基酸组成分析仪测定氨基酸组成及含量[24]。
1.3 数据处理
所有实验重复3 次,SPSS 24.0 对数据进行处理,实验数据以平均值±标准差()表示。组间比较采用ANOVA 单因素方差分析,P<0.05,两组数据间差异显著,数据结果有统计学意义。利用Oringin 软件进行绘图制作。通过SIMCA 14.1 软件进行主成分分析(principal component analysis,PCA)、偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)和正交偏最小二乘法判别分析(orthogonal PLS-DA,OPLS-DA),计算预测变量重要性投影(variable importance in projection,VIP)。采用灰色关联度(grey relational degree analysis,GRA)的统计方法来筛选抑制巨噬细胞分泌细胞因子的氨基酸。
2 结果与分析
2.1 不同超滤组分对RAW264.7 细胞的增殖作用
由表1 中测得A 值可以看出,与空白组相比,LPS 模型组能显著抑制RAW264.7 细胞增殖(P<0.05),证明LPS 模型造模成功;由各组细胞增殖率可以看出,与LPS 模型组相比,各给药组均不同程度地促进受损伤的RAW264.7 细胞增殖,其中BGP-4、RGP-4、SGP-4 组分活性最强,增殖率分别为58.78%、35.14%、33.19%。因此选择BGP-4、RGP-4、SGP-4组分做进一步研究。
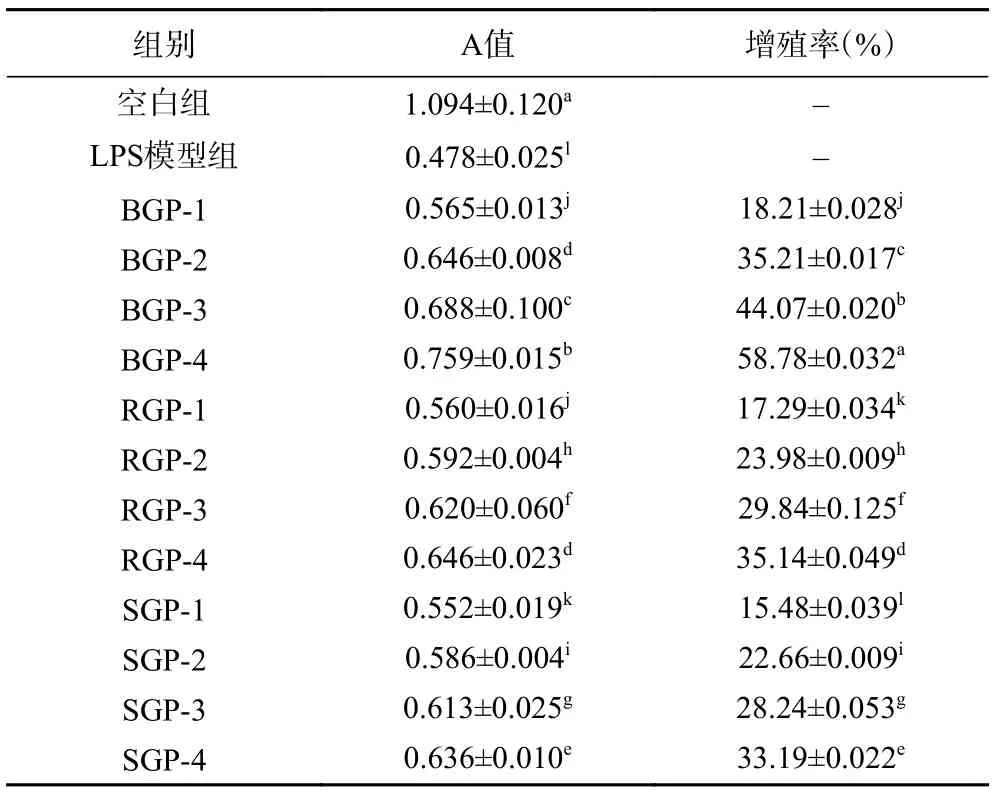
表1 不同超滤组分的BGP、RGP、SGP 对RAW264.7 细胞的增殖作用Table 1 Proliferative effects of different ultrafiltration fractions of BGP,RGP and SGP on RAW264.7 cells
2.2 不同质量浓度BGP-4、RGP-4、SGP-4 对RAW264.7细胞增殖率的影响
由表2 中测得A 值可知,LPS 能够显著抑制RAW264.7 细胞的增殖(P<0.05);在50~200 μg/mL质量浓度范围内,细胞的增殖率呈浓度依赖性,细胞增殖率随着浓度升高而增加。在50~200 μg/mL 质量浓度范围内,BGP-4 促进RAW264.7 细胞增殖的能力最强(P<0.05),其次为RGP-4、SGP-4(P<0.05)。
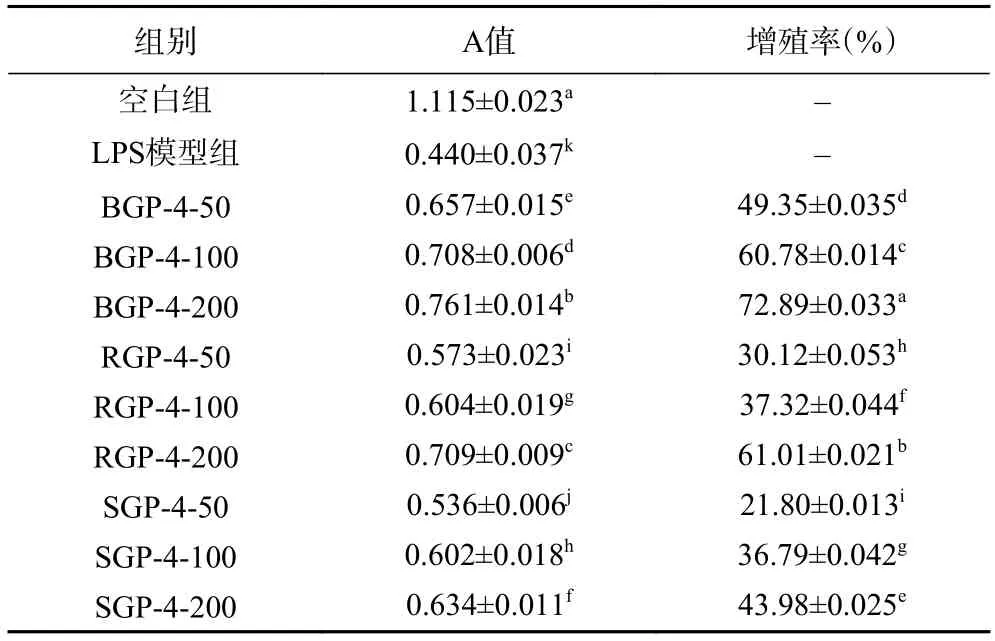
表2 不同质量浓度BGP-4、RGP-4、SGP-4 对RAW264.7细胞增殖率的影响Table 2 Effect of different mass concentrations of BGP-4,RGP-4 and SGP-4 on the proliferation rate of RAW264.7 cells
2.3 BGP-4、RGP-4、SGP-4 对RAW264.7 细胞NO分泌量及炎症因子释放的影响
2.3.1 BGP-4、RGP-4、SGP-4 对RAW264.7 细胞NO分泌量的影响 一氧化氮(NO)是在细胞存活和死亡中起到关键作用的信号传导分子,并且对巨噬细胞显示出各种促炎作用。组织损伤的发病机制与炎性介质的释放密切相关。巨噬细胞通过分泌过量NO,进而介导对损伤的急性期反应。因此,NO 抑制剂在治疗炎症疾病中具有极大潜力[25]。本研究采用LPS 诱导的巨噬细胞炎症模型,检测人参三种炮制品蛋白酶解肽对LPS 诱导的巨噬细胞NO 分泌量的影响,分析三种蛋白酶解肽的抗炎活性。结果由图1 可知,与空白组相比,LPS 诱导的RAW264.7 细胞NO 分泌量显著升高(P<0.05),表明该模型成功。各组样品随着质量浓度的增加,NO 分泌量呈逐渐下降的趋势。其中,BGP-4 抑制RAW264.7 细胞释放NO 的能力显著最强(P<0.05),其次为RGP-4,SGP-4 的抑制能力最弱。
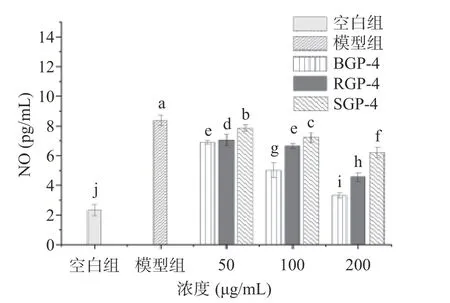
图1 BGP-4、RGP-4、SGP-4 对RAW264.7 细胞NO分泌量的影响Fig.1 Effect of BGP-4,RGP-4 and SGP-4 on NO secretion in RAW264.7 cells
2.3.2 BGP-4、RGP-4、SGP-4 对RAW264.7 细胞释放TNF-α水平的影响 TNF-α是由活化的单核-巨噬细胞和其他细胞产生的一种具有广泛生物学作用的炎症介质[26]。当机体内TNF-α的浓度较低时,可调节免疫应答,具有抗肿瘤、抗感染等多种生物功能。当TNF-α浓度过高时,作为重要的炎症递质,反而会介导炎症反应的病理生理过程[27]。图2 表明与空白组相比,1 μg/mL LPS 诱导后RAW264.7 细胞内TNF-α水平显著增加(P<0.05);给药后各组细胞上清液中TNF-α浓度随着样品质量浓度的增加而下降。与RGP-4 和SGP-4 相比,BGP-4 对LPS 诱导的RAW264.7 细胞释放TNF-α的量抑制作用显著最强(P<0.05)。
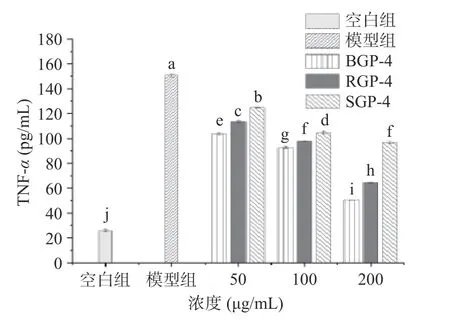
图2 BGP-4、RGP-4、SGP-4 对RAW264.7 细胞TNF-α分泌量的影响Fig.2 Effect of BGP-4,RGP-4 and SGP-4 on TNF-α secretion in RAW264.7 cells
2.3.3 BGP-4、RGP-4、SGP-4 对RAW264.7 细胞释放IL-6 水平的影响 IL-6 作为一种促炎因子,是细胞因子家族中的核心成员,是由T 细胞活化后分泌的一种重要免疫调节因子,可与TNF-α共同参与调节炎症反应。抑制IL-6 的过度表达是减轻炎症的重要手段[28]。由图3 可知,LPS 模型组可显著诱导RAW264.7 细胞分泌IL-6(P<0.05);与模型组相比,各给药组上清液中IL-6 的分泌量均有所降低且呈浓度依赖性。当质量浓度为200 μg/mL 时,IL-6 的分泌量达到最低,显著低于其他浓度下的样品组(P<0.05)。三种蛋白酶解肽对细胞上清液中IL-6 分泌的抑制顺序为BGP-4>RGP-4>SGP-4。
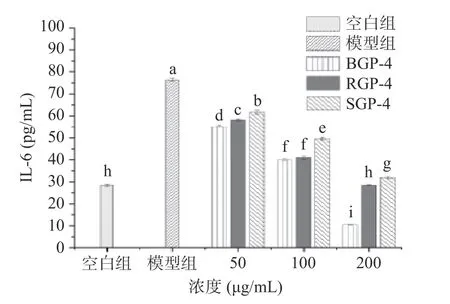
图3 BGP-4、RGP-4、SGP-4 对RAW264.7 细胞IL-6分泌量的影响Fig.3 Effect of BGP-4,RGP-4 and SGP-4 on IL-6 secretion in RAW264.7 cells
2.3.4 BGP-4、RGP-4、SGP-4 对RAW264.7 细胞释放IL-1β水平的影响 当炎症爆发时,细胞中的炎症信号通路被激活并释放多种促炎因子。IL-1β是促炎因子中重要的代表,它的分泌水平可以反映炎症反应的程度[29]。由图4 可知,各给药组对RAW264.7细胞IL-1β分泌量的刺激作用与剂量有关。随着质量浓度的增加,IL-1β释放量不断降低。在200 μg/mL的质量浓度下,IL-1β的分泌量达到最低,抑制作用最强。其中,BGP-4 抑制RAW264.7 细胞释放IL-1β的能力最强(P<0.05),其次为RGP-4,SGP-4 最弱。
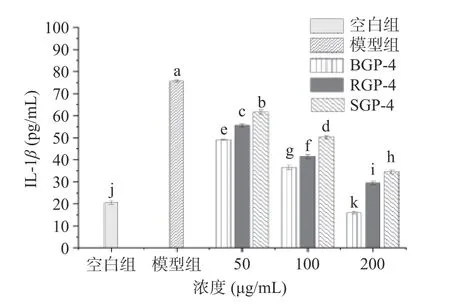
图4 BGP-4、RGP-4、SGP-4 对RAW264.7 细胞IL-1β分泌量的影响Fig.4 Effect of BGP-4,RGP-4 and SGP-4 on IL-1β secretion in RAW264.7 cells
结果表明,与红参蛋白酶解肽和生晒参蛋白酶解肽相比,黑参蛋白酶解肽对RAW264.7 细胞NO分泌量及炎症因子释放的抑制作用更强,具有显著性差异(P<0.05)。这是由于炮制可提高中药疗效,改变药物的功能和临床疗效[30]。在加工过程中可能会导致人参中的有效成分如肽类物质发生一系列转化,使得人参三种炮制品生物活性的差异性[31]。黑参由于蒸制时间最长,在加热过程中可能产生更多种类的小分子活性肽,使其结构发生改变,导致其抗炎活性增加。
2.4 三种蛋白酶解肽氨基酸组成分析
氨基酸的组成及含量可以影响蛋白质的功能性质,一定程度上决定蛋白酶解肽的生理活性[32]。由表3 可知,三种蛋白酶解肽的氨基酸组成基本一致,均含有17 种氨基酸,但含量有所差异。BGP-4、RGP-4、SGP-4 氨基酸总含量为52.619、56.754、64.042 g/100 g。其中,苯丙氨酸的含量是BGP-4、RGP-4、SGP-4 氨基酸总含量中占比最高的,分别为17.073、15.384、14.704 g/100 g,且黑参蛋白酶解肽的苯丙氨酸含量高于红参蛋白酶解肽和生晒参蛋白酶解肽。研究表明,疏水性氨基酸更容易进入细胞发挥作用,有利于提高活性肽的抗炎活性[33]。由此推测,苯丙氨酸作为疏水性氨基酸,其含量的高低与人参不同炮制品蛋白酶解肽的抗炎效果有着一定联系。
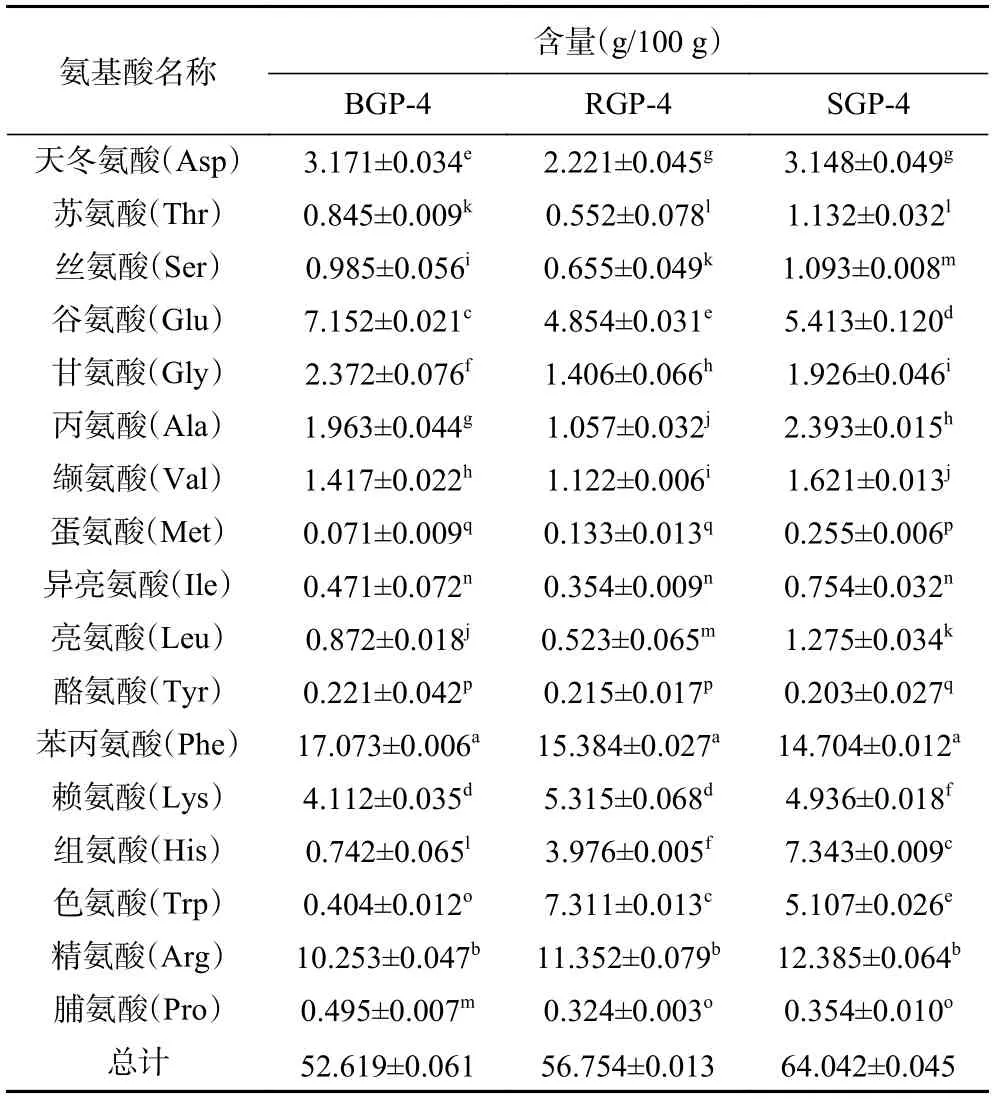
表3 BGP-4、RGP-4、SGP-4 的氨基酸组成及含量Table 3 Amino acid composition and content of BGP-4,RGP-4 and SGP-4
2.5 BGP-4、RGP-4、SGP-4 的氨基酸多元统计分析
通过PCA(无监督)模式识别化学计量学对三种炮制品蛋白酶解肽所含氨基酸进行分析,结果见图5A。从图中可以看出,通过PCA 法可以将三种炮制品蛋白酶解肽分开,三者间存在一定差异,推测可能是人参炮制过程中,由于蒸制时间不同会发生一系列较为复杂的化学成分转化,造成了氨基酸含量的变化。其次,进行了监督的OPLS-DA 分析散点图(图5B)来发现三种炮制品蛋白酶解肽之间的差异氨基酸。此外还进行了置换检验(n=200),来评估判别模型是否对数据过度拟合。如图6 所示,PLS-DA 模型排列实验中左侧任意一次随机变量y 变量所产生的R2值和Q2值均小于右侧的原始点,且Q2点的回归线与垂直轴(左侧)截距为负数(R2=0.255,Q2=-0.362),说明该模型没有过度拟合,表明模型有效[34]。分析得到的VIP 值见表4,选取VIP>1,表示其差异性贡献率大于其他组分,得到三种炮制品蛋白酶解肽所含的差异氨基酸分别是His、Trp、Arg、Phe、Glu、Leu、Ala、Gly、Ile、Thr 和Met。
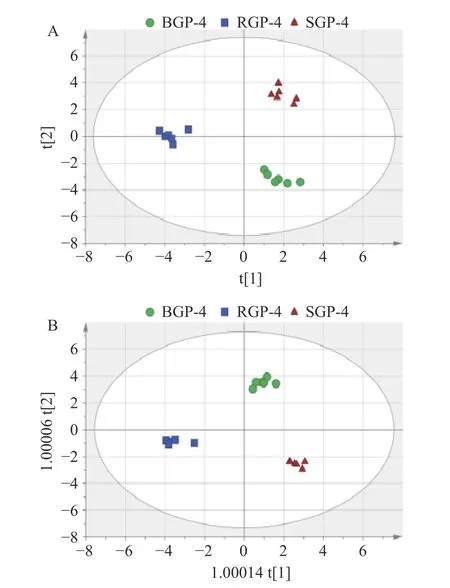
图5 BGP-4、RGP-4、SGP-4 的PCA 分析散点图(A)和OPLS-DA 分析散点图(B)Fig.5 PCA analysis scatterplot (A) and OPLS-DA analysis scatterplot (B) for BGP-4,RGP-4 and SGP-4
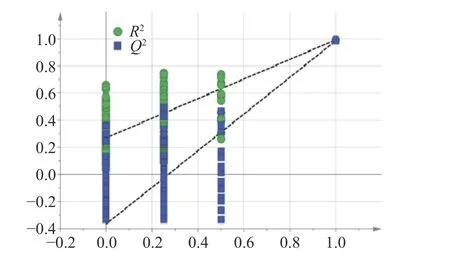
图6 BGP-4、RGP-4、SGP-4 的PLS-DA 模型图Fig.6 PLS-DA model diagram for BGP-4,RGP-4 and SGP-4
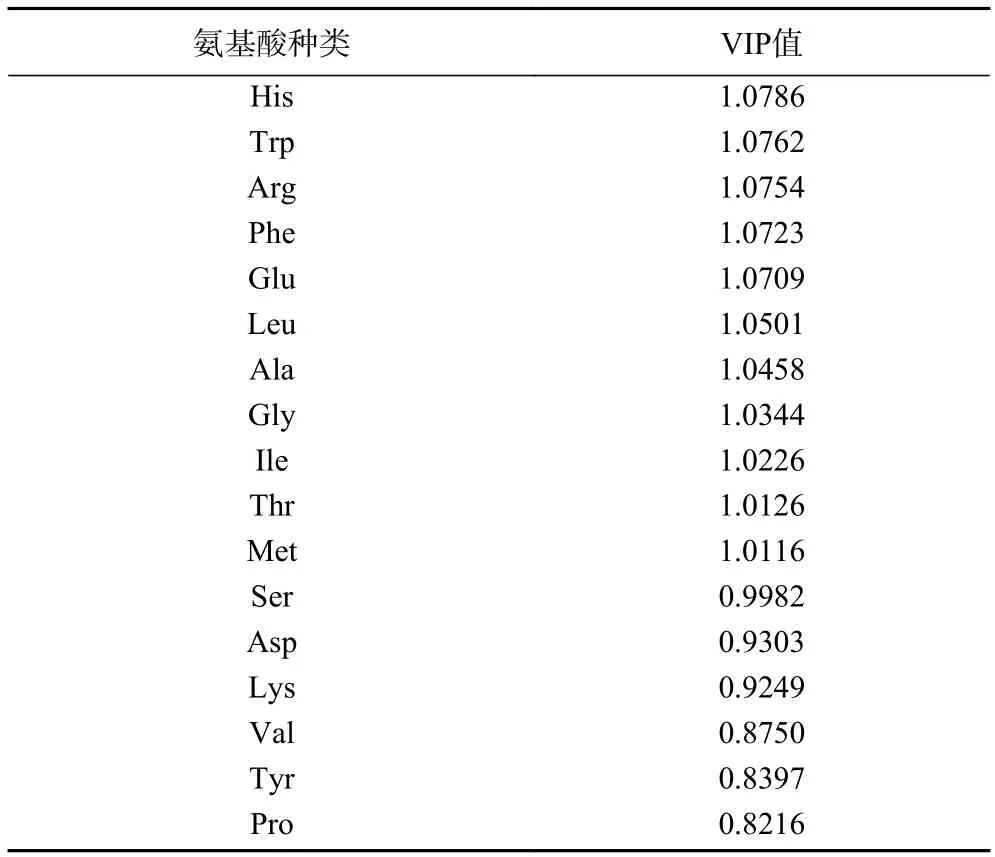
表4 BGP-4、RGP-4、SGP-4 基于OPLS-DA 分析的VIP 值Table 4 VIP values of BGP-4,RGP-4,SGP-4 based on OPLS-DA analysis
通过PCA 分析得到三种人参炮制品蛋白酶解肽中的特征差异氨基酸,但未能筛选出促进RAW264.7 细胞活性的氨基酸。故本研究以NO 和细胞因子(TNF-α、IL-6、IL-1β)释放量为活性指标,应用灰色关联度分析(GRA)筛选出抑制RAW264.7细胞分泌细胞炎症因子的氨基酸。使用EXCEL 对实验数据进行灰色关联度分析,将BGP-4、RGP-4、SGP-4 的氨基酸含量Xi(自变量)设为比较数列(子序列);RAW264.7 分泌炎症因子的含量X0 设为参考序列[35],将对应的数据输入到EXCEL 表中,进行灰色关联分析。当关联度>0.7 时,认为子序列与母序列之间存在一定关联性。结果表明(见表5),Asp、Ser、Val、Phe、Lys 与抑制炎症因子含量水平相关。
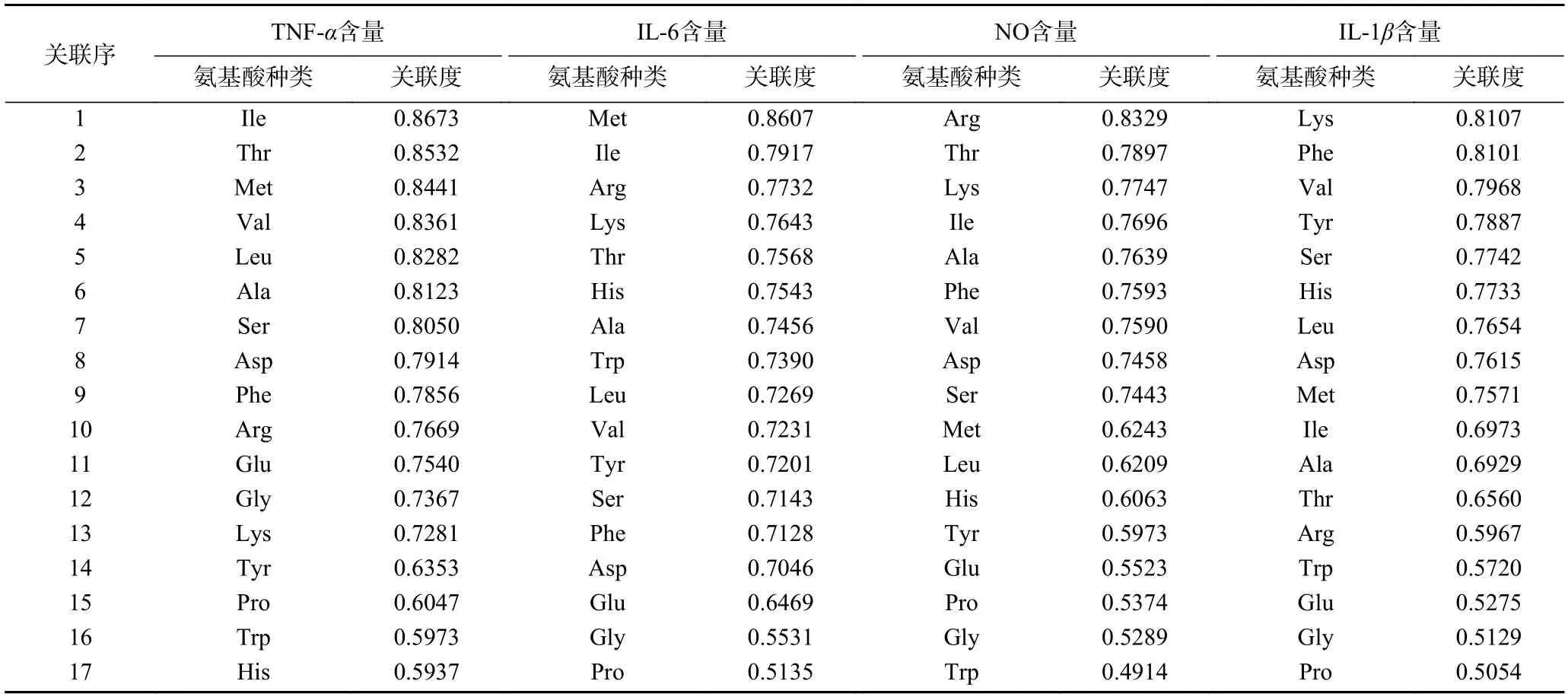
表5 BGP-4、RGP-4、SGP-4 的氨基酸含量与抗炎指标的关联序和关联度Table 5 Sequence and correlation of amino acid content of BGP-4,RGP-4 and SGP-4 with anti-inflammatory indexes
综合多元统计分析VIP>1 和灰色关联度>0.7,筛选出三种人参炮制品蛋白酶解肽的特征性氨基酸为Phe。
苯丙氨酸在体内大部分经苯丙氨酸羟化酶催化作用氧化成酪氨酸,并与酪氨酸一起合成重要的神经递质和激素,参与机体糖代谢和脂肪代谢[36]。据文献报道,苯丙氨酸在两亲性α螺旋肽发挥抗菌、抗炎作用中具有非常重要的作用,可抑制炎症因子过度表达[37]。由此推测,苯丙氨酸含量的高低与人参炮制品蛋白酶解肽的抗炎作用有一定关系,这可能是三种炮制品蛋白酶解肽中黑参蛋白酶解肽体外抗炎活性最佳的原因之一。
3 结论
本实验采用酶解法、超滤分离从人参三种炮制品中提取蛋白酶解肽。通过LPS 诱导的RAW264.7炎症模型对三种蛋白酶解肽的抗炎活性进行对比分析发现,黑参蛋白酶解肽的抗炎活性强于红参蛋白酶解肽和生晒参蛋白酶解肽,能够显著抑制NO 及炎症因子(TNF-α、IL-6、IL-1β)的分泌((P<0.05)。黑参蛋白酶解肽质量浓度为200 μg/mL 时,促进RAW264.7 细胞增殖的能力最强(P<0.05),增殖率为72.89%。综合多元统计分析(VIP>1)和灰色关联度分析(关联度>0.7)结果筛选出Phe 为三种人参炮制品蛋白酶解肽的特征差异性成分。三种蛋白酶解肽的Phe 含量顺序为:黑参蛋白酶解肽(17.07%)>红参蛋白酶解肽(15.38%)>生晒参蛋白酶解肽(14.70%)。黑参蛋白酶解肽所含Phe 含量最高,这可能是在相同浓度下黑参蛋白酶解肽抗炎效果最好的原因之一。但黑参蛋白酶解肽中苯丙氨酸含量的增加与其抑制巨噬细胞分泌炎症因子能力增强的内在关系并不清楚,以及黑参中活性肽的抗炎机制还有待研究。未来黑参多肽的深入研究将是人参炮制品高效利用和科学开发的新领域。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

