牡蛎蛋白酶解肽制备工艺优化及其对小鼠睾丸间质细胞睾酮分泌和氧化应激的影响
刘 璐,李晶峰,兰 梦,李冬冰,张凯月,王跃龙,申嘉明,李春楠,张 辉,*,孙佳明,*
(1.长春中医药大学吉林省人参科学研究院,吉林长春 130117;2.长春中医药大学药学院,吉林长春 130117)
牡蛎为牡蛎科动物长牡蛎(Ostrea gigasThunberg)、大连湾牡蛎(Ostrea talienwhanensisCrosse )或近江牡蛎(Ostrea rivularisGould)的贝壳,素有“海洋牛奶”的美誉,富含丰富的蛋白质、多糖、牛磺酸等物质[1],其中牡蛎蛋白是牡蛎最重要的营养来源[2]。牡蛎壳约占牡蛎总重量的60%[3-4],虽其主要成分为碳酸钙,但其棱柱层中富含丰富的蛋白质[5-6]。我国每年会产生数以万计的牡蛎壳废料[7],不仅会对自然环境产生影响,同时也会对自然资源造成浪费,因此针对牡蛎壳的再利用迫在眉睫。
牡蛎补肾益精的功效在多本医术中均有记载,《名医别录》中记载牡蛎能“疗泻精”,《本草经疏》指出牡蛎能“敛涩精气”,《海药本草》指出牡蛎“主男子遗精”。Zhang 等[8]研究发现牡蛎肉提取物可提高雷公藤内酯(TP)诱导的小鼠睾丸损伤模型的精子数量和活力,降低丙二醛(MDA)水平,增加抗氧化酶(SOD 和GPH-Px)活性,对睾丸损伤具有保护作用。叶贤英[9]研究发现近江牡蛎多糖能通过调节细胞自噬显著改善氧化应激引起的细胞损伤。
生物活性肽是指具有丰富生物学活性的肽类化合物。近年来,通过生物活性肽开发为高附加值食品在世界范围内越来越受到关注。常见的提取生物活性肽的方法有化学提取法、酶解法、微生物提取法[10-11]等,其中化学提取法水解条件难以控制,蛋白质易变性[12];微生物提取法的代谢过程复杂,产物难以控制[13];而酶解法条件温和、安全性高,酶解反应没有副反应且不会降低蛋白质的营养价值而被广泛应用。Liao 等[14]通过木瓜蛋白酶水解得到了中华鳖甲壳肽,且对血管紧张素I 转换酶的抑制活性较强。王振杰[15]采用响应法优化杂色蛤多肽的酶法制备工艺,得到的酶解肽具有较强的抗氧化活性。
因此,本实验选用模拟消化道酸碱环境的两种酶即胃蛋白酶和胰蛋白酶进行仿生酶解,以期模拟蛋白质大分子在人体消化过程,通过单因素实验和响应面优化试验确定最佳酶解条件,制备牡蛎蛋白酶解肽,并探究其对小鼠睾丸间质细胞睾酮分泌和氧化应激的影响,为牡蛎蛋白酶解肽的合理开发和牡蛎资源的合理利用提供科学依据。
1 材料与方法
1.1 材料与仪器
牡蛎 长春市同鑫海鲜市场;胃蛋白酶(1:3000)、胰蛋白酶(1:250) 百克赛斯生物科技(镇江)有限公司;茚三酮 广州和为医药科技有限公司;牛血清白蛋白、DMEM/F12(1:1)培养基、胎牛血清 美国Gibco 公司;小鼠睾丸间质细胞TM3 上海弘顺生物科技有限公司;噻唑蓝(MTT) 上海炎熙生物可以有限公司;4',6-二脒基-2-苯基吲哚(DAPI)染色液 上海碧云天生物科技有限公司;二甲基亚砜(DMSO) 陕西养元神生物科技有限公司;小鼠睾酮ELISA 检测试剂盒、SOD、MDA 测定试剂盒 黄石科研生物科技有限公司;其余试剂 均为国产分析纯。
WP-UP-III-40 超纯水机 四川沃特尔科技发展有限公司;85-2A 双数显恒温磁力加热搅拌器 金坛区西城新瑞仪器厂;GIPP-FD-3 冷冻干燥机 上海继谱电子科技有限公司;L-8900 型氨基酸自动分析仪 日本日立公司;C3-6550-01 酶标仪 日本ASONE公司;CKX 53 倒置荧光生物显微镜 日本Olympus公司。
1.2 实验方法
1.2.1 牡蛎蛋白的制备 取牡蛎适量,洗净后在通风处阴干,粉碎过20 目筛,以料液比1:5 g/mL 加入蒸馏水,冷浸法提取12 h,共提取3 次,合并提取液[16],3600 r/min 离心15 min,将上清液在冷阱温度-50 ℃和真空度10~12 Pa 条件下真空冷冻干燥,即得牡蛎蛋白冻干粉,备用。
1.2.2 牡蛎蛋白含量测定 参考Lowry 法测定牡蛎蛋白含量[17]。标准曲线的建立:精密称取2.0 mg 牛血清白蛋白(BSA)于10 mL 容量瓶中,加蒸馏水溶解并定容至刻度。分别取标准液0、0.1、0.2、0.4、0.6、0.8、1.0 mL 于干燥试管中,每管补充蒸馏水至1.0 mL。分别加入碱性铜试液1 mL,摇匀,加入福林酚试液4 mL,立即摇匀,置55 ℃水浴中反应5 min,取出,置冷水浴中10 min,以0 号管做空白,测定其在650 nm 处的吸光度值,以吸光度为纵坐标,对照品溶液浓度为横坐标制作标准曲线。
样品测定:将牡蛎蛋白冻干粉待测样品配制成质量浓度为1 mg/mL 溶液,照标准曲线的制作项下的方法,测定牡蛎蛋白含量,从标准曲线中计算供试品中蛋白质的含量。
1.2.3 牡蛎蛋白酶解工艺 为模拟人的消化道环境,将酶解固定条件设为温度37 ℃,胃蛋白酶酶解pH 为2.0,胰蛋白酶酶解pH 为8.0[18]。称取适量牡蛎蛋白冻干粉,以料液比1:10 g/mL 加入蒸馏水,于恒温磁力搅拌器中搅拌,加入1.0%的胃蛋白酶酶解1.0 h 后加入2.0%的胰蛋白酶酶解3.0 h,期间加入1 mol/L NaOH 或HCl 使溶液维持在酶的最适pH[19],酶解结束后转入100 ℃沸水中灭活15 min,以3600 r/min 离心15 min,取其上清液在冷阱温度-50 ℃和真空度10~12 Pa 条件下真空冷冻干燥,即得牡蛎蛋白酶解肽冻干粉,备用。
1.2.4 牡蛎蛋白酶解工艺优化
1.2.4.1 单因素实验 以水解度为指标,考察酶用量对水解效果的影响。在固定料液比为1:10 g/mL,胃蛋白酶酶解时间为1.0 h,胰蛋白酶用量为2.0%、酶解时间为3.0 h 的基础上,研究胃蛋白酶量在0.5%、1.0%、1.5%、2.0%、2.5%时对水解度的影响;在固定料液比为1:10 g/mL,胃蛋白酶用量为1.0%、酶解时间为1.0 h,胰蛋白酶酶解时间为3.0 h 的基础上,研究胰蛋白酶量1.0%、1.5%、2.0%、2.5%、3.0%对水解度的影响。
考察酶解时间对水解效果的影响。在固定料液比为1:10 g/mL,胃蛋白酶用量为1.0%,胰蛋白酶用量为2.0%、酶解时间为3.0 h 的基础上,研究胃蛋白酶酶解时间为0.5、1.0、1.5、2.0、2.5 h 对水解度的影响;在固定料液比为1:10 g/mL,胃蛋白酶用量为1.0%、酶解时间为1.0 h,胰蛋白酶用量为2.0%,研究胰蛋白酶酶解时间1.5、2.0、2.5、3.0、3.5 h 对水解度的影响。
考察料液比对水解效果的影响。在固定胃蛋白酶用量为1.0%、酶解时间为1.0 h,胰蛋白酶用量为2.0%、酶解时间为3.0 h 的基础上,研究料液比在1:6、1:8、1:10、1:12、1:14 g/mL 时对水解度的影响。
1.2.4.2 响应面试验设计 Box-Behnken 设计(BBD)因其不包含嵌入的因子或分数因子设计,所以被称为独立的二次设计。在这种设计中,处理组合位于工艺空间边缘的中点和中心[20]。根据单因素实验结果选取胰胃蛋白酶量(A),胃蛋白酶量(B)和胰蛋白酶酶解时间(C)为自变量,选取水解度(Y)作为响应值,进行三因素三水平的响应面试验设计,设计如表1所示。
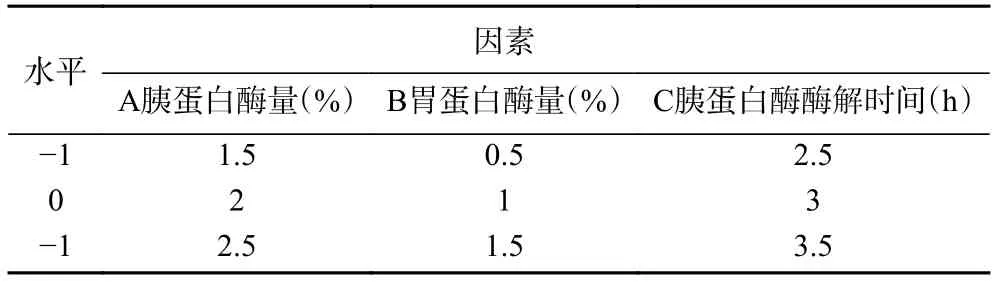
表1 Box-Behnken 试验因素与水平Table 1 Box-Behnken test factors and horizontal
1.2.4.3 水解度的测定 参照刘丽红等[21]等的方法测定水解度,标准曲线回归方为:y=1.8327x-0.0163,R2=0.9949,x 为完全水解液的浓度μg/mL,y 为测得的吸光度值。标准曲线可以计算出蛋白质量,带入下列公式中计算可得到牡蛎蛋白酶解肽的水解度:
其中:A 为通过标准曲线计算得到的待测溶液中的蛋白质量,mg;V1水解液的总体积,mL;W 为实验中称取的样品质量,g;V2表示所用稀释液的体积,mL。
1.2.5 牡蛎蛋白酶解肽对TM3 细胞存活率、睾酮分泌及氧化应激水平的影响
1.2.5.1 细胞培养、分组及造模 将冻存的TM3 细胞在37 ℃的水中快速解冻后离心,弃去上清液加入含有10%胎牛血清的DMEM/F12(1:1)培养液混悬,混悬后将其转移到培养瓶中,并补足培养基,放入细胞培养箱(37 ℃,含有5% CO2)中培养。取对数生长期细胞将其密度稀释为4×103个/mL 后接种于96 孔培养板内,培养24 h 后将细胞分为空白组、模型组和给药组,模型组、给药组加入200 μL 含有H2O2(5 μmol/L)培养基[22],PBS 缓冲液作为空白组。
1.2.5.2 MTT 法测定细胞存活率 TM3 细胞按“1.2.5.1”项下培养4 h 后,各给药组加入相应浓度的牡蛎蛋白酶解肽(50、100、200、300、400 μg/mL),每组设置3 个复孔。培养24 h 后,培养板每孔加入20 μL 5 mg/mL MTT,4 h 后吸出上清液,加入DMSO 150 μL,振摇10 min 至结晶物完全溶解,通过酶标仪于490 nm 波长处测定各孔吸光度,计算细胞存活率,公式如下:
1.2.5.3 DAPI 染色 将细胞密度稀释为3×105个/mL后接种于6 孔培养板内,培养24 h,按照“1.2.5.1”的方法设定空白组、模型组和给药组,给药组加入相应浓度的牡蛎蛋白酶解肽(50、100、200、300、400 μg/mL),培养48 h 后,每孔加入DAPI 染色液5 μL,放入培养箱中孵育20 min,弃去染色液,PBS洗涤2 次,在荧光显微镜下随机选取视野拍照。
1.2.5.4 牡蛎蛋白酶解肽对睾酮分泌量和氧化应激水平的影响 空白组、模型组、给药组设定方法同“1.2.5.1”。给药组加入相应浓度的牡蛎蛋白酶解肽(100、200、300 μg/mL),培养24 h 后,吸出上清液,按睾酮、SOD、MDA 试剂盒说明书进行测定。
1.2.6 牡蛎蛋白酶解肽氨基酸组成 取牡蛎蛋白酶解肽冻干粉10 mg 加入10 mL 6 mol/L 的HCl,置于130 ℃烘箱中水解24 h,得到牡蛎蛋白酶解肽完全水解液,将水解液蒸干并加水反复蒸干3 次后溶于1 mL 0.02 mol/L 的HCl 中,于氨基酸自动检测仪中检测氨基酸含量[23]。
1.3 数据处理
本实验应用Design Expert 13.0 软件进行响应面设计及结果分析,采用GraphPad Prism 8 软件对实验数据进行分析及绘图,应用SPSS 22.0 软件进行单因素方差分析和t检验,数据以x¯±s 表示,所有试验重复3 次。
2 结果与分析
2.1 牡蛎蛋白含量测定
标准曲线的回归方程为:y=2.7972x+0.0228,R2=0.9973,x 为牛血清白蛋白质量浓度mg/mL,y 为测得的吸光度值,计算得牡蛎蛋白冻干粉的蛋白含量为11.04%±0.54%。
2.2 单因素实验结果
2.2.1 蛋白酶用量对牡蛎蛋白酶解肽水解度的影响 蛋白酶用量对牡蛎蛋白酶解肽水解度的影响如图1所示。当胃蛋白酶量为1.0%,胰蛋白酶量为2.0%时,水解程度达到最大,分别为34.98%、35.07%。这可能是因为随着酶浓度的增大,底物与酶接触的概率增加,使水解度增加。当胃蛋白酶用量>1.0%,胰蛋白酶用量>2.0%时,水解度有下降的趋势。可能因为酶蛋白酶量增加后,水解速度加快,产生的小分子肽会和底物竞争与酶结合,导致牡蛎蛋白与酶作用概率大大减小,从而水解度降低[24-25]。当水解度达到最大值时,继续增加酶用量,水解度显著降低(P<0.05)。因此,使用0.5%~1.5%的胃蛋白酶和1.5%~2.5%的胰蛋白酶进行后续的响应面试验。
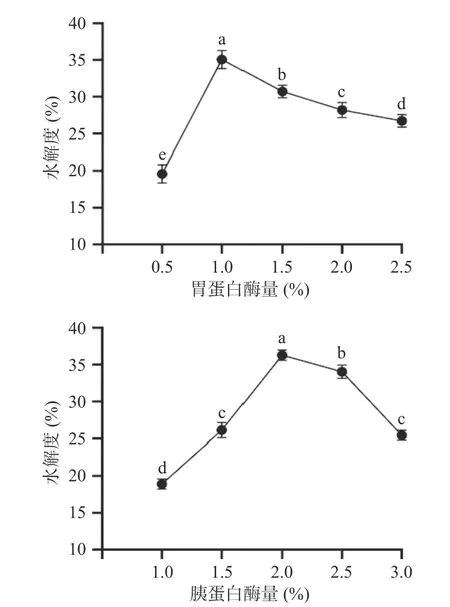
图1 酶用量对水解度的影响Fig.1 Effect of enzyme dosage on hydrolysis degree
2.2.2 酶解时间对牡蛎蛋白酶解肽水解度的影响 酶解时间对牡蛎蛋白酶解肽水解度的影响如图2 所示。当胃蛋白酶酶解时间达到1.0 h,胰蛋白酶酶解时间达到3.0 h 时,水解程度达到最大,分别为35.13%、37.26%,这可能因为在水解前期随着酶解时间的增加,底物与酶反应更彻底,从而水解度增大。当胃蛋白酶酶解时间>1.0 h,胰蛋白酶酶解时间>3.0 h 时,水解度有下降趋势,这可能是因为酶解时间的延长,酶解反应体系中酶解物浓度增大,使酶解体系变稠,不适合酶解反应进行,使水解度降低[26]。当胃蛋白酶酶解时间为1.5 h 时,水解度与1.0 h 时相比没有显著性变化(P>0.05),当水解度达到最大值时,继续增加胰蛋白酶酶解时间,水解度显著降低(P<0.05)。所以在后续的响应面试验中未选择胃蛋白酶酶解时间作为优化因素,以胃蛋白酶酶解1.0 h 作为固定条件,选择胰蛋白酶酶解2.5~3.5 h 对牡蛎蛋白酶解肽进行酶解。
2.2.3 料液比对牡蛎蛋白酶解肽水解度的影响 料液比对牡蛎蛋白酶解肽水解度的影响如图3 所示。当料液比达到1:10 g/mL 时,水解度达到最大为34.72%。料液比的变化即是底物浓度的变化,当底物浓度为1:6、1:8 g/mL 时,底物浓度较大,导致底物与蛋白酶之间扩散与运动受到限制[27-28],使酶解不完全。当底物浓度<1:10 g/mL 时,水解度开始降低,这可能是因为此时底物浓度过小导致底物与酶的碰撞机会变少,酶未被完全饱和。当水解度达到最大值时继续改变料液比,水解度显著降低(P<0.05),但其对水解度的总体趋势较为平缓,故未在后续响应面试验中选择料液比作为优化因素,使用料液比1:10 g/mL作为固定条件。
2.3 Box-Benhnken 试验优化分析
响应面试验设计及结果见表2。两个因素之间交互作用结果见图4,得到以水解度为目标的(Y)预测值对所选自变量的回归方程:Y=38.252+2.98125 A+4.9875B+1.06375C+0.225AB+0.3925AC+0.785BC-5.58475A2-10.36725B2-3.59975C2。
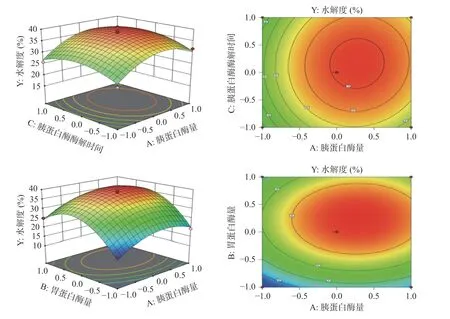
图4 各因素的交互作用影响Fig.4 Interaction influence of various factors

表2 Box-Behnken 试验设计及结果Table 2 Design and results of Box-Behnken experimental
由表3 可知,方程二次多项式回归模型P<0.001,失拟项不显著(P>0.05),模型的R2=0.9835,说明该模型可解释98.35%的水解度变化,R2adj=0.9622,表明试验结果与模型拟合度好,该模型可用于优化牡蛎的酶解工艺。由F值及相应曲面坡度可知各因素的影响大小为B>A>C,即胃蛋白酶用量对牡蛎肽水解度影响最大。通过P值可以看出AC、BC 因素交互作用较强。
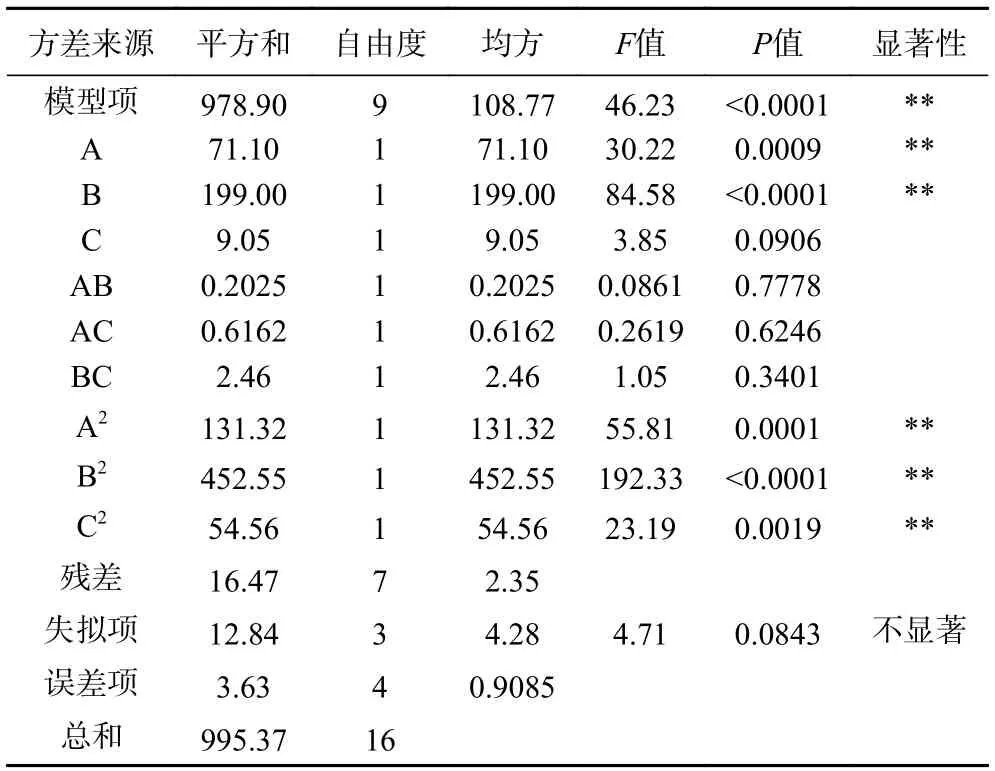
表3 水解度显著性检验及方差分析Table 3 Significance test and variance analysis of hydrolysis degree
通过Design-Expert 13 软件得到了最佳工艺条件优化的组合为料液比1:10 g/mL,胃蛋白酶量1.13%,酶解时间1.0 h,胰蛋白酶量2.14%,酶解时间为3.09 h,在此基础上的水解度预测值为39.40%。考虑到实验的操作情况选取胰蛋白酶量2.1%,胃蛋白酶量1.1%,胰蛋白酶酶解时间3.1 h,验证模型预测的准确性。进行3 次平行实验,水解度为39.43%±0.42%,与预测值无明显差异。综上,采用响应面的方法优化牡蛎仿生酶解工艺是可行的。
2.4 牡蛎蛋白酶解肽对TM3 细胞存活率的影响
由图5 可知,H2O2诱导的TM3 细胞与空白组细胞相比,存活率极显著下降(P<0.01),表明氧化损伤模型造模成功。与H2O2模型组相比,50~400 μg/mL质量浓度的牡蛎蛋白酶解肽对TM3 细胞存活率的影响呈先上升后下降的趋势。当牡蛎蛋白酶解肽的质量浓度为100 μg/mL 时,对TM3 细胞增殖影响显著(P<0.05);当牡蛎蛋白酶解肽的质量浓度为200~400 μg/mL 时,对TM3 细胞增殖影响极显著(P<0.01),且300 μg/mL 质量浓度的牡蛎肽对TM3细胞存活率最大达93.25%。随着牡蛎蛋白酶解肽质量浓度的继续增加,存活率开始下降,故选择100~300 μg/mL 的牡蛎蛋白酶解肽进行进一步研究。
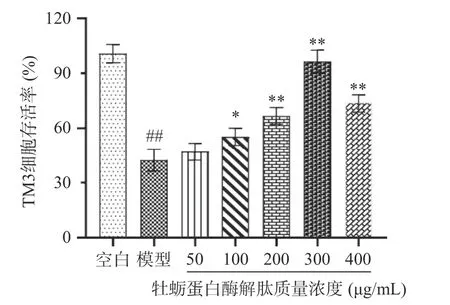
图5 不同质量浓度牡蛎蛋白酶解肽对TM3 细胞存活率的影响Fig.5 Effects of oyster protein enzymolysis peptides with different concentration on the survival rate of TM3 cells
2.5 DAPI 染色结果
由图6 可知,与模型组相比,不同质量浓度的牡蛎蛋白酶解肽处理过的TM3 细胞数量发生明显变化,质量浓度为300 μg/mL 时,细胞数量最多,与细胞存活率的实验结果相一致。

图6 DAPI 染色观察Fig.6 DAPI staining observation
2.6 牡蛎蛋白酶解肽对TM3 细胞睾酮分泌量的影响
睾丸间质细胞的主要功能是合成和分泌睾酮,睾酮是促进睾丸和前列腺等男性生殖组织发育以及维持精子发生和第二性征的重要激素,维系着男性正常的生殖功能[29-30]。由图7 可知,与模型组比较,给药24 h 后200、300 μg/mL 质量浓度的牡蛎蛋白酶解肽极显著增加了TM3 细胞的睾酮分泌量(P<0.01),且质量浓度为200 μg/mL 时睾酮分泌量达到最大,为20.43 ng/mL,表明了牡蛎蛋白酶解肽有一定的补肾作用。200 μg/mL 的牡蛎蛋白酶解肽睾酮分泌量最多,而细胞存活率的最佳浓度为300 μg/mL,这二者的浓度并不一致,推测牡蛎蛋白酶解肽对TM3 细胞的增殖作用可能还伴随着其他物质的分泌来发挥药效。
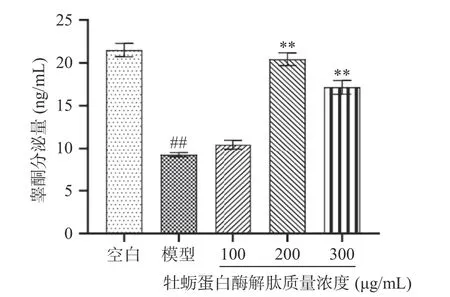
图7 不同质量浓度牡蛎蛋白酶解肽对TM3 细胞睾酮分泌量的影响Fig.7 Effects of oyster protein enzymolysis peptides with different concentration on testosterone secretion in TM3 cells
2.7 牡蛎蛋白酶解肽对TM3 细胞SOD 酶活力、MDA含量的影响
TM3 细胞内发生氧化应激是睾酮水平下降的重要原因,睾酮的分泌需要保证细胞内合适的氧化环境[31]。超氧化物歧化酶(SOD)可以催化超氧自由基歧化为过氧化氢和氧气,去除细胞中自由基[32],常表征机体抗氧化水平[33],SOD 酶活力较低代表着严重的氧化应激水平。丙二醛(MDA)是一种机体过氧化的重要最终产物[34],其含量可有效地反映机体组织中脂质过氧化的强度及速率,已被广泛用于评估氧化应激的水平[35],高含量的MDA 浓度代表着严重的氧化应激水平[36]。二者常用来评价氧化应激水平。
由图8 和图9 可知,与模型组相比,200、300 μg/mL 牡蛎蛋白酶解肽极显著提高SOD 酶活力(P<0.01),极显著降低MDA 含量(P<0.01),且质量浓度为200 μg/mL 时,SOD 酶活力最高,为12.85 ng/mL,MDA 含量最低,为6.59 nmol/mL,可以认定牡蛎蛋白酶解肽可以平衡细胞内氧化应激水平。调节氧化应激的最佳浓度与细胞存活率最佳浓度不一致,推测牡蛎蛋白酶解肽对TM3 细胞的增殖作用不仅仅是调节氧化应激这一个途径。
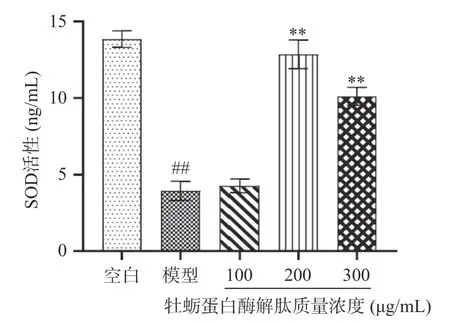
图8 不同质量浓度牡蛎蛋白酶解肽对TM3 细胞SOD活性的影响Fig.8 Effects of oyster protein enzymolysis peptides with different concentration on SOD activity of TM3 cells
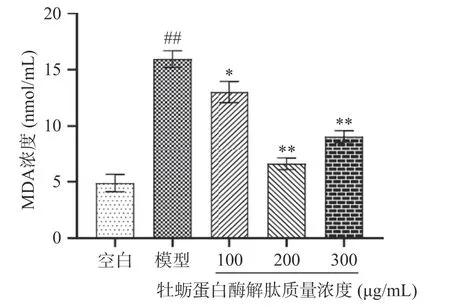
图9 不同质量浓度牡蛎蛋白酶解肽对TM3 细胞MDA浓度的影响Fig.9 Effects of oyster protein enzymolysis peptides with different concentration on MDA concentration in TM3 cells
结果表明,牡蛎蛋白酶解肽浓度为200 μg/mL时,睾酮分泌量达到最大值且此时细胞内氧化环境最好。
2.8 牡蛎蛋白酶解肽氨基酸的组成
由表4 可知,牡蛎蛋白酶解肽中含有17 种氨基酸,其中甘氨酸的含量最高,精氨酸的含量次之。Liu 等[37]研究发现甘氨酸减轻了氟化钠诱导的猪睾丸细胞的氧化应激,细胞凋亡和衰老。初步认为甘氨酸可以防止机体氧化损伤和细胞凋亡。El-Shalofy等[38]研究发现肌肉注射精氨酸可以增强热应激公羊中的血浆睾酮和一氧化氮浓度。初步认定精氨酸可以降低脂质过氧化反应的程度并且维持细胞内ATP的稳定[39-40]。研究表明,赖氨酸、精氨酸、脯氨酸等氨基酸都具有抗氧化活性,在维持机体内氧化应激水平有着重要作用[41]。牡蛎蛋白酶解肽中甘氨酸和精氨酸含量较高,因此能够极显著增加(P<0.01)TM3细胞的SOD 酶活力与睾酮分泌量,极显著降低(P<0.01)MDA 含量。

表4 牡蛎蛋白酶解肽氨基酸组成(n=6)Table 4 Amino acid composition of oyster protein peptides(n=6)
3 结论
本研究以牡蛎壳为原料,冷浸法提取牡蛎蛋白,确定最佳酶解工艺为:温度37 ℃,料液比1:10 g/mL,胃蛋白酶量1.1%,酶解时间1.0 h,pH 2.0,胰蛋白酶量2.1%,酶解时间3.1 h,pH 8.0,制备牡蛎蛋白酶解肽,水解度达最大值为39.43%±0.42%。同时,本研究发现300 μg/mL 质量浓度的牡蛎蛋白酶解肽对H2O2诱导的TM3 细胞表现出较强的增值活性,200 μg/mL 质量浓度的牡蛎蛋白酶解肽能够极显著的增加睾酮分泌,增强SOD 酶活力,降低MDA 水平(P<0.01),表明牡蛎蛋白酶解肽对促进TM3 细胞分泌睾酮,抑制氧化应激反应具有一定的作用。综上所述,本实验为实现废弃牡蛎壳的资源化及牡蛎蛋白酶解肽在食品、保健品领域内的开发提供合理依据。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

