萝卜籽酶解制备萝卜硫素工艺优化及其体外消化研究
李惠琳,刘 昊,李 珏,木耶赛尔·凯代斯,图尔荪阿依·图尔贡,赵 雷,何庆峰,*
(1.和田职业技术学院农业科技系,新疆维吾尔自治区和田 848000;2.天津农学院食品科学与生物工程学院,天津 300000)
萝卜硫素(sulforaphane,1-异硫氰酸酯(4R)-(甲基亚磺酰基)丁烷),又称莱菔硫烷,由十字花科蔬菜及种子中硫代葡萄糖苷(Glucosinolates,GLS)经植物黑芥子酶水解而成,属于异硫氰酸酯中的一类。萝卜硫素是目前发现的蔬菜中抗癌效果较强的天然活性物质,同时,其在抗氧化、抗炎等方面也具有独特的作用[1]。萝卜硫素的制备方法主要包括合成法及酶法,前者需要使用大量的有毒有机试剂,且反应过程难以控制,副产物较多,在食品工业中未能得到广泛应用。而酶法从天然植物中提取的萝卜硫素安全性更高,更能满足市场对功能性食品配料安全性的需求。该法一般包括酶解和提取两个过程。酶解步骤中,GLS 经植物本身内源性黑芥子酶水解转化为萝卜硫素。而酶解产物的组成,以及萝卜硫素得率往往与酶解条件密切联系[2]。因此,目前大部分研究重点主要集中在如何调控酶解条件方面,包括pH、温度、上皮硫特异蛋白(ESP)活性,酶辅助因子(Fe2+、Na+、Ca2+)、外源激素、抗氧化剂、外源性黑芥子酶等[3-4]。而在提取过程中,较多研究使用丙酮及二氯甲烷等有机溶剂,而乙酸乙酯的毒性相对较弱,在萝卜硫素的提取应用中具有一定的研究价值[5]。此外,国内外对于萝卜硫素植物来源的研究主要集中在十字花科芸薹属植物西兰花,而有关萝卜硫素其他植物来源的研究相对较少。
萝卜(Raphanus sativusL.)属于十字花科萝卜属植物,在我国资源丰富,其根部及叶部具有一定的营养及药用价值,而其种子也被称为“莱菔子”,更是我国一种传统的药食两用中药材[6]。已有研究表明,萝卜根茎及种子中含有一定量的萝卜硫素,是制备萝卜硫素的潜在天然来源[7-8]。由于酶法制备萝卜硫素极易受酶解条件的影响,往往需对酶解工艺进行优化。已有少数学者研究了酶解萝卜制备萝卜硫素的工艺优化,例如,阳晖等[9]发现胭脂萝卜废渣中提取萝卜硫素的最优酶解工艺为:酶解温度31 ℃,内源酶酶解时间7.7 h,pH5.6,VC添加量为0.24 mg/kg,此时萝卜硫素得率为561.30 μg/g。而王兆玲等[10]发现萝卜芽苗中提取还原型萝卜硫素的最佳酶解条件为:缓冲溶液的pH 为5.79,酶解时间为49 min,料液比为33.12%,VC含量为6.9 mmol/L,在此条件下还原型萝卜硫素的得率为7.39 mg/g。但目前尚无关于酶解萝卜籽制备萝卜硫素的工艺优化方面的报道。此外,在作为功能食品配料使用时,胃肠消化是影响植物提取物活性成分对机体发挥生物效应的关键因素[11]。而有关萝卜籽萝卜硫素在胃肠消化过程中含量及抗氧化活性变化规律的研究鲜有报道。综上,本研究以来自大红萝卜(RedRaphanus sativus)的种子为原料,在添加自制外源芥子酶,超声及微波多种辅助条件下,利用内源性芥子酶进行GLS 酶解转化,以乙酸乙酯为溶剂提取萝卜硫素。利用单因素实验及响应面分析(Response surface methodology,RSM)法优化酶解条件,建立一种安全、可靠的萝卜籽萝卜硫素酶法提取工艺。并使用体外胃肠消化模型对提取物中萝卜硫素含量及其抗氧化活性的体外消化规律进行了研究。旨在为天然萝卜硫素的制备方法,以及萝卜籽的高附加值利用提供理论依据。
1 材料与方法
1.1 材料与仪器
‘红丰一号’萝卜种子 购于天津农科院,于2022 年采集;芥菜籽 购于当地市场;萝卜硫素对照品(纯度>90%,HPLC) 购于天津尖峰天然产物有限公司;胃蛋白酶(30000 U/g)、胰蛋白酶(250 U/g)购于上海源叶生物科技有限公司;铁氰化钾、1,1-二苯基-2-三硝基苯肼、硫酸亚铁、邻苯三酚、乙酸乙酯 均为分析纯,购于天津明川生物科技公司。
1100 系列高效液相色谱仪 安捷伦科技有限公司(中国);RE-201D 旋转蒸发仪 郑州科文仪器设备有限公司;BK-FD10S 型真空冷冻干燥机BioBASE 博科集团;FA-1004 电子分析天平 绍兴景迈仪器设备有限公司;VGT-1730QG 超声波清洗机 广东固特科技有限公司;CYWB-10 微波消解仪 杭州川一实验仪器有限公司;HH-4 电热恒温水浴锅 安瑞医疗器械有限公司;FW-100 高速万能粉碎机 天津泰斯特仪器有限公司;7200 系列可见光分光光度计 尤尼柯(上海)仪器有限公司。
1.2 实验方法
1.2.1 萝卜硫素的提取方法
1.2.1.1 外源黑芥子酶液制备 参考胡翠珍等[12]的方法制备黑芥子酶液并测定其活性。芥菜籽粉碎,过60 目筛,取0.5 g 放入三角瓶中,再加入25 mL 蒸馏水,40 ℃条件下,360 W 超声波振荡20 min,过滤除杂,得黑芥子酶粗酶液,测得酶活为0.891 μmol/(min·g)。
1.2.1.2 萝卜硫素的制备 参考Tanongkankit 等[13]的方法,略作修改,如下:
前处理:0.2 g 萝卜种子样品在研磨机中粉碎,过40 目筛,并在55 ℃下加热5 min,然后立即在冰上冷却,以失活ESP。
脱脂:在培养箱摇动器中,用正己烷将种子粉脱脂一段时间,然后将剩余的种子粉在通风橱中干燥过夜。
酶解转化提取:脱脂后的种子样品添加10 mL芥子酶粗酶液,然后加入磷酸钾缓冲液(pH7.0)调节料液比(1:20 mg/mL),在酶解体系中加入不同量的抗坏血酸,并使用设计的温度和时间进行酶解转化,超声提取2 次,每隔5 min 超声一次,每次超声30 min。
微波提取:酶解后,置于微波炉中,37 ℃,500 W提取5 min,随后,按体积比1:1 加入乙酸乙酯萃取3 次,合并乙酸乙酯,4000 r/min 离心20 min,过滤乙酸乙酯层。在40 ℃下,用旋转蒸发仪旋转浓缩至乙酸乙酯完全挥发,得膏状萝卜硫素粗提物,甲醇溶解,冷藏待用。
纯化:将萝卜硫素粗提物用少量丙酮溶解后,过0.45 μm 有机膜去除杂质后,上硅胶SPE 柱(2.5 cm×100 cm,柱体积 400 mL),以丙酮为洗脱溶剂,洗脱体积一般为2 个保留体积(约400 mL),洗脱流量为2 mL/min,大约每2 h 收集一次馏分(5~10 mL/管),采用薄层色谱法(Thin-Layer Chromatography,TLC)检测含有萝卜硫素的馏分,合并这些馏分,冷冻干燥后得到纯化后萝卜硫素样品。
1.2.2 萝卜硫素的HPLC 测定
1.2.2.1 HPLC 检测 参照卢旭等[14]的方法,略作改进。具体HPLC 条件为:色谱柱为SB-C18柱(150 mm×4.6 mm,5 μm),流动相为乙腈-乙酸(15:85);流速设置为0.6 mL/min。进样体积为10 μL;柱温为35 ℃,使用紫外检测器,检测波长为254 nm。
1.2.2.2 萝卜硫素标准曲线绘制 取5 mg 萝卜硫素标准品溶解于5 mL 甲醇,配成终浓度为500、250、125、62.5、31.25、0 μg/mL 的标准溶液。浓度由低到高依次进样,进样量为10 μL,每个浓度重复3 次。按照以上HPLC 条件进行分析。以萝卜硫素质量浓度为纵坐标Y,以萝卜硫素出峰面积为横坐标X,进行线性回归,得回归方程:Y=0.00003X-0.3102,R2=0.992。
1.2.2.3 萝卜硫素得率计算:分别测定各样品提取液中的萝卜硫素含量,根据回归方程计算提取液中萝卜硫素质量浓度,各样品萝卜硫素得率按公式(1)计算:
式中:C 为萝卜硫素提取液质量浓度(mg/mL);V 为复溶溶液体积(mL);m 为样品的质量(g)。
1.2.3 单因素实验
1.2.3.1 酶解时间对萝卜硫素得率的影响 准确称取萝卜种子样品0.2 g,在固定外源酶添加量10 mL,400 W 超声30 min/次(2 次),500 W 微波5 min 的基础上,将酶解温度、VC添加量分别设定为35 ℃、1.5 mg/g,酶解时间分别调为10、20、30、40、50、60 min,在该条件下进行实验,考察酶解时间对萝卜硫素得率的影响。
1.2.3.2 酶解温度对萝卜硫素得率的影响 准确称取萝卜种子样品0.2 g,在固定外源酶添加量10 mL,400 W 超声30 min/次(2 次),500 W 微波5 min 的基础上,将酶解时间、VC添加量分别设定为20 min、1.5 mg/g,酶解温度分别调为25、30、35、40、45、50、55 ℃,在该条件下进行实验,考察酶解温度对萝卜硫素得率的影响。
1.2.3.3 VC添加量对萝卜硫素得率的影响 准确称取萝卜种子样品0.2 g,在固定外源酶添加量10 mL,400 W 超声30 min/次(2 次),500 W 微波5 min 的基础上,将酶解时间、酶解温度分别设定为20 min、35 ℃,VC添加量分别调为0.1、0.4、0.7、1.0、1.5、2.0、3.0 mg/g,在该条件下进行实验,考察VC添加量对萝卜硫素得率的影响。
1.2.4 响应面Box-Behnken 试验设计 采用三因素三水平Box-Behnken 设计(BBD)。自变量的范围及水平见表1。
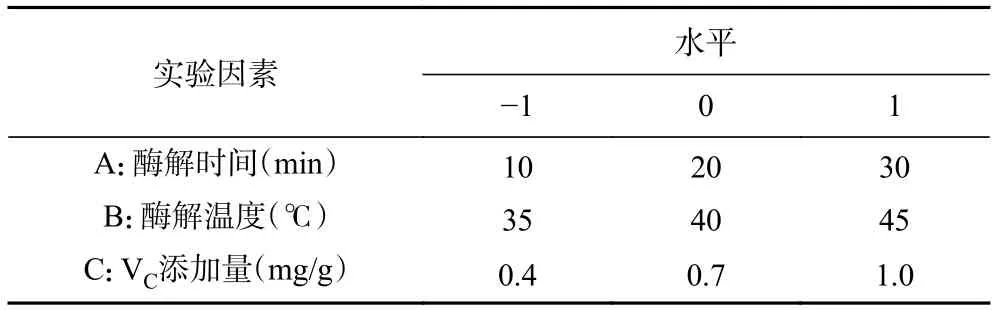
表1 响应面分析因素和水平Table 1 Response surface analysis factors and levels
1.2.5 验证实验 在实验的取值范围内,以最大得率为目标,利用Design-Expert 8.0.6 Trial 软件中的Optimization 功能,确定最优酶解工艺条件。使用修正工艺条件,重复3 次实验对响应面优化工艺进行验证。
1.2.6 体外模拟胃肠消化 在确定的最优酶解工艺条件下,按照上述提取条件制备萝卜硫素乙酸乙酯提取物,并参考Lü等[15]的方法对其进行体外消化实验,主要步骤如下:
胃消化:将1 g 提取物样品溶解于50 mL 甲醇,用1 mol/L 的盐酸溶液调节pH 到2.0 后,加入胃蛋白酶溶液(0.48 g 胃蛋白酶溶解于15 mL 0.1 mol/L HCl)12 mL,恒温水浴振荡(37 ℃,160 r/min)2 h 模拟体外胃内消化,消化过程避光进行。消化结束后,另一部分在沸水浴中加热5 min 终止酶解反应,冷却,5000 r/min 离心10 min,收集上清液及残渣待测。
肠消化:胃液消化结束步骤以后,取30 mL 胃消化液,用NaOH 调节pH 到7.8,加入胰蛋白酶液(0.288 g 胰蛋白酶溶于12 mL pH7.0 的0.01 mol/L PBS 缓冲液中)8 mL,在避光条件下恒温水浴振荡2 h 模拟肠道消化(37 ℃,160 r/min),模拟消化结束后,在沸水浴中加热5 min,终止酶解反应,冷却,5000 r/min 离心10 min,收集上清液及残渣待测。
1.2.7 胃肠消化对清除自由基能力的影响
1.2.7.1 DPPH 自由基清除实验 参照郭丽萍等[16]的方法,略有改动,具体步骤:取2 mL 消化液样品,加入2 mL 现配的DPPH 乙醇溶液(0.1 mmol/L),混合均匀,室温下避光反应35 min,在517 nm 波长下测其吸光度值,实验重复三次,按公式(2)计算DPPH 自由基清除率。
式中:A0为DPPH 乙醇溶液吸光度值;A1为DPPH 乙醇溶液和样品液反应液吸光度值;A2为乙醇与样品溶液混合液吸光度值。
1.2.7.2 ABTS+自由基清除实验 参考龙芳[17]的方法,略有改动,如下:ABTS 溶液(7 mmol/L)和K2S2O8(2.45 mmol/L)1:1(v/v)混合。在室温避光条件下放置16 h,用乙醇稀释混合溶液至734 nm 波长处吸光值在(0.700±0.005)范围内,即为ABTS+工作液。取50 μL 消化液样品,加入0.15 mL ABTS+工作液,室温避光静置6 min 后测定734 nm 处的吸光值。按照式(3)计算清除率。
式中:As为样品和ABTS+工作液吸光值;Ab为无水乙醇替代ABTS+工作液的吸光度;A0为无水乙醇替代样品的吸光度。
1.2.7.3 OH 自由基清除实验 参考Wang 等[18]的方法,略有改动。取1.0 mL 消化液样品,加入2.0 mL 水杨酸乙醇溶液(6 mmol/L)和2.0 mL FeSO4(6 mmol/L)混合均匀,再加入0.1 mL H2O2溶液(6 mmol/L)于试管中,混匀,在37 ℃水浴中反应30 min,在510 nm 波长测定吸光度,按照公式(4)计算羟基自由基清除率,结果以羟基自由基清除率(%)表示。
式中:A1为样品吸光度值;A2为不加显色剂H2O2吸光度值;A0为空白吸光值。
1.3 数据处理
2 结果与分析
2.1 单因素实验结果
2.1.1 酶解时间对萝卜硫素得率的影响 如图1 所示,萝卜硫素得率在酶解20 min 时达到最大(1.55 mg/g),显著高于10 min 及40~60 min(P<0.05)。该结果表明,酶解时间小于20 min 时,随着酶解时间的延长,萝卜硫素得率增高,而随着酶解时间过长,得率反而下降。酶解时间过短,萝卜硫素提取不充分,得率较低。随着酶解时间的增加,萝卜硫素被充分提取,得率增高。但酶解时间过长,萝卜硫素的降解量超过其生成量,导致得率降低[19]。通过统计学分析,酶解时间对萝卜硫素得率的影响有显著差异(P<0.05),其中酶解时间20 min 时极显著,选取酶解时间10、20、30 min 进行响应面试验。
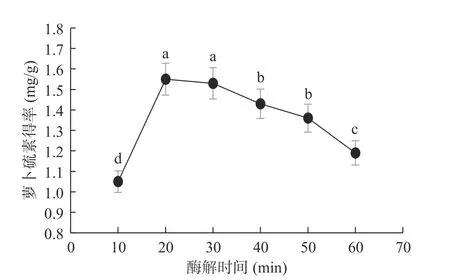
图1 酶解时间对萝卜硫素得率的影响Fig.1 Effect of enzymatic hydrolysis time on extraction yield of sulforaphane
2.1.2 酶解温度对萝卜硫素得率的影响 如图2 所示,随温度升高,萝卜硫素得率先增加后降低(P<0.05),在40 ℃条件下得率达到最高值。说明40 ℃为外源芥子酶的最适反应温度。这和Gonzalez 等[20]的研究结果相似。随着温度的继续升高,萝卜硫素得率不断降低。在适宜的温度条件下,芥子酶活性高,有利于硫代葡萄糖苷水解生成萝卜硫素[21];但当温度过高时,芥子酶活性大大降低,或高温使生成的萝卜硫素部分分解[2],从而导致得率下降。通过统计学分析,酶解温度对萝卜硫素得率的影响有显著差异(P<0.05),其中酶解温度40 ℃时极显著,选取酶解温度35、40、45 ℃进行响应面试验。
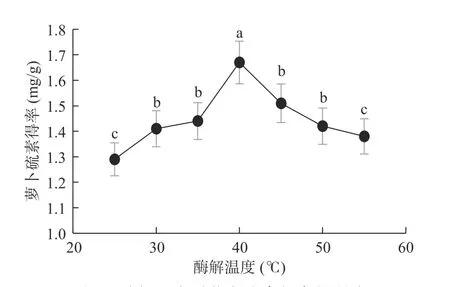
图2 酶解温度对萝卜硫素得率的影响Fig.2 Effect of enzymatic hydrolysis temperature on extraction yield of sulforaphane
2.1.3 VC添加量对萝卜硫素得率的影响 如图3 所示,当VC添加量达到0.7 mg/g 时得率最高,达到1.75 mg/g,显著高于VC添加量为0.1、0.4、2.0 及3.0 mg/g 条件下的萝卜硫素得率(P<0.05)。该结果表明较低和较高的VC添加量均不利于萝卜硫素提取。VC是芥子酶的非竞争性激化剂,添加VC浓度适宜,有利于异硫氰酸盐的生成,提高萝卜硫素生成量[22]。而VC添加量过高时,则对芥子酶活性有一定的抑制作用[23],从而导致萝卜硫素的生成量降低。通过统计学分析,VC添加量对萝卜硫素得率的影响有显著差异(P<0.05),其中VC添加量0.7 mg/g 时极显著,选取VC添加量0.4、0.7、1.0 mg/g 进行响应面试验。
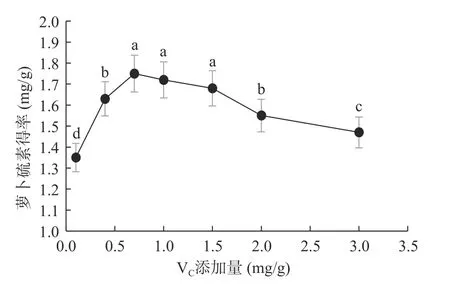
图3 VC 添加量对萝卜硫素得率的影响Fig.3 Effect of VC addition on extraction yield of sulforaphane
2.2 响应面试验结果及分析
萝卜硫素得率(Y)被认为是自变量组合的响应值,各自变量因素对响应值的影响可以由以下二次方程解释:
式中,β0是偏移项,βi、βii和βij分别是线性、二次和交互回归系数。
所有试验设计和数据分析均采用试用版软件Design Expert(Version 12.0)进行,以估计自变量的响应值。应用 Box-Behnken 建立了三因素三水平的响应面优化试验,结果见表2。用Design Expert 12.0 软件拟合得到如下编码值回归方程:
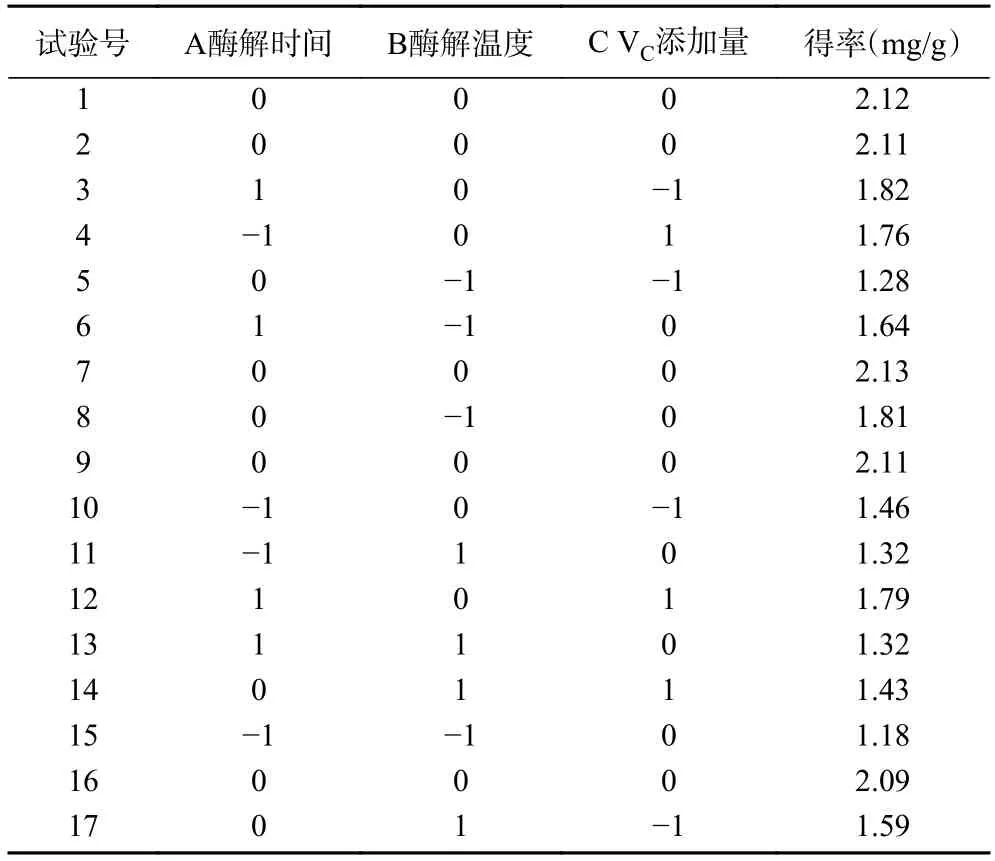
表2 BBD 试验设计及结果Table 2 Experimental design and results of BBD
方差分析结果如表3 所示。模型F=322.65(P<0.001),表明该模型方程具有较高的精确度。失拟项通常用来表示所用的模型方程和实验的拟合程度,即二者差异的程度,而回归模型的失拟项F=5.11(P>0.05),说明失拟项误差不显著,该响应面模型的误差较小。模型的校正决定系数为R2adj=0.9945,决定系数R2=0.9976,表明该模型能较好地解释响应值的变化,该模型能较好地描述各因素与响应值之间的真实关系。总的来说,该模型方程可以较好地预测萝卜硫素得率。一次项A、B、C 对得率均具有极显著的影响(P<0.01)。二次项(A2、B2、C2)及交互作用项(AB、AC、BC)均极显著(P<0.01)。各因素的影响顺序为:A(酶解时间)>C(VC添加量)>B(酶解温度)。
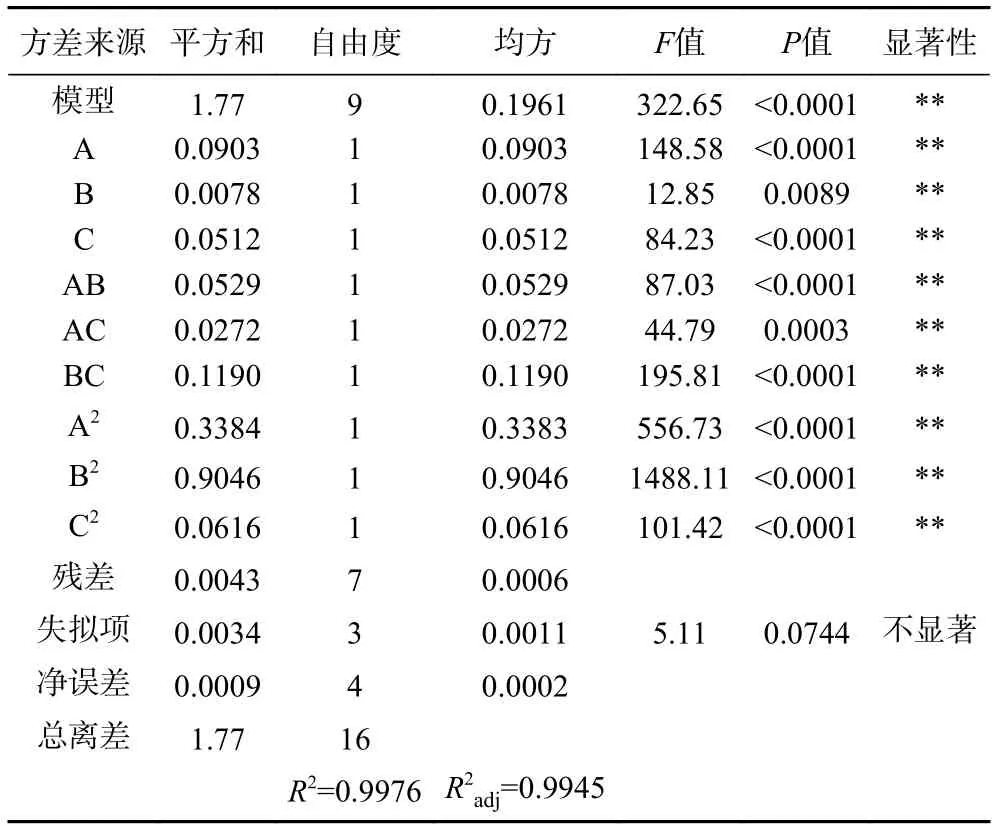
表3 萝卜籽萝卜硫素得率回归分析Table 3 Regression analysis of sulforaphane yield of Raphanus sativus seeds
2.3 响应面分析
响应面图可以形象地反映工艺条件对响应值影响的交互作用,一般响应曲线越陡峭,因素的影响越显著,而走势越平滑,影响越小。由图4 所示,得率曲线随着各因素(酶解时间、酶解温度、VC添加量)的变化规律相似,在这三个自变量取值接近0 编码值时,得率值最大,但当各因素水平超过0 编码值时,得率反而降低。适当的延长酶解时间和提高酶解温度,有利于萝卜籽中的GLS 向萝卜硫素的酶解和转换,但过高的时间和温度可能导致芥子酶的损失,不利于GLS 的酶解[24]。VC能保护生成的萝卜硫素,避免其氧化损失,提高萝卜硫素得率[25]。而过多的VC可能改变提取体系的pH,从而导致得率降低,其影响规律有待于进一步研究。
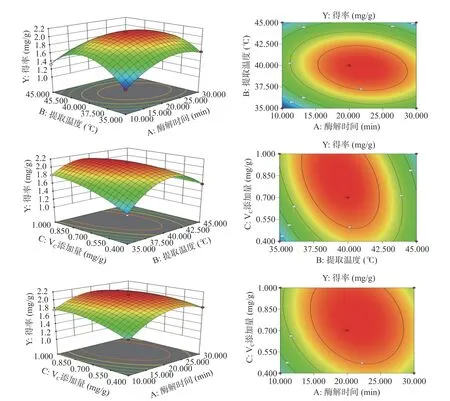
图4 各因素交互作用响应面图与等高线图Fig.4 Response surface and contour plots of the interactive effects of various factors
此外,各因素的响应面图颜色由绿变红,颜色变化差异较大,且存在最高点。各等高线图的中心区域均呈椭圆形,以上结果表明各因素对萝卜硫素得率的影响存在显著的交互作用。其中,酶解时间与其他两个因素的响应面图中心区域呈现较为显著的椭圆形,且交互项F值较高,表明交互作用较为明显。郭彩慧等[26]研究发现,酶解时间与酶解温度的交互作用对西兰花萝卜硫素提取量的影响较大。其机制有待于进一步研究。
2.4 验证实验
进一步通过回归分析得到萝卜硫素的理论最佳酶解工艺条件为:酶解时间21.59 min、酶解温度为39.39 ℃、VC添加量为0.809 mg/g,萝卜硫素得率为2.14 mg/g。考虑到实践操作的可行性,将实际提取条件调整为酶解时间22 min、酶解温度40 ℃、VC添加量为0.8 mg/g。平行3 次实验验证优化工艺的真实性,得到实际萝卜硫素得率为2.11±0.02 mg/g,与理论值接近,相对误差为1.40%,说明优化的酶解工艺准确可靠,对实际生产具有指导意义。
2.5 体外模拟胃肠消化中萝卜硫素的变化
体外胃肠消化模型能反映生物活性物质在人体胃肠道消化过程中的生物利用情况,被广泛应用于植物活性成分生物可及性研究[27]。本研究在最优酶解条件下制备萝卜籽乙酸乙酯提取物,并采用体外消化模拟模型评价了胃肠消化对提取物中萝卜硫素含量的影响。结果如图5A 所示,未消化的提取物中萝卜硫素含量为1.85±0.02 mg/g,经过体外消化实验后,不可溶残渣中的萝卜硫素含量约为0.4 mg/g,而胃肠消化液中萝卜硫素的含量分别1.47±0.05 和1.41±0.03 mg/g,保留率分别为79.64%±1.58%、76.22%±2.17%,差异不显著(P>0.05)(图5B)。胃消化液及肠消化液中的萝卜硫素含量差异不显著(P>0.05)。肠消化液中萝卜硫素一般容易被机体吸收或被肠道菌群利用,该结果表明萝卜籽萝卜硫素有较好的生物可及性。以往类似研究也表明西兰花籽萝卜硫素经唾液及胃肠消化后,能有效到达肠道被肠道菌群利用,具有较好生物可及性[28]。此外,该结果还提示胃消化对提取物中萝卜硫素的破坏较强,其可能原因与萝卜硫素被胃酸及胃蛋白降解或转化有关[29-30]。
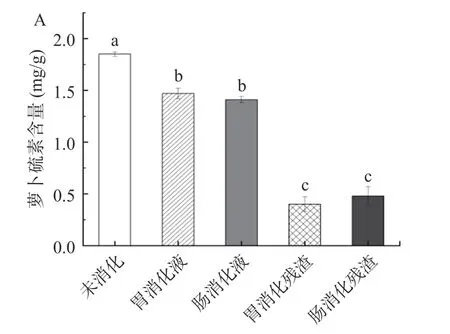
图5 萝卜籽乙酸乙酯提取物在体外模拟胃肠消化中萝卜硫素的变化Fig.5 Changes of sulforaphane in ethyl acetate extracts from Raphanus sativus seeds during different stages in vitro simulated digestion
2.6 体外模拟胃肠消化中抗氧化活性的变化
单一的抗氧化检测方法无法充分评价物质抗氧化活性,一般使用多种抗氧化检测方法共同解释其抗氧化能力。因此,本研究采用体外胃肠消化模型,结合DPPH、ABTS+及OH 自由基清除实验综合检测了提取物在模拟消化过程中的抗氧化活性变化规律,结果见图6 所示,未消化组中,ABTS+、DPPH、OH 三种自由基清除率分别为64.80%、44.46%及20.63%,提取物对这三种自由基均表现出有一定的清除作用。以往研究已经证实了萝卜硫素具有较强的自由基清除能力[31],因此,推测萝卜籽提取物的抗氧化活性与萝卜硫素有关。在胃消化液中,这三种自由基清除率分别为54.25%、33.90%及15.07%,均显著低于未消化组(P<0.05),其中DPPH 自由基的清除率下降率最大,达到了23.75%。而在肠消化液中,三种自由基清除率分别降低至42.36%、32.70%及15.95%,与胃消化组比较,差异不显著(P>0.05)。胃肠消化过程中自由基清除率与萝卜硫素含量的变化趋势相符,进一步提示提取物抗氧性的变化与萝卜硫素有关。但以往有研究表明萝卜籽提取物中含有包括萝卜硫素在内的多种抗氧化活性成分[32],本研究萝卜籽乙酸乙酯提取物中的萝卜硫素含量仅约为1.85 mg/g,是一种混合组分,其表现的抗氧化活性是该体系中所有组分综合作用的结果,尚不能阐明其中具体的活性组分及其作用机制,因此有必要对其进行进一步分离纯化,对其抗氧化活性进行分析。
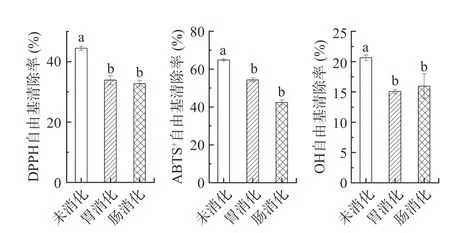
图6 萝卜籽乙酸乙酯提取物在体外模拟消化中DPPH、ABTS+和OH 自由基清除率变化Fig.6 DPPH,ABTS+ and OH free radical scavenging rate in ethyl acetate extracts from Raphanus sativus seeds during different stages in vitro simulated digestion
3 结论
制备萝卜籽萝卜硫素最优酶解工艺:酶解时间22 min,酶解温度40 ℃,VC添加量0.8 mg/g,在此最佳酶解条件下,萝卜硫素得率为2.11±0.02 mg/g。得到的二次回归模型拟合度高。萝卜籽乙酸乙酯提取物中萝卜硫素成分在胃肠消化过程中出现一定程度的降解或转化,但仍有约80%的该成分得到了保留。胃液消化对萝卜硫素的影响高于肠液消化。三种自由基(ABTS+、DPPH、OH 自由基)清除率在胃肠消化过程中的变化与萝卜硫素含量变化规律一致。本研究探索了酶法制备萝卜籽萝卜硫素的最优酶解工艺参数,建立的模型方程能可靠预测萝卜硫素得率。萝卜籽萝卜硫素提取物经消化,萝卜硫素释放性较好,具有较好的生物可及性及抗氧化活性。本研究不仅对萝卜硫素的实际生产具有一定的指导意义,同时也为提高萝卜籽经济附加值提供了一定的理论依据。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

