基于体外消化与发酵模型的多花黄精多糖对肠道菌群的影响
刘晓丹,肖 瀛, ,周建金,高 雅,王伊朋,唐庆九,俞 苓
(1.上海城建职业学院食品与旅游学院,上海 201415;2.三明市农业科学研究院,福建省(山区)作物遗传改良与创新利用重点实验室,福建三明 365051;3.上海应用技术大学香料香精化妆品学部,上海 201418;4.上海市农业科学院食用菌研究所,上海 201403)
近年研究表明肠道微生物与人类健康密切相关,肠道细菌生态系统对人体疾病、免疫调控等方面起着重要的作用[1-3]。从肠道微生物和代谢产物的角度诠释益生元对肠道微生物群的调节作用已成为研究的热点[4-6]。已有研究表明中药中的有效成分如多糖,能够对肠道菌群失调起到一定调节作用[7]。
多花黄精(Polyonatum cyrtonemaHua.)作为一种历史悠久且药食同源的药材[8],是中国药典收载的黄精基原植物之一,其多糖具有较好的药理作用和应用价值[9-12]。多花黄精多糖(Polyonatum cyrtonemaHua.Polysaccharide,PCP)的分子量为2~7 kDa,主要由果聚糖及半乳聚糖组成[13-14]。研究发现PCP 的结构组成与菊粉(Inulin,INU)结构相似[15],INU 是一种优质的益生元和膳食纤维,不会被胃肠道内源酶消化,能够调节肠道菌群平衡[16],因此,本研究推测PCP 具有潜在的抗消化性和益生元活性。但目前对于PCP 对肠道微生物的影响少有文献报道,目前仅有研究通过单一菌株的培养模式下,发现多花黄精多糖对双歧杆菌(Bifidobacterium)、乳杆菌(actobacillus)等有益菌有着促进生长的作用[16],但这种研究方式没有考虑肠道中多种微生物以及代谢物之间的相互作用。
因此,本研究以从多花黄精中提取的多糖为原料,以INU 作为阳性对照,通过体外模拟消化模型研究其抗消化特性,并采用体外厌氧发酵模型,探究PCP 对pH、微生物结构数量及代谢产物短链脂肪酸的影响,为多花黄精产品在食品中的推广应用提供基础数据,为多花黄精益生元食品的开发提供参考依据。
1 材料与方法
1.1 材料与仪器
多花黄精(福建省三明市宁化县人工栽培,品种编号 FJ-105-1) 福建省三明农科院提供;无水乙醇AR,上海泰坦(Titan)科技股份有限公司;乙酸、丙酸、丁酸等标准品 >99%,上海梯希爱(TCI)化成工业发展有限公司;α-淀粉酶(100 U/mg)、胃蛋白酶(3000 U/g)、胃脂肪酶(3000 U/g)、胰酶(4000 U/g)美国西格玛奥德里奇公司;胆盐 阿拉丁试剂(上海)有限公司;DNAzol 基因组DNA 快速提取试剂盒 上海美吉逾华生物医药科技有限公司;其他试剂国药集团化学试剂有限公司;粪便样品 年龄为22~25 岁的志愿者(男性、女性各三人,签署参与本研究项目的知情同意书)的粪便,所选志愿者身体状况良好、健康,饮食正常,6 个月内无肠道疾病,且2 周内未服用过益生菌或抗生素;发酵培养基的制备[17]0.1 mol/L 无菌磷酸盐缓冲液1 L(pH6.8)2 g 蛋白胨,2 g 酵母浸提物,0.1 g NaCl,0.04 g K2HPO4,0.04 g KH2PO4,0.01 g MgSO4·7H2O,0.01 g CaC12·6H2O,2 g NaHCO3,2 mL 吐温-80,0.02 g 血红素,10 μL 维生素K1,0.5 g 胆盐,0.5 g 半胱氨酸。
XMTD-204 型恒温水浴锅 天津市欧诺仪器有限公司;Infinite M200PRO 型多功能酶标仪 奥地利帝肯有限公司;VS-8401 型超净操作台 上海博讯实业有限公司;LRH-250 型生化培养箱 上海一恒科技有限公司;FE-28 型pH 计 上海梅特勒-托利多仪器有限公司;TQ8040 型气相色谱仪 日本岛津公司;TGL-16M 型台式冷冻离心机 湖南湘仪实验室仪器开发有限公司。
1.2 实验方法
1.2.1 黄精多糖的制备 取干燥多花黄精生品粉碎,过60 目筛,按料液比1:25(g/g)加水,于80 ℃加热2 h,4000 r/min 离心15 min 收集上清,加入无水乙醇,使提取液中乙醇浓度达到75%,于4 ℃过夜沉淀,离心(6000 r/min,20 min)收集沉淀后冻干,即获得水提多糖[18]。制备的多糖经蒽酮硫酸法[19]分析提取PCP 多糖含量为83.1%,其它组分包括糖醛酸(8.8%)、蛋白质(3.6%)、多酚类(4.5%)。PCP 多糖经凝胶渗透色谱(Gel Permeation Chromatography,GPC)[20]分析其Mw 为4.2 kDa,多糖经过三氟乙酸水解,高效液相色谱仪(High Performance Liquid Chromatography,HPLC)测定单糖组成[21]为葡萄糖71.21%、木糖 13.21%、半乳糖4.57%、甘露糖4.47%、岩藻糖 4.15%、果糖2.39%。
1.2.2 黄精多糖的体外模拟消化实验
1.2.2.1 模拟口腔、胃肠道消化 模拟唾液、模拟胃液和模拟小肠液及三段式体外消化模型参考文献[22]的方法并略作修改,以INU 作为对照。
模拟口腔消化:用HCl(6 mol/L)将模拟唾液pH 调至6.8,在37 ℃的水浴中预热0.5 h 后,将50 mL 多糖样品(15.0 mg/mL)、CaCl2溶液(0.25 mL,0.3 mmol/L)和α-淀粉酶溶液(75 U/mL,5 mL)加入40 mL 模拟唾液中,加入超纯水定容至100 mL 后于37 ℃水浴孵育5 min,后用HCl(6 mol/L)将pH调至3.0。
模拟胃消化:将80 mL 模拟胃液于37 ℃水浴中预热,加入上一阶段模拟口腔消化液、CaCl2溶液(0.05 mL,0.3 mmol/L)、胃蛋白酶溶液(2000 U/mL,5 mL)、胃脂肪酶溶液(60 U/mL,5 mL)和超纯水补充至100 mL,在37 ℃下孵育4 h。用NaOH(6 mol/L)将pH 调至7.0。
模拟肠道消化:在37 ℃水浴中预热40 mL 模拟小肠液,加入上一段模拟消化液、胆盐溶液(25 mL,10 mmol/L)、CaCl2溶液(0.4 mL,0.3 mmol/L)、胰酶溶液(5 g,100 U/mL)和超纯水补充至200 mL,37 ℃孵育6 h,沸水灭活酶。在模拟消化培养基中加入超纯水作为空白对照组。
1.2.2.2 总糖和还原糖测定 将胃模拟消化4 h 和小肠模拟消化6 h 样品分别测定总糖和还原糖含量,总糖含量采用苯酚硫酸法测定[23],分别取0、0.1、0.2、0.4、0.6、0.8、1.0 mL 葡萄糖标准溶液(0.1 mg/mL)于试管中,用蒸馏水补足至1 mL,混匀后加入0.5 mL 5%苯酚溶液混匀,再加入2.5 mL 浓硫酸溶液,混匀后放于沸水浴15 min,冷却后于490 nm 处检测吸光度,获得标准曲线为y=9.6407x+0.0353(R2=0.999),样品加样量为1 mL,操作过程同前,根据标准曲线计算出总糖含量。还原糖含量采用3,5-二硝基水杨酸(DNS)方法测定[23],分别取0、0.2、0.4、0.6、0.8、1.0 mL 葡萄糖标准溶液(1 mg/mL)于定容管中,用蒸馏水补足至2 mL,然后加入3 mL DNS 试剂,混匀后沸水浴中加热5 min,冷却后用蒸馏水定容至25 mL,摇匀后在520 nm 处检测吸光度值,绘制标准曲线为y=1.2975x-0.0313(R2=0.997)。样品加样量为2 mL,操作过程同前,根据标准曲线计算出还原糖含量。
1.2.3 黄精多糖的体外厌氧发酵
1.2.3.1 粪便处理 将粪便取样器、一次性手套、镊子、牛皮纸、自封袋、EP 管离心管、试剂瓶等采样工具提前灭菌,在厌氧操作箱中将采集的6 位志愿者的新鲜粪便等量混合,取混合粪样10 g 加入到100 mL 无菌磷 酸盐缓冲液(PBS,pH6.8)中 按1:10 稀释,加几粒无菌玻璃珠涡旋振荡混匀配制成粪便悬液。稀释的粪液用4 层无菌纱布过滤取滤液为菌源液,所有新鲜粪便样品的采集和处理需在1 h 内完成。
1.2.3.2 体外厌氧发酵 体外厌氧发酵方法参考文献[24-25]并对方法进行一定的改进,以基础发酵液为空白对照组,以1%(w/v)INU 作为阳性对照,以1%(w/v)PCP 作为实验组,并以1:9(v:v)的接种量接入菌源液,于37 ℃厌氧培养箱内培养,每组实验5 个重复。分别在发酵 0、6、12、24 h 后取样,用0.4 mL 0.5%硫酸铜或20%乙腈停止微生物的发酵。
1.2.3.3 pH 的测定 厌氧发酵0、6、12、24 h 对空白对照组和实验组分别取样,使用pH 计对样品进行pH 的测定。
1.2.3.4 总糖和还原糖测定 对发酵0、6、12、24 h空白对照组和实验组分别取样,离心后(4000×g 离心15 min)取上清液,按1.2.2.2 方法,测定发酵液的总糖和还原糖的含量。
1.2.4 16S rDNA 基因及生物信息学分析 发酵24 h后的发酵液于8000×g 离心15 min,取离心后得到的菌泥沉淀,保存于-80 ℃冰箱中,用于肠道菌群测序。使用DNAzol 基因组DNA 快速提取试剂盒提取菌泥沉淀中肠道微生物中的DNA,用琼脂糖凝胶电泳(1%)对抽提的DNA 进行检测,检测合格的样品由上海美吉生物医药科技有限公司检测,通过Illumina MiSeq PE300 平台对进行肠道菌群进行测序(引物序列为:338F(5′-ACTCCTACGGGAGGC AGCAG-3′);806R(5′-GGACTACHVGGGTWTCT AAT-3′)),得到 16S rDNA 数据。
16S rDNA 数据分析方法:MiSeq/Novaseq 测序得到的PE reads 进行样本拆分后,首先根据测序质量对双端Reads 进行质控和过滤,同时根据双端Reads 之间的Overlap 关系进行拼接,获得质控拼接之后的优化数据。然后使用序列降噪方法(DADA2/Deblur 等)处理优化数据,获得ASV(Amplicon Sequence Variant)代表序列和丰度信息,使用Majorbio在线云平台(www.majorbio.com)对微生物数据进行α、β多样性的分析;运用ANOSIM 进行各组之间的多样性差异检验分析;采用 Kruskal-Wallis(KW)sum-rank test 进行物种组间差异显著性分析;对各组样本群落组成进行分类学可视化分析。
1.2.5 短链脂肪酸(SCFAs)的测定 样液使用0.22 μm 膜过滤,装入进样瓶待用。采用GC-MS 测定,色谱条件:岛津Rtx-WAX 色谱柱(30 m×0.25 mm,0.25 μm);进样口温度250 ℃;柱温100 ℃;离子源温度220 ℃;接口温度250 ℃,升温程序:100 ℃以7.5 ℃/min 的速率升温至140 ℃,保持4 min,再以60 ℃/min 升温至 200 ℃;样品进样量1 μL;载气He;分流比10:1;流速2 mL/min;溶剂延迟1.5 min;Q3 Scan 方式采集1.5 min 到9.5 min,质量扫描范围m/z 20.0~300.0。分别配制浓度梯度在0.25~32 mmol/L 范围内的乙酸、丙酸、丁酸标准溶液,采用外标法定量分析。
1.3 数据处理
本研究实验数据以平均值±标准差表示;运用SPSS 21.0 软件的单因素方差分析方法(ANOVA)进行显著性分析(P<0.05 表示差异有统计学意义);通过Origin2021 软件进行作图。高通量测序的原始数据进行质控、过滤、去嵌合体,得到有效数据,进行分类操作单元的划分,菌群结构差异及微生物种类差异通过美吉生物云平台分析。
2 结果与分析
2.1 黄精多糖的体外抗消化特性
通过模拟口腔、胃、小肠消化液,对PCP 进行体外消化,结果见表1。INU 和PCP 在三段消化过程中总糖含量几乎无变化(P>0.05),在口腔与小肠模拟消化后还原糖含量没有显著性变化(P>0.05)。在模拟胃消化过程中INU 还原糖含量显著升高(P<0.05),可能是在酸性环境下INU 的部分糖苷键断裂成为单糖或寡糖[26],少量多糖被降解为还原糖,而PCP 则无显著变化(P>0.05),表明INU 与PCP 具有一定的抗消化特性,且PCP 的抗消化能力更强,PCP 能够不被消化系统降解,进入结肠后可能被微生物利用并发酵,具有益生元的潜能。
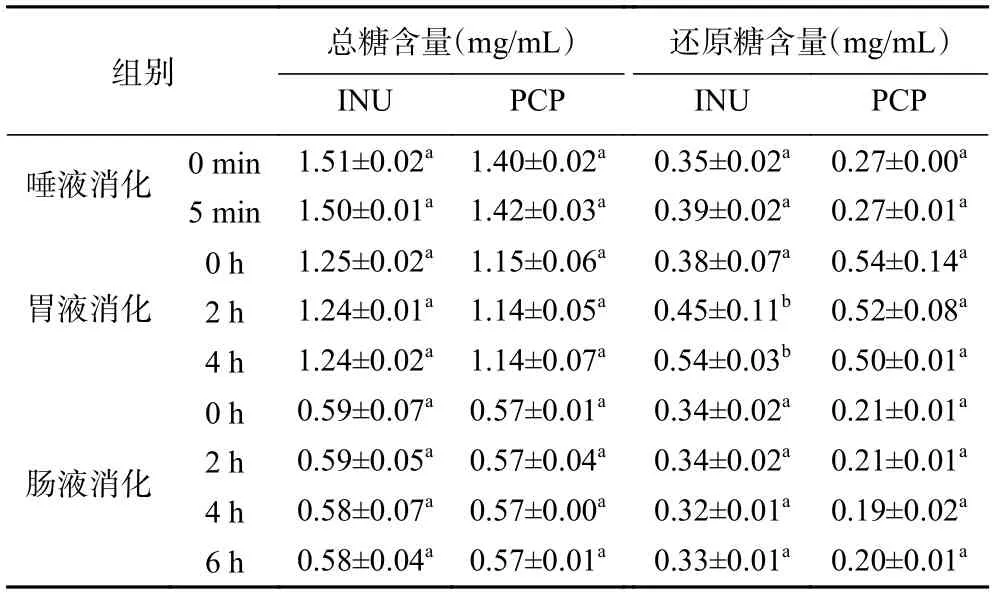
表1 不同消化时间的总糖含量、还原糖含量变化Table 1 Changes in total sugar content and reducing sugar content at different digestion times
2.2 发酵过程中pH、总糖和还原糖的变化
肠道微生物体外厌氧发酵和肠道内发酵在细菌数量、组成、多样性和代谢产物等方面都相似[27-28]。因此,本研究通过体外粪便菌群厌氧发酵模型,探究PCP 对肠道菌群调节与利用的影响,肠道微生物能够利用不被消化的碳水化合物,产生有机酸、短链脂肪酸等一系列代谢产物,进而改变肠道生境的酸碱度[29],不同时间的发酵液pH、总糖和还原糖含量结果如表2 所示。
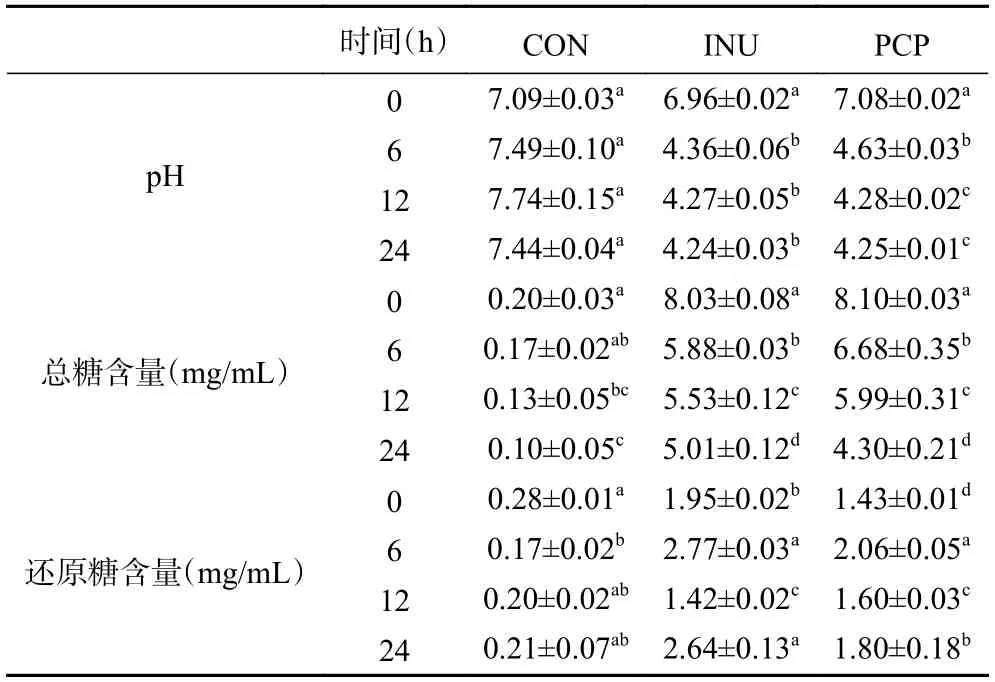
表2 体外发酵过程pH、总糖含量、还原糖含量变化Table 2 Changes in pH,total sugar content and reducing sugar content during in vitro fermentation
由表2 可知,空白对照组pH 变化没有显著性差异(P>0.05),而PCP 组和INU 组的pH 在6 h 急剧下降后趋于稳定,同时,前6 h 总糖含量快速下降且还原糖有一定上升,表明肠道微生物能够利用PCP、INU 作为碳源生长,并产生大量有机酸与短链脂肪酸类等代谢产物,导致整个发酵体系中的pH 下降;而后总糖含量下降趋缓,pH 也变化不明显,表明肠道微生物生长进入稳定期。上述结果表明,INU 和PCP 能够被肠道菌群作为碳源利用,促进产酸。
2.3 黄精多糖体外发酵对肠道菌群α、β 多样性的影响
本研究采用16S 多样性测序技术,进一步探究PCP 对肠道菌群结构的影响。Rank-Abundance 曲线能够说明物种丰度和群落均匀度。在水平方向,物种的丰富度由曲线的宽度来反映,物种的丰富度越高,曲线在横轴上的范围越大;曲线的平滑程度反映了样本中物种的均匀度,曲线越平缓,群落中物种分布越均匀[30]。如图1 所示,三组在ASV 等级水平上的宽度较大,说明物种丰富度高;从纵轴来看,曲线较平缓,说明样本中物种分布较为均匀,取得的测序结果适宜用于分析。
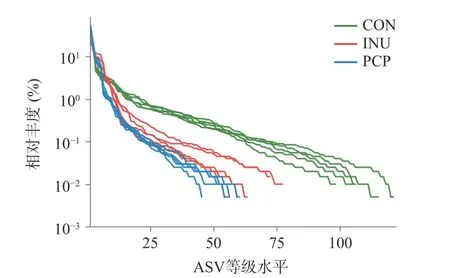
图1 体外发酵样本 Rank-Abundance 曲线Fig.1 Rank-Abundance curve of in vitro fermentation samples
Alpha 多样性分析可以表明肠道微生物群的均匀度和丰富度,ACE 指数与Chao1 指数反映菌群丰度,Shannon 指数和Simpson 指数反映菌群多样性[31]。由图2 可知,PCP 组、INU 组与CON 组相比,呈现类似的影响,Shannon 指数、ACE 指数与Chao1 指数显著降低(P<0.05),而Simpson 指数显著上升(P<0.05),这说明PCP 与INU 可降低肠道菌群的丰富度和多样性。这与先前INU 在小鼠实验的结果一致,可能由于其促进某些有益肠道菌群增殖有关[32]。
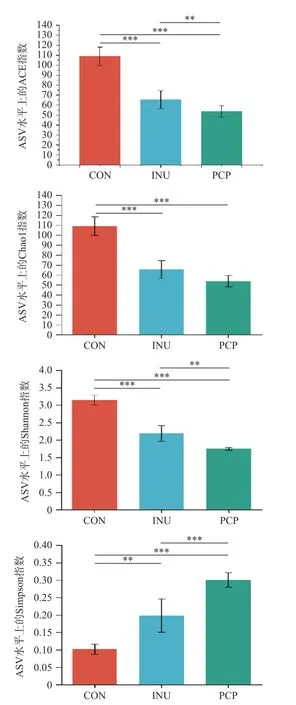
图2 体外发酵菌群α 多样性分析Fig.2 Alpha diversity of community by in vitro fermentation
主坐标分析(PCoA)代表了各组间肠道菌群的差异性,由图3 可知,主成分PC1 与PC2 占比分别为88.78%、7.04%。三组间区别明显,说明发酵24 h后,发酵液中的肠道菌群发生显著变化,表明PCP 能够调控肠道菌群组成和结构。此外,PCP 和INU 两组在PC1 轴位置相近,而在PC2 轴上距离较远,这表明两者对肠道菌群调控作用虽然有所差异但具有较大的相似性。
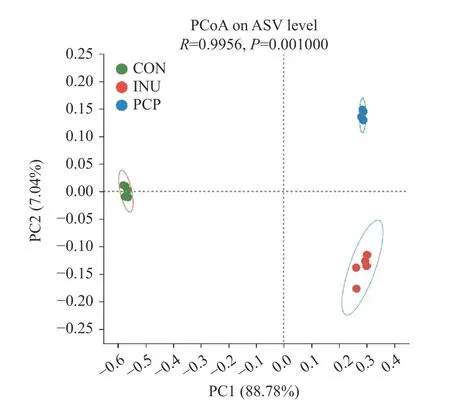
图3 体外发酵菌群β 多样性分析Fig.3 Beta diversity of community by in vitro fermentation
2.4 黄精多糖体外发酵对肠道菌群丰度的影响
如图4 所示,16S rDNA 基因测序表明了PCP基于体外发酵模型能够在门水平上改变肠道菌群组成。相对于CON 组,PCP 组和INU 组中厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)相对丰度显著增加(P<0.05),变形菌门(Proteobacteria)相对丰度显著减少(P<0.05)。厚壁菌门通常能够利用多糖产生SCFAs,并有助于抑制病原菌的增长[33]。放线菌门中包含益生菌如双歧杆菌,能够通过产生醋酸盐保护宿主免受肠道致病性感染[34]。变形菌门包括很多病原菌,如大肠杆菌、志贺氏菌等,易导致肠道微生物失调,与糖尿病、炎症和癌症正相关,进而影响宿主的机体健康[35]。
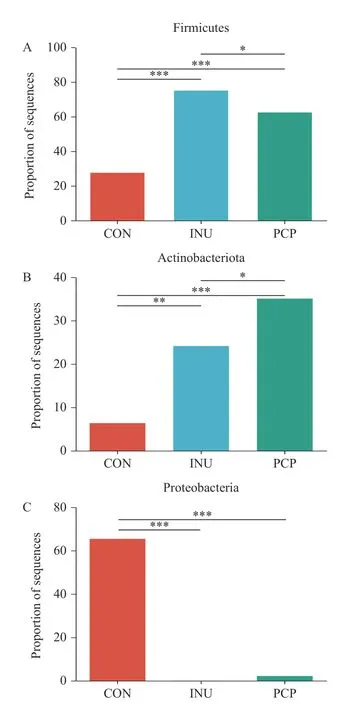
图4 采用K-W H 秩检验分析体外发酵24 h 后肠道微生物菌群门水平组成Fig.4 Analysis of intestinal microbial community composition at phylum level after in vitro fermentation for 24 h with Kruskal-Wallis H test
采用Student’st-test 检验对丰度前25 的菌属进行显著性差异比较分析,结果如图5 所示,INU 组或PCP 组相较于CON 组,巨单胞菌属(Megamonas)、双歧杆菌属(Bifidobacterium)、大肠杆菌属(Enterobacteriaceae)、志贺氏菌属(Escherichia-Shigella)、克雷伯氏菌属(Klebsiella)、肠杆菌属(Enterobacter)、肠球菌属(Enterococcus)、经黏液真杆菌属(Blautia)、丹毒丝菌属(Erysipelotrichaceae)、霍氏真杆菌属(Eubacterium_hallii_group)、普拉梭菌(Faecalibacterium)共10 种菌属均存在显著性差异(P<0.05)。与CON 组相比,INU 组的巨单胞菌属(Megamonas)和双歧杆菌属(Bifidobacterium)的相对丰度显著增加(P<0.05)、志贺氏菌属(Escherichia-Shigella)、克雷伯氏菌属(Klebsiella)、肠杆菌属(Enterobacter)、肠球菌属(Enterococcus)、丹毒丝菌属(Erysipelotrichaceae_UCG-003)等相对丰度显著降低(P<0.05)。通过对比PCP 组与CON 组显著差异菌属,可以发现,PCP 组在属水平上对菌群调节作用与INU 相似,PCP 与INU 两组中最为优势为巨单胞菌属(Megamonas)和双歧杆菌属(Bifidobacterium)。研究表明,巨单胞菌的增殖可以通过竞争能量摄入抑制有害细菌的生长,其主要代谢产物为乙酸和丙酸[36]。双歧杆菌和肠球菌属是益生菌,具有增强免疫,阻止有害菌黏附以及帮助宿主消化吸收营养物质等多种生理功能[37-38]。因此,PCP 可能通过促进双歧杆菌和肠球菌等有益菌的增殖,抑制大肠杆菌、志贺氏菌的增殖,来调节肠道微生态并发挥益生元活性。此外,PCP 与INU 对肠道菌群调节趋势相似但调节能力有所差异,PCP 组中双歧杆菌属(Bifidobacterium)的相对丰度显著高于INU 组(P<0.05),除巨单胞菌属(Megamonas)、拟杆菌属(Bacteroides)、戴阿利斯特杆菌属(Dialister)外,PCP 组与INU 组的其它主要优势菌群均有显著差异(P<0.05)。
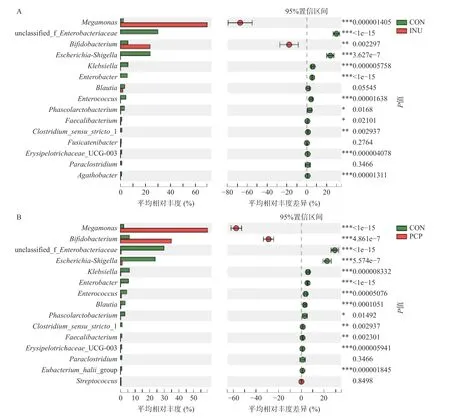
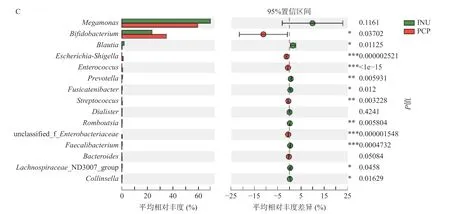
图5 t-检验分析属水平组间显著性差异Fig.5 Significant difference on genus level by Student’s t-test bar plot
2.5 发酵过程中SCFAs 的变化
SCFAs 作为人体肠道菌群的发酵产物,能够起到维持肠道水电解质平衡、抑制病原微生物、调节菌群平衡和抗炎等重要作用[39]。膳食中的碳水化合物是肠道微生物发酵产生SCFAs 的主要底物[40]。如表3 所示,经过体外厌氧发酵24 h 后,PCP 组的乙酸含量显著高于INU 组(P<0.05),是CON 组的6.7倍,这可能与PCP 促进产乙酸的双歧杆菌、巨单胞菌丰度显著增加(P<0.05)有关,乙酸通常被认为是双歧杆菌等有益菌的发酵产物,能够通过激活G 蛋白偶联受体调节肠道菌群环境,并能够作为周围组织的能量来源[33,41]。
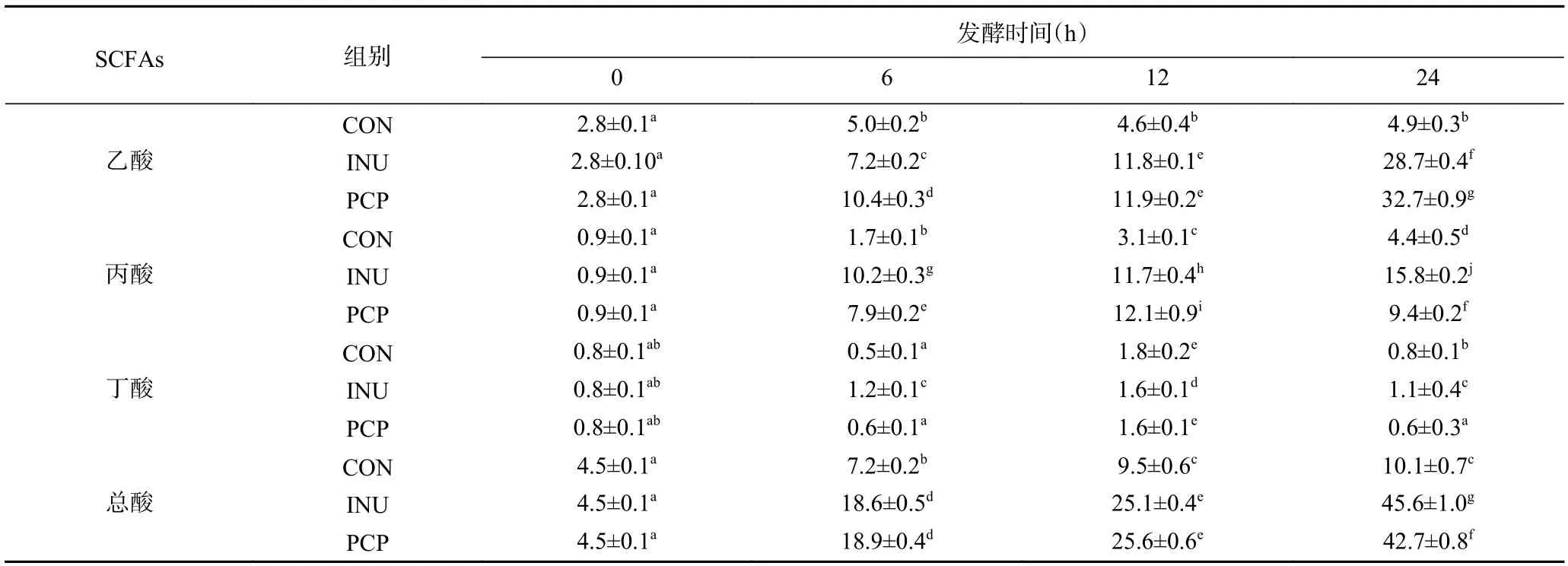
表3 体外发酵过程中不同 SCFAs 含量的变化(mmol/L)Table 3 Changes in different SCFAs content during in vitro fermentation (mmol/L)
此外,经过24 h 发酵,丙酸在PCP 和INU 组均有显著增加(P<0.05),这可能与巨单胞菌有关,巨单胞菌可产乙酸和丙酸[33],PCP 和INU 均能显著增加巨单胞菌丰度(P<0.05)。丙酸经肠道细菌产生后,可被人体吸收进入血液随后转运至肝脏,下调肝脏和血浆中的脂肪酸含量,抑制免疫过度激活,提高胰岛素敏感性,并对肝癌细胞有抗增殖作用[42]。丁酸可以由肠道细菌代谢未消化的碳水化合物产生,也可通过对乙酸及乳酸的转化产生,与结肠细胞的抗炎和抗肿瘤作用相关[43],丁酸在三组中虽有显著差异(P<0.05),但整体含量占比低。此外,PCP 组中总的SCFAs 含量显著增加(P<0.05),与CON 组相比,增加了3.2倍。SCFAs 的产生能够降低周围环境的pH,有利于双歧杆菌等益生菌的生长[44]。
3 结论
本研究通过体外模拟口腔、胃与小肠消化与体外粪便细菌发酵模型,探究了PCP 的抗消化特性及其对于肠道菌群结构与短链脂肪酸代谢产物的影响。本研究发现,PCP 与INU 具有相似的活性,具有抗消化性,能够到达结肠被肠道菌群所利用,并能调节肠道菌群结构的活性,促进双歧杆菌等有益菌群增殖,促进乙酸与丙酸等短链脂肪酸代谢产物含量,是一种潜在的益生元。本研究为多花黄精多糖作为功能因子开发应用提供了理论依据,同时,后续研究需要进一步明确多糖功效成分的结构,并进一步通过体内实验验证其活性功效。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

