Pickering 全营养乳和传统全营养乳体外消化特性研究
王迎香,刘金洋,夏 凯,杨宗玲,丁振江,张子阳,曹亚洲,柳 嘉,段盛林,*
(1.中国食品发酵工业研究院有限公司,功能主食创制与慢病营养干预北京市重点实验室,北京 100020;2.西藏金谷农业高科有限公司,西藏拉萨 850000)
全营养配方食品是可作为单一营养来源满足目标人群营养需求的特殊医学用途配方食品,产品形态以粉剂和乳剂最为常见。其中乳剂使用前无需进行冲调,使用场景更加便捷[1]。全营养乳是由人体所需的宏量营养素(蛋白质、碳水化合物、油脂)、微量营养素(矿物质、维生素)、以及膳食纤维等可选择成分通过与水混合、剪切、均质和灭菌等工艺制备的乳液[2-3]。全营养乳是针对进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养素或膳食的特殊需要,专门加工而成的乳液食品,可有效改善体弱、长期营养不良、长期卧床病人、老年人等人群的营养状况[4-8]。
全营养乳是水相和油相通过乳化剂而形成的水包油体系[9-12],其中乳化剂在避免水相和油相之间的相分离方面起着重要作用。乳化剂主要有皮克林乳化剂和传统乳化剂。皮克林乳化剂是指吸附在油水界面处不溶于水或微溶于水的微米或纳米固体颗粒,包括多糖颗粒、蛋白质颗粒、脂肪颗粒和无机颗粒等;传统乳化剂是指天然或合成的具有两亲性的化合物,包括磷脂(Phospholipid,PL)、蔗糖脂肪酸酯、吐温和聚甘油酯等。食品中常用的皮克林乳化剂主要有辛烯基琥珀酸淀粉颗粒(Octenyl succinic acid starch,OS)和玉米醇溶蛋白颗粒(Zein)等,它们能不可逆地吸附在油水界面,形成不易受pH、离子强度、温度等环境因素影响的乳化稳定体系[13-14]。食品中常用的传统乳化剂主要有PL、单双脂肪酸甘油酯和柠檬酸脂肪酸酯等,天然PL 乳化剂因具有更好的生物相容性和更高的安全性而受到广泛的应用。
乳化剂因其性质不同而使乳液表现出不同的特性。研究表明,不同类型的乳化剂(大豆蛋白分离物、酪蛋白酸钠、吐温20 和磷脂)对乳液体外消化程度和营养素生物可及性具有影响[15]。消化主要发生在胃和小肠中。胃内的消化是由胃蛋白酶和胃脂肪酶水解,而在小肠内则是由胰蛋白酶和胰脂肪酶水解。其中,脂肪酶必须吸附到液滴表面,以便它能够接近液滴内所含的脂质底物[16-18]。乳化剂是一种表面活性化合物,具有亲脂性和亲水性。因此,最初包裹食物中脂滴的乳化剂分子的性质可能会影响乳化剂在胃肠道中的行为[19-25]。此外,乳化剂的性质将影响脂滴在胃肠道内合并和降解的敏感性,从而改变暴露于脂肪酶的脂的总表面积[26-27],最终影响脂质的消化和吸收。当脂质被摄入时,它在通过胃肠道时可能会发生化学和结构组织的变化[28-30]。但目前对于传统乳化剂和皮克林颗粒乳化的全营养乳的体外消化行为的研究较少。
本研究旨在通过采用不同乳化剂OS、Zein 和PL制备全营养乳,研究其在体外口腔胃肠道中的消化特性(粒径分布、zeta 电位和微观结构的变化规律)以及全营养乳的脂质消化率,为基于Pickering 乳化剂和传统乳化剂的全营养乳的消化吸收提供参考。
1 材料与方法
1.1 材料与仪器
糊精、OS 中柏兴业食品科技有限公司;酪蛋白酸钙 新东康营养科技有限公司;菊粉、低聚半乳糖 云浮市新金山生物科技股份有限公司;大豆膳食纤维 鲁发信德生物科技有限公司;复合稳定剂(结冷胶、卡拉胶、微晶纤维素) 阿泽雷斯国际贸易(上海)有限公司;复配宏量矿物质元素(钠、钾、镁、磷、氯)、复配微量矿物质元素(铁、铜、碘、锌、锰、硒)、复配维生素(维生素A、D、E、K1、B1、B2、B6、B12、烟酸、泛酸、叶酸、维生素C、生物素) 江苏科伦多食品配料有限公司;葵花籽油、大豆油、PL 青岛高科技工业园海博生物技术有限公司;Zein 上海兴隆生物科技有限公司;NaCl、KCl、MgCl2·6H2O、CaCl2·2H2O、HCl、NaOH、NaHCO3、KH2PO4、(NH4)2CO3、CH3COONa 分析纯,北京化工厂;唾液淀粉酶(>5 U/mg)、胃蛋白酶(>250 U/mg)、胰酶(4×USP)、胰脂肪酶(>20000 U/mg) 美国Sigma-Aldrich 公司;胆盐 上海麦克林生化科技有限公司。
AL204 电子天平、FE20 实验室pH 计 梅特勒-托利多仪器(上海)有限公司;D2010W 电动搅拌器 上海梅颖浦仪器仪表制造有限公司;T25 digital ULTRA TURRAX 分散机 德国IKA 公司;HOMOLAB 2 高压均质机 意大利FBF 公司;YXQ-LS30SII立式压力蒸汽灭菌锅 上海博迅医疗生物仪器股份有限公司;907 自动电位滴定仪 瑞士万通中国有限公司;Multistirrer digital 15 水浴循环磁力搅拌器意大利VELP 公司;S3500 激光粒度分析仪 美国Microtrac 公司;ZEN3700zeta 电位仪 英国马尔文公司;CKX41 倒置显微镜 日本奥林巴斯株式会社。
1.2 实验方法
1.2.1 全营养乳的制备 乳液的制备参照武林贺等[31]、Shimokawa 等[32]、Remanan 等[33]和Bao 等[34]的方法,并做相应的修改。将12%糊精、5%酪蛋白酸钙、0.6%菊粉、1.3%低聚半乳糖、1%大豆膳食纤维、0.05%复合稳定剂(结冷胶、卡拉胶、微晶纤维素)、0.6%复配矿物质和0.05%复配维生素加入超纯水中搅拌均匀形成水相,用1% KOH 调节pH 至7.0。称取葵花籽油、大豆油(14:11)加热至60 ℃混匀形成油相。缓慢将3%油相加入水相,高速剪切3 min(7000 r/min)形成粗乳液,用蒸馏水定容至100 mL。将粗乳液在50 MPa 压力下高压均质1 次后进行灌装,121 ℃灭菌15 min,冷却制得乳液。其中,将1% Zein 或OS 加入到糊精溶液中制备的乳液分别为Zein 基Pickering 全营养乳和OS 基Pickering 全营养乳,将1% PL 加入到油脂混合液中制备的乳液为PL 传统全营养乳。
1.2.2 体外消化 体外消化参照INFOGEST 静态消化模型[35-37],并稍加修改。采用体外三个阶段的模拟消化模型(口腔、胃、小肠)来研究各种乳液的消化特性[38-39]。
1.2.2.1 模拟消化液的配制 参考Minekus 等[40]的方法分别制备模拟口腔消化液(Simulated salivary fluid,SSF)、模拟胃消化液(Simulated gastric fluid,SGF)和模拟肠消化液(Simulated intestinal fluid,SIF)。
1.2.2.2 体外静态消化模型的构建 口腔消化阶段:将SSF 与乳液样品在37 ℃下预热10 min,取20 mL预热的SSF 和20 mL 乳液样品以1:1(v:v)混合,然后迅速用2 mol/L NaOH 调节混合液pH7.0,混合液被放置于37 ℃的恒温水浴振荡器中以100 r/min 的转速振荡2 min,模拟口腔消化阶段。本阶段,α-淀粉酶在终消化体系的浓度为75 U/mL。
胃消化阶段:将SGF 在37 ℃下预热10 min,取40 mL 预热的SGF 和40 mL 口腔消化液以1:1(v:v)混合,然后迅速用2 mol/L HC1 调节混合液pH至2.0,混合液被放置于37 ℃的恒温水浴振荡器中以100 r/min 的转速振荡2 h,模拟胃消化阶段。本阶段,胃蛋白酶在终消化体系的浓度为2000 U/mL。
小肠消化阶段:将SIF 在37 ℃下预热10 min,取80 mL 预热的SIF 和80 mL 胃消化液以1:1(v:v)混合,然后迅速用2 mol/L NaOH 调节混合液pH 至7.0,混合液被放置于37 ℃的恒温水浴振荡器中以100 r/min 的转速振荡2 h,模拟小肠消化阶段。本阶段,胰脂肪酶在终消化体系的浓度为2000 U/mL,胆盐在终消化体系的浓度为10 mmol/L。
采用上述口腔、胃和小肠的体外静态消化模型模拟乳液在体内的消化过程,研究乳液的消化特性。实验过程中始终维持消化体系处于37 ℃。
1.2.3 粒径测定 用激光粒度分析仪测定乳液原液及各消化阶段的粒径及粒径分布。采用湿法测定,水的折射率设置为1.33[33]。
1.2.4 zeta 电位测定 使用zeta 电位仪测定乳剂的电位。在测定之前,乳液分别用蒸馏水、模拟胃液或模拟肠液稀释10 倍[24]。
1.2.5 微观结构观察 使用光学显微镜观察乳液的微观形态[28]。滴一滴样品在载玻片上,用盖玻片盖住,在40×10 放大倍数下观察,用数码相机(Olympus DP22)拍摄图像。
1.2.6 游离脂肪酸释放率测定 在肠道消化阶段,由于脂肪酶的作用,乳液中的油从甘油三酯和甘油二酯转化为游离脂肪酸(Free fatty acids,FFA)。这些FFA 的释放是样品pH 降低的原因,使用pH-stat 法模拟小肠消化,用0.1 mol/L NaOH 溶液滴定小肠消化液,通过计算小肠消化阶段pH 保持在7.0 时NaOH消耗的总体积[41],按照以下公式计算得到乳液脂质消化过程中FFA 的释放率。
式中:FFA 释放率表示游离脂肪酸的释放率,%;V 表示肠消化过程中消耗的NaOH 体积,L;c 表示NaOH 溶液的浓度,0.1 mol/L;M 表示油相相对分子质量(255.682);W 表示肠相所含油脂的总质量,0.52 g。
1.3 数据处理
每个实验进行三次平行实验,结果以平均值±标准差表示。采用SPSS Statistics 20 软件对数据进行方差分析(P<0.05 为差异显著),采用OriginPro 8.5 软件进行数据分析和图表处理。
2 结果与分析
2.1 不同乳化剂制备的乳液消化前后的粒径分布
消化过程中,酶吸附到油水界面水解液滴的能力与液滴大小相关[42]。液滴越大,油水界面的表面积越小,酶吸附的可能性就越大;液滴越小,油水界面的表面积越大,酶吸附的可能性就越小[43]。因此,液滴大小可影响消化速率。
图1 为不同乳化剂制备的原液、口腔、胃、小肠消化阶段粒径的变化和粒径分布。如图1a 所示,由Zein、OS、PL 制备的乳液的粒径分别为:29.94、22.95、26.74 μm。模拟消化过程中,三种乳液粒径的变化趋势一致,呈先增大后减小的趋势,这主要是因为胃中较低的pH 和较高离子强度导致乳液的稳定性下降,液滴发生不同程度的絮凝或聚集,粒径增大。OS 乳液的平均粒径由22.95 μm 增加到27.65 μm,Zein 乳液由29.94 μm 增加到30.89 μm,PL 乳液由26.74 μm 增加到29.62 μm,说明Zein 乳液和PL 乳液中的液滴与脂肪酶接触的可能性大于OS 乳液。与Zein 乳液相比,OS 乳液在口腔中的平均粒径显著增大(P<0.05),由22.95 μm 增加到27.72 μm,由图1c可观察到相似的结果,乳液在口腔消化阶段粒径分布的峰向右偏移且出现多峰形式,说明其液滴粒径变大,这是由于口腔消化阶段唾液淀粉酶的存在,淀粉类乳化剂被唾液淀粉酶水解,从而导致乳液粒径增大[44]。Zein 乳液在胃中的粒径分布呈现多峰模式(图1b),说明其液滴发生了一定程度的聚集,这是由于模拟胃消化过程中胃蛋白酶的消化作用,蛋白类乳化剂可能被胃蛋白酶水解,导致乳液中液滴之间发生絮凝甚至聚结[45];PL 乳液在胃中呈均一单峰模式(图1d),说明其在胃消化阶段后大部分液滴被水解消化,以上结果说明胃消化阶段PL 传统全营养乳脂质消化程度大于Pickering 全营养乳。
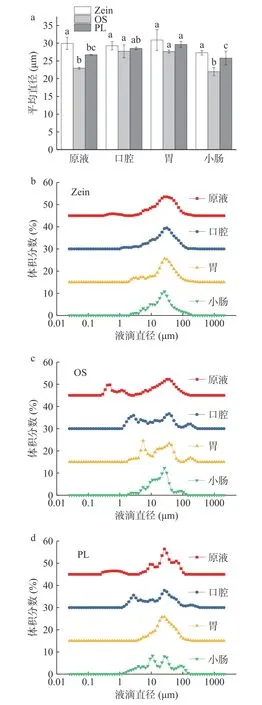
图1 不同乳化剂制备的原液和各个消化阶段的粒径变化Fig.1 Particle size changes of emulsion prepared with different emulsifiers at initial and various digestion stages
2.2 不同乳化剂制备的乳液消化前后的zeta 电位
zeta 电位是表征乳液稳定性的重要指标,液滴表面的高电位值可与临近液滴产生强烈的静电斥力,从而防止液滴的絮凝。液滴表面的电位值不仅取决于表面电荷的类型和浓度[46],还取决于周围液体中离子的类型和浓度[47]。通过zeta 电位测量评估了乳化剂类型和体外消化阶段液滴表面电荷的变化。不同乳化剂因含有不同的表面官能团而产生不同的电位值。另外,吸附在液滴界面上的粒子的电荷是皮克林乳液表面电荷形成的主要原因[22]。如图2 所示,Zein、OS 和PL 原液呈现出不同的负电荷(分别为-11.53、-18.03、-16.4 mV),这些结果与之前的研究一致[48-50]。模拟口腔消化阶段,与原液相比,Zein 包被液滴上的电荷量几乎没有变化,而OS 和PL 包被液滴上的电荷量有明显的下降,电荷的这种变化可能是由于模拟口腔液中离子的存在而产生的静电屏蔽效应[51],也可能是由于唾液淀粉酶与液滴表面的相互作用[24]。模拟胃消化阶段,三种乳液都由负电荷转变为正电荷,这可能是由于胃液中较低的pH 和较高离子强度所致。Zein 乳液和PL 乳液的电位绝对值明显降低,OS 乳液的电位绝对值有所增加,说明Zein 乳液和PL 乳液在模拟胃消化阶段的稳定性弱于OS 乳液,这可能是由于胃蛋白酶水解了Zein 乳化剂,使液滴稳定性下降甚至发生聚集,也可能是因为酸性条件诱导了Zein 和PL 包被的液滴的桥接絮凝[23]。模拟小肠消化阶段,三种乳液都具有相对高的负电荷,与原液相当,这可能是因为脂质消化过程中存在的各种阴离子颗粒(未消化的脂滴、囊泡或胶束)以及这些颗粒表面含有的来自肠液或脂质消化产物(胆汁、胰酶、游离脂肪酸),都可能对乳液的zeta 电位产生影响[52]。消化过程中,酶解、新物质形成、成分之间的相互作用等也会导致乳液中液滴的界面性质发生变化,改变其电荷[53]。另外,肠液pH为中性,与未消化的原液相近,这可能是获得相似zeta 电位值的另一个原因[54]。模拟小肠消化阶段,Zein 乳液、OS 乳液、PL 乳液的zeta 电位值分别为:-14.53、-19.90、-18.80 mV,说明Zein 乳液中的液滴被酶水解的程度大于OS 乳液和PL 乳液。
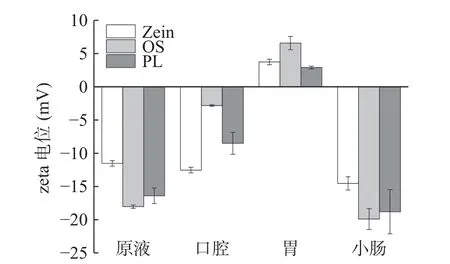
图2 不同乳化剂制备的原液和各个消化阶段的zeta电位变化Fig.2 Zeta potential changes of emulsion prepared with different emulsifiers at initial and various digestion stages
2.3 不同乳化剂制备的乳液消化前后的微观形态
利用光学显微镜对Zein 乳液、OS 乳液、PL 乳液消化前后的微观结构进行了观察。模拟体外消化过程中,不同乳化剂制备的乳液的微观结构具有较大差异(图3)。Zein 乳液、OS 乳液、PL 乳液中的油滴都呈现均匀分散的状态。模拟口腔消化阶段,Zein 乳液和PL 乳液中的油滴发生了轻微的聚集现象,而OS 乳液发生了明显的聚集,这也和粒径的变化趋势一致。模拟胃消化阶段,三种乳液中油滴的聚集程度进一步加剧,其中Zein 乳液中油滴的聚集最为明显,说明在胃消化过程中胃蛋白酶对Zein 的水解使其从油水界面脱去,使液滴逐渐聚结形成大油滴,增大了小肠中胰脂肪酶与油脂的接触面积[45]。同时,PL 乳液中油滴的絮凝现象明显大于OS 乳液,说明在胃消化过程中Zein 乳液和PL 乳液中的油滴比OS 乳液更容易被水解消化。模拟小肠消化阶段,三种乳液中观察到了更大的油滴颗粒,其他关于乳液体外消化的研究中也观察到了类似的现象[55],这可能与乳液被模拟小肠消化液稀释、甘油三酯被胰脂肪酶水解以及脂质消化产物进入混合胶束中有关[38]。
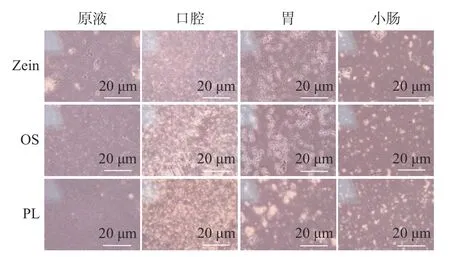
图3 不同乳化剂制备的原液和各个消化阶段的微观形态变化Fig.3 Morphological changes of emulsion prepared with different emulsifiers at initial and various digestion stages
2.4 不同乳化剂对乳液FFA 释放的影响
采用pH-stat 法模拟乳液在小肠中的消化过程,探究不同乳化剂对乳液FFA 释放的影响。如图4 所示,三种乳液之间脂质消化的初始速率存在差异。10 min 内,Zein 乳液和PL 乳液的FFA 初始释放速度相似且快于OS 乳液,而PL 乳液在10 min 之后便达到平衡,说明其表现为快速释放不利于油脂的持续消化和吸收。10~30 min,Zein 乳液和OS 乳液的FFA 释放速度相似且缓慢,而OS 乳液在30 min 之后便达到平衡。模拟小肠消化过程中,Zein 乳液在2 h 后仍未达到平衡,说明Zein 稳定的乳液表现出持续释放的特性,更利于油脂的持续消化和吸收,其原因可能是胃中的胃蛋白酶和小肠中的胰蛋白酶对Zein 的水解作用导致油滴的聚集和暴露,增加了胰脂肪酶的作用时间[46,56],表现为FFA 的持续释放。尽管OS 乳液在模拟口腔条件下,有被唾液淀粉酶水解的趋势,但由于作用时间太短,导致其水解程度较低,暴露的油滴相比Zein 乳液更少,因此其释放率更低。与Pickering 全营养乳相比,PL 乳液在模拟胃条件下油滴絮凝聚集的现象更明显,在胃中的水解程度可能更高,所以其在小肠阶段FFA 释放率表现为最低,也可能与卵磷脂作为乳化剂的阴离子性质对脂肪酶的抑制作用有关[29]。此外,由Zein、OS、PL 乳化剂制备的乳液在模拟小肠消化阶段的FFA 释放率分别为:20.54%、17.21%、14.29%,三种乳液中脂质的消化程度依次为Zein 乳液>OS 乳液>PL 乳液,说明Pickering 全营养乳较传统全营养乳的脂质消化速率更高。此外,Zein 乳液中的FFA 表现为持续释放,更有利于油脂的体外消化和吸收。
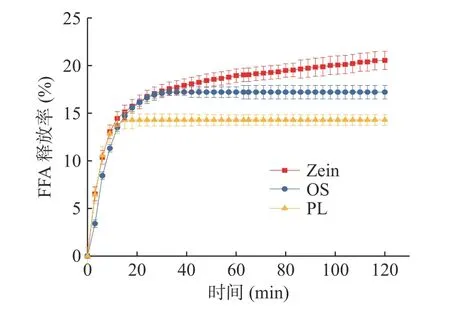
图4 不同乳液在小肠消化过程中FFA 释放率Fig.4 FFA release rate of different emulsion during intestinal digestion
3 结论
本研究通过体外模拟消化研究了Pickering(OS 和Zein)全营养乳和传统(PL)全营养乳消化特性。研究结果表明,全营养乳的消化速率和消化程度与乳化剂的类型有关,Zein 全营养乳在模拟消化过程中表现为消化程度最大,这些变化可以从粒径、粒径分布、zeta 电位以及微观结构的变化来证明。脂滴在模拟口腔胃肠道不同区域的电荷和聚集稳定性取决于包裹的乳化剂。小肠内脂质消化速率和程度也取决于乳化剂类型,Pickering 全营养乳的脂质消化速率高于传统全营养乳,其中Zein 包裹的脂滴的脂质消化速率高于OS 乳液且表现为持续释放。本研究有助于将Zein、OS 应用于具有高生物利用度的亲脂性生物活性成分的Pickering 全营养乳化体系的设计与开发。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

