玉米醇溶蛋白-假酸浆子胶二元复合物的制备及在Pickering 乳液中的应用
景成童,涂 安,赵春昊,董 琪,王亚潇,郭 鹏,2,董 爽,*
(1.山东理工大学农业工程与食品科学学院,山东淄博 255000;2.山东扳倒井股份有限公司,山东淄博 256399)
玉米醇溶蛋白(Zein)是从玉米中分离出来的植物蛋白,价格低廉,具有醇溶性、低水溶性、高生物相容性和生物降解性。玉米醇溶蛋白结构中由于存在大量(>50%)的非极性氨基酸残基而表现出固有的疏水性,这使得它可以单独组装或与其他生物聚合物组装成薄膜、微粒、纳米颗粒、纳米纤维和胶束等[1]。这种自组装特性使玉米醇溶蛋白广泛用于食品包装和输送系统的制造。作为传递载体,玉米醇溶蛋白常适用于递送疏水性生物活性物质[2],如姜黄素[3]、白藜芦醇[4]、百里香酚[5]等。然而,玉米醇溶蛋白由于特殊的溶解性可能会导致产品稳定性差以及相关性能欠佳[6],很大程度上限制了玉米醇溶蛋白在食品、药品、材料等领域的实际应用。作为一种天然蛋白质,其结构和功能具有高度可调控性[1],可以通过其他物质的结构修饰来优化玉米醇溶蛋白的理化和功能特性来弥补上述缺陷。
假酸浆是一种一年生直立草本茄科植物,最初起源于南美洲,但目前已在中国广泛种植。浆果根部的种子是假酸浆的主要产物,其外胚层中含有丰富的果胶类多糖。假酸浆子胶(Nicandra physaloidesgum,NPG)的酯化程度为46.93%,半乳糖醛酸含量为65.8%,浓度在1.3%~1.5%时有自发凝胶化特性[7]。NPG 可以在酸性条件下形成凝胶,且凝胶的pH 范围十分广泛,因此可作为酸性食品的增稠剂和稳定剂[8]。
食品级Pickering 乳液主要是由多糖、蛋白质或其复合颗粒而不是传统小分子表面活性剂稳定的乳液[9]。近年来,随着消费者对“绿色食品”和“清洁标签”的关注日益增加,天然来源的生物大分子材料越来越多地应用于Pickering 乳液稳定剂,以提高食品乳液的安全性和环境相容性。然而,研究发现采用单一蛋白组分作为稳定剂时,Pickering 乳液的界面稳定效果并不理想,在后期贮藏或各加工条件下容易发生乳析行为。若不联用传统小分子乳化剂,很难满足在真实食品乳液体系中的稳定性要求,但小分子乳化剂的使用又不可避免带来一些食品安全性问题。因此,亟需探寻合适的天然组分来修饰玉米醇溶蛋白结构,改善其在Pickering 乳液中的应用性能。
近些年来,研究发现采用蛋白和多糖或多酚结合形成的二元复合物制备的Pickering 乳液,其理化功能特性有明显改善。如利用大豆分离蛋白和羧甲基壳聚糖的络合来提高Pickering 的稳定性[10]。目前,玉米醇溶蛋白和假酸浆子胶复合颗粒(NGP-Zein composite particles,NZPs)及其在Pickering 乳液中的应用鲜有研究,其具体复合机制以及对乳液稳定特性的影响尚不可知。基于此,本文采用热水浸提法提取假酸浆果实中的胶质多糖,通过复凝聚法制备玉米醇溶蛋白-假酸浆子胶二元复合物颗粒,并构建其Pickering 乳液。在此基础上,通过三相接触角、粒径、内源荧光光谱、差式扫描量热仪(DSC)、傅里叶红外光谱(FT-IR)、微观形貌等探究了不同蛋白-多糖比例对复合物的理化特性及结构的影响机制,并考察了Pickering 乳液的流变特性和乳液稳定性等相关指标。本文研究为Zein-多糖二元复合物的制备及相关食品级Pickering 乳液开发提供新的思路。
1 材料与方法
1.1 材料与仪器
玉米醇溶蛋白 高邮市日星药用辅料有限公司;假酸浆子、玉米胚芽油、大豆油 市售。
UV-2600 可见分光光度计 日本岛津公司;Mastersizer 2000 马尔文粒度仪、Kinexus lab+型高级旋转流变仪 英国马尔文仪器有限公司;Nicolet 5700 傅里叶变换红外光谱仪 美国热电尼高力仪器公司;JY-82A 型视频接触角测量仪 承德鼎盛试验机检测设备有限公司;Quanta 200F 型扫描电子显微镜 美国FEI 公司;Q2000 型差示扫描量热仪 美国TA 公司。
1.2 实验方法
1.2.1 假酸浆子胶的提取 采用热水浸提法[11]对假酸浆果实中的胶质成分进行提取。将假酸浆子除杂过筛后,采用70 ℃水浴加热40 min,每隔5 min 搅动一次防止假酸浆子胶粘结。随后使用纱布(100目)滤出假酸浆子胶,真空冷冻干燥48 h 收集干燥的假酸浆子胶粉末。
1.2.2 玉米醇溶蛋白-假酸浆子胶复合颗粒(NZPs)的制备 参考Yu 等[12]方法,采用复凝聚法制备NZPs。将Zein 溶解于80%乙醇配制成浓度为2.5%(w/v)的Zein 溶液,在磁力搅拌下匀速将Zein 溶液滴入3 倍体积的去离子水中,持续搅拌30 min。随后,采用真空旋转蒸发(40 ℃)15 min 去除乙醇,并调整Zein 悬浮液终浓度为0.625%(w/v)。此外,将假酸浆子胶粉末分散于去离子水中(2.5%,w/v),采用70 ℃水浴加热4.5 h 并将所得溶液过滤。待冷却至室温(25.0±0.5 ℃)后调整pH 分别至3.5、4.0、4.5 和5.0,即得不同pH 的假酸浆子胶溶液。随后,按照Zein 与假酸浆子胶不同比例(1:0、10:1、5:1、2:1、1:1、1:2 和0:1,样品分别标记为ZPs、N1ZPs、N2ZPs、N3ZPs、N4ZPs、N5ZPs、NPs),磁力搅拌下(600 r/min,1 h)将Zein 悬浮液以200 mL/h 的速度滴加至假酸浆子胶溶液中,获得NZPs 分散液。将溶液置于4 ℃冰箱中储存待测。另外,为了获得复合颗粒的干燥样品,将部分NZPs 悬浮液采用真空冷冻干燥48 h 后收集待测。
1.3 玉米醇溶蛋白-假酸浆子胶复合颗粒理化特性及结构表征
1.3.1 三相接触角测定 采用压片机将颗粒粉末样品压片(厚度2 mm,直径13 mm)并浸入玉米胚芽油中。使用微量注射器每次将5 μL 去离子水垂直滴落至片剂表面。在接触角测量仪的高速摄像机记录下液滴轮廓,采用JY-82A 软件自动拟合到LaPlace Young 方程中,以计算三相接触角(θ)。
1.3.2 粒径分布测定 使用Mastersizer 2000 激光粒度仪测定复合颗粒的粒径分布。每个样品自动重复测试三次。
1.3.3 内源荧光光谱扫描 根据Sun 等[13]的方法并进行适当修改。将复合颗粒分散液稀释至0.2 mg/mL,以Zein 分子内的荧光基团作为探针,采用荧光分光光度计进行内源荧光光谱扫描,其中激发波长为270 nm,发射波长范围为280~450 nm。激发和发射狭缝宽分别为5 nm 和3 nm。
1.3.4 DSC 分析 称量5 mg 复合颗粒样品置于坩埚中进行DSC 测定,加热温度设置为20~180 ℃,升温速率设置为10 ℃/min,氮气的流速设定为20 mL/min。
1.3.5 FT-IR 分析 将复合颗粒样品与溴化钾按照1:100 的比例研磨并压片。在4000~400 cm-1范围内进行扫描,扫描次数为64,分辨率为4 cm-1。
1.3.6 扫描电子显微镜(SEM)观察 将复合颗粒样品固定、喷金,采用SEM 观察微观结构特性并拍照,样品放大倍数为5×104倍和1×105倍。
1.4 NZPs 基Pickering 乳液制备及性能研究
1.4.1 NZPs 基Pickering 乳液的制备 根据Tao 等[14]的方法并适当修改,采用恒流泵以3 mL/min 的速度匀速将复合颗粒悬液加入到大豆油中。颗粒悬液与油的体积比为3:7。然后采用高速均质机在14000 r/min 下乳化剪切3 min,即得NZPs 基Pickering 乳液,存于4 ℃中冷藏待测。
1.4.2 NZPs 基Pickering 乳液的流变特性 采用动态流变仪测定Pickering 乳液的动态黏弹性,测试采用C35/1 Ti 锥板,间距为1 mm,频率扫描范围为0.1~20.0 Hz,应力为1.0%,测定温度25 ℃。
1.4.3 乳液pH 稳定性 取5 mL 乳液样品分别加入5 mL pH 为3、6、9 的HCl 或NaOH 溶液(1 mol/L),搅拌均匀,加盖密封,室温储存(25.0±0.5 ℃)3 d。随后观察记录乳液表面出油及分层情况,按照如下公式计算乳液的乳析指数(Creaming index,CI)。
式中:CI—乳析指数(%);Hs—析出相(底部析出水层或顶部析出颗粒)高度(cm);Ht—乳液总高度(cm)。
1.4.4 乳液热稳定性 取乳液样品10 mL 于试管中,加盖密封,分别置于60 和90 ℃水浴锅中加热12 h,并观察记录乳液表面出油及分层状况,参考1.4.3 中方法测定乳液的CI 值。
1.5 数据处理
所有实验至少重复测定三次,使用SPSS 25.0和Origin 2022 对实验数据进行分析和图片绘制。
2 结果与分析
2.1 玉米醇溶蛋白-假酸浆子胶复合颗粒的三相接触角
表面润湿性是固体颗粒的重要特性,其大小是由颗粒自身决定的。接触角过大或过小均会导致固体颗粒较难吸附到油水界面而导致乳液不稳定、破乳。当接触角越接近90°时,颗粒同时表现出亲水和疏水性,制备的乳液体系稳定性更好[15]。在不同pH(3.5、4.0、4.5、5.0)下复合形成的NZPs 三相接触角如图1 所示。由结果可知,相比复合颗粒,ZPs 颗粒在不同pH 条件下接触角均较大,这是由于Zein 为疏水性蛋白质,非极性氨基酸残基比重较大。随着复合物中NPG 比例的增大,NZPs 三相接触角明显下降,这是由于假酸浆子胶质多糖主要由半乳糖、半乳糖醛酸、鼠李糖、葡萄糖等组成,其中占比最大的半乳糖醛酸结构中含有丰富的-COOH 和-OH 等极性基团[7],因此,复合颗粒中NPG 比例越大,颗粒的表面润湿性越强。另外,对比不同pH 下NZPs 的三相接触角可知,复合颗粒形成时的pH 对颗粒三相接触角有一定影响,pH 为4.0 时接触角最大。复凝聚法制备Zein-NPG 复合物基于酸性pH 下通过静电吸引使蛋白与多糖结合。在复合过程中,pH 环境直接影响了蛋白和多糖的带电荷数,合适的pH 条件能促使Zein 与NPG 之间的静电相互作用增强,提高了交联程度,进而导致颗粒表面亲/疏水性的改变[16]。结合三相接触角与乳液稳定性之间的关联,后续研究选择pH4.0 为Zein 和NPG 的复合pH。
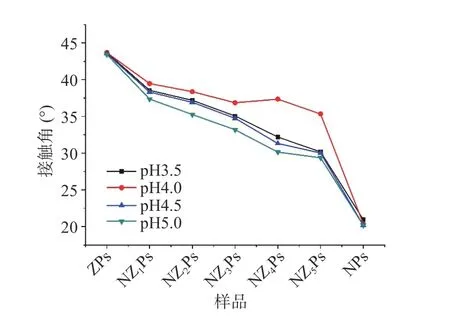
图1 pH 对玉米醇溶蛋白-假酸浆子胶复合颗粒表面亲/疏水性的影响Fig.1 Effect of pH on the surface hydrophilicity/hydrophobicity of Zein-NPG composite particles
2.2 玉米醇溶蛋白-假酸浆子胶复合颗粒的粒径分布
图2 和表1 分别为玉米醇溶蛋白-假酸浆子胶不同比例下复合颗粒的粒径分布和平均径(D50和D[4,3])。由图2 可知,N1ZPs 和N2ZPs 粒径呈双峰分布,但随着NPG 比例的增加,N3ZPs~N5ZPs 粒径均呈较窄的单峰分布且相对集中。这表明随着NPG添加量的增加,复合颗粒的粒径大小更加均匀。由表1 中复合颗粒的D50结果可知,随着NPG 比例的增加,复合颗粒的粒径尺寸逐渐缩小,由49.40 μm(Zein:NPG=10:1)降至18.62 μm(Zein:NPG=1:2)。此外,D[4,3]呈现整体降低趋势,但其下降趋势并没有随NPG 添加量呈明显规律性。天然Zein 在反溶剂自组装过程中形成的颗粒粒径大小不均一,粒径分布较宽,普遍为双峰分布[17]。在本研究中,N1ZPs 和N2ZPs 的粒径呈双峰分布,可能是由于NPG 添加量较少,在静电作用力下,带正电荷的Zein 与带负电荷的阴离子多糖NPG 形成了少量结构更紧密的二元复合物,所以粒径呈现双峰。但随着NPG 比例的继续增加,二者在静电作用下形成了更多尺寸更均匀的复合颗粒,进而导致粒径尺寸的降低,这与Sun 等[13]的研究结果一致。
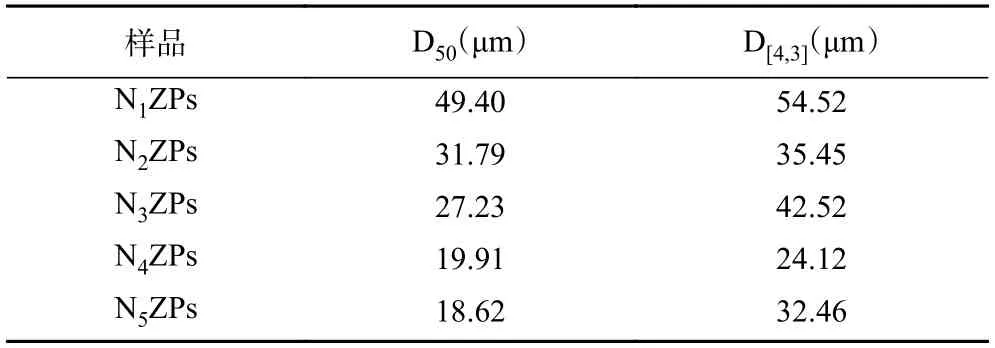
表1 玉米醇溶蛋白-假酸浆子胶复合颗粒的平均粒径Table 1 Average particle size of Zein-NPG composite particles
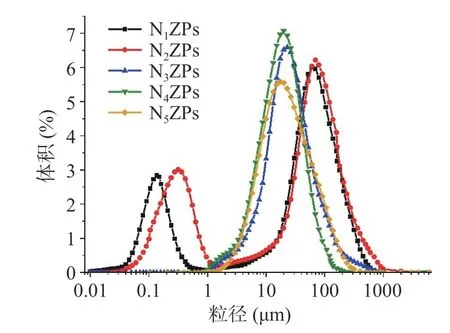
图2 玉米醇溶蛋白-假酸浆子胶复合颗粒的粒径分布Fig.2 Size distribution of Zein-NPG composite particles
2.3 玉米醇溶蛋白-假酸浆子胶复合颗粒的内源荧光光谱
酪氨酸残基对蛋白质的局部环境条件高度敏感[18],NZPs 中蛋白质的构象变化以及蛋白-多糖的互相作用[19]可以通过监测内源荧光发射光谱的谱峰变化来解析。由图3 中复合颗粒的内源荧光光谱可知,基于酪氨酸残基的荧光发色特性,Zein 在300 nm(峰1)处出现了一个发射峰(ZPs)。而NPG 在330 nm附近(峰2)出现了一个较强的发射峰(NPs),这表明NPG 本身也具有荧光特性。由图3 可明显看出,NZPs在300 nm 和330 nm 处均出现了荧光峰,且随着NPG 含量的增加,复合颗粒在峰1 处的峰值强度逐渐下降,在峰2 处的峰值强度逐渐上升。这表明NZPs 的荧光光谱中对应特征峰的峰强分别与Zein和NPG 的含量呈正比。在复合颗粒中多糖比重的增加使Zein 中酪氨酸残基处于极性更强的微环境[20]。此外,NPG 的添加增强与蛋白之间的相互作用,复合颗粒内部发生了更紧密的交联,使Zein 分子中疏水性氨基酸残基进一步向内包埋,进而导致300 nm 处荧光峰发生猝灭,这与2.2 中粒径结果相符。
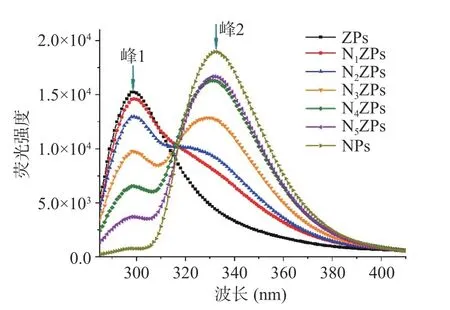
图3 玉米醇溶蛋白-假酸浆子胶复合颗粒的内源荧光光谱Fig.3 Internal fluorescence spectra of Zein-NPG composite particles
2.4 玉米醇溶蛋白-假酸浆子胶复合颗粒的热力学特性
采用DSC 研究NZPs 的热力学特性,DSC 热谱图如图4 所示,表2 为DSC 中的吸热峰和对应的吸热焓。图4 中所有样品在20~180 ℃升温范围内均呈现为较宽大的吸热峰,表明样品在热变性过程中受热导致化学键断裂,分子结构展开需要吸收热量,这与蛋白和多糖聚合物中结合水的蒸发有关[19]。ZPs的吸热峰出现在88.95 ℃,此处为Zein 的变性温度(Td)。NPs 的吸热峰出现在87.71 ℃。相比于ZPs或NPs,NZPs 的吸热峰温度均有所下降,且吸热峰峰面积明显减小。结合表2 可知,随着NPG 比例的增加,复合颗粒吸热峰温度呈现先降低后升高趋势,在N2ZPs 处(即Zein:NPG=5:1)降到最低77.54 ℃。此外,复合颗粒的吸热焓也有明显降低。相比于ZPs 或NPs,复合颗粒中蛋白多肽链结构舒展,分子链柔韧性较强,且蛋白-多糖之间的作用力主要为静电作用力、氢键、疏水键等次级键,因此导致复合物的热稳定性有所降低。但随着NPG 添加量的增加(N3ZPs~N5ZPs),NZPs 复合物形成了更紧密空间构象,且NPG 中亲水性基团的存在增加了水分子与二元聚合物网络的结合能力,导致热稳定性反而有所提高[20]。
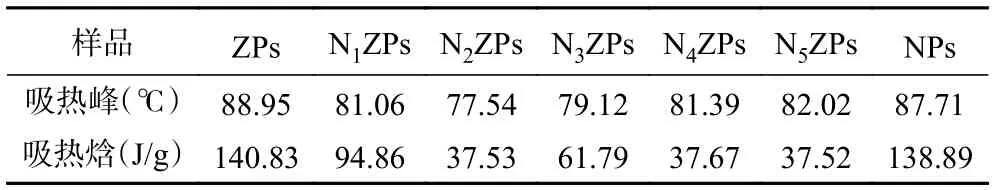
表2 玉米醇溶蛋白-假酸浆子胶复合颗粒的吸热峰和吸热焓Table 2 Endothermic peak and enthalpy of Zein-NPG composite particles
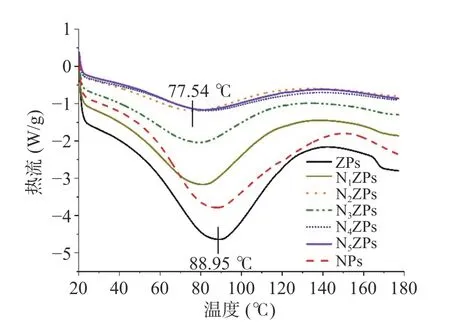
图4 玉米醇溶蛋白-假酸浆子胶复合颗粒的DSC 热谱图Fig.4 DSC thermal spectrum of Zein-NPG composite particles
2.5 玉米醇溶蛋白-假酸浆子胶复合颗粒的FT-IR
由图5 中NZPs 的FT-IR 可以看出,ZPs 在3304 cm-1处出现宽的吸收条带[21],NPs 在3417 cm-1处出现吸收带,根据之前的研究报道可知3500~3100 cm-1范围内的谱带是由O-H 的拉伸或N-H 拉伸振动引起的[7]。但是,当NPG 与Zein 按照不同的比例复合时,该谱带相比ZPs 分别红移至3305(N1ZPs)、3310(N2ZPs)、3314(N3ZPs)、3321(N4ZPs)、3392 cm-1(N5ZPs)。FT-IR 的强度、位移发生微妙的变化说明分子间发生了相互作用[22],此处FT-IR 谱峰位置发生变化可能是因为O-H 或N-H 基团的暴露,蛋白质-多糖复合物中形成了新的H 键[23]。
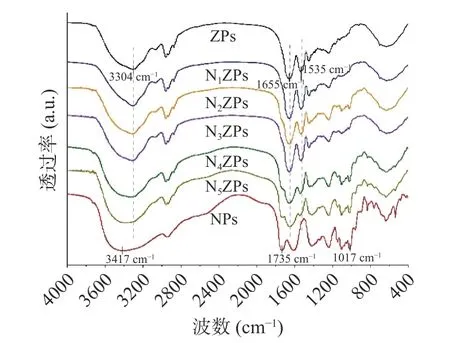
图5 玉米醇溶蛋白-假酸浆子胶复合颗粒的FT-IRFig.5 FT-IR spectra of Zein-NPG composite particles
在1655 cm-1和1535 cm-1处观察两个峰为Zein的主要特征峰,分别对应酰胺I 带(1690~1600 cm-1)和酰胺II 带(1575~1480 cm-1)区域。酰胺I 带主要反映了C-O 基团和C-N 基团伸缩振动。而酰胺II带主要反映了N-H 基团的弯曲振动和C-N 基团的伸缩振动[24]。NPG 加入后,可以观察到酰胺II 带和酰胺I 带特征峰明显缩小。对于样品N3ZPs、N4ZPs和N5ZPs 的特征峰在1540 cm-1附近,这与ZPs 相比发生较为明显的偏移。Wu 等[25]报道过复合物红外光谱中酰胺I 和酰胺II 区附近峰位的偏移表明了刺梧桐胶与Zein 之间存在静电相互作用,推断Zein 和NPG 之间同样存在较强静电相互作用,导致电子密度发生变化。
值得注意的是,Zein-NPG 复合胶体颗粒中N2ZPs~N5ZPs 样品均在1017 cm-1处出现新的官能团峰,N4ZPs 和N5ZPs 样品在1735 cm-1处出现新的官能团峰。对比发现,上述两个峰分别对应NPs在1017 cm-1处的C-C 骨架的振动和1735 cm-1处的C=O 的拉伸振动[26]。这表明NPG 中的-COOH与Zein 之间可能发生了相互作用,再次证明了蛋白与多糖的成功复合。
2.6 玉米醇溶蛋白-假酸浆子胶复合颗粒的微观形貌
采用SEM 观察Zein-NPG 复合颗粒的微观形貌(图6)。与先前的研究报道一致,ZPs 颗粒呈规则球形[27]。Zein 是一种球状蛋白,在乙醇水溶液中能形成球状的分子聚集体。对比发现,Zein 与NPG 复合物多为大尺寸的团聚体,证实了2.2 粒径结果中较大粒径复合物的形成。由图6b~f 可知,随着NPG比例的增加,Zein-NPG 复合颗粒由球状聚集体(N1ZPs)-网络状结构(N2ZPs、N3ZPs)-纤维状聚集体(N4ZPs)-交联成膜(N5ZPs)。低浓度的NPG 可以中和Zein 电荷,促进蛋白-多糖交联,当Zein:NPG 比例为5:1 时,观察到复合颗粒开始形成均匀的网络结构,随着多糖比例的增加,聚集程度越高,网络结构更为紧密,甚至在1:1(N4ZPs)时形成了纤维状的颗粒形貌。但当多糖浓度过高(Zein:NPG 达到1:2)时,蛋白颗粒之间发生严重粘连,进而诱导形成片状的膜结构。对比可知,Zein:NPG 比例为5:1(N2ZPs)时Zein-NPG 复合物内部的桥联相对疏松,这与2.4中DSC 结果一致。

图6 玉米醇溶蛋白-假酸浆子胶复合颗粒的微观形貌Fig.6 Morphology of Zein-NPG composite particles
2.7 NZPs 基Pickering 乳液流变特性及稳定性
2.7.1 流变特性 对不同Zein 和NPG 配比的复合颗粒构建的Pickering 乳液进行动态黏弹性分析,其储能模量(G')和损耗模量(G")结果如图7 所示。由图可知,随着剪切频率的增加,G'均大于G",表明上述Pickering 乳液更多表现为固体流变行为。随着NPG 配比的不断增加,G'和G"呈现先上升后下降的趋势,在Zein:NPG=1:1(N4ZPs)时G'和G"均达到最大,形成的乳液胶体体系结构结构最强,可能是因为该蛋白-多糖比例下颗粒内部静电相互作用和氢键都达到了平衡,同时颗粒粒径较小,液滴之间的相互作用显著[28],从而影响了Pickering 乳液的黏弹特性[29]。
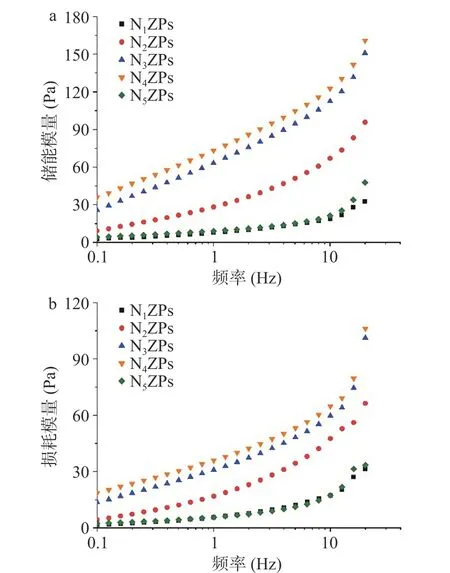
图7 NZPs 基Pickering 乳液的G'、G"值Fig.7 G' and G" values of Pickering emulsion based on NZPs
2.7.2 乳液的pH 稳定性和热稳定性 NZPs 基Pickering 乳液的pH 稳定性和热稳定性结果如表3所示。在不同pH(3、6、9)下,乳液放置3 d 后通过观察CI 值变化可知,ZPs 与NPs 乳液的CI 普遍高于Zein-NPG 复合颗粒乳液的CI 值,证明复合颗粒制备的Pickering 乳液的稳定性相对高于ZPs 或NPs基乳液。当pH 由3 增加到6 时,N2ZPs~N4ZPs 复合颗粒乳液的CI 随之增加。这可能是由于Zein 的等电点为6.2 左右,当pH 接近6 时,体系pH 接近等电点,聚合物溶解度降低从而导致乳化性的降低,聚合物出现絮凝沉淀,造成纳米粒子之间会发生粒子聚集[30]。当pH 远离等电点时(pH9),通过静电相互作用和疏水相互作用使复合颗粒粒子直径变小,颗粒处于良好的稳定状态没有出现大范围的聚集行为,此时的Pickering 乳液的稳定性相对较好[31]。
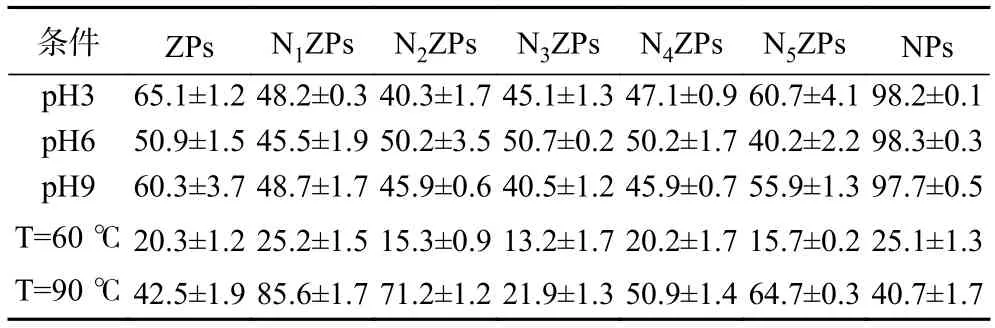
表3 NZPs 基Pickering 乳液的pH 稳定性和热稳定性(%)Table 3 pH stability and thermal stability of Pickering emulsion based on NZPs (%)
与pH 稳定性结果类似,在热处理温度条件为60 ℃下,同样观察到复合颗粒基Pickering 乳液CI值基本都低于ZPs 和NPs 乳液,表明NZPs 比单一蛋白或多糖具有更优良的乳液稳定效果。但当T=90 ℃时,析油现象比较明显,可能是因为较高加热温度下,蛋白发生严重变性,其空间构象遭到了破坏,复合颗粒的稳定性下降,进而导致乳液的热稳定性降低。另外,60 ℃加热下CI 值整体上小于90 ℃,这是由于在60 ℃加热下,蛋白的分子构象适当展开,提高了Zein 分子结构的柔韧性,使NZPs 复合颗粒更容易吸附在水/油界面上,从而提高了颗粒的乳化性及乳化稳定性[32]。
3 结论
本文通过热水浸提法提取了假酸浆子中的胶质多糖,并与Zein 按照不同比例制备成Zein-NPG 二元复合颗粒。结果显示,随着NPG 比例的增加,NZPs的表面润湿性越强,粒径尺寸越小且趋于均匀分布。DSC 结果表明,NZPs 的吸热峰温度和焓值相比单一Zein 或NPG 明显降低,复合物分子链的柔韧性增强。内源荧光光谱和FT-IR 显示,NPG 的引入改变了Zein 中酪氨酸残基所处微环境的极性,Zein 和NPG 之间存在H 键作用以及新的化学键生成。SEM图像表明,NZPs 微观形貌经历了球状聚集体-网络状结构-纤维状聚集体-成膜的过程。
虽然在不同pH 和加热处理下,NZPs 基Pickering 乳液的稳定性普遍高于单一的Zein 或NPG 乳液,但其分层现象均比较明显,为了更好满足食品工业化应用,后续还需要进一步提升Zein-NPG 二元复合颗粒的乳化性能。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

