土壤含水率对豫中植烟土壤微生物群落多样性及氮循环功能基因丰度的影响
刘威 赵园园 陈小龙 史宏志

摘要:为揭示豫中典型浓香型烤烟产区植烟土壤氮素矿化动态变化、土壤微生物多样性以及氮素循环功能基因对水分条件的响应特征,通过室内培养法研究50%(H-50%)、65%(H-65%)和80%(H-80%))持水量条件下,河南许昌植烟土壤细菌和真菌群落功能多样性的差异。结果表明,H-65%处理土壤的无机氮矿化量及矿化速率均高于其他处理。在土壤细菌中,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)、芽单胞菌门(Gemmatimonadetes)为优势菌门(相对丰度>3%),其中,H-80%处理中变形菌门的相对丰度显著高于其他处理,而厚壁菌门的相对丰度显著低于其他处理;H-50%处理中放线菌门、绿弯菌门的相对丰度显著高于其他处理。在土壤真菌中,子囊菌门(Ascomycota)占土壤真菌总OTU(operational taxonmic units)数的90%以上,其相对丰度随土壤含水率增加呈倒“V”的变化趋势。LEfSe(LDA effect size)分析结果表明,各处理在细菌属水平共检测出6种活性生物标志物(LDA值>3.5)。细菌群落具有丰富的功能多样性,一级功能层表现为代谢方面较活跃,二级功能层的功能基因丰度在不同含水率条件下发生明显变化;与固氮过程相关的固氮酶基因nifK、nifD、nifH 的相对丰度在不同处理中表现为H-50%>H-65%>H-80%,反硝化过程相关基因norB、nirK、nosZ的相对丰度均在H-65%处理最高。综合来看,合理调控土壤含水率可以有效调节豫中烟区土壤氮素矿化动态、土壤微生物群落功能多样性以及氮循环相关功能基因的丰度。
关键词:氮素矿化;土壤含水率;氮素循环;功能基因;土壤微生物群落结构
doi:10.13304/j.nykjdb.2022.0810
中图分类号: S153; S154 文献标志码:A 文章编号:10080864(2024)01021412
土壤微生物作为构成土壤生态系统的重要组成部分,在维持土壤生态系统物质循环、有机质分解、养分供应、能量流动等方面发挥着重要作用[1]。土壤微生物不仅是土壤营养元素微生物矿化、固定的执行者,其自身也是土壤养分库,通过微生物作用与周围环境发生交换,获得营养物质来满足自身需要,对生态系统土壤养分的有效性和流动性具有重要作用[23]。土壤氮循环是农业生态系统元素循环的关键组成部分,主要包括氮异化还原、氮同化还原、反硝化作用、固氮作用、硝化作用等过程[4]。氮矿化是土壤氮素循环中把有机氮转化成能被植物吸收利用的无机氮的过程[56]。
土壤含水率作为土壤氮素转化过程中至关重要的影响因素,通过改变土壤的孔隙度及孔隙分布影响氧气在土壤中的流通,进而影响微生物活性及其利用有机质的能力,最终影响土壤生态系统中的氮素矿化过程[7]。
从本质上讲,氮循环是由植物、真菌、细菌和古菌等共同催化的氮化合物氧化还原反应网络[8],其中土壤微生物作为主要的驱动者通过一系列相互关联的生化途径在促进氮循环上发挥着不可或缺的作用[9]。与氮循环相关的功能微生物主要通过相关功能基因的表达来调控各过程中关键酶的合成,进而调控土壤氮循环过程[10]。nifH 作为编码固氮酶的结构基因,也是固氮微生物最保守的功能基因,在生物固氮中发挥着重要的指示作用[11]。nirK和nirS 基因编码催化反硝化过程最关键的酶——亚硝酸还原酶,是反硝化过程中研究最多也是最重要的功能基因[12]。norB、nosZ 基因分别参与了反硝化过程中NO和NO2的还原[13]。amoA 基因的丰度可以表征催化硝化过程氨单加氧酶的活性。因此,通常采用以上功能基因来评价土壤微生物参与的氮循环过程[14]。
河南作为典型的浓香型烤烟产区,其气候特点表现为旺长期雨热同步,伸根期降雨偏少,成熟期温度较高[15]。烤烟生育期内雨热条件的变化导致其最适土壤相对含水量的不同,势必会引起土壤中可吸收氮量的差异,使烤烟从生理到形态上均表现出较大差异。在全球变暖的背景下,土壤水热环境发生极大变化,而土壤含水量作为影响土壤氮循环的重要外部因子,会引起微生物活性、丰度和群落结构及相关功能基因的改变。本研究以河南许昌植烟土壤为研究对象,采用室内模拟培养的方法,研究植烟土壤的氮素矿化过程、土壤微生物及氮循环功能基因对水分变化的响应,以期为烟草栽培中最适宜土壤含水率的设置提供理论依据,并为预测环境条件变化对植烟土壤氮素循环的影响提供科学依据。
1 材料与方法
1.1 试验材料
供试土壤取自浓香型烤烟代表产区河南许昌(33°95′N,113°55′E),该区属暖温带季风气候,年均气温16.30 ℃,年均降水量91.34 mm,主要集中在7—9月。该地土壤为黄河沉积物发育的潮土,质地为沙壤土。统一于烟株移栽前采集2—20 cm耕层土壤,按“S”形设置5个采样点,将各点土样混合,于室内自然风干后去除石砾和动植物残体等,磨细过0.01 mm筛。取一部分土壤用于土壤基础理化性质的测定,其余储存于4 ℃冷藏柜,用于室内培养。土壤基础理化性质:全氮1.48 g·kg-1,碱解氮68.76 mg·kg-1,有机质10.13 g·kg-1,硝态氮14.25 mg·kg-1,铵态氮11.97 mg·kg-1,pH 7.56,田间持水量203.00 g·kg-1。
1.2 试验设计与样品采集
试验设置50%(H-50%)、65%(H-65%)、80%(H-80%)共3个田间持水量水平,于35 ℃恒温培养35 d,各处理重复3次。称取过0.01 mm筛的土样25.00 g装入100 mL容量瓶中,加入蒸馏水调节至设定含水量。调节方法如下:将土样在容量瓶底均匀铺开,计算所需的水量,用注射器均匀加入。瓶口用塑料薄膜密封,薄膜上扎2个小孔,保持通气。期间每隔3 d通过称重法补充瓶内水分。于培养的第7、14、21、28、35天进行破坏性取样,用于测定土壤中硝态氮、铵态氮含量;于第35天采集土样用于分析土壤微生物群落功能多样性。
1.3 土壤指标测定及计算
土壤pH 按照土水质量比1.0∶2.5 混合后用pH 计测定;全氮(total nitrogen,TN)含量采用硫酸-催化剂消解-凯氏定氮法测定[16];土壤有机质(soil organic matter,SOM)含量采用重铬酸钾容量法-外加热测定;碱解氮含量采用碱解扩散法[17]测定;土壤田间持水量采用环刀法测定;土壤硝态氮(nitrate nitrogen,NO-3-N)、铵态氮(ammonianitrogen,NH+4-N)含量均使用试剂盒(苏州科铭生物技术有限公司)测定,并根据试剂盒使用说明书进行操作。计算土壤矿质氮含量、土壤硝化速率和土壤矿化速率。
土壤矿质氮含量=NO-3 含量+NH+4 含量(1)
土壤硝化速率=(各时段土壤NO-3 含量-初始
土壤NO-3 含量)/培养时间(2)
土壤矿化速率=(各时段土壤NO-3 和NH+4 总含量-初始土壤NO-3 和NH+4 含量)/培养时间(3)
1.4 土壤微生物群落分析
1.4.1 DNA提取和PCR扩增 土壤总DNA的提取采用HiPure Soil DNA Kit 试剂盒(D3142;广州美基生物科技有限公司),并用带有barcode的特异引物对提取的细菌和真菌基因组进行16SrRNA 区、ITS2 区进行PCR 扩增。其中细菌引物为341F (CCTACGGGGGCWCAG) 和806R(GGACTACHVGGGTATCTAAT)[18];真菌引物为ITS3-KYO2 (GATGAAGACGAGYRAA) 和ITS4(TCCTCCGCTTATTGATATGC)[19]。扩增产物经2%的琼脂糖凝胶电泳检测合格后进行纯化,构建测序文库,将纯化产物使用Novaseq PE250测序平台进行上机测序。
1.4.2 聚类与物种注释 用Usearch软件对获得的基因序列进行大规模筛选,并以97%的相似性将序列聚类成为操作分类单元(operationaltaxonomic units,OTUs),使用QIIME软件包挑选序列集合中丰度最高的序列作为各OTUs的代表序列,这些代表性序列集合用RDP Classifier 的Na?ve Bayesian assignment算法与数据库比对进行物种注释(设定置信度的阈值为0.8~1.0),获得各分类水平上的群落组成[2021]。
1.5 数据处理分析
利用Excel 2011 进行数据统计,用Origin2021 作图,通过SPSS 17.0 用多重比较法进行差异显著性检验(P<0.05)。基于已分类的OTU,利用QIIME 软件[22]计算细菌、真菌的α 多样性,包括Coverage 指数、Chao1 指数、Simpson 指数和Shannon 指数。利用R 软件包(R Studio)[23]对细菌和真菌群落进行主坐标分析(principalcoordinate analysis,PCoA)。使用基于线性判别分析(linear discriminant analysis, LDA)[24]的LEfSe(LDA effect size)找到丰度有差异的微生物类群及标志性物种,细菌LDA 阈值为3.5。利用PICRUSt2 软件进行16S rRNA 基因数据功能预测,参考KEGG(kyoto encyclopedia of genes andgenomes)数据库,得到KO(KEGG orthology)功能的丰度预测表及KEGG 氮循环途径相关基因丰度。
2 结果与分析
2.1 土壤含水率对土壤氮素矿化特征的影响
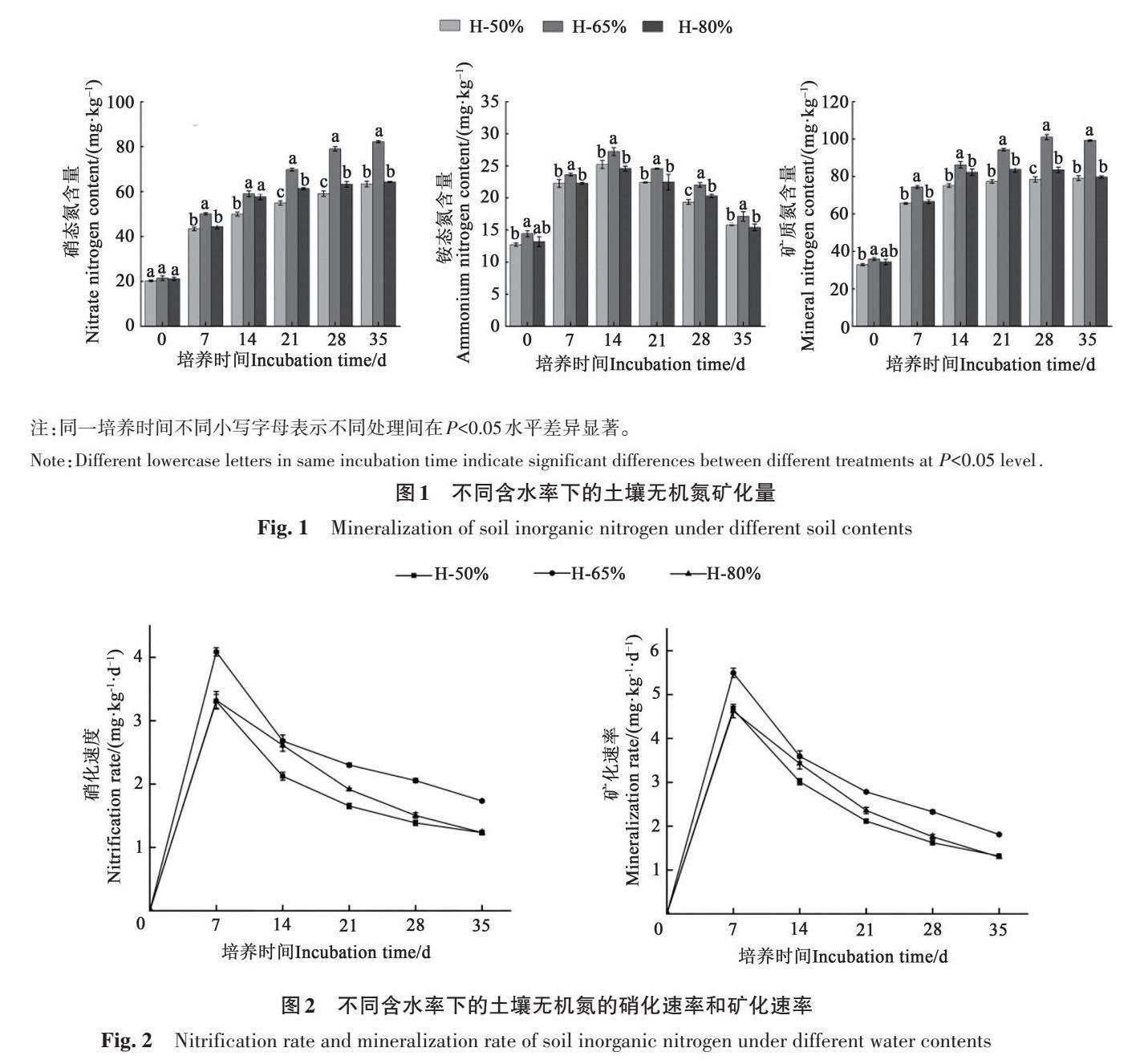
2.1.1 土壤含水率对无机氮矿化量的影响 从整个NO-3-N变化过程来看(图1),NO-3-N的矿化主要发生在培养的前21 d,其含量随培养时间的延长逐渐增加,在培养后期达到稳定状态。培养结束时,H-50%、H-65%和H-80%处理的土壤NO-3-N含量分别为63.39、82.19 和64.29 mg·kg-1,其中H-65%处理的NO-3-N含量显著高于其他处理。即NO-3-N含量随土壤含水率的增加而增加,超过一定范围,随着土壤含水率的继续增大,NO-3-N含量反而下降。由图1可知,NH+4-N的矿化主要发生在培养的前14 d,随着培养时间的延长,NH+4-N含量呈速增、平缓、速降的变化规律,最终稳定在较低水平。在培养的各个时期,H-65%处理的土壤NH+4-N 含量显著高于其他处理。各处理矿质氮含量随着培养时间的延长呈先迅速增加后缓慢增加的趋势,其中H-65% 和H-80% 处理的矿质氮含量在培养35 d时略有下降;在培养过程中,H-65%处理土壤矿质氮含量显著高于其他处理;在培养结束时,其土壤矿质氮含量最高,为99.31 mg·kg-1(图1)。
2.1.2 土壤含水率对无机氮矿化速率的影响
由图2 可知,随着时间的推移,各处理土壤的硝化速率和矿化速率均表现为先升高后快速降低、最终缓慢降低的趋势,在第7天时各处理土壤的硝化速率和矿化速率均达到峰值,其中H-65%处理的硝化速率和矿化速率最高,分别为4.09 和5.49 mg·kg-1·d-1。总体来看,H-65% 处理土壤的硝化速率、矿化速率最高;其次为H-80% 处理;H-50%处理最低。
2.2 土壤微生物群落结构分析
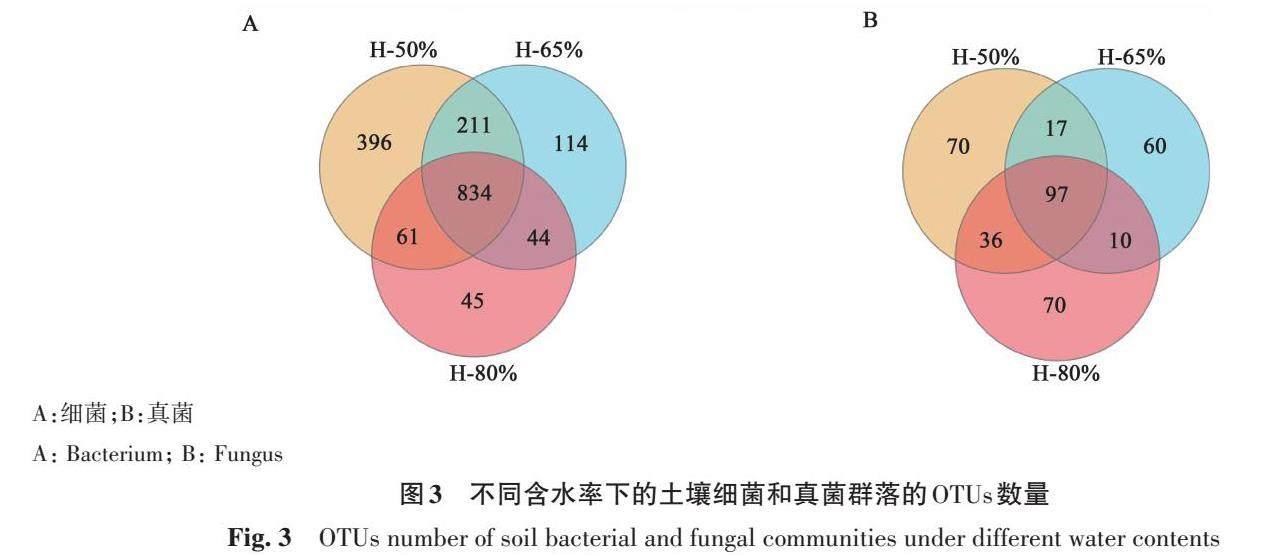
2.2.1 微生物物种Venn图分析 细菌OTUs分析结果(图3A)显示,H-50%、H-65%、H-80%处理检测到的特有OTU数分别为1 502、1 203、984;3个处理检测到的共有OTUs数为834;且随着土壤含水率的升高,细菌OTU数逐渐减少。真菌OTUs分析结果(图3B)显示,H-50%、H-65%、H-80%处理检测到的特有OTUs数分别为220、184、213,共有OTUs数为97,即真菌OTUs数表现为H-50%>H-80%>H-65%。
2.2.2 微生物群落在门水平上的组成 由图4A可知,相对丰度排名前10的菌门涵盖了土壤样品中超过98% 的细菌类群,其中变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)、芽单胞菌门(Gemmatimonadetes)的相对丰度大于3%,为优势菌门,累计占比超过90%。由表1可知,变形菌门在H-80%处理中的相对丰度显著高于其他处理;厚壁菌门在H-50%和H-65%处理中的相对丰度差异不显著,但均显著高于H-80%处理;放线菌门和绿弯菌门在H-50%处理中的相对丰度显著高于其他处理。随着土壤含水率的升高,变形菌门和浮霉菌门的相对丰度逐渐升高;而放线菌门、绿弯菌门的相对丰度逐渐降低。
由图4B可知,不同土壤含水率的样本中平均相对丰度大于1%的真菌门有3个,分别为子囊菌门(Ascomycota)、绿藻门(Chlorophyta)和担子菌门(Basidiomycota)。其中子囊菌门占土壤真菌总OTU数的90%以上,在H-65%处理中的相对丰度略高于其他处理,但差异不显著(表1)。
2.2.3 物种差异分析 LEfSe分析是一种基于线性判别分析(LDA)效应量,并将其与非参数的Kruskal-Wallis及Wilcoxon秩和检验相结合,从而筛选关键生物标记物(即组间差异显著物种)的分析方法。由图5 可知,H-50%、H-65% 和H-80% 处理的土壤样本中存在差异的细菌分别有18、2 和17 种。在属水平,苯基杆菌属(Phenylobacterium)、硝基菌属(Nitrolancea)、水恒杆菌属(Mizugakiibacter) 、链霉菌属(Streptomyces)、牙单胞菌属(Gemmatimonas)、固定杆菌属(Conexibacter)为6 种活性生物标志物(LDA 值>3.5),且表现出显著差异。其中,链霉菌属、固定杆菌属为H-50%处理的标志微生物;苯基杆菌属、硝基菌属、水恒杆菌属、牙单胞菌属为H-80% 处理的标志微生物; H-65% 处理未检测到标志微生物。
2.3 土壤微生物群落α 和β 多样性分析
Illumina MiSeq 测序分析表明,利用各样本在不同测序深度时的微生物OTUs 指数构建稀释曲线,随着测序深度的增加稀释曲线趋于平缓且测序数据达到饱和(图6),即测序数据量能够覆盖本研究中绝大部分土壤微生物群落,可以进行下一步分析。
Simpson 指数和Shannon 指数用来评价群落的多样性,Chao1 指数反映群落的丰富度,Coverage 指数反映群落覆盖度。对不同土壤含水率条件下土壤细菌和真菌群落的α 多样性指数进行分析,结果(图7)表明,不同处理下土壤细菌和真菌群落的丰富度和多样性存在差异。
H-65%、H-80% 处理下细菌的Coverage 指数显著高于H-50%处理,而H-50%处理下细菌的Chao1指数、Shannon 指数显著高于其他处理。真菌在不同含水率处理间的Chao1指数、Simpson指数、Shannon指数差异不显著,而H-80% 处理下真菌的Coverage指数显著高于其他处理。
细菌群落主坐标分析结果(图8)显示,PC1和PC2的贡献率分别为84.83% 和10.12%。可以看出,同一处理下不同样本间的重复性良好,且不同处理间群落结构差异较大,说明土壤含水率对土壤微生物细菌群落结构影响显著。真菌群落主坐标分析结果(图8)显示,PC1和PC2的贡献率分别为74.69%和8.02%。可以看出,同一处理下不同样本间的重复性较差,且不同处理间真菌群落差异不明显。
2.4 PICRUSt 功能预测分析
2.4.1 功能基因代谢通路特征 基于PICRUSt2软件进行菌群功能分析,得到不同处理样品细菌的功能预测信息(图9)。利用KEGG数据库对测序数据进行比对,在一层级下所有样品共涉及6类生物代谢通路,包括细胞过程(represents cellularprocess)、生物体系统(organismal systems)、代谢(metabolism)、人类疾病(human diseases)、遗传信息处理(geneticinformation processing)和环境信息处理(environmental information)。其中占主导功能的是代谢;其次为遗传信息处理和环境信息处理。二级功能层共预测出35种子功能,其中最主要的有24种。
2.4.2 氮素循环相关基因变化 基于16S rRNA测序结果和PICRUSt2工具获得的KEGG 65个直系同源基因簇(KO)的具体注释信息。将注释得到的所有KO值映射到KEGG代谢通路数据库的“氮代谢通路图”中,可比对出与氮代谢相关的功能基因,如图10所示。参与氮循环5个阶段(Ⅰ硝化作用、Ⅱ同化硝酸盐还原、Ⅲ异化硝酸盐还原、Ⅳ固氮作用、Ⅴ反硝化作用)的相关基因共有23个,展现出丰富的氮代谢功能多样性。
由图11可知,硝化过程常用氨单加氧酶的编码基因amoA、amoB、amoC 及羟胺氧化还原酶的编码基因hao 作为主要的功能基因均在H-50%处理中的相对丰度较高。与固氮作用相关的固氮酶基因主要包括nifK、nifD、nifH、anfH,其中nifK、nifD、nifH 基因在不同处理中的相对丰度表现为H-50%>H-65%>H-80%,而anfH 基因在H-65% 处理中的相对丰度最高。一氧化氮还原酶基因norB、亚硝酸还原酶基因nirK、氧化亚氮还原酶基因nosZ 作为反硝化作用过程的关键基因均在H-65% 处理中的相对丰度较高。氧化亚氮还原酶基因nirS 在H-50%处理中的相对丰度较高。
3 讨论
本研究表明,在一定范围内,土壤NO-3 -N、NH+4 -N含量随着土壤含水率的增加而增加;超过一定范围后,其含量随着土壤含水率的增大反而下降。H-65% 处理土壤的NO-3-N、NH+4-N 含量均显著高于其他处理,与周才平等[25]的研究结果相似。这可能是由于土壤中氧气含量随着土壤含水率的升高逐渐降低,抑制了氨化作用微生物的活性。随着培养时间的延长,NH+4-N含量总体上呈速增、平缓、速降的变化规律,最终稳定在较低水平,可能是由于NH+4-N含量的增加抑制了氨化微生物的活性,而以矿化出的NH+4 -N为氮源的土壤微生物迅速繁殖,将NH+4-N逐渐转化为NO-3-N,导致NH+4-N含量逐渐降低[26]。NO-3-N含量随着培养时间的延长整体呈现上升趋势,与韩晓飞等[27]研究结果一致。
本研究表明,随着土壤含水率的变化,土壤细菌群落多样性及丰富度发生显著变化,而真菌群落对水分变化的响应并不明显,与Ren 等[28]、Waldrop等[29]的研究结果一致。这可能是由于水分条件的改变使土壤碳氮含量及养分有效性发生变化,细菌、真菌在不同土壤环境中具有生理差异性[30]。研究发现,土壤不同细菌群落存在适宜其生长的水分条件的生态位[31]。放线菌门作为对固氮作用、硝化作用贡献率最大的细菌门[32],其相对丰度随着土壤含水率的升高逐渐降低。Barnard等[33]也发现,在干旱条件下放线菌门的相对丰度较大,变形菌门的相对丰度则随含水率的升高逐渐升高。变形菌门大多是兼性或专性厌氧菌,具有较强的氧化胁迫耐受能力,说明其更适应含水率较高的生长环境,与本研究结果一致。土壤真菌群落随着土壤水分梯度的变化也会发生变化,本研究表明,担子菌门的相对丰度随土壤水分含量的升高逐渐降低,这与刘会会等[34]的研究结果一致。子囊菌门作为典型的陆生型真菌,占土壤真菌总OTUs数的90%以上,适应在土壤水分低、通气条件好的环境中生存与繁殖[35]。本研究发现,子囊菌门的相对丰度随土壤水分含量的升高呈倒“V”型的变化趋势,即在H-65%处理最高,因此需要进一步研究影响其丰度变化的因素。
土壤水分条件的变化能够影响氮循环基因的丰度。本研究显示,nirK 基因的相对丰度随着土壤含水率的增加呈倒“V”型的变化趋势,在H-65%处理最高,可能是因为土壤含水率的升高形成了土壤中过度还原的条件,使反硝化底物浓度降低,从而抑制了反硝化微生物的繁殖与生长[4]。研究表明,nirK 基因的相对丰度与NO-3-N、NH+4 -N含量呈显著正相关[3,36],这与本研究H-65%处理中NO-3-N、NH+4-N 含量显著高于其他处理的研究结果一致。nirS 基因的相对丰度随土壤含水率的升高逐渐降低,可能是由于高含水量的土壤环境不利于氨化作用和反硝化作用[37]。反硝化过程中通过(nirK+nirS)/nosZ 值可预测N2O 排放,通过提高nosZ 基因丰度,降低该比值使N2O还原大于产生,进而减少N2O 的排放[38]。本研究表明,H-65% 处理显著提高了nosZ 基因的丰度,且(nirK+nirS)/nosZ 值低于其他处理,可减少N2O 的产生,进而减小反硝化过程对环境的污染。与硝化过程相关的amoA、amoB、amoC 基因的相对丰度均与NO-3-N、NH+4-N含量呈显著负相关[39],因此不同含水率的土壤可能通过影响其NO-3-N、NH+4-N含量进而影响硝化过程相关功能基因的表达。
本研究通过室内模拟培养的方法解析了不同土壤含水率对氮素矿化及土壤微生物的影响,但是土壤微生物(细菌、古菌、真菌及病毒)互作机制及土壤-微生物-烟草系统中三者是否存在协同进化的交互作用及机制亟待进一步研究,因此在今后的研究中有必要在大田生长条件下对功能基因与土壤性质、微生物群落结构间的关系进行深入分析,从而揭示土壤氮循环过程的分子生物学机制以及土壤微生物群落与生态功能间的关联机制,为有效调控优质烟叶生产所需要土壤氮素供应量提供科学依据。
参考文献
[1] 范瑞英,杨小燕,王恩姮,等.黑土区不同林龄落叶松人工林土壤微生物群落功能多样性的对比研究[J].北京林业大学学报,2013,35(2):63-68.
FAN R Y, YANG X Y, WANG E Y, et al .. Comparative studieson functional diversity of soil microbial community of larchplantations with different ages in black soil region [J]. J.Beijing For. Univ., 2013, 35(2):63-68.
[2] 仇少君,彭佩钦,荣湘民,等.淹水培养条件下土壤微生物生物量碳、氮和可溶性有机碳、氮的动态[J].应用生态学报,2006,17(11):2052-2058.
QIU S J, PENG P Q, RONG X M, et al .. Dynamics of soilmicrobial biomass carbon, nitrogen and soluble organic carbonand nitrogen under submerged cultivation [J]. Chin. J. Appl.Ecol., 2006, 17(11): 2052-2058.
[3] 马秀艳,蒋磊,宋艳宇,等.温度和水分变化对冻土区泥炭地土壤氮循环功能基因丰度的影响[J].生态学报,2021,41(17):6707-6717.
MA X Y, JIANG L, SONG Y Y, et al .. Effects of temperatureand water changes on gene abundance of nitrogen cyclingfunction in peatland soil in permafrost region [J]. J. Ecol.,2021, 41(17):6707-6717
[4] 吴照祥,刘巧丽,李辉虎,等.有机肥对退化红壤中细菌群落功能组成影响的PICRUSt 基因预测分析[J].江苏农业科学,2021,49(16):60-66.
WU Z X, LIU Q L, LI H H, et al .. PICRUSt gene predictionanalysis of the effect of organic fertilizer on the functionalcomposition of bacterial community in degraded red soil [J].Jiangsu Agric. Sci., 2021, 49(16):60-66.
[5] 谷海红,李岩,刘宏斌,等.土壤氮素矿化及其对烤烟品质的影响研究进展[J].中国农学通报,2008,24(10):327-333.
GU H H, LI Y, LIU H B, et al .. Research progress on soilnitrogen mineralization and its effect on flue-cured tobaccoquality [J]. Chin. Agric. Sci. Bull., 2008, 24(10):327-333.
[6] ZANG X, WANG Q, LI L, et al .. Seasonal variations innitrogen mineralization under three land use types in agrassland landscape [J]. Acta Oecol., 2008, 34(3):322-330.
[7] KLAUS B, ELIZABETH M, BAGGS M, et al .. Nitrous oxideemissions from soils: how well do we understand the processesand their controls? [J/OL]. Philos. Trans. R. Soc. Lond. B Biol.Sci., 2013, 368(1621):20130122 [2022-08-10]. https://doi.org/10.1098/rstb.2013.0122.
[8] COSKUN D, BRITTO D T, SHI W, et al .. How plant rootexudates shape the nitrogen cycle [J]. Trends Plant Sci., 2017,22(8):661-673.
[9] 林伟,李玉中,李昱佳,等.氮循环过程的微生物驱动机制研究进展[J].植物营养与肥料学报,2020,26(6):1146-1155.
LIN W, LI Y Z, LI Y J, et al .. Research progress on microbialdriving mechanism of nitrogen cycle process [J]. Plant Nutr.Fert. Sci., 2020, 26 (6):1146-1155.
[10] OUYANG Y, EVANS S E, FRIESEN M L, et al .. Effect ofnitrogen fertilization on the abundance of nitrogen cyclinggenes in agricultural soils: a meta-analysis of field studies [J].Soil Boil. Biochem., 2018, 127(12):71-78.
[11] KIZILOVA A K, TITOVA L V, KRAVCHENKO I K, et al ..Evaluation of the diversity of nitrogen-fixing bacteria in soybeanrhizosphere by nifH gene analysis [J]. Microbiology, 2012, 81(5):621-629.
[12] 王海涛,郑天凌,杨小茹,等.土壤反硝化的分子生态学研究进展及其影响因素[J].农业环境科学学报,2013,32(10):1915-1924.
WANG H T, ZHENG T L, YANG X R, et al .. Advances inmolecular ecology of soil senitrification and its influencingfactors [J]. J. Agric. Environ. Sci., 2013, 32(10):1915-1924.
[13] KELLY C N, SCHWANER G W, CUMMING J R, et al ..Metagenomic reconstruction of nitrogen and carbon cyclingpathways in forest soil: influence of different hardwood treespecies [J/OL]. Soil Biol. Biochem., 2021, 156(5): 108226[2022-08-10]. https://doi.org/10.1016/j.soilbio.2021.108226.
[14] 廖李容,王杰,张超,等.禁牧对半干旱草地土壤氮循环功能基因丰度和氮储量的影响[J].应用生态学报,2019,30(10):3473-3481.
LIAO L R, WANG J, ZHANG C, et al .. Effects of grazingprohibition on gene abundance and nitrogen storage of soilnitrogen cycle function in semi-arid grassland [J]. Chin. J.Appl. Ecol., 2019, 30(10):3473-3481.
[15] 刘晓迎,左璇,刘雅星,等. 河南浓香型烟叶产区气候条件分析[J].河南农业科学,2017,46(3):52-58.
LIU X Y, ZUO X, LIU Y X, et al .. Analysis on climatic conditionsin Henan uzhou flavor tobacco leaf production area [J]. J. Henan Agric. Sci., 2017, 46(3):52-58.
[16] 鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,2000:1-638.
[17] 鲍士旦. 土壤农化分析[M]. 北京:中国农业科技出版社:2000:1-495.
[18] GUO M J, WU F H, HAO G E, et al .. Bacillus subtilis improvesimmunity and disease resistance in rabbits [J/OL]. Front.Microbiol., 2017, 8:354 [2022-08-10]. https://doi.org/.10.26914/c.cnkihy.2019.033734.
[19] TOJU H, TANABE A S, YAMAMOTO S, et al .. High-coverageITS primers for the DNA-based identification of ascomycetesand basidiomycetes in environmental samples [J/OL]. PLoSOne, 2012, 7(7):e40863 [2022-08-10]. https://doi.org/10.1371/journal.pone.0040863.
[20] EDGAR R C. UPARSE: highly accurate OTU sequences frommicrobial amplicon reads [J]. Nat. Methods, 2013, 10(10):996-998.
[21] EDGAR R C. Search and clustering orders of magnitude fasterthan BLAST [J]. Bioinformatics, 2010, 26(19):2460-2461.
[22] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al ..QIIME allows analysis of high-throughput communitysequencing data [J]. Nat. Methods, 2010, 7(5):335-336.
[23] 徐扬,张冠初,丁红,等.土壤类型对花生根际土壤细菌群落多样性和产量的影响[J].生物技术通报,2022,38(6):221-234.
XU Y, ZHANG G C, DING H, et al .. Effects of soil types onbacterial community diversity and yield in peanut rhizospheresoil [J]. Biol. Bull., 2022, 38(6):221-234.
[24] SEGATA N, IZARD J, WALDRON L, et al .. Metagenomicbiomarker discovery and explanation [J]. Genome Biol., 2011,12(6):1-18.
[25] 周才平,欧阳华.温度和湿度对暖温带落叶阔叶林土壤氮矿化的影响[J].植物生态学报, 2001, 25(2):204-209.
ZHOU C P, OUYANG H. Effects of temperature and humidity onsoil nitrogen mineralization in warm temperate deciduous broadleavedforest [J]. J. Plant Ecol., 2001,25(2):204-209.
[26] 胡坤. 典型香型烟区植烟土壤氮素矿化及云南大理烤烟减氮增效效果研究[D]. 郑州:河南农业大学,2017.
HU K. Study on nitrogen mineralization of tobacco plantingsoil in typical aromatic tobacco area and effect of nitrogenreduction and efficiency increase of flue-cured tobacco in Dali,Yunnan [D]. Zhengzhou: Henan Agricultural University, 2017.
[27] 韩晓飞,郑文冉,徐畅,等.重庆市植烟区不同肥力植烟土壤氮素矿化特性研究[J].中国农学通报,2010,26(24):188-192.
HAN X F, ZHENG W R, XU C, et al .. Study on nitrogenmineralization characteristics of different fertility tobaccoplanting soils in Chongqing tobacco planting area [J]. Chin.Agric. Sci. Bull., 2010, 26(24):188-192.
[28] REN C J, CHEN J, LU X, et al .. Responses of soil total microbialbiomass and community compositions to rainfall reductions [J].Soil Boil. Biochem., 2018, 11(6):4-10.
[29] WALDROP M P, FIRESTONE M K. Response of microbialcommunity composition and function to soil climate change [J].Microbiol. Ecol., 2006, 52(4):716-724.
[30] 杨阳,陈克龙,章妮,等.青海湖流域高寒湿地土壤微生物群落对不同降水梯度的响应[J].应用与环境生物学报,2022,28(2):290-299.
YANG Y, CHEN K L, ZHANG N, et al .. Response of soilmicrobial community of alpine wetland in Qinghai Lake basinto different precipitation gradients [J]. J. Appl. Environ. Biol.,2022, 28(2):290-299.
[31] LENNON J T, AANDERUD Z T, LEHMKUHL B K, et al ..Mapping the niche space of soil microorganisms using taxonomyand traits [J]. Ecology, 2012, 93(8):1867-1879.
[32] 徐惠风,刘兴土,白军红.长白山沟谷湿地乌拉苔草沼泽湿地土壤微生物动态及环境效应研究[J].水土保持学报,2004,18(3):115-117,122.
XU H F, LIU X T, BAI H J. Study on soil microbial dynamicsand environmental effects of carex wula swamp wetland inChangbai mountain valley wetland [J]. J. Soil Water Conserv.,2004,18(3):115-117,122.
[33] BARNARD R L, OSBORNE C A, FIRESTONE M K. Responsesof soil bacterial and fungal communities to extreme desiccation andrewetting [J]. ISME J., 2013, 7(11): 2229-2241.
[34] 刘会会, 喻庆国, 王行, 等. 碧塔海湿地不同水分梯度下土壤真菌群落结构及功能类群研究[J]. 微生物学报,2022,62(8):3007-3023.
LIU H H, YU Q G, WANG X, et al.. Study on community structureand functional groups of soil fungi under different water gradientsin Bitahai wetland [J]. J. Microbiol., 2022, 62(8):3007-3023.
[35] TANG Y S, WANG L, JIA J W, et al .. Response of soilmicrobial community in Jiuduansha wetland to differentsuccessional stages and its implications for soil microbialrespiration and carbon turnover [J]. Soil Biol. Biochem., 2011,43(3):638-646.
[36] 张文学,王少先,夏文建,等.脲酶抑制剂与硝化抑制剂对稻田土壤硝化、反硝化功能菌的影响[J].植物营养与肥料学报,2019,25(6):897-909.
ZHANG W X, WANG S X, XIA W J, et al.. Effects of ureaseinhibitor and nitrification inhibitor on functional nitrifier anddenitrifier in paddy soil [J]. Plant Nutr. Fert. Sci., 2019, 25(6):897-909.
[37] 国秀丽.温度和水分对土壤碳、氮转化影响的研究[D].长春:吉林农业大学, 2003.
GUO X L. The country is beautiful study on the effects oftemperature and water on the transformation of soil carbonand nitrogen [D]. Changchun: Jilin Agricultural University,2003.
[38] LEVY-BOOTH D J, PRESCOTT C E, GRAYSTON S J.Microbial functional genes involved in nitrogen fixation,nitrification and denitrificati on in forest ecosystems [J]. SoilBiol. Biochem., 2014, 75(8):11-25.
[39] 马龙, 高伟, 栾好安, 等. 有机肥/秸秆替代化肥模式对设施菜田土壤氮循环功能基因丰度的影响[J]. 植物营养与肥料学报,2021,27(10):1767-1778.
MA L, GAO W, LUAN H A, et al .. Effects of partial substitutionof chemical fertilizer with manure and/or straw on the abundanceof functional genes related to soil N-cycling [J]. Plant Nutr. Fert.Sci., 2021, 27(10):1767-1778.
(责任编辑:张冬玲)

