lncRNA DANCR靶向调控miR-193a-3p表达对缺氧诱导的神经细胞氧化损伤的影响
宋海英 李红霞 王逍

摘要 目的:探讨长链非编码RNA(lncRNA)DANCR对缺氧诱导的大鼠肾上腺嗜铬细胞PC12氧化损伤的影响及其可能作用机制。方法:选取榆林市星元医院于2019年10月—2021年10月就诊的缺血性脑卒中病人40例为疾病组,以同期30名健康体检者为正常组,检测lncRNA DANCR、miR-193a-3p表达量,Pearson法分析血清lncRNA DANCR与miR-193a-3p的相关性;建立缺氧诱导的PC12细胞损伤模型,si-NC、si-DANCR、miR-NC、miR-193a-3p mimics分别转染至PC12细胞后缺氧处理24 h,si-DANCR+anti-miR-NC、si-DANCR+anti-miR-193a-3p分别共转染至PC12细胞后缺氧处理24 h;实时荧光定量聚合酶链式反应(qRT-PCR)检测lncRNA DANCR、miR-193a-3p表达量;试剂盒检测乳酸脱氢酶(LDH)漏出率、丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性;用凋亡试剂盒检测凋亡率;双荧光素酶报告实验检测lncRNA DANCR、miR-193a-3p靶向关系;蛋白质免疫印迹法(Western Blot)检测cleaved-Caspase-3、cleaved-Caspase-9蛋白表达量。结果:血清中lncRNA DANCR与miR-193a-3p表达呈负相关。缺氧处理后,PC12细胞中lncRNA DANCR表达量升高(P<0.05),miR-193a-3p表达量降低(P<0.05);分别与转染si-NC或miR-NC比较,转染si-DANCR或miR-193a-3p mimics后,缺氧诱导的PC12细胞LDH漏出率、MDA含量、凋亡率、cleaved-Caspase-3、cleaved-Caspase-9蛋白水平降低(P<0.05),SOD活性升高(P<0.05);与共转染si-DANCR+anti-miR-NC比较,共转染si-DANCR+anti-miR-193a-3p后,缺氧诱导的PC12细胞LDH漏出率、MDA含量、凋亡率、cleaved-Caspase-3、cleaved-Caspase-9蛋白水平升高(P<0.05),SOD活性降低(P<0.05)。结论:干扰lncRNA DANCR可通过促进miR-193a-3p表达而抑制氧化应激、细胞凋亡,从而减轻缺氧诱导的PC12细胞损伤,血清中lncRNA DANCR、miR-193a-3p水平对缺血性脑卒中病人具有预测价值,且联合诊断价值更高。
关键词 缺氧;长链非编码RNA DANCR;miR-193a-3p;神经细胞;氧化应激;细胞凋亡
doi:10.12102/j.issn.1672-1349.2024.02.013
作者单位 1.榆林市星元医院( 陕西榆林 719000);2.陕西中医药大学附属医院(陕西咸阳 712000)
通讯作者 王逍,E-mail:459403867@qq.com
引用信息 宋海英,李红霞,王逍.lncRNA DANCR靶向调控miR-193a-3p表达对缺氧诱导的神经细胞氧化损伤的影响[J].中西医结合心脑血管病杂志,2024,22(2):279-285.
缺血性脑卒中属于脑血管疾病,我国缺血性脑卒中发病率、死亡率逐年上升,严重影响病人生活质量,脑组织缺氧、缺血可促进神经细胞损伤进而诱发神经功能障碍[1]。长链非编码RNA(lncRNA)可调节细胞分化、代谢等生理过程,并可在脑血管疾病发生中发挥调控作用[2]。已有研究表明,lncRNA MALAT1在缺氧诱导的大鼠肾上腺嗜铬细胞PC12中表达量增加,并可促进细胞凋亡、氧化应激[3-4]。lncRNA DANCR在葡聚糖硫酸钠诱导的肠上皮细胞中表达上调,并可增加白细胞介素(IL)-1β、IL-6表达量、细胞凋亡率从而引起细胞损伤[5]。但lncRNA DANCR与脑血管疾病相关研究相对较少。StarBase预测显示,lncRNA DANCR、miR-193a-3p存在结合位点。有研究表明,miR-193a-3p在高糖诱导的人视网膜内皮细胞损伤中表达降低,上调其表达可减轻高糖诱导的人视网膜内皮细胞凋亡[6]。目前lncRNA DANCR、miR-193a-3p在缺氧诱导的PC12细胞损伤中的研究尚未见报道。因此,本研究主要探究lncRNA DANCR/miR-193a-3p是否介导缺氧诱导的PC12细胞损伤过程。
1 材料与方法
1.1 材料与试剂
上海通派生物科技有限公司提供大鼠肾上腺嗜铬细胞PC12;美国Thermo Fisher公司提供Lipofectamine 2000、Trizol、反转录试剂盒;北京天根生化科技有限公司提供miRNA提取、SYBR Green试剂盒;上海吉玛制药技术有限公司提供si-NC、si-DANCR、miR-NC、miR-193a-3p mimics、pcDNA、pcDNA-DANCR、anti-miR-NC、anti-miR-193a-3p;南京建成生物工程研究所提供乳酸脱氢酶(LDH)、丙二醛(MDA)、超氧化物歧化酶(SOD)检测试剂盒;上海爱必信生物科技有限公司提供凋亡检测试剂盒;美国Promega公司提供野生型载体WT-DANCR、突变型载体MUT-DANCR;北京索莱宝公司提供荧光素酶活性检测试剂盒;美国Abcam公司提供实验所需cleaved-Caspase-3、cleaved-Caspase-9、甘油醛-3-磷酸脱氢酶(GAPDH)一抗及二抗。
1.2 方法
1.2.1 一般资料
选取2019年10月—2021年10月于榆林市星元医院就诊的缺血性脑卒中病人40例为疾病组,均为我院依据相关标准确诊的缺血性脑卒中病人,其中男18例,女22例;年龄45~68(61.65±3.72)岁;另选取30名同期健康体检者作为正常组,男12名,女18名;年龄44~71(63.55±1.52)岁。研究对象性别、年龄等一般资料比较差异均无统计学意义(P>0.05)。分别采集40例病人及30名健康体检者空腹静脉血6 mL,离心分离血清后保存至-80 ℃待测。
1.2.2 实验处理及分组
PC12细胞用含有10%胎牛血清(FBS)的DMEM培养基培养,记为对照组。依据细胞密度不同分别接种于6孔板(1×105个/孔)、96孔板(2×103个/孔),放入缺氧培养箱(37 ℃、4%CO2体积分数、95%N2、1%O2)内缺氧处理24 h[7],记为缺氧组。si-NC、si-DANCR、miR-NC、miR-193a-3p mimics用Lipofectamine 2000分别转染至PC12细胞,转染48 h,缺氧处理24 h,分别记为缺氧+si-NC组、缺氧+si-DANCR组、缺氧+miR-NC组、缺氧+miR-193a-3p组。si-DANCR与anti-miR-NC、si-DANCR与anti-miR-193a-3p用Lipofectamine 2000分别共转染至PC12细胞,转染48 h,缺氧处理24 h,分别记为缺氧+si-DANCR+anti-miR-NC组、缺氧+si-DANCR+anti-miR-193a-3p组。
1.2.3 实时荧光定量聚合酶链式反应(qRT-PCR)检测血清及细胞中lncRNA DANCR、miR-193a-3p的表达水平
用Trizol试剂、miRNA提取试剂盒分别提取细胞总RNA,用反转录试剂盒将RNA反转录合成cDNA,qRT-PCR反应体系:SYBR Green Master Mix 10 μL/孔,正反向引物0.8 μL/孔,cDNA 1 μL/孔,双蒸水(ddH2O)补足体系至20 μL。GAPDH表达量作为lncRNA DANCR内参,U6表达量作为miR-193a-3p内参,2-ΔΔCt法分析lncRNA DANCR、miR-193a-3p相对表达量。
1.2.4 检测LDH漏出率、MDA含量、SOD活性
收集1.2.2实验分组PC12细胞,参照试剂盒说明书检测LDH水平,并检测细胞吸光度(OD),计算LDH漏出率。将1.2.2中实验分组PC12细胞分别接种于24孔板后弃培养基,加入裂解液裂解细胞,用试剂盒检测上清液中MDA含量、SOD活性。
1.2.5 流式细胞术检测细胞凋亡率
取各组PC12细胞接种于6孔板,弃培养基,胰蛋白酶消化,取细胞悬液(1×105个/mL),离心(1 000 r/min)10 min,弃上清,膜联蛋白Ⅴ(Annexin Ⅴ)-异硫氰酸荧光素(FITC)、碘化丙啶(PI)分别染色,流式细胞仪检测凋亡率。
1.2.6 验证lncRNA DANCR、miR-193a-3p的靶向关系
双荧光素酶报告实验:WT-DANCR/MUT-DANCR与miR-NC、miR-193a-3p mimics用Lipofectamine 2000分别共转染至PC12细胞,培养48 h,试剂盒检测荧光素酶活性。qRT-PCR实验:si-NC、si-DANCR、pcDNA、pcDNA-DANCR用Lipofectamine 2000分别转染至PC12细胞,培养48 h,qRT-PCR法检测miR-193a-3p相对表达量。
1.2.7 蛋白质免疫印迹法(Western Blot)检测蛋白表达量
RIPA裂解液提取PC12细胞蛋白,蛋白、上样缓冲液充分混匀,沸水内放置5 min。在每个泳道上加入40 μg蛋白后进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),采用常规湿法将蛋白凝胶转移至聚偏氟乙烯(PVDF)膜,5%脱脂牛奶封闭2 h,与稀释的一抗[cleaved-Caspase-3(1∶1 000)、cleaved-Caspase-9(1∶1 000)、GAPDH(1∶2 000)]4 ℃反应24 h,与稀释的二抗(1∶3 000)37 ℃结合1 h,以GAPDH为内参,采用Quantity One软件对蛋白条带进行定量。
1.3 统计学处理
采用SPSS 21.0统计学软件分析数据。定量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义;采用Pearson相关分析法分析缺血性脑卒中病人lncRNA DANCR、miR-193a-3p表达的相关性。
2 结 果
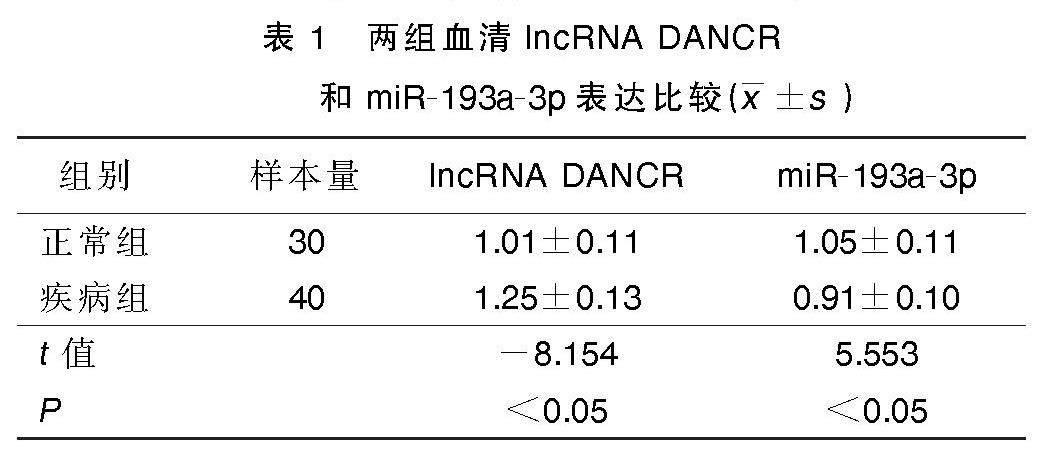
2.1 疾病组与正常组血清lncRNA DANCR和miR-193a-3p表达比较
与正常组相比,疾病组血清lncRNA DANCR表达增加,miR-193a-3p表达降低(P<0.05)。详见表1。
2.2 血清中lncRNA DANCR和miR-193a-3p的相关性
Pearson相关分析结果显示,缺血性脑卒中病人血清lncRNA DANCR和miR-193a-3p呈负相关(r=-0.365,P<0.05)。详见图1。
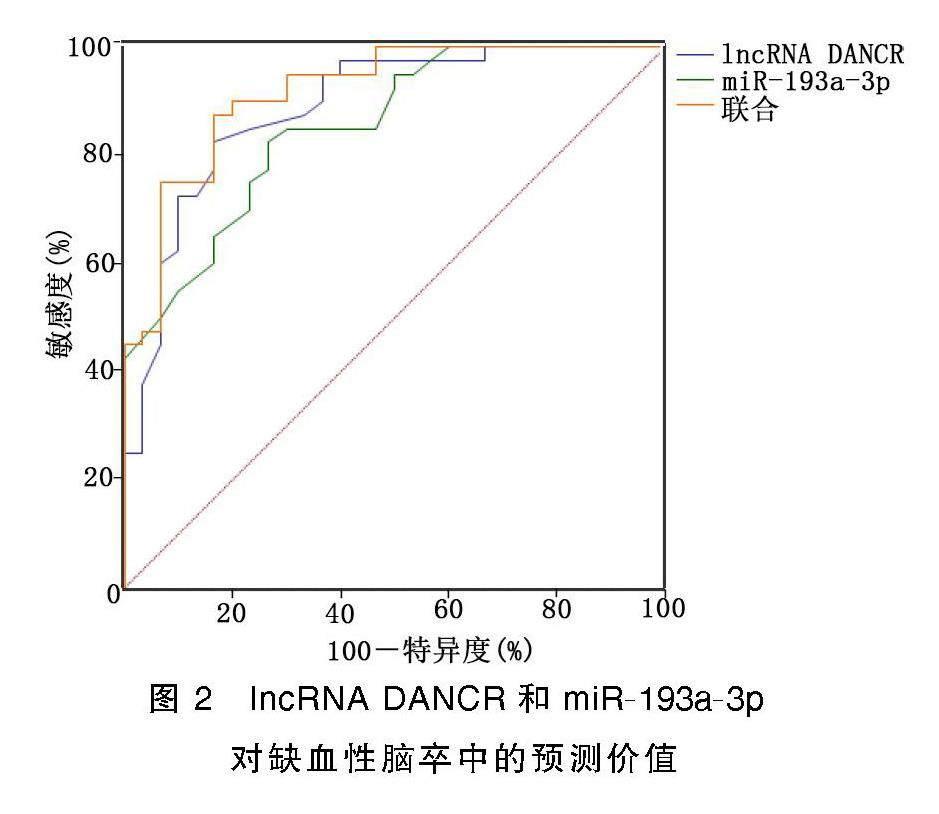
2.3 血清lncRNA DANCR和miR-193a-3p水平对缺血性脑卒中的预测价值
血清lncRNADANCR、miR-193a-3p水平预测缺血性脑卒中病人的曲线下面积分别为0.888、0.853,特异度分别为83.33%、73.33%,敏感度分别为82.50%、82.50%,最佳截断值分别为0.84、0.59;二者联合预测缺血性脑卒中病人的曲线下面积、特异度、敏感度分别为0.917、83.33%、87.50%。详见图2。
2.4 lncRNA DANCR和miR-193a-3p在缺氧诱导的神经细胞损伤中的表达
与对照组比较,缺氧组lncRNA DANCR表达量升高(P<0.05),miR-193a-3p表达量降低(P<0.05)。详见表2。
2.5 干扰lncRNA DANCR表达对缺氧诱导的神经细胞氧化损伤的影响
与对照组比较,缺氧组LDH漏出率、MDA含量升高(P<0.05),SOD活性降低(P<0.05),凋亡率、cleaved-Caspase-3、cleaved-Caspase-9蛋白表达水平升高(P<0.05);与缺氧+si-NC组比较,缺氧+si-DANCR组LDH漏出率、MDA含量降低(P<0.05),SOD活性升高(P<0.05),凋亡率、cleaved-Caspase-3、cleaved-Caspase-9蛋白表达水平降低(P<0.05)。详见图3、表3。
2.6 lncRNA DANCR靶向调控miR-193a-3p的表达
lncRNA DANCR、miR-193a-3p存在互补序列,详见图4。miR-193a-3p过表达可降低野生型载体WT-DANCR荧光素酶活性(P<0.05),而对突变型载体MUT-DANCR荧光素酶活性无明显影响。详见表4。与si-NC组比较,si-DANCR组miR-193a-3p表达量升高(P<0.05);与pcDNA组比较,pcDNA-DANCR组miR-193a-3p表达量降低(P<0.05)。详见表5。
2.7 miR-193a-3p过表达对缺氧诱导的神经细胞氧化损伤的影响
与缺氧+miR-NC组比较,缺氧+miR-193a-3p组LDH漏出率、MDA含量降低(P<0.05),SOD活性升高(P<0.05),凋亡率、cleaved-Caspase-3、cleaved-Caspase-9蛋白表达水平降低(P<0.05)。详见图5、表6。
2.8 下调miR-193a-3p表达逆转了干扰lncRNA DANCR表达对缺氧诱导的神经细胞氧化损伤的作用
与缺氧+si-DANCR+anti-miR-NC组比较,缺氧+si-DANCR+anti-miR-193a-3p组LDH漏出率、MDA含量升高(P<0.05),SOD活性降低(P<0.05),凋亡率、cleaved-Caspase-3、cleaved-Caspase-9蛋白表达水平升高(P<0.05)。详见图6、表7。
3 讨 论
lncRNA作为内源性长链非编码RNA分子,其作用机制主要为lncRNA含有miRNA结合位点,一个lncRNA包含多个miRNA的反应元件,并可通过充当miRNA竞争性内源RNA(ceRNA)而影响miRNA靶基因表达,该机制在细胞增殖、凋亡等生物学过程中具有重要调控作用,并可参与神经细胞损伤过程[8-10]。
lncRNA DANCR在氧糖剥夺诱导心肌细胞损伤中表达水平升高,lncRNA DANCR直接与miR-19a-3p结合,敲低lncRNA DANCR可促进心肌细胞增殖、抑制细胞凋亡[11]。lncRNA DANCR表达下调可降低氧化型低密度脂蛋白(ox-LDL)诱导的血管平滑肌细胞炎性细胞因子水平并减少细胞凋亡[12]。骨折病人血清中lncRNA DANCR表达明显升高,干扰lncRNA DANCR可促进成骨细胞系的增殖和分化[13]。lncRNA DANCR在缺氧诱导的PC12细胞损伤中的作用机制尚未明确。本研究结果显示,缺血性脑卒中病人血清及缺氧条件下PC12细胞中lncRNA DANCR表达上调,提示lncRNA DANCR可能促进神经细胞损伤,引发神经功能障碍,在缺血性脑卒中发生、发展中发挥作用。LDH、MDA属于氧化酶,SOD属于抗氧化酶,SOD可清除负氧离子而保护细胞免受损伤[14]。本研究结果显示,缺氧诱导的PC12细胞LDH、MDA水平升高,SOD活性降低,而干扰lncRNA DANCR可降低LDH、MDA水平,并可增强SOD活性,提示干扰lncRNA DANCR可抑制氧化应激而减轻细胞损伤。Caspase家族蛋白可参与脑组织损伤过程,cleaved-Caspase-3、cleaved-Caspase-9表达量增加可促进神经细胞凋亡[15]。本研究结果显示,缺氧诱导的PC12细胞凋亡能力增强,其主要通过激活Caspase-3、Caspase-9而促进细胞损伤,干扰lncRNA DANCR可减弱缺氧对PC12细胞凋亡的作用。提示干扰lncRNA DANCR可抑制缺氧诱导的PC12细胞凋亡。
本研究进一步证实lncRNA DANCR、miR-193a-3p存在靶向调控作用,lncRNADANCR可以充当miR-193a-3p ceRNA而抑制其表达。有研究表明,miR-193a-3p过表达可减轻ox-LDL诱导的血管内皮细胞氧化损伤并抑制细胞凋亡[16]。miR-193a-3p在脂多糖(LPS)诱导的人胚肺成纤维细胞中表达下调,上调其表达可抑制细胞凋亡和炎症损伤[17]。然而,Jiang等[18]研究表明脓毒症致急性肺损伤中miR-193a-3p表达增加,并促进促炎细胞因子分泌量、细胞凋亡增加,降低细胞活力。表明miR-193a-3p在不同组织损伤中可发挥不同作用。本研究结果显示,缺血性脑卒中病人血清及缺氧诱导的PC12细胞中miR-193a-3p表达量降低,miR-193a-3p过表达可抑制细胞氧化应激、减少凋亡,而下调miR-193a-3p可降低干扰lncRNA DANCR对细胞氧化应激、凋亡的作用,且血清lncRNA DANCR与miR-193a-3p表达呈明显负相关,提示lncRNA DANCR/miR-193a-3p可介导缺氧诱导的PC12细胞损伤过程,且血清lncRNA DANCR、miR-193a-3p水平对缺血性脑卒中具有预测价值,且联合诊断价值更高。
综上所述,干扰lncRNA DANCR可通过靶向调控miR-193a-3p而抑制氧化应激、细胞凋亡,从而抵抗缺氧诱导的PC12细胞损伤,lncRNA DANCR对神经细胞的作用与miR-193a-3p密切相关,为进一步阐释缺血性脑卒中的分子机制奠定实验基础,lncRNA DANCR可能是缺血性脑卒中潜在治疗靶点。但lncRNA DANCR/miR-193a-3p如何调控下游靶基因表达而参与神经细胞损伤过程仍需进一步探究。
参考文献:
[1] ZHENG X Y,LEI B X,LIN Y Y,et al.Long noncoding RNA MEG3 silencing protects against hypoxia-induced pheochromocytoma-12 cell injury through inhibition of TIMP2 promoter methylation[J].Journal of Cellular Physiology,2020,235(2):1649-1662.
[2] DENG D,LIANG H.Silencing MEG3 protects PC12 cells from hypoxic injury by targeting miR-21[J].Artificial Cells,Nanomedicine,and Biotechnology,2020,48:610-619.
[3] HU Y B,YE C,CHENG S,et al.Propofol downregulates lncRNA MALAT1 to alleviate cerebral ischemia-reperfusion injury[J].Inflammation,2021,44(6):2580-2591.
[4] YANG L,XU F,ZHANG M,et al.Role of lncRNA MALAT-1 in hypoxia-induced PC12 cell injury via regulating p38MAPK signaling pathway[J].Neuroscience Letters,2018,670:41-47.
[5] ZHANG X J,MA L Z,ZHANG C,et al.Silencing LncRNA-DANCR attenuates inflammation and DSS-induced endothelial injury through miR-125b-5p[J].Gastroenterologiay Hepatologia,2021,44(9):644-653.
[6] 秦建民,张来香,魏振英.miR-193a-3p抑制高糖诱导人视网膜血管内皮细胞凋亡[J].基础医学与临床,2021,41(7):995-1000.
[7] 孙小琴,任玲,孙阳阳,等.microRNA-499通过靶向调节SOX6抵抗缺氧诱导的神经细胞损伤[J].神经解剖学杂志,2018,34(1):53-59.
[8] YI M,LI Y,WANG D,et al.KCNQ1OT1 exacerbates ischemia-reperfusion injury through targeted inhibition of miR-140-3p[J].Inflammation,2020,43(5):1832-1845.
[9] WANG J T,FU Z Q,WANG M H,et al.Knockdown of XIST attenuates cerebral ischemia/reperfusion injury through regulation of miR-362/ROCK2 axis[J].Neurochemical Research,2021,46(8):2167-2180.
[10] CHEN Z P,CHEN X M,GUO R,et al.Protective effects of lncRNA H19 silence against hypoxia-induced injury in PC-12 cells by regulating miR-28[J].International Journal of Biological Macromolecules,2019,121:546-555.
[11] RUAN Y,LI H,CAO X J,et al.Inhibition of the lncRNA DANCR attenuates cardiomyocyte injury induced by oxygen-glucose deprivation via the miR-19a-3p/MAPK1 axis[J].Acta Biochimica et Biophysica Sinica,2021,53(10):1377-1386.
[12] ZHANG R L,HAO Y M,ZHANG J R.The lncRNA DANCR promotes development of atherosclerosis by regulating the miR-214-5p/COX20 signaling pathway[J].Cellular & Molecular Biology Letters,2022,27(1):15.
[13] JIANG S Y,MIAO Y X,HIROKAZU T,et al.Effects of lncRNA DANCR on proliferation and differentiation of osteoblasts by regulating the Wnt/β-catenin pathway[J].European Review for Medical and Pharmacological Sciences,2019,23(13):5558-5566.
[14] 张运辉,周小青,伍大华,等.二苯乙烯苷和远志总皂苷配伍对Aβ25-35诱导PC12细胞损伤的影响[J].湖南中医药大学学报,2020,40(2):134-138.
[15] ZHANG L,WANG H P,LIU Y,et al.Morroniside protects HT-22 cells against oxygen-glucose deprivation/reperfusion through activating the Nrf2/HO-1 signaling pathway[J].Journal of Receptors and Signal Transduction,2022,42(1):9-15.
[16] 王彬,齐县伟,张宪亮.miR-193a-3p通过调控S100A4表达对oxLDL诱导的血管内皮细胞损伤影响[J].中国循证心血管医学杂志,2021,13(6):742-746;751.
[17] NONG W X.Long non-coding RNA NEAT1/miR-193a-3p regulates LPS-induced apoptosis and inflammatory injury in WI-38 cells through TLR4/NF-κB signaling[J].American Journal of Translational Research,2019,11(9):5944-5955.
[18] JIANG Y,ZHANG W.LncRNA ZFAS1 plays a role in regulating the inflammatory responses in sepsis-induced acute lung injury via mediating miR-193a-3p[J].Infection,Genetics and Evolution,2021,92:104860.
(收稿日期:2022-06-13)
(本文编辑王丽)

