活细胞应激反应过程中线粒体和核仁微环境动力学的荧光寿命成像研究*
杨志刚 刘颖超 张仕青 罗瑞鉴 赵需谦 连加荣 屈军乐
(深圳大学物理与光电工程学院,光电子器件与系统教育部/广东省重点实验室,深圳 518060)
核仁和线粒体在维持细胞平衡发挥重要作用,研究其生理过程有助于深入了解生物学功能.本文采用一种红色荧光的芘罗丹明荧光探针在不同条件下靶向标记细胞线粒体和核仁.通过激光共聚焦成像和荧光寿命成像技术分析HeLa 细胞在光照和药物刺激下细胞凋亡的形态变化,并利用相图定量分析了线粒体与核仁的微环境变化,确定在稳态HeLa 细胞中探针标记到的线粒体的平均荧光寿命约为3.65 ns,线粒体黏度约为66×10-3 Pa·s.在激光光照后,探针标记到HeLa 细胞线粒体的荧光寿命降至3.61 ns,对应线粒体黏度增至约131×10-3 Pa·s;使用紫杉醇和秋水仙碱诱导细胞凋亡,观察到探针标记于HeLa 细胞核仁的荧光寿命先增加后降低,反映了在HeLa 细胞凋亡过程中核仁微环境的变化,证明HeLa 细胞在非稳态情况下核仁和线粒体的功能变化,为线粒体和核仁功能障碍相关疾病研究提供了新的研究方法.
1 引言
核仁被称为“细胞的核糖体工厂[1],主要由纤维中心、致密纤维组分和颗粒组分构成[2],是核糖体合成和RNA 组装的场所[3],与细胞生长和增殖密切相关,核仁的异常通常导致疾病如癌症的发生[4,5].同时,黏度作为细胞微环境的重要参数之一,为维持细胞器生理过程的正常运行提供保障,对细胞器结构和功能发挥着显著的影响,细胞微环境黏度变化对RNA 的扩散和运动影响深远,甚至可以改变活细胞中RNA 的功能[6-8].此外,线粒体作为细胞中重要的“能量工厂”,受到外界刺激损伤会发生黏度变化[9],线粒体异常是代谢或神经退行性疾病等发生发展的重要标志[10-17].在阿尔兹海默症等神经退行性疾病中,脑组织中神经细胞线粒体黏度明显增大[18],并且核仁的形态也与神经退行性疾病密切相关[19,20].此外,DNA 损伤、热刺激、病毒入侵等各种压力刺激下,核仁的结构会发生如崩解等形态学变化[20,21].因此,研究线粒体和核仁形态变化和量化局部黏度值将有助于深入研究核仁和线粒体的生物学功能.
近年来,不同荧光探针被用于亚细胞结构标记与成像,其中有机染料作为构建荧光探针的主要部分[22-25],相比于荧光蛋白、纳米材料等在细胞器标记与成像方面具有显著优势.有机荧光分子探针具有体积小、成像分辨率高等优势可用于活细胞线粒体和核仁的标记成像及外界刺激下的应激反应研究,如线粒体微环境黏度定量变化[26-28],线粒体和核仁之间可逆迁移成像,监测在紫外光照射、秋水仙碱及紫杉醇等诱导细胞凋亡过程中线粒体膜电位变化[8].Dutta 等[1]研究线粒体和核仁在非偶联氧化磷酸化、诱导细胞凋亡和细胞周期停滞过程中微黏度变化,指出同时存在于线粒体和核仁的特定蛋白引导了这两种细胞器之间的相互关联.对线粒体和核仁受到上述刺激产生应激反应的定量研究有利于深入了解其相关生物学功能.因此,开展基于小分子荧光探针的线粒体与核仁成像研究,对局部环境中线粒体和核仁形态变化进行实时监测和定量分析具有重要意义.
在本工作中,为了跟踪线粒体和核仁并量化细胞应激反应过程中线粒体和核仁的局部环境变化,采用了一种基于芘罗丹明荧光染料 (RH) 作为标记线粒体与核仁的标记探针,RH 具有红色荧光,在不同实验条件下可以靶向标记活细胞的线粒体和核仁,通过荧光成像和荧光寿命成像(fluorescence lifetime imaging microscopy,FLIM) 实时监测线粒体和核仁形态及微环境变化.此外,通过FLIM 定量线粒体黏度可以研究细胞应激反应过程中线粒体微环境的变化,同时在研究过程中应用相图技术进行定量分析[29],为更好地了解细胞应激反应中线粒体和核仁微环境变化在维持细胞稳态中的作用提供研究手段.
2 实验测试与荧光成像材料
2.1 实验试剂
ER-Tracker Blue,Lyso-Tracker Green,Mito-Tracker Deep Red FM 和Hochest 33342 购自美国Invitrogen 公司;胎牛血清 (fetal bovine serum,FBS) 购自美国Sigma 公司,双抗 (penicillin streptomycin,PS),DMEM 培养基、磷酸盐缓冲盐水(phosphate buffer saline,PBS) 和其他细胞培养试剂购自美国Gibco 公司;小牛胸腺DNA、酵母RNA、DNase I 和RNase A 购自美国Aldrich公司.
2.2 荧光探针测试仪器及制备方法
RH 探针在不同溶剂、不同极性、不同pH 值和黏度环境中的吸收、发射光谱和荧光寿命研究,分别使用紫外可见分光光度计 (GBC Cintra2020)和模块化荧光光谱仪 (HORIBA Fluorolog-3) 记录紫外可见吸收光谱和荧光发射光谱及荧光寿命.不同极性的溶剂由四氢呋喃和水按体积分数递增10%的比例混合而成,不同黏度溶剂由甘油和甲醇按照体积分数递增10%的比例混合制备而成,不同pH 值的溶剂由在去离子水中滴加盐酸或氢氧化钠溶液配制而成.参考Zhang 等[30]工作,吸收光谱所用探针浓度为5 μmol/L,发射光谱和荧光寿命所用探针浓度均为1 μmol/L.染料分子的荧光信号比吸收光谱信号灵敏,因此,一般吸收光谱使用的浓度比荧光光谱的高.吸收光谱使用的浓度如果过低,则吸光度小,光谱波动较大,导致的误差也较大.
2.3 细胞培养和共定位实验
将HeLa 细胞(人宫颈癌细胞)、COS-7 细胞(非洲绿猴肾成纤维细胞)和ID-8 细胞(小鼠卵巢上皮癌细胞)以约1.5×105的密度接种在玻璃底培养皿上,添加10% FBS 和1% PS 的DMEM 混合培养基,将细胞皿置于5% CO2,37 ℃的细胞培养箱中培养24 h,待细胞密度达到60%后,将细胞生长状态良好的细胞皿取出进行下一步实验.将HeLa 细胞分别与RH 探针、商品化的内质网探针、溶酶体探针、线粒体探针和细胞核探针共孵育,置于细胞培养箱中培养30 min.其中,RH 探针(0.5 μmol/L) 分别与商品化内质网探针ERTracker Blue (0.5 μmol/L),溶酶体探针Lyso-Tracker Green (0.05 μmol/L) 和线粒体探针(Mito-Tracker Deep Red FM) (0.5 μmol/L) 共孵育,RH 探针 (2 μmol/L) 和商用细胞核探针Hoechst 33342 (0.2 μmol/L) 共孵育.细胞成像前,用PBS洗涤两次后,用于共聚焦激光扫描显微 (confocal laser scanning microscope,CLSM) 成像 (Nikon A1,60×油镜,数值孔径1.49).然后分别采集以下通道的图像: 425—475 nm (ER-Tracker Blue 和Hoechst 33342),500—550 nm (Lyso-Tracker Green),570—620 nm (RH),667.5—732.5 nm (Mito-Tracker Deep Red),共定位分析结果的Pearson 系数由Image J 软件计算获得.
2.4 核酸消化实验
加入1 mL 的4%多聚甲醛溶液用来固定HeLa细胞,置于培养箱培养20 min,之后取出用PBS清洗两次.固定后的细胞分别加入1 mL 的无DNase I 的RNase A (100 μg/mL) 和无RNase A 的DNase I (100 U/mL),空白对照组仅加入1 mL 的PBS,置于培养箱2 h 之后用PBS 冲洗两次,再与RH 探针(2 μmol/L) 和Hoechst 33342 (0.2 μmol/L)共孵育30 min.细胞成像前用PBS 洗涤两次,之后加入新的PBS,留待使用.
2.5 CLSM 成像和FLIM 成像
为了研究RH 在标记不同细胞线粒体和核仁的情况,分别将HeLa 细胞、COS-7 细胞和ID-8 细胞分别与RH (0.5,2 μmol/L) 共孵育,置于细胞培养箱中培养30 min,之后用PBS 洗涤两次,并加入新鲜培养基,进行相应培养待用.为了研究线粒体和核仁在细胞凋亡过程中的动态变化,使用紫杉醇和秋水仙碱诱导HeLa 细胞凋亡.细胞中分别加入含100 nmol/L 紫杉醇、10 nmol/L 和100 nmol/L 秋水仙碱的培养基,然后置于培养箱中培养,其中加入秋水仙碱的置于培养箱培养30 min,加入紫杉醇的则培养0.5,1,2,4 h,之后用PBS 清洗两次,然后用2 μmol/L 的RH 探针孵育30 min.细胞成像前用PBS 洗涤两次,加入新鲜培养基.为了研究光照对细胞线粒体和核仁的影响,CLSM 成像过程使用“时间序列”功能采集荧光图像.同时,使用FLIM 系统(DCS120,100倍油镜,数值孔径1.49) 研究线粒体在光照刺激下发生的断裂、融合等形态变化以及核仁在紫杉醇和秋水仙碱诱导细胞凋亡情况下发生的微环境变化,使用SPCImage (8.4 版本,Becker&Hickl GmbH) 进行荧光寿命拟合和相图分析,采用双指数拟合.
3 结果与讨论
首先,为了研究荧光探针的光物理特性,分别测试了RH 在不同溶剂极性、pH 值及不同黏度环境中的紫外吸收、荧光发射光谱和荧光衰减寿命,如图1 所示.RH 在二氯甲烷、丙酮、甲醇等溶剂中的吸收、发射光谱变化较小,随着溶剂极性增大,最大吸收波长 ((576±3) nm) 或发射峰值(590 nm),位移较小(图1(a),(b)和表1);另外,进一步测试RH 在四氢呋喃与水混合溶剂中的荧光变化,随着四氢呋喃的比例逐渐增大,溶剂的极性(介电常数)连续减小,探针的荧光发射强度变化较小,最大变化幅度不超过10%.随着水含量的增大(>90%),RH 的荧光强度显著降低,可能是由于RH 在水中溶解度低,发生聚集导致荧光减弱 (见图1(c),(d)).此外,在覆盖细胞生理pH 值3—12的范围内RH 的荧光寿命变化仅为0.06 ns (图1(e),(f)),环境pH 值对RH 的荧光寿命的影响较小.相较极性和pH 的影响,RH 在不同黏度环境中的荧光强度和荧光寿命变化较大,如图1(g)—(h)所示,随着甘油含量的增大(甲醇与甘油混合溶剂),环境黏度从甲醇(0.6×10-3Pa·s)增至甘油(0.945 Pa·s),探针的荧光强度和荧光寿命均呈现规律下降趋势,荧光强度降低幅度超过50%,荧光寿命从3.95 ns下降到3.45 ns,降低幅度达到0.5 ns.因此,探针RH 受到环境黏度影响更大,而可以忽略环境极性和pH 变化对探针的影响.溶剂极性对荧光寿命的影响主要包括溶剂分子介电常数、氢键等因素对荧光染料分子的作用.首先,RH 分子带一个正电荷,能量比较低,溶剂的极性(介电常数)对RH 分子的影响较小;另外,RH 分子中没有氢键活性结构,溶剂分子也不能与染料发生氢键作用,因此RH 分子对溶剂极性不敏感,环境极性对RH 探针荧光寿命的影响可以忽略.在分子设计上,我们采用芘与间氨基酚合成罗丹明衍生物,旨在构造对黏度响应的荧光探针,芘的相对振动或转动,可以影响罗丹明衍生物的荧光效应,参照课题组以前的黏度分子转子研究工作[27,31,32].本文采用芘作为振动部分(不能完全转动)来调控荧光分子的荧光信号,通过分子模拟(高斯计算),在低黏度环境中,分子中芘与罗丹明衍生结构处于垂直状态,二者之间没有电子转移淬灭效应,荧光寿命长,在黏度环境中,芘与罗丹明结构发生一定转动,增强电子转移淬灭的效应,导致荧光寿命缩短.因此,可以将探针分子的荧光寿命与环境黏度关联用于研究微环境的黏度效应.对探针的荧光强度或荧光寿命构建与黏度的函数关系,可以通过测量荧光寿命定量分析所处环境的黏度.

图1 荧光探针RH 光物理性能研究 (a) RH 在不同溶剂中的紫外吸收光谱;(b) RH 在不同溶剂中的荧光光谱;(c) RH 在不同比例的四氢呋喃和水混合溶剂中的发射光谱,激发波长495 nm;(d) 荧光强度与不同比例的四氢呋喃和水混合溶剂之间的关系;(e) RH 在不同pH 值溶剂环境中荧光寿命衰减曲线;(f) RH 的荧光寿命与pH 值的关系;(g) RH 在甲醇和甘油混合的黏度溶剂中的发射光谱(室温20 ℃),激发波长495 nm;(h) 荧光强度与黏度同时取对数后的线性关系;(i) RH 在甲醇和甘油混合的黏度溶剂中的荧光衰减曲线(室温20 ℃),荧光寿命的激发波长为456 nm;(j) RH 荧光寿命与黏度同时取对数后的线性关系Fig.1.Fluorescence spectra of RH in different solvents: (a) UV absorption spectrum of RH in different solvents;(b) fluorescence spectra of RH in different solvents;(c) the emission spectrum of RH in the mixture of tetrahydrofuran and water with an excitation wavelength of 495 nm;(d) the relationship between fluorescence intensity and different proportions of the mixture of tetrahydrofuran and water;(e) RH fluorescence lifetime decay curves of RH in solvents with different PH values;(f) relationship between the fluorescence lifetime of RH and PH value;(g) emission spectrum of RH in the viscous solvent mixed with methanol and glycerol (room temperature 20 ℃),excitation wavelength is 495 nm;(h) linear relationship between fluorescence intensity and viscosity after taking logarithm simultaneously;(i) the fluorescence attenuation curve of RH in a viscous solvent mixed with methanol and glycerol (room temperature 20 ℃),the excitation wavelength of the fluorescence lifetime is 456 nm;(j) linear relationship between fluorescence lifetime and viscosity after taking logarithm simultaneously.

表1 探针RH 在不同溶剂中的吸收发射波长及荧光寿命Table 1.Absorption,emission wavelength and fluorescence lifetime of probe RH in different solvents.
此外,还研究了探针RH 分别对DNA 与RNA的荧光滴定分析,分别获得了RH 的荧光光谱和荧光寿命响应曲线,如图2 所示.向RH 的水溶液中刚加入DNA 或RNA 时,RH 的发射强度均显著下降,之后随着DNA 或RNA 的继续滴加,产生不同幅度的增强.可能是刚加入DNA 或RNA 时,RH 探针因正负电荷吸引被吸附到DNA 或RNA表面发生荧光淬灭(图2(a)—(d)),随着DNA 或RNA 的继续增加,探针又逐渐分散并嵌入DNA或RNA 中,使得荧光强度产生增强.同样,RH 的荧光寿命也随着DNA 或RNA 的增加而发生相应的变化,如图2(e)—(h)所示,RH 荧光寿命随DNA含量增大而延长,从3.72 ns 增至5.02 ns;而RH探针与RNA 结合后寿命先由3.72 ns 降至2.97 ns,之后随RNA 含量增大缓慢增至3.65 ns.可能因DNA/RNA 的单双链结构不同,发生作用的方式也不一样.为了进一步解释探针的荧光变化,利用Autodocking 生物对接计算软件分别模拟了探针RH 与DNA (CGCGATATCGCG 序 列),RNA(任选了有一个位置没有配位的双链RNA) 进行了模拟计算.结果如图2(i),(j)所示,探针只是附着在DNA 序列表面,没有嵌入到DNA 的大沟、小沟或碱基序列中,这种作用的结合能较高(-5.25 eV)且只有一种结合方式,可能因为探针分子位阻较大,导致探针与DNA 作用力较弱;而对配位有缺失的双链RNA 序列,通过对接计算可以明显发现,探针RH 与RNA 的作用构型有两种,都嵌入到缺失的配位点,并且是探针带正电荷的罗丹明部分插入RNA 中,疏水的芘基团分别伸向小沟和大沟中,结合能分别是-11.2 eV 和-11.62 eV,结合能较低,说明探针与RNA 具有较强的结合力,具有稳定的结合模式,这也相应解释探针与DNA 和RNA 作用后的荧光与荧光寿命的变化.

图2 探针RH (1 μmol/L) 的DNA/RNA 荧光滴定光谱及荧光寿命衰减曲线以及生物计算对接模拟探针与DNA/RNA 的结合模式 (a) RH 的RNA 荧光滴定光谱;(b) RH 的荧光强度随RNA 浓度变化曲线;(c) RH 的DNA 荧光滴定光谱;(d) RH 的荧光强度随DNA 浓度的变化曲线;(e) RH 的RNA 荧光滴定的荧光寿命衰减曲线;(f) RH 的荧光寿命随RNA 浓度的变化曲线;(g) RH的分子结构模型以及RH 的DNA 荧光滴定的荧光寿命衰减曲线;(h) RH 的荧光寿命随DNA 浓度的变化曲线,激发光波长456 nm;(i) RH 与DNA 的生物对接模拟计算;(j) RH 与RNA 的生物对接模拟计算,横坐标为分子结合能,纵坐标为分子结构,使用开源的Windows 版Autodocking 软件Fig.2.The DNA/RNA fluorescence titration spectrum and fluorescence lifetime decay curve of probe RH (1 μmol/L) and the binding mode of probe with DNA/RNA were simulated by biocomputation: (a) RNA fluorescence titration spectroscopy of RH;(b) the fluorescence intensity of RH varies with the concentration of RNA;(c) DNA fluorescence titration spectroscopy of RH;(d) the fluorescence intensity of RH varies with the concentration of DNA;(e) fluorescence lifetime decay curve for RNA fluorescence titration of RH;(f) the fluorescence lifetime of RH varies with RNA concentration;(g) molecular structure model of RH and fluorescence lifetime decay curve for DNA fluorescence titration of RH;(h) the fluorescence lifetime of RH varies with DNA concentration;excitation light wavelength 456 nm;(i) biological docking simulation of RH and DNA;(j) biological docking simulation of RH and RNA;where the horizontal coordinate is the molecular binding energy,and the vertical coordinate is the molecular structure,using the open source Windows version of Autodocking software.
为了研究探针在细胞内的定位情况,分别采用两种不同浓度的RH (0.5,2 μmol/L)与HeLa 细胞进行孵育,经过30 min 的培养后,通过复染与共定位成像发现RH 探针在较低浓度 (0.5 μmol/L)时主要定位到线粒体上;在高浓度(2 μmol/L) 时,除了定位线粒体也明显定位在细胞核仁.
图3(a)—(l)分别是商用溶酶体、内质网、线粒体探针和RH 探针标记HeLa 细胞的荧光成像及迭加图和Pearson 相关系数分析;RH 探针在低浓度 (0.5 μmol/L) 情况下与线粒体探针的Pearson共定位系数最高(达到0.89) (图3(i)—(l)),高于与溶酶体探针的共定位系数(0.23) (图3(a)—(d))和与内质网探针的共定位系数(0.50) (图3(e)—(h)).由此说明RH 探针在低浓度(0.5 μmol/L) 情况下优先标记到活细胞内的线粒体.当使用高浓度(2 μmol/L) 时,先和Hoechst 探针一起与HeLa 细胞共孵育,RH 探针标记的细胞核区域与Hoechst探针标记的区域重合(图3(m)—(p)),说明RH 探针在高浓度时除了标记线粒体外,还能标记细胞核内的结构.
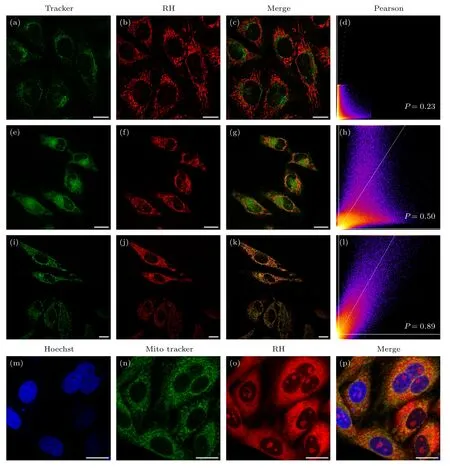
图3 共定位实验 (a)—(c) RH 探针 (0.5 μmol/L) 和溶酶体荧光探针 (0.05 μmol/L) 共定位结果;(e)—(g) RH 探针 (0.5 μmol/L和内质网荧光探针 (0.5 μmol/L) 共定位结果;(i)—(k) RH 探针 (0.5 μmol/L) 和线粒体荧光探针 (0.5 μmol/L) 共定位结果;(m)—(p) RH 探针 (2 μmol/L) 分别与细胞核探针Hoechst (0.2 μmol/L)和线粒体荧光探针 (0.5 μmol/L) 共定位结果;标尺20 μm;(d),(h),(l) 由Image J 软件计算得到的相应通道图像的Pearson 共定位系数Fig.3.Cell colocalization imaging: (a)-(c) The colocalization images of RH probe (0.5 μmol/L) and lysosomal fluorescence probe(0.05 μmol/L);(e)-(g) the colocalization images of RH probe (0.5 μmol/L) and ER fluorescence probe (0.5 μmol/L);(i)-(k) the colocalization images of RH probe (0.5 μmol/L) and mitochondrial fluorescence probe (0.5 μmol/L);(m)-(p) the co-localization images of the probe (RH) (2 μmol/L) with the commercial nuclear probe of Hoechst (0.2 μmol/L) and mitochondrial fluorescent probe of Mito-Tracker (0.5 μmol/L);scale bar is 20 μm;(d),(h),(l) the Pearson co-location coefficient of the corresponding channel image calculated by Image J software set,respectively.
为进一步证明RH 探针在较高浓度 (2 μmol/L)时标记细胞核内核仁,分别使用DNA 和RNA 水解酶进行了细胞内的DNA 和RNA 水解实验与荧光成像,如图4 所示.图4(a)—(c)是探针与商用Hoechst 探针的对细胞进行共定位成像的对照实验图,可见RH 探针标记到细胞核区域的圆形目标;经过RNase A 酶消化后,核仁内的RNA 被分解,RH 探针标记细胞核内的荧光区域也随之消失,如图4(d)—(f)所示;经过DNase I 酶消化后,细胞内的DNA 被分解,如图4(g)—(i)所示,Hoechst 标记的细胞核区域荧光明显减弱,而RH 探针在细胞核区域标记的圆形目标荧光还在,由此说明RH 探针标记的细胞核内目标为核仁.
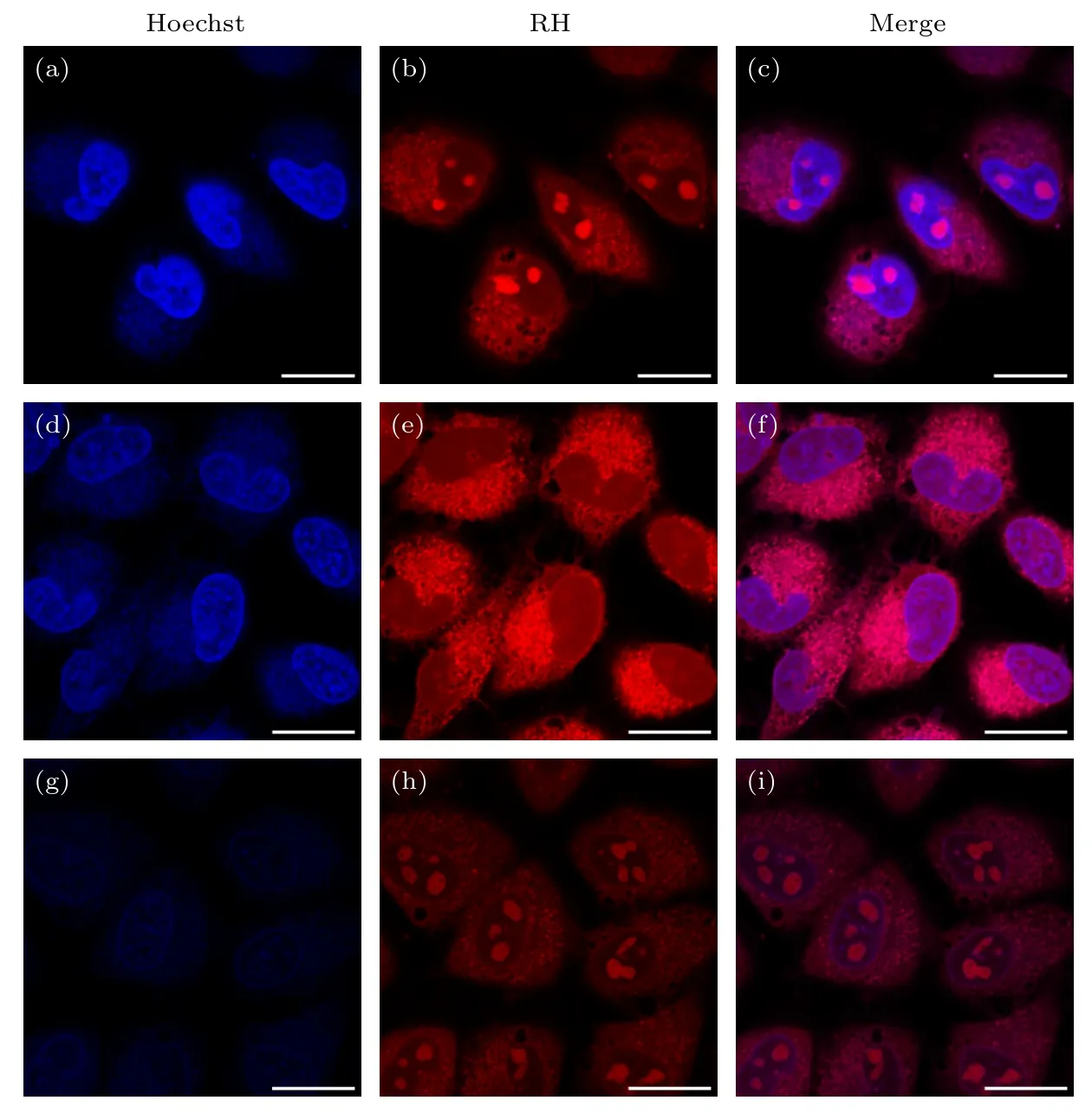
图4 DNA 与RNA 水解酶水解实验 (a)—(c) 空白对照组;(d)—(f) 固定的HeLa 细胞经过RNase A 消化后的结果;(g)—(i) 固定的HeLa 经过DNase I 消化后的结果,细胞先用4%多聚甲醛处理20 min 固定,之后分别用DNase I 和RNase A 消化2 h,最后与RH 探针(2 μmol/L)和Hoechst 探针(0.2 μmol/L)共孵育30 min,细胞成像前用PBS 清洗两次,标尺20 μmFig.4.Hydrolytic experiment on DNA and RNA using hydrolase: (a)-(c) Control group;(d)-(f) result of digestion of fixed HeLa cells by RNase A;(g)-(i) the result of digestion of fixed HeLa by DNase I;the cells were treated with 4% paraformaldehyde for 20 min,then digested with DNase I and RNase A for 2 h,respectively,and incubated with RH probe (2 μmol/L) and Hoechst probe(0.2 μmol/L) for 30 min;cells were washed twice with PBS before imaging.Scale bar is 20 μm.
在上述实验基础上,RH 探针在低浓度情况下标记到HeLa 细胞的线粒体并研究了活HeLa 细胞线粒体的黏度变化.图5 为通过FLIM 研究活HeLa细胞线粒体在长时间光照下微环境的变化.图5(a)所示的活HeLa 细胞线粒体内探针的平均寿命为3.65 ns,计算可知活HeLa 细胞线粒体的黏度为66×10-3Pa·s,与文献[33]报道相接近.此外,我们研究了HeLa 细胞在长时间激光照射刺激下,线粒体发生的融合和断裂等形态变化,结果如图5(b)—(h)红色边框标记处所示.其中,图5(b)所示的线粒体荧光寿命平均值为3.64 ns,图5(h)中的线粒体荧光寿命平均值为3.61 ns,可得到线粒体的黏度由78×10-3Pa·s 增至131×10-3Pa·s,均与已有报道结果一致[27],证明探针RH 通过FLIM 定量成像线粒体微环境黏度结果的可靠性.

图5 活HeLa 细胞线粒体FLIM (a) RH 探针(0.5 μmol/L)染色30 min 后标记的HeLa 细胞;(b)—(h) 图(a)中红色边框选中的区域放大的图像,记录了线粒体在光照刺激下30 min 时间内发生的融合和断裂变化.标尺5 μmFig.5.Fluorescence lifetime imaging of mitochondria in living cells: (a) HeLa cells labeled after 30 min staining with RH probe(0.5 μmol/L);(b)-(h) the enlarged images of the region selected by the red border in panel (a),which record the fusion and fracture changes of mitochondria within 30 min under the stimulation of light.Scale bar is 5 μm.
由前面的共定位实验结果 (图3(o)—(p)) 可知,RH 探针在高浓度 (2 μmol/L) 情况下标记到活HeLa 细胞的核仁和线粒体.为了研究长时间光照对核仁和线粒体的影响,我们使用CLSM 和FLIM 对活HeLa 细胞的核仁和线粒体同时进行长时间的成像研究,如图6 所示.随着激光光照时间的增加 (图6(a)—(d)),定位到线粒体上的红色荧光信号逐渐减弱,定位到核仁上的红色荧光信号几乎保持不变.可能是激光诱导线粒体膜电位发生变化,导致探针分子从线粒体脱离.接着,使用FLIM研究活HeLa 细胞的核仁和线粒体在长时间光照下发生的荧光强度和荧光寿命变化,如图6(e)—(h)所示,蓝色区域为线粒体,浅绿色或红色区域为核仁.随着激光光照时间的增加,线粒体和核仁分别发生不同的变化: 一方面,RH 探针标记的线粒体所在的蓝色区域逐渐减少,定位到的线粒体荧光信号逐渐减弱,这与前面共聚焦成像结果相一致;另一方面,RH 探针标记的核仁以及周围的细胞核区域强度逐渐增加,浅蓝色 (短寿命区域) 逐渐减少,绿色和橙红色区域 (长寿命区域) 逐渐增多.对应地,探针定位于核仁平均寿命也从4.23 ns 增至4.32 ns.此外,对活HeLa 细胞的FLIM 成像进行相图分析(图6(i)—(l))[34],发现长寿命区域处在相图边界上,对应探针定位在细胞核仁区域,短寿命处于相图内部,对应的探针定位于线粒体上,探针的荧光寿命符合双指数衰减模式,二者所示的变化与荧光寿命图像变化一致.
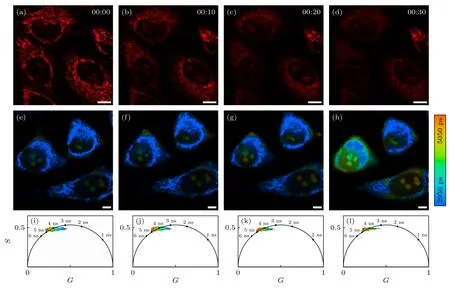
图6 荧光寿命随光照时间变化 (a)—(d) RH 探针(2 μmol/L)标记的HeLa 细胞在长时间光照的共聚焦成像结果;(e)—(h) RH 探针(2 μmol/L)标记HeLa 细胞在长时间光照的荧光寿命变化情况;(i)—(l)分别为图(e)—(h)相应的荧光寿命的相位图,荧光信号数据落在一个以坐标(0.5,0)为中心,0.5 为半径的半圆轨迹上,其中 G 和S 分别为相位图的横纵坐标(G=1/(ω2+τ2),S=ωτ/(ω2+τ2),ω 为激发光调制角频率,τ 为荧光寿命)[34],坐标(0,0)代表寿命为无穷大,坐标(1,0)代表寿命为0;标尺为10 μmFig.6.Fluorescence lifetime changes with illumination time: (a)-(d) Confocal imags of HeLa cells labeled with RH probe(2 μmol/L) under prolonged illumination;(e)-(h) the change in fluorescence lifetime of RH probe (2 μmol/L) labeled HeLa cells under prolonged illumination;(i)-(l) the phase diagram of the corresponding fluorescence lifetime of panels (e)-(h),respectively,and the fluorescence signal data falls on a semicircular trajectory with coordinates (0.5,0) as the center and 0.5 as the radius,where G and S are the horizontal and vertical coordinates of the phase diagram (G=1/(ω2+τ2),S=ωτ/(ω2+τ2),ω is the excitation light modulation angular frequency and τ is the fluorescence lifetime)[34],the coordinate (0,0) represents infinite lifetime,and the coordinate (1,0) represents 0 in lifetime;scale bar is 10 μm.
另外,还补充了RH 探针标记活COS-7 细胞和ID-8 细胞线粒体和核仁的FLIM 成像,结果见图7,再次验证RH 探针分别靶向线粒体和核仁跟与其浓度有关.如图7(a),(b) 所示,RH 在低浓度(0.5 μmol/L)标记到COS-7 细胞和ID8 细胞的线粒体,同时RH 标记到COS-7 细胞和ID-8 细胞线粒体的平均荧光寿命分别为3.29 ns 和3.28 ns(图7(i),(j)),跟标记HeLa 线粒体时的荧光寿命有所差异,这可能为不同种类细胞的线粒体微环境差异导致.HeLa 细胞来源人的宫颈,对比COS-7细胞和ID-8 细胞,三种细胞之间存在种属和器官来源差异,细胞内环境存在一定的差异,从而导致了RH 在标记HeLa 细胞与COS-7 细胞和ID-8 细胞线粒体时荧光寿命的差异.另外,如图7(c),(d)所示,RH 在高浓度(2 μmol/L)标记COS-7 细胞和ID-8 细胞的核仁和线粒体,图中细胞内橙红色区域为RH 标记到的核仁结构,蓝绿色区域为RH标记到的线粒体结构.图7(k),(l)的相位图也显示RH 在高浓度的荧光寿命有两个组分,蓝色区域为低荧光寿命组分,对应RH 标记到线粒体上,橙红色区域为高荧光寿命组分,对应RH 标记到核仁上,其中RH 标记到COS-7 细胞和ID-8 细胞核仁的荧光寿命分别为4.27 ns 和4.28 ns.由此可见RH 在不同细胞标记线粒体和核仁的方式是一样的.一方面,RH 因结构上含有罗丹明基团带正电荷,因而能够较为容易地标记到线粒体上;另一方面,RH 结构上含有疏水的芘基团,而核仁内有一定的疏水空间,同时还含有带负电荷RNA 结构,因而RH 能够标记到核仁上.RH 分别靶向线粒体和核仁由RH 的浓度介导,在低浓度(0.5 μmol/L)时主要靶向线粒体,在高浓度 (2 μmol/L) 时同时标记核仁和线粒体,标记线粒体和核仁时探针的寿命存在较大差异,因而能够很好地区分二者,为进一步研究细胞在非稳态过程中生理功能变化提供基础.
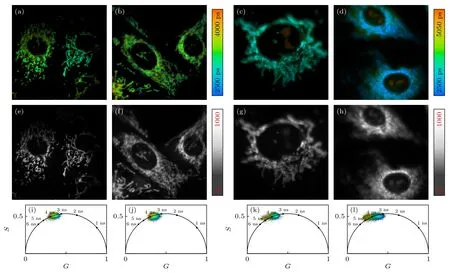
图7 RH 探针标记COS-7 细胞和ID-8 细胞的FLIM 成像 (a),(b) 分别为低浓度RH (0.5 μmol/L)标记COS-7 细胞和ID-8 细胞线粒体的荧光寿命图像;(c),(d) 分别为高浓度RH (2 μmol/L) 标记COS-7 细胞和ID-8 细胞核仁的荧光寿命图像;(e)—(h) 分别为图(a)—(d)的荧光强度图像;(i)—(l) 分别为对应的荧光寿命图像的相位图Fig.7.Fluorescence lifetime imaging of COS-7 cells and ID-8 cells labeled by RH probe: (a),(b) With low concentration RH(0.5 μmol/L),fluorescence lifetime images of mitochondria of COS-7 cells and ID-8 cells labeled,respectively;(c),(d) with high concentration RH (2 μmol/L),fluorescence lifetime images of nucleolus of COS-7 cells and ID-8 cells labeled,respectively;(e)-(h) the fluorescence intensity image of panels (a)-(d);(i)-(l) the phase diagram of the corresponding fluorescence lifetime image.
为进一步研究细胞应激反应中核仁的动力学变化,使用100 nmol/L 的紫杉醇诱导HeLa 细胞凋亡[35],CLSM 成像结果和FLIM 成像结果如图8所示.相较于空白处理的HeLa 细胞(图8(a)),紫杉醇处理过的HeLa 细胞(图8(b))能够更加明显地观察到核仁染色荧光.另外,随着紫杉醇处理时间的增加,观察到活HeLa 细胞的形态由梭形展开状态(图8(b))过渡到椭圆形或圆形的收缩状态(图8(d)),说明了紫杉醇诱导HeLa 细胞凋亡过程的发生.在紫杉醇诱导HeLa 细胞凋亡过程中,我们观察到细胞内的核仁位置的变化,如图8(b)—(d)和图8(j)—(l)白色箭头所示.在正常HeLa 细胞内(图8(a)),核仁居于细胞核较为居中的位置;而紫杉醇处理过的HeLa 细胞,核仁向细胞核外移动甚至进入到细胞质中,如图8(b)白色箭头所示,另外还观察到细胞表面的洞穿凹痕,如图8(c)白色箭头所示.Lieu 等[36]报道,紫杉醇的诱导细胞凋亡效果与其浓度和处理时间相关,10—100 nmol/L 浓度范围的紫杉醇可以抑制微管的组装动力学,导致细胞停滞在细胞周期中的G2/M 期;用60 nmol/L的紫杉醇处理1 h 或20 nmol/L 的紫杉醇处理12 h可诱导细胞凋亡.另外,FLIM 观察到的HeLa细胞形态变化跟CLSM 成像系统的结果一致,如图8(m)—(p)所示.同时,在紫杉醇诱导细胞凋亡过程中,我们发现RH 探针标记HeLa 细胞核仁的平均寿命由4.19 ns (处理0.5 h,图8(q)) 先增至4.38 ns (处理1 h,图8(r))和4.47 ns (处理2 h,图8(s)),最后降至4.42 ns (处理4 h,图8(t)),反映了紫杉醇的作用效果与处理时间的相关.在处理时间较短时 (0.5 h),紫杉醇(100 nmol/L)积累在细胞微管上的量不足以抑制细胞分裂诱导细胞凋亡;随着处理时间的增加(1 h),紫杉醇结合到微管的量可以抑制细胞分裂诱导细胞凋亡,而且随着处理时间的增加,更加容易诱导细胞凋亡.

图8 紫杉醇诱导细胞凋亡的CLSM 成像图像与FLIM 成像图像 (a)空白对照;(b)—(d) 紫杉醇 (0.1 μmol/L) 分别预先处理0.5,1,2 h 后RH 探针 (2 μmol/L) 标记的HeLa 细胞的共聚焦成像结果;(e)—(h) 对应的明场图像;(i)—(l) 红色通道和明场通道的叠加结果;(m)—(p) 分别为紫杉醇 (0.1 μmol/L) 预先处理0.5,1,2,4 h 后,RH 探针 (2 μmol/L) 标记的HeLa 细胞的荧光寿命图像;(q)—(t) 相应图像的相位图,标尺10 μm.Fig.8.Laser confocal imaging images and fluorescence lifetime imaging images of paclitaxel-induced apoptosis: (a) As a blank control;(b)-(d) the confocal image of HeLa cells labeled with RH probe (2 μmol/L) after 0.5 and 1,2 hours of paclitaxel (0.1 μmol/L)pretreatment,respectively;(e)-(h) the corresponding bright field image,respectively;(i)—(l) the superposition result of red channel and bright field channel,respectively;(m)-(p) the fluorescence lifetime image of RH probe (2 μmol/L) labeled HeLa cells after pretreatment with paclitaxel (0.1 μmol/L) for 0.5,1,2,4 h,respectively;(q)-(t) phase diagram of the corresponding image,respectively,scale bar is 10 μm.
此外,我们还研究了秋水仙碱在诱导细胞凋亡过程中细胞微环境的变化[37],结果如图9 所示.相较于空白处理的HeLa 细胞(图8(a)),较低浓度(10 nmol/L)秋水仙碱处理的HeLa 细胞核仁染色荧光更加明显(图9(a)—(c)).RH 探针标记于空白处理的HeLa 细胞核仁的平均荧光寿命为4.10 ns (图9(j)),标记于较低浓度秋水仙碱处理的HeLa 细胞核仁平均寿命为 4.34 ns (图9(k)),这与100 nmol/L 的紫杉醇处理1 h 的结果相近;而较高浓度(100 nmol/L)处理的细胞则更容易发生凋亡(图9(d)—(f)),探针标记于HeLa 细胞核仁的平均寿命为4.47 ns (图9(l)),这与100 nmol/L的紫杉醇处理2 h 结果相近.Paschke 等[38]报道,秋水仙碱在较低浓度(10 nmol/L)时会降低细胞的变形能力,限制细胞的运动;而在较高浓度(100 nmol/L)时,作用机制跟紫杉醇的类似,与微管蛋白结合抑制细胞分裂,从而诱导细胞凋亡.

图9 秋水仙碱诱导细胞凋亡CLSM 成像图像与FLIM 成像结果 (a)—(c) 10 nmol/L 和(d)—(f) 100 nmol/L 的秋水仙碱预先处理1 h 后,RH 探针(2 μmol/L)标记的HeLa 细胞的共聚焦成像结果.(a),(d) RH 探针红色通道图像;(b),(e) 相应的明场通道图像;(c),(f) 相应的红色通道和明场通道叠加的结果;(g) 空白对照;(h),(i) 分别为10 nmol/L 和100 nmol/L 的秋水仙碱预先处理1 h 后,RH 探针 (2 μmol/L) 标记HeLa 细胞的荧光寿命图像;(j)—(l) 相应荧光寿命图像的相位图,标尺10 μmFig.9.Confocal laser imaging images and fluorescence lifetime imaging results of colchicine-induced apoptosis: (a)-(c) 10 nmol/L and (d)-(f) 100 nmol/L is respectively the confocal image of HeLa cells labeled with RH probe (2 μmol/L) after 1 h pre-treatment with colchicine.(a),(d) Red channel images of RH probe;(b),(e) the corresponding bright field channel images;(c),(f) the superposition result of the corresponding red channel and bright field channel;(g) a blank control;(h),(i) fluorescent lifetime image of HeLa cells labeled with RH probe (2 μmol/L) after pre-treatment with 10 nm and 100 nm colchicine for 1 h,respectively;(j)-(l) the phase diagram of the corresponding fluorescence lifetime image,respectively,scale bar is 10 μm.
4 结论
活细胞在受到激光光照、紫杉醇及秋水仙碱等不同刺激下发生应激反应,细胞形态及微环境发生相应的变化,通过荧光寿命可获得定量的成像与测量研究.本文选用具有红色荧光的芘罗丹明探针RH 在不同条件下能够分别靶向标记活细胞的线粒体和核仁.我们使用Autodocking 软件进行生物计算模拟探针与DNA/RNA 的结合模式,得到RH 探针与DNA 只有一种结合方式,且结合能较高 (-5.25 eV),从而导致探针只是附着在DNA序列表面,与DNA 的结合力较弱;而RH 探针与RNA 有两种结合构型,结合能分别是-11.2 eV 和-11.62 eV,对应探针的疏水基团分别嵌入RNA 序列中的小沟和大沟中,与RNA 的结合力较强.使用FLIM 技术监测到活HeLa 细胞在光照刺激过程中发生的线粒体断裂、融合形态变化,以及探针标记线粒体的平均荧光寿命由3.65 ns 降低到3.61 ns,对应线粒体的黏度由66×10-3Pa·s 增至131×10-3Pa·s.同时,我们还补充了RH 探针标记COS-7 细胞和ID-8 细胞线粒体和核仁的FLIM 成像,结果显示RH 靶向标记线粒体和核仁的情况与HeLa 细胞的类似,在低浓度(0.5 μmol/L)时主要靶向线粒体,在高浓度 (2 μmol/L)时同时标记核仁和线粒体,标记到COS-7 细胞和ID-8 细胞中的线粒体的平均寿命约为3.29 ns 和3.28 ns,比标记到HeLa 细胞中线粒体的寿命略低,这可能为不同种类细胞的线粒体内环境差异导致.另外,我们使用RH 探针在CLSM 成像和FLIM 成像可视化了活HeLa 细胞在激光光照、紫杉醇和秋水仙碱诱导细胞凋亡过程中的核仁动力学变化,观察到活HeLa 细胞核仁在细胞凋亡过程中的移动,RH 的平均荧光寿命发生变化: 光照时间从0 min 增至30 min,RH 标记到HeLa 细胞核仁的平均寿命也从4.23 ns 增至4.32 ns,反映了长时间激光照射引起HeLa 细胞核仁微环境的变化;100 nmol/L 的紫杉醇处理时间从0.5 h 增至4 h,探针标记于HeLa 细胞核仁的平均寿命由4.19 ns,增至4.47 ns,最后降至4.42 ns,反映了紫杉醇处理不同时间诱导HeLa 细胞凋亡所引起的细胞核仁微环境差异;对比空白处理的HeLa 细胞,低浓度(10 nmol/L)秋水仙碱处理1 h 后,探针的平均寿命由4.10 ns增至4.34 ns,高浓度(100 nmol/L)秋水仙碱处理1 h 后,探针标记于核仁的平均寿命增至4.47 ns,反映了不同浓度秋水仙碱诱导细胞凋亡所引起的细胞核仁微环境变化的差异.
以上激光光照、紫杉醇和秋水仙碱三种方式诱导HeLa 细胞损伤或凋亡,证明了在HeLa 细胞非稳态情况下核仁和线粒体微环境的变化以及功能变化,为研究不同途径诱导细胞凋亡的动态过程以及核仁和线粒体功能障碍相关疾病研究提供了新的研究方法.

