两种不同气候类型下酿酒葡萄果实有机酸代谢的比较分析
李帅 冯铭鑫 雷煜璐 白世践 孟江飞 许腾飞
摘 要 有机酸是葡萄果实中重要的风味化合物。在浆果发育过程中,环境温度会影响有机酸的积累。以酿酒葡萄‘赤霞珠和‘马瑟兰为试材,比较了新疆鄯善为代表的的炎热气候与山西乡宁地区为代表的冷凉气候两种栽培条件下葡萄果实中有机酸积累的差异。结果表明,山西乡宁葡萄果实更大,果粒百粒质量、横纵径均高于鄯善产区;鄯善地区葡萄可滴定酸含量显著低于乡宁,pH则高于乡宁。转色前有机酸持续积累,包括酒石酸、苹果酸及少量柠檬酸;转色后鄯善和乡宁葡萄果实可滴定酸分别降低84.8%和78.5%,其中以苹果酸的降解尤为显著。鄯善地区成熟葡萄果实酒石酸含量保持在7.23~8.96 mg/粒,乡宁葡萄果实酒石酸含量显著高于鄯善,达到9.06~10.75 mg/粒;在葡萄发育的整个周期,乡宁葡萄果实中酒石酸、苹果酸和抗坏血酸含量均高于鄯善,两个供试品种表现趋势一致。此外,相较于苹果酸合成与降解相关基因,液泡膜质子泵基因VvVHP在响应高温转运苹果酸并改变可滴定酸含量中可能发挥了更关键的作用。
关键词 酿酒葡萄;有机酸;高温;基因表达
葡萄(Vitis vinifera L.)是世界上广泛栽培的水果之一,具有适应性强、味道鲜美、经济价值高的特点。根据国际葡萄与葡萄酒组织(OIV)的统计报告,2020年全球葡萄园面积为7.33 Mhm2,其中中国的葡萄园表面积为7.85 khm2,占世界面积的10.7%(OIV, 2020)。葡萄浆果含有丰富的化合物,糖、酸和酚类物质的存在会显著影响葡萄和葡萄酒的感官质量[1]。其中,有机酸调节着“酸碱平衡”,会影响葡萄浆果的口感和葡萄酒的风味。有机酸的积累和调控是葡萄品质控制的一个重要方面。
葡萄中有机酸种类丰富,Kliewer[2]在葡萄浆果中发现了近23种有机酸,其中酒石酸和苹果酸含量最高,柠檬酸较少,其他有机酸含量都极低[3-4]。L-酒石酸(2,3-二羟基丁二酸)是葡萄屬和天竺属植物中特有的有机酸,多存在于叶片与果实中[5]。研究认为,酒石酸主要以抗坏血酸为基础,经过五或六步生化反应形成,目前鉴定到的两种关键合成途径酶为L-艾杜糖酸脱氢酶(L-IdnDH)和2-酮-L-古洛糖酸还原酶(2-KGR),酒石酸合成中其他相关酶还需进一步发掘[5-7]。L-酒石酸在植物中的生物功能尚不明确,但在葡萄酒风味、微生物稳定性等方面具有重要贡献[8-9];Zhao等[10]的研究表明,酒石酸化合物可通过改变蛋白质-多酚配合物之间的氢键和疏水键,形成三元配合物,使蛋白质结构拉伸,影响葡萄酒的涩味。与酒石酸不同,作为光合作用的早期产物,苹果酸是许多植物代谢物和化合物的前体,并能够为不同细胞组织中发生的不同代谢途径传递电子;通过TCA循环和乙醛酸循环,苹果酸能够转化为柠檬酸或其他二羧酸从而改变果实细胞酸度[11]。作为葡萄果实中第二种主要有机酸,苹果酸参与植物细胞代谢并在控制叶片气孔孔径,改善植物营养和增加对重金属毒性的抵抗力等方面发挥作用[12]。
除了少量关于光照[13]、干旱[14]和嫁接砧木[15]的报道外,人们认为酒石酸的积累不受胁迫和环境或栽培管理措施的影响;然而,在具体实践中不同地区葡萄中酒石酸含量存在很大差异[16]。苹果酸和柠檬酸对环境因素很敏感,研究表明,如植物库源关系[17]、灌溉[18-19]和温度[20]等均影响苹果酸和柠檬酸的积累。葡萄果实中的有机酸含量取决于品种特性、外部栽培方式和自然环境的相互作用;温度是影响葡萄中有机酸积累的重要环境因素[21]。高温破坏了植物的一些代谢途径,导致对葡萄品质至关重要的必需化合物的生物合成发生改变。研究表明,积温每升高100 ℃,有机酸含量降低0.03%~0.08%;平均温度每升高 1 ℃,有机酸含量降低0.04%~0.08%[22]。虽然苹果酸代谢随温度升高而增加,但当温度达到 40 ℃时,苹果酸含量急剧下降[23]。高温改变了葡萄有机酸的积累进而影响了葡萄酒的品质。然而,在冷凉与炎热两种气候类型条件下酿酒葡萄不同有机酸的代谢差异仍不清楚。因此,本研究旨在通过比较以新疆鄯善为代表的炎热气候和山西乡宁为代表的冷凉气候下葡萄果实有机酸积累变化,阐明高温对葡萄果实发育过程中有机酸生物合成和降解的影响,为揭示高温调控葡萄有机酸合成和代谢的分子机制提供研究基础。
1 材料与方法
1.1 试验材料与生长条件
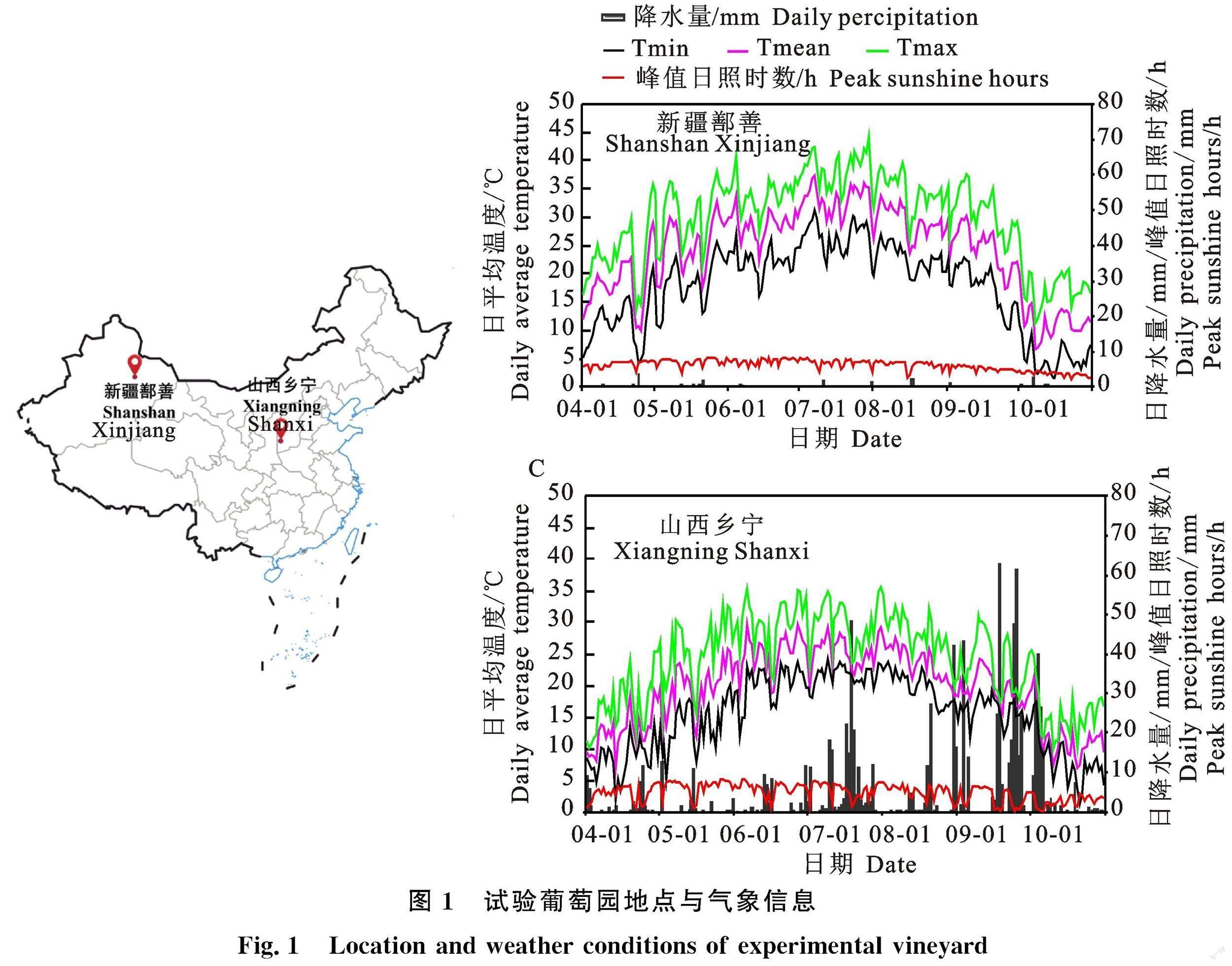
供试材料分别为新疆鄯善(42.87°N, 90.21°E)和山西乡宁(35.97°N, 110.85°E)地区(图1)的酿酒葡萄品种‘赤霞珠(Vitis vinifera cv.Cabernet Sauvignon)与‘马瑟兰(Vitis vinifera cv.Marselan)。葡萄树于2011年种植,南北行向,间距为1.2 m× 3.0 m,‘厂字形树形,两地葡萄园管理方式基本一致。
1.2 样品采集
参考Coombe[24]的改良E-L系统,采集EL29、EL32、EL35、EL36和EL38这5个不同发育阶段的浆果。每次取样从葡萄树的两侧分别采集4串葡萄;从每串葡萄的不同部位采集3粒葡萄,并立即在液氮中冷冻,于-80 ℃冰箱保存, 待测。
1.3 测定指标与方法
1.3.1 生长发育指标 随机选取100粒葡萄果实,采用数显游标卡尺测定横纵径,采用电子天平称单粒质量,重复3次,结果取平均值。
1.3.2 品质指标 随机选取100粒葡萄果实揉碎过滤取汁,采用数显糖度计测定可溶性固形物含量;采用酸度计法测定果实pH;采用斐林试剂热滴定法测定还原糖含量;采用氢氧化钠滴定法(参照GB/T 15038-2006)测定可滴定酸含量,每次试验重复3次,结果取平均值。
1.3.3 有机酸的提取 取部分葡萄样品在液氮中研磨成粉末。每个样品精确称量1 g,加入10 mL 0.02 mol/L的KH2PO4溶液(pH=2.8)。混合物在25 ℃水浴中以300 W功率超声处理30 min,然后在 4 ℃下10 000 r/min离心20 min。用0.22 μm的滤膜过滤上清液,用于高效液相色谱 (HPLC)分析。
1.3.4 HPCL色谱条件 采用WATERS系列高效液相色谱仪,Athena C18-WP色谱柱(150 mm × 4.6 mm × 5 mm)。流动相为0.02 mol/L KH2PO4(磷酸调节pH至2.8),流速为0.5 mL/min,恒温40 ℃。施用光电二极管阵列 (PDA)进行检测,波长为 210 nm。
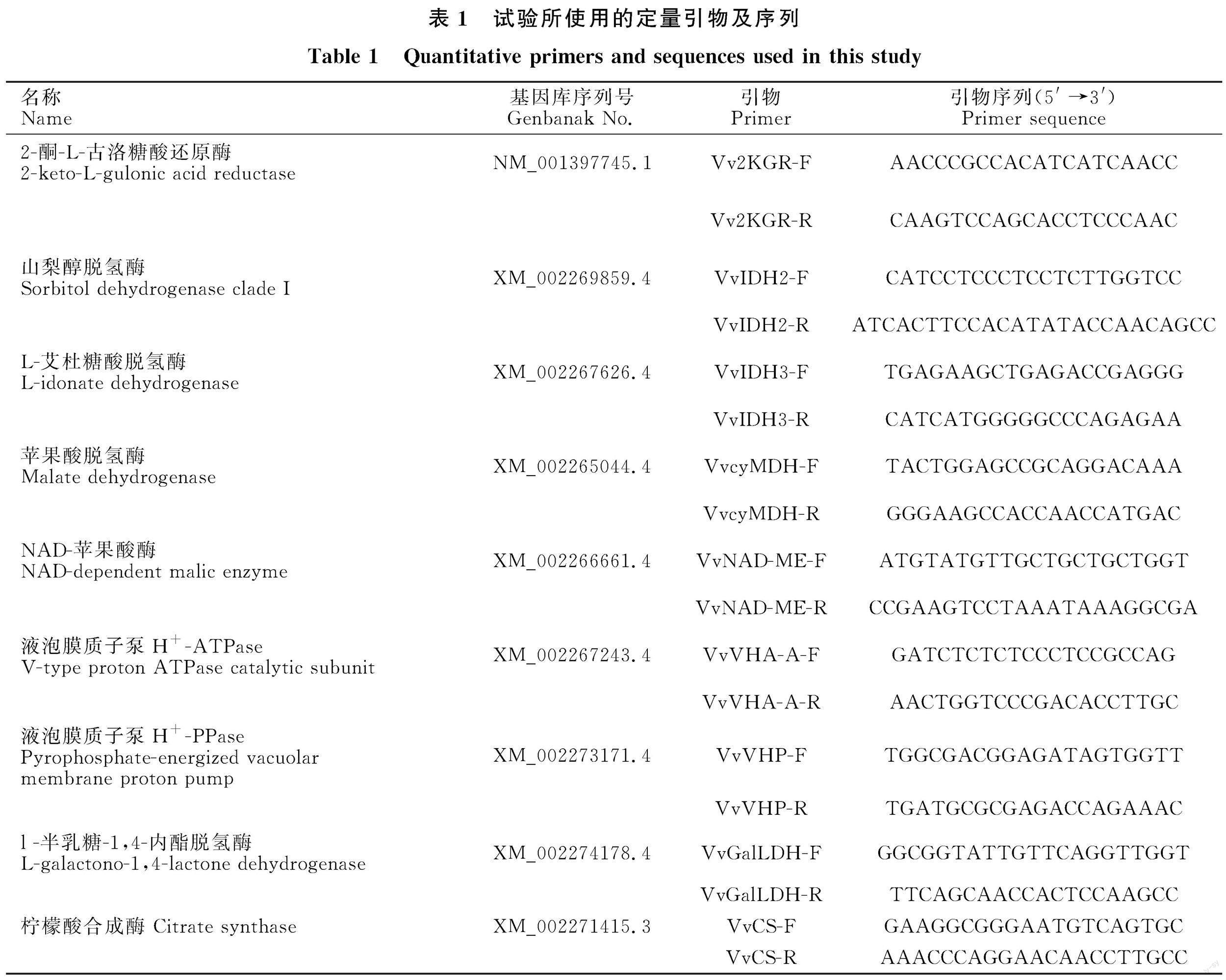
1.3.5 总RNA分离及定量逆转录聚合酶链反应(qRT-PCR) 总RNA的提取使用Pure Plant RNA制备试剂盒(百泰克生物技术有限公司,北京),对提取的总RNA进行琼脂糖凝胶电泳和紫外分光光度检测。使用Revert Aid first strand cDNA synthesis kit合成试剂盒(诺唯赞生物科技有限公司,南京)进行反转录 (1 000 ng总RNA)。qRT-PCR分析采用ABI QuantStudio 6 Flex荧光定量PCR系统(Life Technologies, Carlsbad, 美国)检测有机酸生物合成相关基因的表达水平。使用引物见表1。采用两步qRT-PCR试剂盒(诺唯赞生物科技有限公司,南京),按照厂家说明书对每个样品进行3次分析。数据分析采用2-ΔΔCT法[25]。
1.4 数据统计与分析
采用Microsoft Excel 2016进行数据统计与处理,使用IBM SPSS Statistcs 25 进行单因素方差分析,显著性分析采用LSD(L)和Duncans(D)进行假定方差齐性检验,P<0.05表示差异达到显著水平。
2 结果与分析
2.1 鄯善和乡宁地区葡萄果实生长发育变化
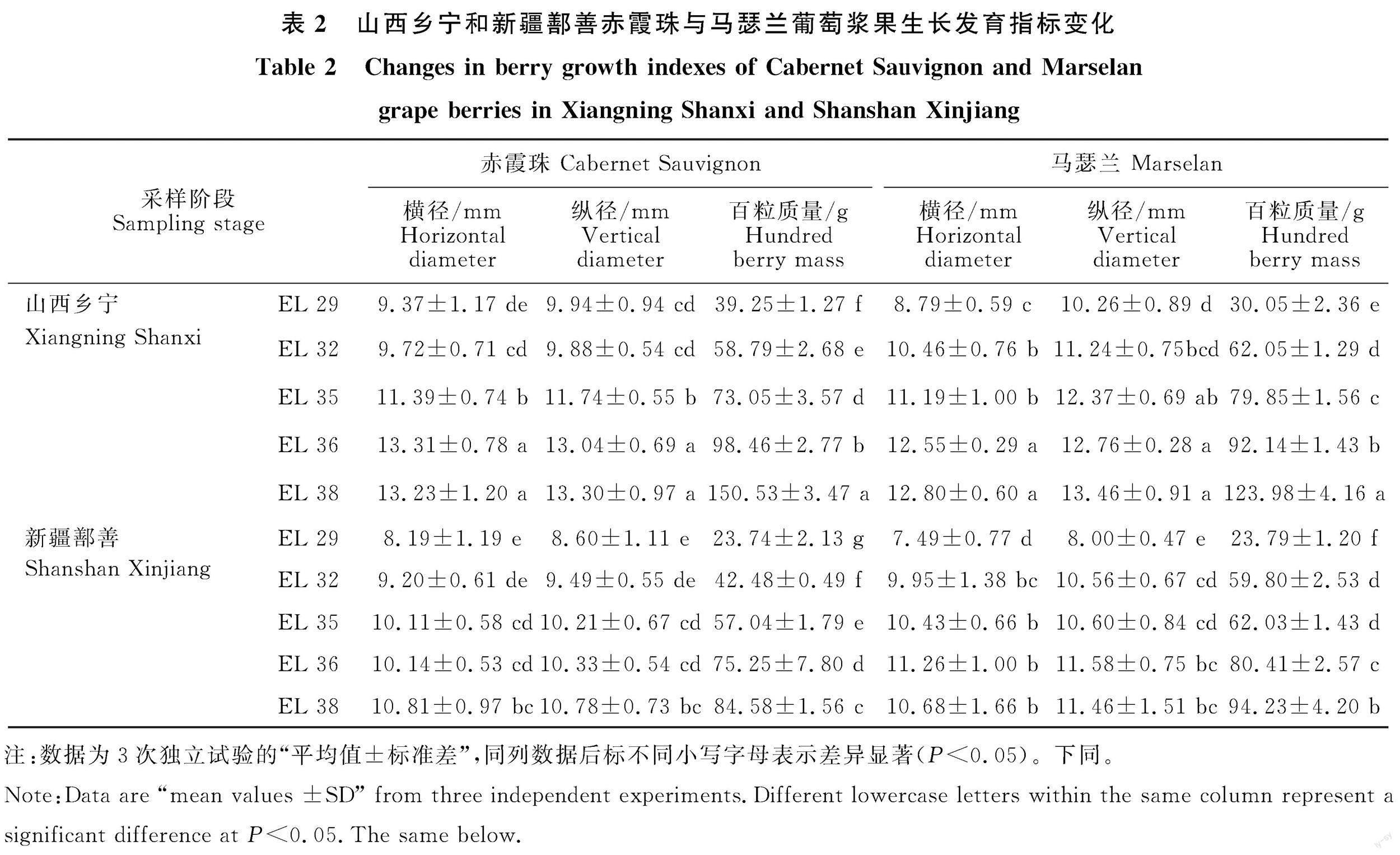
新疆鄯善和山西乡宁地区2021年的日平均温度(℃)、日降水量(mm)、峰值日照时数(h)等气象信息如图1所示,鄯善地区葡萄生长季(4月—10月)月均温较乡宁地区高4.76 ℃,最高月均气温为33.12 ℃,单日最高气温可达44.11 ℃。在葡萄生长季节,鄯善地区共有34 d日最高气温超过37 ℃,而乡宁无单日温度超过37 ℃。表2为两个地区‘赤霞珠和‘马瑟兰葡萄5个不同发育阶段葡萄浆果生长发育指标参数。葡萄果实横纵径随果实生长发育呈现先快速增加后逐渐稳定的趋势,百粒浆果质量也持续增加。山西乡宁葡萄果实发育速度更快,且在整个葡萄发育周期中,乡宁地区葡萄百粒质量、横纵径均高于鄯善产区,两个品种表现趋势一致。
2.2 鄯善和乡宁地区葡萄果实品质指标的差异分析
由图2可知,在葡萄果实发育过程中,果实还原糖含量和可溶性固形物随果实发育逐渐增加,EL35(转色开始)阶段开始加速积累,山西乡宁地区葡萄果实还原糖含量积累速度较快,但在采收时,两地区葡萄还原糖与可溶性固形物含量相差较小,差异并不显著。转色后果实可滴定酸含量迅速下降,其中新疆鄯善‘马瑟兰葡萄果实可滴定酸含量变化最大,较最大值降低88.3%;鄯善‘赤霞珠可滴定酸含量下降81.6%;山西乡宁‘赤霞珠下降79.7%;山西乡宁‘马瑟兰下降80.9%;新疆鄯善下降幅度均高于山西乡宁。鄯善地区葡萄可滴定酸含量显著低于乡宁,pH则高于乡宁;且转色期之后,鄯善地區葡萄果实pH迅速升高,‘赤霞珠与‘马瑟兰葡萄果实pH分别在转色阶段提高32.9%和 39.8%。结果表明在达到相应技术成熟度时,新疆鄯善地区的有机酸含量更低。
2.3 鄯善和乡宁地区葡萄果实有机酸含量的差异分析
如图3所示,总体来看‘赤霞珠与‘马瑟兰葡萄在两个地区的有机酸含量都存在较大差异,对于葡萄主要有机酸,乡宁葡萄果实酒石酸和苹果酸的含量高于鄯善,其他酸的含量在两个地区也有显著差异。葡萄中有机酸的积累主要发生在转色前,尤其是酒石酸和苹果酸,从EL29 (坐果期)至 EL35(转色前)阶段,对于赤霞珠葡萄,果实酒石酸含量在两个地区增加了0.7~1.2倍,而苹果酸含量则升高1.4~3.4倍;‘马瑟兰葡萄酒石酸含量在此阶段两个地区均增加了1.4倍左右;而苹果酸含量增加约3.5倍。相较于‘马瑟兰,‘赤霞珠葡萄有机酸积累速率在两个地区出现较大差异;鄯善地区葡萄有机酸含量增加速率快,但含量低,转色后葡萄果实酒石酸含量保持在7.23~8.96 mg/粒,乡宁地区葡萄果实酒石酸含量显著高于鄯善,达到了9.06~10.75 mg/粒。在转色之后酒石酸含量整体呈稳定趋势,苹果酸开始降低,乡宁葡萄果实苹果酸含量下降程度更高,‘赤霞珠与‘马瑟兰分别较最大值下降了66.6%和74.7%,且在采收阶段,乡宁葡萄果实苹果酸含量低于鄯善,这在两个品种中是一致的。转色前,乡宁‘赤霞珠葡萄中抗坏血酸含量呈略微下降趋势,其余样品中抗坏血酸和柠檬酸含量明显升高,但整体变化不显著(小于1 mg/粒)。‘赤霞珠葡萄柠檬酸含量在整个发育周期在两地区没有表现出显著差异,而鄯善地区‘马瑟兰葡萄柠檬酸含量则显著高于乡宁。
2.4 鄯善和乡宁地区葡萄果实有机酸相关基因表达的差异分析
通过查询NCBI (http://www.ncbi.nlm.nih.gov/)数据库,结合已发表的其他物种有机酸相关基因作为参考,筛选出9个基因,其中酒石酸代谢相关基因3个(列出来),苹果酸代谢相关基因2个(列出来),抗坏血酸代谢相关基因1个(列出来),柠檬酸代谢相关基因1个(列出来),苹果酸转运相关基因2个(列出来)。采用NCBI数据库设计引物进行qRT-PCR分析(表1)。
如图4所示,以乡宁地区EL29(坐果期)阶段采样的葡萄果实为对照,在葡萄的各个发育阶段观察赤霞珠与马瑟兰在两个地区有机酸基因表达的变化。其中酒石酸合成基因Vv2KGR和VvIDH3在葡萄果实发育早期表达较高,但在葡萄果实转色后(酒石酸合成结束)后,其转录仍然存在;VvIDH2在果实发育后期表达量显著升高。VvcyMDH是苹果酸合成关键基因,催化草酰乙酸向苹果酸的转化,在果实发育的大部分阶段,鄯善地区赤霞珠与马瑟兰葡萄VvcyMDH的表达均高于乡宁;VvNAD-ME催化苹果酸脱羧形成丙酮酸,结果表明VvNAD-ME在葡萄果实发育过程中表达量逐渐增加。VvVHA-A与VvVHP是植物体内两种重要的膜转运蛋白,能够引起的质子浓度梯度从而为物质的跨膜运输提供驱动力,两种质子泵的转录变化趋势不同,葡萄成熟后VvVHP的表达量增加,其中乡宁地区葡萄的表达量高于鄯善,这在马瑟兰品种中尤为显著;新疆地区葡萄VvVHA-A基因表达量在果实发育过程中逐渐降低。VvGalLDH催化L-半乳糖-1,4-内酯合成抗坏血酸,其表达呈现先升高后降低的趋势,且鄯善地区葡萄VvGalLDH的表达显著高于乡宁。总体而言,两个地区赤霞珠与马瑟兰葡萄有机酸基因表达的变化呈现出不同表达模式。
3 讨论与结论
中国东西跨度大,新疆鄯善与山西乡宁地区气候条件存在显著差异,根据Xie等[26]的研究模型,新疆鄯善位于温暖干旱气候,光热条件充足,但降水较少;新疆鄯善7-9月日照时数较山西乡宁地区多出200~300 h[27]。在葡萄成熟阶段,鄯善平均温度较高,温度的升高促进营养吸收,缩短繁殖周期,从而使浆果的发育阶段向生长季节的温暖月份转移。本研究中,在达到相同的技术成熟度的条件下,新疆鄯善地区葡萄果粒大小及横纵径更小,表明新疆鄯善地区葡萄果实发育阶段有向温暖月份转移的趋势。葡萄果粒大小及横纵径的影响因素很多,除了光热因素外,有研究表明水分状况[28-29]等也可能改变葡萄果实大小。本研究发现新疆鄯善地区和山西乡宁葡萄果实还原糖和可溶性固形物含量在果实发育的部分阶段存在差异,但在EL36(转色完成)阶段后的差异较小;而有机酸的积累存在显著差异,新疆鄯善葡萄果实可滴定酸含量低,pH更高,这与Xie等[26]在5个不同气候特征地区检测到的‘赤霞珠葡萄糖酸含量变化一致。结果表明,气候因素对葡萄果实发育有显著影响,鄯善地区炎热干燥的气候可显著降低葡萄果实的酸含量。
葡萄是典型的酒石酸水果。酒石酸和苹果酸占总酸的90%以上,此外还有少量柠檬酸、抗坏血酸、琥珀酸和其他有机酸[30]。本研究对4种主要的有机酸,包括酒石酸、苹果酸、抗坏血酸和柠檬酸进行了定量分析。两个地区的‘赤霞珠和‘马瑟兰葡萄果实在有机酸含量上都表现出很大的差异。对于两种主要有机酸酒石酸和苹果酸,在乡宁地区的含量均高于鄯善,这在两个品种中是一致的。研究表明,在葡萄发育的早期阶段,适度升高温度会加速浆果生长、苹果酸和酒石酸的积累,然而当受到严重热胁迫时,酒石酸和苹果酸的合成就会受到抑制[31-32]。此外,两个地区的其他酸水平也有显著差异,结果表明在葡萄发育过程中,由于糖的积累和糖酵解作用的抑制,有机酸(主要为苹果酸与柠檬酸)作为TCA循环和呼吸、糖异生、氨基酸相互转化等途径的重要碳源而被消耗;高温加速葡萄浆果代谢,促进了有机酸的降解,是有机酸积累差异的主要因素。葡萄中有机酸的积累主要在转色(EL35)前,尤其是酒石酸和苹果酸水平的增加;转色期是葡萄酸积累的转折点,在此之后可滴定酸含量的显著下降主要是由于苹果酸含量的下降,而酒石酸在果实成熟后并不参与植物代谢在转色后含量保持稳定,这与前人的研究结果是一致的[33]。在本研究中,抗坏血酸含量在转色期间(EL35到EL36)含量突然增加,随后在采样前含量下降,由于抗坏血酸为酒石酸合成的前体,推测酒石酸合成在转色期停止,从而中断了抗坏血酸向酒石酸的转化,导致其在转色完成后大量积累。
2KGR和L-IDH是已知与酒石酸合成有关的酶;L-IDH有3种异构体, VvIDH3与酒石酸生物合成密切相关[5]。 Vv2KGR和 VvIDH3基因在葡萄果實发育早期表达较高,但在葡萄果实转色完成后,其转录仍然存在。Wen等[34]对葡萄发育过程中IDH蛋白水平的变化进行研究,发现IDH水平在幼果期急剧上升,花后4~6周后达到峰值,随后发育阶段逐渐下降。磷酸烯醇丙酮酸(PEP)是糖酵解途径中的一种中间体,可由磷酸烯醇丙酮酸羧化酶(PEPC)催化生成草酰乙酸(OAA),再由胞质NAD依赖性苹果酸脱氢酶(NAD-cyMDH)还原合成苹果酸,VvNAD-ME在葡萄果实发育过程中表达量逐渐增加,并已被证明参与苹果酸的降解[12]。在本研究中,鄯善地区‘赤霞珠与‘马瑟兰葡萄VvcyMDH的表达均高于乡宁,但并未观察到苹果酸含量相应升高,表明有机酸含量可能与降解及转运基因更相关。液泡膜质子泵H+-PPase(VHP)和H+-ATPase(VHA)通过调节细胞膜的电位,控制细胞内离子的浓度,从而驱动苹果酸和其他有机酸在植物液泡中的积累与转运。乡宁地区葡萄VvVHA和VvVHP基因表达量显著高于鄯善,这与有机酸表型结果一致。鄯善地区葡萄VvVHA基因表达量在发育过程中增加,但在成熟过程中迅速降低,而VvVHP基因则在葡萄转色后期表达量相对升高。研究表明,VvVHP无法酸化pH超过3.7的液泡,成熟过程中液泡pH的增加与有机酸含量(主要为苹果酸)的降低可能是由于VvVHA被VvVHP所取代,从而导致新疆地区较低的有机酸含量[35]。GalLDH是植物中催化抗坏血酸生物合成最后一步(L-半乳糖途径)的关键酶。在鄯善地区,VvGalLDH表达量较高,抗坏血酸和酒石酸含量较低。
本文研究了中国两个气候特征显著不同的产区——炎热的新疆鄯善和冷凉的山西乡宁的‘赤霞珠和‘马瑟兰葡萄发育过程中有机酸及其相关基因的表达模式。结果表明,新疆鄯善和山西乡宁葡萄果实酸的积累存在显著差异,鄯善地区葡萄果实可滴定酸含量低,pH更高。两个产区葡萄有机酸含量差异显著,乡宁地区葡萄酒石酸、苹果酸和抗坏血酸含量均高于鄯善,这在两个葡萄品种之间没有差异。此外,与果实有机酸的合成和降解的相关基因不同,液泡膜质子泵H+-PPase基因VvVHP在响应高温转运苹果酸并改变鄯善地区葡萄可滴定酸含量中可能发挥了更关键的作用。
参考文献 Reference:
[1] BALDWIN E A.Fruit flavor,volatile metabolism and consumer perceptions[J].Fruit Quality and Its Biological Basis,2002(8):89-106.
[2]KLIEWER W M.Sugars and organic acids of Vitis vinifera[J].Plant physiology,1966,41(6):923-931.
[3]GERS H,CHAVES M,DELROT S.The Biochemistry of the Grape Berry[M].Bentham Science Publishers Ltd:soest,The Netherlands,2012.
[4]MORRIS J,SIMS C,CAWTHON D.Effects of excessive potassium levels on pH,acidity and color of fresh and stored grape juice[J].American Journal of Enology and Viticulture,1983,34(1):35-39.
[5]BURBIDGE C A,FORD C M,MELINO V J,et al.Biosynthesis and cellular functions of tartaric acid in grapevines[J].Frontiers in Plant Science,2021,12:309.
[6]DEBOLT S,MELINO V,FORD C M.Ascorbate as a biosynthetic precursor in plants[J].Annals of Botany,2007,99(1):3-8.
[7]WHEELER G L,JONES M A,SMIRNOFF N.The biosynthetic pathway of vitamin C in higher plants[J].Nature,1998,393(6683):365-369.
[8]曹慧玲,舒河霖,邵建輝,等.葡萄果实酒石酸生物合成研究进展[J].中国果树,2021(4):8-13.
CAO H L,SHU H L,SHAO J H,et al.Research progress on biosynthesis of tartaric acid in grape berries[J].China Fruits,2021(4):8-13.
[9]CAPUCHO I,SAN ROMAO M.Effect of ethanol and fatty acids on malolactic activity of Leuconostoc oenos[J].Applied Microbiology and Biotechnology,1994,42:391-395.
[10] ZHAO Q,DU G,WANG S,et al.Investigating the role of tartaric acid in wine astringency[J].Food Chemistry,2023,403:134385.
[11]IGAMBERDIEV A U,BYKOVA N V.Role of organic acids in the integration of cellular redox metabolism and mediation of redox signalling in photosynthetic tissues of higher plants[J].Free Radical Biology and Medicine,2018,122:74-85.
[12]SWEETMAN C,DELUC L G,CRAMER G R,et al.Regulation of malate metabolism in grape berry and other developing fruits[J].Phytochemistry,2009,70(11/12):1329-1344.
[13]SMART R E,SMITH S M,WINCHESTER R V.Light quality and quantity effects on fruit ripening for Cabernet Sauvignon[J].American Journal of Enology and Viticulture,1988,39(3):250-258.
[14]SAVOI S,WONG D C,DEGU A,et al.Multi-omics and integrated network analyses reveal new insights into the systems relationships between metabolites,structural genes,and transcriptional regulators in developing grape berries (Vitis vinifera L.) exposed to water deficit[J].Frontiers in Plant Science,2017,8:1124.
[15]ZHANG Z,LIU H,SUN J,et al.Nontarget metabolomics of grape seed metabolites produced by various scion-rootstock combinations[J].Journal of the American Society for Horticultural Science,2020,145(4):247-256.
[16]RIENTH M,TORREGROSA L,SARAH G,et al.Temperature desynchronizes sugar and organic acid metabolism in ripening grapevine fruits and remodels their transcriptome[J].BMC Plant Biology,2016,16(1):1-23.
[17]ETIENNE A,GNARD M,LOBIT P,et al.What controls fleshy fruit acidity? A review of malate and citrate accumulation in fruit cells[J].Journal of experimental botany,2013,64(6):1451-1469.
[18]KALLSEN C E,SANDEN B,ARPAIA M L.Early navel orange fruit yield,quality,and maturity in response to late-season water stress[J].Horticultural Science,2011, 46(8):1163-1169.
[19]THAKUR A,SINGH Z.Responses of ‘Spring Brightand ‘Summer Brightnectarines to deficit irrigation:Fruit growth and concentration of sugars and organic acids[J].Scientia Horticulturae,2012,135:112-119.
[20]LAKSO A,KLIEWER W M.The influence of temperature on malic acid metabolism in grape berries.II.Temperature responses of net dark CO2 fixation and malic acid pools[J].American Journal of Enology and Viticulture,1978,29(3):145-149.
[21]VENIOS X,KORKAS E,NISIOTOU A,et al.Grapevine responses to heat stress and global warming[J].Plants,2020,9(12):1754.
[22]XU D,LI X,WANG S.The research of relationships among content of grapes sugar,acid and meteorological conditions in Xinjiang[J].Journal of Arid Land Resources and Environment,2003,17(6):138-143.
[23]KELLER M.The science of grapevines[M].Academic press,2020.
[24]COOMBE B G.Growth stages of the grapevine:Adoption of a system for identifying grapevine growth stages[J].Australian Journal of Grape and Wine Research,1995, 1(2):104-110.
[25]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Methods,2001,25(4):402-408.
[26]XIE S,LEI Y,WANG Y,et al.Influence of continental climates on the volatile profile of Cabernet Sauvignon grapes from five Chinese viticulture regions[J].Plant Growth Regulation,2019,87(1):83-92.
[27]杜远鹏,张一帆,黄文尉,等.葡萄栽培生态指标体系建设及生态区划[J].中外葡萄与葡萄酒,2022(4):1-7.
DUY P,ZHANG Y F,HUANG W W, et al.Construction of viticulture ecological index system and ecological regionalization[J].Sino-Overseas Grapevine & Wine,2022(4):1-7.
[28]TRIOLO R,ROBY J P,PISCIOTTA A, et al.Impact of vine water status on berry mass and berry tissue development of Cabernet franc (Vitis vinifera L.),assessed at berry level[J].Journal of the Science of Food and Agriculture,2019,99(13):5711-5719.
[29]尹海寧,王兆祥,王 琳,等.海拔和行向对酿酒葡萄果实生长发育及品质的影响[J].西北农林科技大学学报(自然科学版),2021,49(4):93-101.
YIN H N,WANG ZH X,WANG L, et al.Effects of altitude and row orientation on growth and quality of wine grape berries[J].Journal of Northwest A & F University(Natural Science Edition),2021,49(4):93-101.
[30]SOYER Y,KOCA N,KARADENIZ F.Organic acid profile of Turkish white grapes and grape juices[J].Journal of Food Composition and Analysis,2003,16(5):629-636.
[31]GOUOT J C,SMITH J P,HOLZAPFEL B P,et al.Impact of short temperature exposure of Vitis vinifera L.cv.Shiraz grapevine bunches on berry development,primary metabolism and tannin accumulation[J].Environmental and Experimental Botany,2019,168:103866.
[32]ARRIZABALAGA M,MORALES F,OYARZUN M, et al.Tempranillo clones differ in the response of berry sugar and anthocyanin accumulation to elevated temperature[J].Plant Science,2018,267:74-83.
[33]RSTI J,SCHUMANN M,CLROUX M,et al.Effect of drying on tartaric acid and malic acid in Shiraz and Merlot berries[J].Australian Journal of Grape and Wine Research,2018,24(4):421-429.
[34]WEN Y Q,LI J M,ZHANG Z Z,et al.Antibody preparation,gene expression and subcellular localization of L-idonate dehydrogenase in grape berry[J].Bioscience,Biotechnology,and Biochemistry,2010,74(12):2413-2417.
[35]TERRIER N,SAUVAGE F-X,AGEORGES A,et al.Changes in acidity and in proton transport at the tonoplast of grape berries during development[J].Planta,2001, 213(1):20-28.
Comparative Analysis of Organic Acid Metabolism in Wine Grape under Two Different Climatic Conditions
Abstract Organic acids,essential flavor compounds in grape berries,are influenced by ambient temperature during berry development.In this study,we compared the difference of organic acid accumulation under two distinct climate types:a hot climate represented by Shanshan in Xinjiang and a cold climate represented by Xiangning in Shanxi.‘Cabernet Sauvignon and ‘Marselan grape varieties were used as materials.The results showed that the grape fruit in Xiangning was larger than that in Shanshan,with significantly lower titratable acid content in grapes from Shanshan and higher pH levesl.Organic acids continued to accumulate before veraison,including tartaric and malic acid,as well as a small amount of citric acid.After veraison,the titratable acid content decreased by 84.8% in Shanshan grapes and 78.5% in Xiangning grapes,with significant degradation of malic acid.Tartaric acid content in ripening grape from Shanshan remained between 7.23-8.96 mg/berry,while that in Xiangning grape was significantly higher,ranging 9.06-10.75 mg/berry; during the grape development,Xiangning grapes exhibited higher levels of tartaric,malic,and ascorbic acids compared to Shanshan grapes,with both varieties showing similar trends.In addition,compared with genes related to malic acid synthesis and degradation,the vacuolar membrane proton pump gene VvVHP may play a more critical role in responding to high temperature to transport malic acid and change the content of titratable acid.
Key words Wine grape; Organic acid; High temperature; Gene expression

