胎儿颈项透明层增厚的产前诊断结果分析
眭建忠 黄淑瑜 禤洁甜 欧水英
胎儿颈项透明层(nuchal translucency,NT)是指超声图像上胎儿颈后皮下液体积聚形成的颈后无回声区,其中NT值≥3.0 mm诊断为NT增厚,NT值2.5 ~<3.0 mm诊断为NT临界增厚。 近年来研究[1-2]发现,胎儿NT增厚与染色体异常、染色体微缺失和微重复、胎儿先天性心脏病等的发生密切相关;基于微阵列芯片的比较基因组杂交(array-based comparative genomic hybridization,aCGH)不仅可检测出染色体非整倍体及大片段的缺失和重复,亦能检测出100 kb以下的基因拷贝数变异(copy number variation,CNV),其对染色体微缺失、微重复等异常的识别优于传统的染色体核型分析。
此外,NT增厚还与50多种遗传综合征相关,其中较为常见的为努南综合征(Noonan syndrome,NS)。大约有50%的NS病例由PTPN11基因突变引起,还有至少8种基因(SOS1、RAF1、RIT1、KRAS、NRAS、BRAF、MAP2K1、SHOC2)的致病性变异可导致NS。在这些情况下,染色体核型分析和aCGH分析结果均提示未见异常,全外显子测序(whole exome sequencing, WES)则能更好地做出诊断。若在临床工作中遇到NT增厚病例,应在充分告知胎儿家长各类检测方法的优缺点后,共同决策采取何种检测方案。可建议胎儿家长先行染色体核型分析和染色体微阵列分析(chromosomal microarray analysis, CMA),若其结果为阴性,可进一步进行WES。一项前瞻性评估研究[3]结果显示,NT增厚的胎儿进一步行WES分析,其诊断率可增加5%~8%,当超声检查发现多个结构异常时,其诊断率则可达到15%。
本文回顾性分析了佛山市第一人民医院于2019年1月-2020年10月被诊断为NT增厚的143例胎儿的染色体核型分析和aCGH分析的结果,以探讨产前诊断对于评估胎儿NT增厚的意义,为产前诊断、遗传咨询提供参考。
1 对象与方法
1.1 研究对象 回顾性分析了佛山市第一人民医院于2019年1月—2020年10月经超声检查发现NT值≥2.5 mm的143例胎儿及其孕母资料。所有孕妇均为单胎妊娠,于孕11~13+6周测量NT值,并行介入性产前诊断抽取绒毛或羊水进行染色体核型分析和aCGH分析。胎儿父母均于产前进行遗传咨询,并完成介入性产前诊断的术前知情同意书签署。本研究符合2013年修订的《赫尔辛基宣言》的要求。
1.2 研究方法
1.2.1 超声检查 由取得资质的超声科医师对所有于孕11~13+6周的孕妇进行胎儿NT值的测量。参照英国胎儿医学基金会制订的标准:头臀径(crown-rump length, CRL)规定在45~84 mm范围之内,NT值≥2.5 mm,进行遗传咨询,建议行介入性产前诊断穿刺。
1.2.2 绒毛穿刺检查 术前根据超声检查结果测量胎儿CRL(45~84 mm),以核实孕妇孕周确为11~13+6周。观察胎盘位置,以确定能否行绒毛穿刺取材。具体穿刺方法见文献[4]相关内容。
1.2.3 羊膜腔穿刺检查 该操作建议在孕18~25周时进行,穿刺前提供近期胎儿超声检查结果,确定是否为单胎、孕周、胎盘位置和羊水量,在羊水暗区最深处,避开胎盘。在超声引导下,行无菌操作以21 G八光穿刺针经腹壁垂直刺入羊膜腔,弃去最初抽取的2 mL羊水,换另一注射器抽取40 mL羊水送检。
1.2.4 实验室检查 ①染色体核型分析:采用原位细胞培养法,常规进行细胞培养、收获、制片和G显带,每例计数20~30个分裂相,至少分析5个核型。② aCGH:使用美国agilent公司生产的8×60 k的芯片进行全基因组扫描检测,结果参照DECIPHER(Database of Chromosomal Imbalance and Phenotype in Human using Ensembl Resource)、ISCA(International Standards for Cytogenomic Arrays)、OMIM(Online Mendelian Inheritance in Man)、DGV(Database of Genomic Variants)、UCSC(University of California Santa Cruz)等数据库进行分析。
1.3 观察指标 收集、分析孕妇的年龄、胎儿的NT值,以及超声检查结果等一般资料。计算染色体核型分析和aCGH分析检测出的染色体异常的胎儿例数,并比较各NT值区间G显带分析和aCGH分析检测出的染色体异常的胎儿占比。
2 结 果
2.1 一般资料分析 143例孕妇的年龄为(29.52±4.78)岁(范围为22~41岁),其中预产期年龄≥35岁的高龄孕妇20例(14.0%)。143例胎儿的NT值为(3.78±1.49) mm(范围为2.50~8.00 mm),其中129例为单纯NT增厚,经超声检查发现5例合并鼻骨缺失,4例合并脉络丛囊肿,1例合并淋巴水囊瘤,1例合并全身水肿,1例合并多发畸形,1例合并脊柱侧弯,1例合并严重腹裂。
2.2 染色体核型分析和aCGH分析结果 染色体核型分析的G显带结果显示,染色体异常胎儿20例(14.0%),其中非整倍体12例(8.4%),包括21-三体综合征11例和18-三体综合征1例;致病性染色体异常8例(5.6%),包括嵌合体3例、染色体不平衡易位2例、染色体平衡易位2例、染色体倒位1例。
aCGH分析检出19例(13.3%)染色体异常胎儿,其中非整倍体12例(8.4%),包括21-三体综合征11例和18-三体综合征1例;致病性微缺失、微重复7例(4.9%)。
2.3 不同区间NT值胎儿染色体异常占比的比较 NT值为2.5~<3.0 mm的胎儿60例,其G显带分析和aCGH分析共检出5例(8.3%)致病染色体异常。NT值为3.0~<3.5 mm的胎儿45例,其G显带分析和aCGH分析共检出9例(20.0%)致病染色体异常;NT值为3.5~<4.0 mm胎儿23例,其G显带分析和aCGH分析共检出7例(30.4%)致病染色体异常;NT值≥4.0 mm的胎儿15例,其G显带分析和aCGH分析共检出6例致病染色体异常。与2.5~<3.0的NT值区间相比,其他NT值区间染色体异常的胎儿占比均显著增高(P值均<0.05)。见表1。
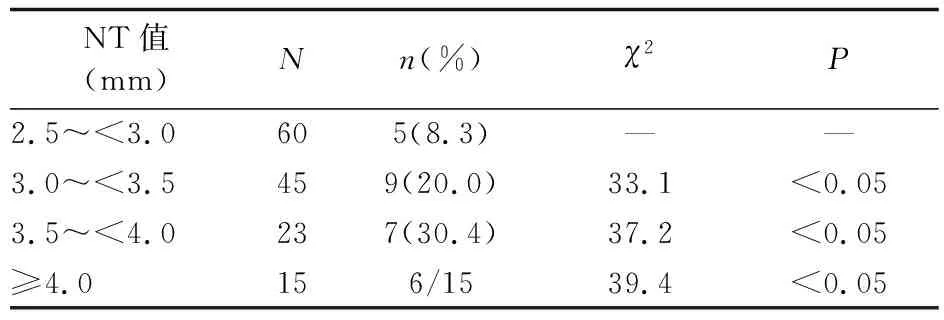
表1 不同区间NT值胎儿染色体异常占比的比较
3 讨 论
NT随孕周增加,一般于14周后自然消退。本研究发现NT增厚的病例常伴随鼻骨缺失、脉络丛囊肿、淋巴水囊瘤、全身水肿、脊柱侧弯及严重腹裂,甚至合并多发畸形。因此,胎儿NT增厚的孕妇在孕期应进行专业的遗传咨询及产前诊断[5]。
本研究对143例NT值≥2.5 mm的胎儿进行介入性产前诊断,并同时进行染色体核型分析和aCGH分析,前者检出染色体异常胎儿20例(14.0%),其中21-三体综合征11例、18-三体综合征1例、嵌合体3例、染色体不平衡易位2例、染色体平衡易位2例、染色体倒位1例,后者检出染色体异常胎儿19例(13.3%)。此外,还应用aCGH分析检测出传统染色体核型分析技术所不能检出的致病性微缺失、微重复胎儿7例(4.9%),这与Grande等[6]的研究结论一致,该研究提示在NT增厚的病例中,当染色体核型分析结果正常时,通过进行aCGH分析,可检测出约4.0%的致病性微缺失、微重复病例。在本研究中,胎儿的NT值分别在2.5 ~<3.0 mm、3.0~<3.5 mm、3.5~<4.0 mm和NT≥4.0 mm区间时,染色体核型分析和aCGH分析检出的相应染色体异常胎儿的占比分别为8.3%、20.0%、30.4%和6/15,提示随着NT值的增加,胎儿染色体异常的发生率可能增高,这与麦明琴等[7]的研究结果相符,提示胎儿的NT增厚与染色体异常发生的关系密切。
《染色体微阵列分析技术在产前诊断中的应用指南(2023)》[8]指出,aCGH分析是指在孕期取得绒毛、羊水或脐血组织,应用全基因组高分辨检测CNV,通过致病性CNV对胎儿基因疾病进行产前诊断,以降低出生缺陷率,其主要检测对象为产前超声发现胎儿结构异常、胎儿NT增厚,以及孕妇外周血游离DNA(cell-free DNA,cfDNA)筛查提示除21、18、13号染色体以外的其他染色体及基因组异常高风险的产前诊断病例等。结合指南的推荐,本研究对143例NT增厚胎儿及其孕母同时进行了染色体核型分析和aCGH分析,经aCGH分析额外检出致病性微缺失、微重复7例(4.9%),其染色体核型分析结果正常,若该类病例未同时行aCGH分析,将会有致病性微缺失、微重复患儿出生,进一步提示了aCGH分析技术应用在产前诊断中的重要性。
2020年1月8日,美国医学遗传学与基因组学学会(ACMG)权威发布了胎儿外显子组测序技术在产前诊断中的应用指南,该指南针对外显子组测序技术在产前的应用场景、检测策略、报告周期、报告变异范围、检测前后的遗传咨询等进行了详细的阐述,并提出指导建议。2020年9月12日,由广东省妇幼保健院牵头,组织国内多个产前诊断中心共同参与撰写,并通过广东省精准医学应用学会发布了《产前外显子组测序遗传咨询和报告规范》,其指出:对于胎儿NT增厚,有1个或多个器官结构异常或重度胎儿宫内生长受限的胎儿,建议行产前WES检测。
综上所述,胎儿NT增厚与染色体非整倍体、染色体微缺失和微重复关系密切,随着NT值增加,胎儿染色体异常发生率显著增高。因本单位尚未开展WES检测技术,对于NT增厚胎儿未能进行进一步的WES检测,可能致使罕见病、单基因病胎儿漏诊,故迫切需要开展WES检测技术。NT增厚为独立的产前诊断软指标,并建议同时行染色体核型分析和aCGH分析,若两者结果均为阴性,建议在后续的遗传咨询中完善胎儿的WES检测。

