长链非编码RNA-TUG1在胃癌发生和发展中的作用及其机制
谢津璧 王善娟 刘艳丽 张丽航 陈 秋 丁仕群 郭润生
胃癌是人类最常见的肿瘤之一。据统计,亚洲地区的胃癌新发病例占全球的3/4,而中国的胃癌新发病例占亚洲一半以上[1-2]。由于早期胃癌的症状隐匿,且胃镜等早期筛查手段在国内的开展程度有限,多数患者在确诊时已处于进展期,丧失了根治性手术的机会。尽管近年来治疗胃癌的外科技术有所进步,且联合了化学治疗等多种治疗方式,但进展期胃癌的5年生存率仍无显著提高。胃癌的侵袭、转移和术后复发是大多数进展期胃癌患者死亡的主要原因[3]。胃癌的发生、发展过程十分复杂,涉及细胞增殖、迁移、侵袭、凋亡等多个环节,以及多条信号转导通路多层次的交叉调控。研究胃癌发生、发展的分子机制对提高临床治疗效果和患者生存率具有重要意义。近年来,长链非编码RNA(long noncoding RNA, lncRNA)作为新的转录调节因子备受关注[4-5]。lncRNA在肿瘤发生、发展过程中的生长、侵袭、转移和耐药等多个环节中发挥调控作用。关于lncRNA与胃癌关系的研究亦受到广泛关注,一些lncRNA在胃癌发病过程中具有促癌作用,如linc01503、CRNDE等可以促进胃癌的发生、发展[6-7];相反,LINC00982、TUBA4B等则可以抑制胃癌的发生、发展[8-9]。既往研究[10]显示,TUG1在胃癌组织中表达增高,并能促进胃癌细胞增殖,但鲜见TUG1促进胃癌细胞迁移、侵袭的研究,尤其是关于其在体内的生物学作用尚未见报道。本研究采用lncRNA芯片对胃癌和癌旁组织中差异表达的lncRNA进行筛查并验证,发现TUG1在胃癌组织中表达异常,且与一些临床及病理因素相关,并通过一系列细胞、分子生物学实验对其在胃癌发生、发展中的作用进行了初步研究。
1 材料与方法
1.1 病例标本 收集2018年10月-2020年9月于上海健康医学院附属嘉定区中心医院普外科行胃癌根治术的胃癌患者60例,将切除的肿瘤组织和癌旁组织(切缘2 cm以上)标本保存于液氮中,选取其中存在淋巴结转移的3例患者的组织样本进行lncRNA芯片检测。所有患者均签署知情同意书,并知晓术后组织作为本次研究所用。
1.2 方法
1.2.1 细胞培养 人胃癌细胞株NCI-N87、MGC-803和人胃黏膜上皮细胞GES-1(中国科学院典型培养物保藏委员会细胞库)置于含10%胎牛血清(美国赛默飞公司)、100 U/mL 青霉素和 100 mg/mL 链霉素(德国默克公司)的DMEM高糖培养基(德国默克公司)中。
1.2.2 lncRNA芯片检测 采用lncRNA芯片(美国Arraystar公司)筛查胃癌和癌旁组织样本中的差异表达lncRNA,通过基因本体(Gene Ontology,GO)分析和信号通路分析对差异表达lncRNA的靶基因进行基因功能和信号通路分析。
1.2.3 慢病毒构建和转染 携带目标lncRNA全长的慢病毒(Lenti-TUG1)和携带TUG1-shRNA的慢病毒(Lenti-TUG1-shRNA)由上海伯豪生物科技有限公司构建。应用阳离子转染试剂Lipofectamine 2000(美国赛默飞公司)进行细胞转染,以无血清培养基培养NCI-N87、MGC-803细胞4 h后,将携带目标基因的慢病毒和Lipofectamine 2000同时加入细胞培养基中,继续孵育12 h。再以加入嘌呤霉素的培养基培养2周进行稳定转染。根据慢病毒转染分为Lenti-TUG1处理组与Lenti-TUG1-shRNA处理组。
1.2.4 细胞增殖实验(CCK-8实验) 于96孔板中每孔接种2×103个NCI-N87、MGC-803细胞/100 μL培养过夜后,加入慢病毒孵育,孵育12 h后每孔加入10 μL CCK-8溶液(上海碧云天公司),继续孵育2 h。将96孔板放入酶标仪中,检测溶液在波长为450 nm处的光密度(A)。设计不加慢病毒的细胞为对照组。
1.2.5 裸鼠胃癌荷瘤模型构建 选取18只4~5周龄,体重20 g左右雌性裸鼠(上海斯莱克公司)构建动物荷瘤模型,以检测TUG1基因在体内对胃癌细胞迁移和侵袭的影响。腹腔内转移瘤模型的构建方法:将悬于0.9%氯化钠溶液中的5×106个携带绿色荧光蛋白(green fluorescent protein,GFP)的胃癌稳转细胞株注入裸鼠腹腔内,3~4周后应用小动物活体成像仪检测胃癌在腹腔内的扩散和转移情况,以相对荧光强度来表示。实验动物生产许可证号:SCXK(沪)2022-0004。实验动物使用许可证号:SYXK(沪)2023-0035。
1.2.6 细胞迁移和侵袭实验(Transwell实验) 迁移实验使用无胶被的24孔板Transwell小室(美国Corning公司),侵袭试验使用基质胶包被Transwell小室上室的底部膜。取细胞悬液5× 104/200 μL,加入24孔板Transwell小室上室,贴壁过夜后换无血清培养基。24孔板下室加入500 μL含20%胎牛血清的培养基,培养24 h后观察NCI-N87、MGC-803细胞的穿膜状况。以棉签擦去上室内的细胞,用0.1%结晶紫溶液染色,置于显微镜下观察细胞迁移和侵袭情况,拍照并计数。
1.2.7 细胞凋亡实验[膜联蛋白(Annexin)V/碘化丙啶(PI)实验] 至少收集1×105个经慢病毒处理后的NCI-N87、MGC-803细胞,使用预冷的70%乙醇固定30 min后,分别加入Annexin V和PI(美国BD公司),室温避光孵育15 min,应用流式细胞仪检测细胞凋亡情况。
1.2.8 蛋白质印迹法 采用蛋白质印迹法检测TUG1基因对凋亡及上皮间质转化(EMT)相关蛋白质表达的影响。检测Lenti-TUG1处理组与Lenti-TUG1-shRNA处理组细胞中RAB2A、MMP-14、Bcl-2、Bax、caspase-3和E-cadherin的蛋白质相对表达量。在慢病毒转染细胞3、6、12、24、48、72 h后,裂解细胞,收集蛋白质,测定样品浓度定量,制备十二烷基硫酸钠聚丙烯酰胺凝胶,进行样品电泳,转膜、封闭、一抗孵育、二抗孵育、底物发光和拍片。
1.2.9 qRT-PCR 使用实时荧光定量试剂盒对筛选出的lncRNA进行qRT-PCR。以GAPDH为内参进行相对表达量统计。
1.2.10TUG1基因信号通路预测分析 应用starBase 2.0软件平台(https:∥rnasysu.com/encori/)预测微RNA(microRNA, miR)-186与RAB2A、miR-186与TUG1的潜在结合位点,并根据软件现有数据对上述3种基因在229例胃癌患者中的表达水平进行相关性分析。
2 结 果
2.1 lncRNATUG1在胃癌组织中的表达水平 lncRNA芯片检测结果显示,在胃癌组织与癌旁组织中有86种lncRNA表达水平的差异有统计学意义(P<0.05),其中18个lncRNA相对表达量的FC≥2。与癌旁组织比较,胃癌组织中有11种lncRNA表达上调,分别是TUG1、RNU6ATAC、CHI3L1、VTCN1、MUC1、ZNF202、LRRC15、SLC34A2、CSF1R、DCSTAMP、ALOX5,对应FC值分别为5.321、5.218、4.765、4.589、4.256、3.779、 3.685、3.246、2.963、2.717、2.431;有7种lncRNA表达下调,分别是THY1、COL3A1、CEMIP、CEACAM6、CD209、KLK7、C4B,对应FC值分别为4.325、3.564、3.552、3.102、2.889、2.418、2.165。见图1。对上述差异基因进行信号通路分析,结果发现TUG1涉及肿瘤发生、发展的多个环节(如细胞增殖、细胞黏附等)。根据信号通路分析结果和参考相关文献,本研究选取TUG1作为研究靶点。qRT-PCR结果显示,胃癌组织中TUG1的相对表达量显著高于癌旁组织(P<0.001)。在胃癌细胞株NCI-N87、MGC-803中,TUG1的相对表达量分别为4.642±0.477、2.234±0.127,均显著高于人胃黏膜上皮细胞GES-1的1.011±0.17(P值均<0.01)。经Lenti-TUG1处理后,NCI-N87和MGC-803的相对表达量增高至6.319±0.177、3.654±0.060;经Lenti-TUG1-shRNA处理后,NCI-N87和MGC-803的相对表达量降低至2.948±0.093、1.565±0.130。
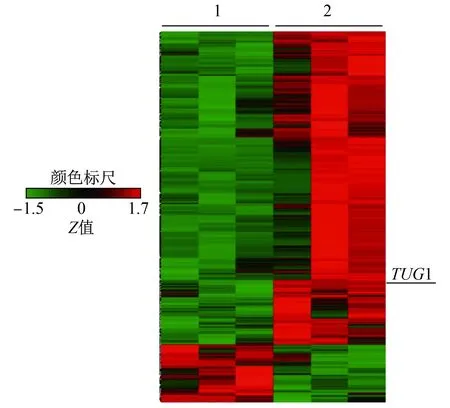
1 胃癌组织 2 癌旁组织
2.2 不同TUG1基因表达水平的患者临床及病理因素的比较 根据胃癌组织中TUG1的中位相对表达量,将患者分为高表达组(30例)和低表达组(30例)。TUG1高表达组肿瘤体积≥5 cm3、有淋巴结转移、有远处转移、TNM分期为Ⅲ期的患者构成均显著高于TUG1低表达组(P值均<0.05)。两组间患者年龄、性别构成和病理分型构成的差异均无统计学意义(P值均>0.05)。见表1。
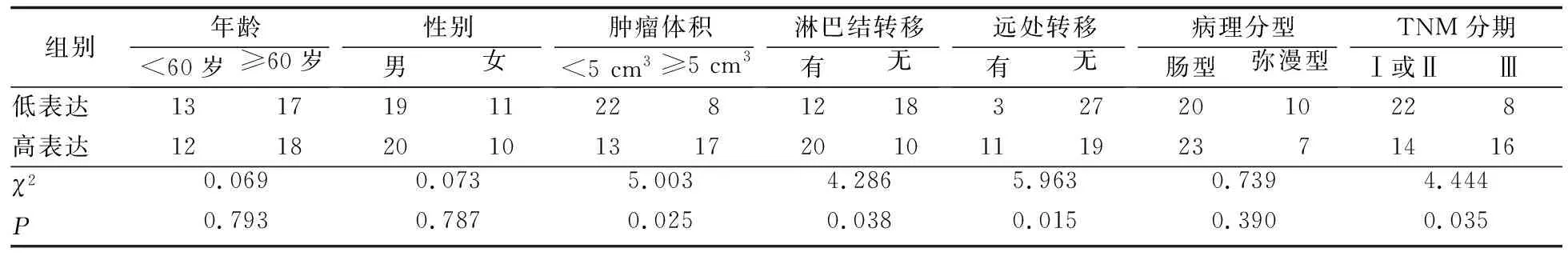
表1 TUG1低表达组与高表达组患者临床及病理因素的比较 (n, N=30)
2.3TUG1基因对NCI-N87、MGC-803细胞增殖的影响 CCK-8实验结果显示,与对照组比较,Lenti-TUG1处理组NCI-N87细胞的A值显著增高,Lenti-TUG1-shRNA处理组NCI-N87细胞的A值显著降低(F=142.691;3组间两两比较P值均<0.01)。与对照组比较,Lenti-TUG1处理组MGC-803细胞的A值显著增高,Lenti-TUG1-shRNA处理组MGC-803细胞的A值显著降低(F=255.906;3组间两两比较P值均<0.01)。见表2。
表2 对照组与Lenti-TUG1-shRNA处理组、Lenti-TUG1处理组A值的比较
2.4TUG1基因对NCI-N87、MGC-803迁移和侵袭的影响 Transwell实验结果显示,与对照组细胞迁移数量(82.2±10.7)和侵袭数量(49.2±4.0)相比,Lenti-TUG1处理组NCI-N87细胞迁移数量(132.0±12.0)和侵袭数量(67.7±4.7)均显著增多;Lenti-TUG1-shRNA处理组NCI-N87细胞迁移数量(42.3±6.4)和侵袭数量(19.8±3.6)均显著减少(迁移实验:F=121.088,P值均<0.01。侵袭实验:F=206.96,P值均<0.01)。与对照组细胞迁移数量(41.3±7.6)和侵袭数量(24.0±5.5)相比,Lenti-TUG1处理组MGC-803细胞迁移数量(62.8±3.3)和侵袭数量(34.3±2.7)均显著增多;而Lenti-TUG1-shRNA处理组MGC-803细胞迁移数量(25.3±4.6)和侵袭数量(15.0±2.4)均显著减少(迁移实验:F=71.212,P值均<0.01。侵袭实验:F=38.057,P值均<0.01)。见图2。
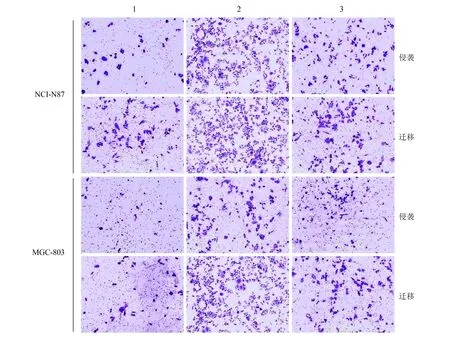
1 Lenti-TUG1处理组 2 Lenti-TUG1-shRNA处理组 3 对照组
2.5TUG1基因对NCI-N87、MGC-803凋亡的影响 Annexin V/PI实验结果显示,与对照组细胞凋亡比例[(8.43±1.06)%]相比,Lenti-TUG1处理组NCI-N87细胞凋亡比例[(3.79±0.42)%]显著降低;Lenti-TUG1-shRNA处理组NCI-N87细胞凋亡比例[(19.39±2.16)%]显著增高(F=193.485;3组间两两比较P值均<0.01)。与对照组细胞凋亡比例[(8.96±2.32)%]相比,Lenti-TUG1处理组MGC-803细胞凋亡比例[(5.53±0.39)%]显著降低;Lenti-TUG1-shRNA处理组MGC-803细胞凋亡比例[(17.46±2.88)%]显著增高(F=49.168;3组间两两比较P值均<0.05)。见图3。

A、B、C 依次为NCI-N87细胞的对照组、Lenti-TUG1处理组、Lenti-TUG1-shRNA处理组 D、E、F 依次为MGC-803细胞的对照组、Lenti-TUG1处理组、Lenti-TUG1-shRNA处理组
2.6TUG1基因对裸鼠腹腔种植瘤的影响 小动物活体成像仪检测结果显示,与对照组细胞相对荧光强度(1.10±0.03)相比,Lenti-TUG1处理组NCI-N87细胞相对荧光强度(3.19±0.64)显著增高,Lenti-TUG1-shRNA处理组NCI-N87细胞相对荧光强度(0.83±0.12)显著降低(F=35.092;3组间两两比较P值均<0.01);与对照组细胞相对荧光强度(1.30±0.25)相比,Lenti-TUG1处理组MGC-803细胞相对荧光强度(3.22±0.51)显著增高,而Lenti-TUG1-shRNA处理组MGC-803细胞相对荧光强度(0.89±0.24)显著降低(F=36.46;3组间两两比较P值均<0.01)。见图4。
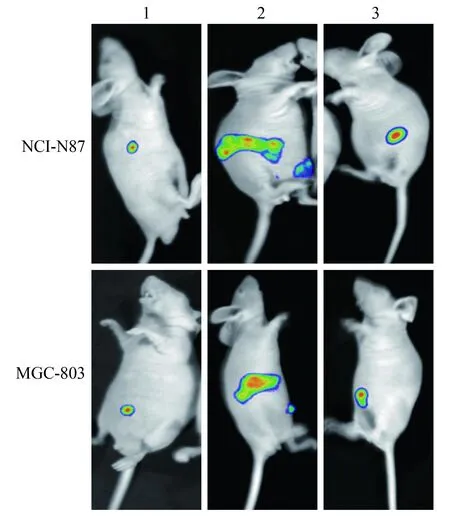
1 Lenti-TUG1处理组 2 Lenti-TUG1-shRNA处理组 3 对照组
2.7TUG1基因对凋亡相关蛋白和EMT相关蛋白表达的影响 蛋白质印迹法检测结果显示,与对照组相比,Lenti-TUG1处理组NCI-N87细胞和MGC-803细胞中Bax、caspase-3和E-cadherin的蛋白质相对表达量均显著降低,RAB2A、MMP-14和Bcl-2的蛋白质相对表达量均显著增高; Lenti-TUG1-shRNA处理组NCI-N87细胞和MGC-803细胞中Bax、caspase-3和E-cadherin蛋白质相对表达量均显著增高,RAB2A、MMP-14和Bcl-2蛋白质相对表达量均显著降低(P值均<0.01)。见图5、表3。
表3 3组间凋亡和EMT相关蛋白质相对表达量的比较

1、2、3 依次为NCI-N87细胞的Lenti-TUG1处理组、Lenti-TUG1-shRNA处理组、对照组 4、5、6 依次为MGC-803细胞的Lenti-TUG1处理组、Lenti-TUG1-shRNA处理组、对照组
2.8TUG1基因信号通路分析 starBase 2.0软件分析结果显示,miR-186、RAB2A和TUG1存在相互结合的序列。在229例胃癌组织中,TUG1与RAB2A相对表达量呈正相关(r=0.180,P=0.006); miR-186与RAB2A相对表达量呈负相关(r=-0.147,P=0.026)。见图6。

A miR-186与TUG1的潜在结合序列 B miR-186与RAB2A的潜在结合序列 C TUG1与RAB2A相对表达量呈正相关 D miR-186与RAB2A相对表达量呈负相关
3 讨 论
胃癌发病的分子机制至今尚未被完全阐明,本研究探索了 lncRNATUG1在胃癌发生和发展中的作用。首先,本团队应用lncRNA芯片技术从胃癌组织中筛选出表达增高最为显著的TUG1基因,并通过qRT-PCR对此结果在60例胃癌患者中进行了验证,结果显示在胃癌组织中TUG1相对表达量显著高于癌旁组织,并且不同表达水平间肿瘤体积、淋巴转移、远处转移、TNM分期的差异均有统计学意义。既往研究[11-13]发现,TUG1基因在胃癌中表达增高,且其表达水平与患者预后相关,TUG1表达高者预后更差。因纳入本研究的多数患者术后未满3年,故未探讨TUG1表达水平与患者预后(3或5年存活率)之间的关系,在后续研究中本团队会继续跟踪随访患者,完善这部分数据。
以上研究结果提示,TUG1可能参与胃癌的发生、发展,故本研究通过细胞水平实验进一步探讨其在胃癌细胞增殖、凋亡、迁移、侵袭过程中的作用。目前,TUG1被证实在多种肿瘤中发挥促癌作用,可以促进多种消化道恶性肿瘤(如肝癌、结肠癌、胰腺癌等)发生、发展[14-16],故抑制其表达则能抑制肿瘤发展。2016年,国内两项研究[17-18]相继发现TUG1可以促进胃癌细胞的增殖、迁移和侵袭。因此,本团队在后续的功能学中对此进行了验证。本研究选择两种胃癌细胞株,MGC-803来源于胃癌原发灶,NCI-N87来源于胃癌肝转移灶。CCK-8实验、Annexin V/PI凋亡实验和Transwell实验结果显示,TUG1表达增高可以促进胃癌NCI-N87和MGC-803细胞增殖、迁移和侵袭,并且诱导凋亡抵抗,以上结果与其他学者的研究结果相似。值得注意的是,本研究通过小动物活体成像仪检测TUG1基因在体内对胃癌细胞生长的影响,结果显示,与对照组比较,Lenti-TUG1处理组(即TUG1表达升高时)种植瘤的荧光强度显著增高,而与Lenti-TUG1-shRNA处理组(即TUG1表达降低时)种植瘤的荧光强度显著降低,表明TUG1基因在体内也可以促进胃癌细胞生长,而在其他研究中关于其在体内的活性较少报道。
既往研究[14-15,17-18]显示,TUG1可以通过与miRNA如miR-145-5p、miR-144、miR-137、miR-138等结合(“海绵”作用),抑制上述miRNA表达,进而发挥其生物学功能。本研究应用starBase2.0软件对TUG1调控的信号通路进行生物信息学分析,结果显示miR-186、RAB2A和TUG1存在相互结合的序列,并且在229例胃癌组织中TUG1与RAB2A基因表达呈正相关;miR-186与RAB2A基因表达呈负相关,表明TUG1可能通过“海绵”作用负向调控miR-186表达,进而正向调控RAB2A蛋白表达。有学者认为miR-186具有抑癌基因特征,在肿瘤中通常表达降低,参与调控多种肿瘤细胞的生物学行为如增殖、迁移、侵袭、肿瘤耐药。胃癌中的miR-186可以靶向TWIST1基因抑制细胞增殖、迁移和侵袭[19]。而RAB2A基因是Ras基因超家族成员之一,是表皮生长因子受体通路中较上游的一个功能基因,通过Ras-Raf-MAPK信号通路在细胞分化、增殖、迁移、侵袭等多方面发挥生物学作用。RAB2A作为原癌基因,其在正常细胞中的表达水平较低,且受到多种因素的调节,保证Ras-Raf-MAPK信号通路对细胞增殖的正常调控[20]。肿瘤中的RAB2A通常处于持续激活状态,目前已经证实RAB2A基因在膀胱癌、乳腺癌等多种肿瘤中的表达水平异常升高[21-22]。RAB2A基因过表达一方面诱导MMP-14蛋白表达促进肿瘤侵袭转移;另一方面,也可以调控细胞质E-cadherin表达而促进肿瘤细胞EMT。本研究对MMP-14和E-cadherin的表达进行了检测,结果显示当TUG1表达降低时(即Lenti-TUG1-shRNA处理组)MMP-14的蛋白质相对表达量显著降低,而E-cadherin蛋白质相对表达量显著增高,从一定程度上证明TUG1可能通过miR-186/RAB2A信号通路调控细胞增殖、迁移、侵袭和凋亡。在后续研究中,本团队将采用荧光素酶技术来验证TUG1与miR-186,以及miR-186与RAB2A的结合作用。
综上所述,TUG1是促进胃癌发生、发展的重要基因,针对TUG1的靶向治疗设计可能为胃癌治疗提供新的思路。

