七氟醚对小鼠海马区BDNF-TrkB-CREB 信号通路表达影响及其氧化应激机制研究
苏凤龙,刘 军,郭艳苓,杨 颖,韩玉琴
(河北省承德市妇幼保健院 1.麻醉科;2.院办;3.产科,河北 承德067000)
七氟醚是目前广泛应用于手术麻醉的一类全麻辅助用药,和咪达唑仑相比,七氟醚可减轻手术过程中的应激反应、术后躁动和术后疼痛,提高围手术期病人的舒适度。新生儿和婴幼儿因疾病不可避免地需要接受外科手术、有创性治疗或影像学检查,从而需要接受各种麻醉药和镇静药的辅助治疗,因此,麻醉药对发育中大脑的影响越来越受到关注。妊娠末期以及出生后早期是大脑学习记忆功能发育的关键时期,神经系统对内外环境的变化异常敏感,海马CA3区被认为与空间辨别性学习记忆活动的关系最为密切[1-3]。脑源性神经营养因子(BDNF)/酪氨酸蛋白激酶B(TrkB)/环磷腺苷效应元件结合蛋白(CREB)信号通路在中枢神经系统发育过程中,对神经元的存活、分化、生长、发育均起到重要的导向作用。BDNF-TrkB-CREB 信号通路还能有效防止神经元受损伤死亡、改善病理状态下的神经元、促进受损伤神经元再生及分化等生物修复效应,而且也是成熟的中枢及周围神经系统的神经元维持生存及正常生理功能所必需[4-8]。本研究从动物实验角度,分析七氟醚对小鼠海马区BDNF-TrkB-CREB 信号通路表达影响,并探讨其氧化应激机制。
1 材料与方法
1.1 实验动物
32只6~7周龄SPF级健康雄性C57BL/6小鼠,体质量15~20 g。购于河北医科大学生物医学工程中心,生产许可证号:SCXK(冀)2019-001。小鼠于笼中适应性饲养7 d。HAV-1病毒株(MacIntyre)来源:美国ATCC公司,通过Vero细胞培养48 h,当有50%VERO细胞变大或变圆,收集病毒测定病毒滴度,半数组织培养感染剂量为10-5,选择10-4浓度接种小鼠。
1.2 药品、主要试剂和仪器
七氟醚(四川省维克奇生物科技有限公司);谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物岐化酶(superoxide dismutase,SOD)ELISA试剂盒(上海烜雅生物科技有限公司);兔抗β-actin多克隆抗体、兔抗鼠核因子E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)、血红素加氧酶1(heme oxygenase 1,HO-1)多克隆抗体、山羊抗兔二抗IgG(北京百奥莱博科技有限公司);RPMI-1640细胞培养基、胎牛血清(美国Hyclone公司);青-链霉素混合液(华北制药股份有限公司)。SIM BFI-HR型激光散斑血流成像系统(PRO微光电科技有限公司);211型二氧化碳培养箱(美国ThermoScience公司);K30B型电热干燥灭菌器(杭州奥盛仪器有限公司)。
1.3 模型建立与分组
遵循随机化原则及等额原则分为对照组/实验组,每组16只。对照组:生理盐水腹腔注射,连续注射5 d。采用颈椎脱臼法将小鼠处死。实验组:行七氟醚吸入诱导,七氟醚挥发罐开至8%,氧流量6 L/min,监测七氟醚的呼出浓度(Exhalation concentration of sevoflurane:ETsevo)。观察小鼠呼吸运动,必要时给予辅助呼吸。当ETsevo达3%,且小鼠意识消失、下颌松弛时,维持 ETsevo在3%。待小鼠麻醉成功后采用颈椎脱臼法将小鼠处死。
小鼠海马组织处理方法:(1)将小鼠颅骨沿颅中缝撬开,暴露颅内后使用眼科镊取出海马组织,于3.5%多聚甲醛中固定4 h,然后用75%、90%、100%三个浓度梯度的乙醇进行脱水,包埋切片,留待备用;(2)冷冻台分离小鼠海马组织,移入-80℃冰箱冻存备用;(3)冰冻切片取出后,二甲苯、酒精脱蜡,蒸馏水浸润5 min,PBS冲洗3次,冲洗结束后滴加由PBS配制成的4%羊血清封闭液,室温下封闭30 min后添加一抗(BDNF/TrKb/CREB抗体的稀释浓度均为1∶1 000),冰箱冻存过夜,次日取出去除一抗,再用 PBS 清洗后滴加荧光素标志稀释的二抗(BDNF/TrKb/CREB抗体的稀释浓度均为1∶4 000),避光条件下孵育4 h。(4)用封片剂进行封片,吸尽多余液体,于4℃黑暗环境下晾干保存,荧光显微镜观察并拍片。
1.4 氧化应激因子水平检测
取出海马组织匀浆样品和ELISA试剂盒,按照MDA、GSH-Px和SOD试剂盒说明书操作,于标准管、空白管、测定管分别加入10 nmol·mL-1标准品、无水乙醇和测试样品50 μL,充分混匀37℃水浴30 min,弃液拍干,各孔内加入抗体工作液100 μL,37℃水浴30 min,洗板拍干,加入显色剂A液与B液50 μL暗处反应20 min,加入终止反应。酶标仪蒸馏水调零,1 cm光径,于532 nm处测定吸光值,绘制标准曲线,计算待测样品浓度。
1.5 海马组织HE染色观察
取固定后的小鼠海马组织,依次放入梯度酒精溶液逐步脱去组织水分,再使用二甲苯处理至组织透明。将组织浸入石蜡杯,待石蜡冷却凝固后,切片机切成5 μm的薄片,再于热水中进行展平,捞取组织切片室温下干燥,在60℃烤箱中烘烤1 h。切片脱蜡脱水后用苏木精染液浸染5 min,流水冲洗再于盐酸酒精中分化10 s,流水冲洗,伊红染液浸染2 min,流水冲洗,再次使用不同浓度酒精脱去组织水分,二甲苯处理至透明,最后使用中性树脂封片,置于光学显微镜下观察海马组织病理学变化。
1.6 RT-PCR检测BDNF/TrKb/CREB mRNA表达
取出小鼠海马组织剪取约100 mg放入1.5 mL无酶EP管内,加入1 mLRNAiso Plus,剧烈震荡充分匀浆,使用Trizol法提取总RNA。取1 μL RNA样品使用核酸蛋白测定仪检测RNA浓度和纯度。通过RNA浓度计算所需上样体积,按照PrimeScriptTMRT Master Mix逆转录试剂盒获得cDNA。使用两步法进行PCR扩增反应,引物序列设计为:BDNF上游5′-TCTTGGAGTAAGTCGAGA-AGTGT-3′,下游5′-GTTGAAACTGAGCGAAAA-AGGC-3′;TrKb上游5′-CTTTAGTCAGCGACAGAAGGAC-3′,下游5′-AGGCATCTTGTTTGGGAATGTG-3′;CREB上游5′-TAGATGACCATGAGTCGCTTGC-3′,下游5′-GCCAAACTTGCTCCATGTCCGG-3′。PCR反应体系为SYBR Premix Ex TaqⅡ 10 μL,上、下游引物各1 μL,cDNA 2 μL,ddH2O 6 μL。于95℃ 5 s,60℃ 10 s,72℃ 15 s共进行40个循环。反应结束后绘制熔解曲线,使用2-△△CT法计算基因表达的相对定量结果。
1.7 Western Blot检测BDNF/TrKb/CREB蛋白表达
取小鼠海马组织放入匀浆器内,按照1∶10比例加入RIPA组织裂解液,冰水浴中充分研磨至组织完全裂解。4℃下,12 000 r·min-1离心15 min,吸取上层清液。取少量上层清液按照BCA蛋白试剂盒检测蛋白浓度,计算蛋白上样量。上样后加入分离胶与浓缩胶开始电泳,在80 V下电泳至Marker分离出红色标记,转为120 V电泳至分离胶底部。电泳结束后,电流210 mA下转至PVDF膜。加入脱脂奶粉孵育1 h后,放入10 mL目标蛋白对应的稀释一抗工作液(1∶1 000),4℃孵育过夜,TBST清洗PVDF膜,加入稀释二抗工作液(1∶3 000)孵育2 h。TBST清洗PVDF膜5次,滴加ECL发光液,设置参数曝光显影,保存蛋白条带并分析目的条带光密度值。
1.8 统计学分析

2 结果
2.1 2组实时免疫荧光定量PCR结果
与对照组比较,实验组小鼠海马组织中 BDNF mRNA、Trkb mRNA、CREB mRNA 基因表达量显著升高(P<0.05)。见表1。
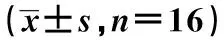
表1 2组实时免疫荧光定量 PCR 结果比较
2.2 2组蛋白免疫印迹分析结果
实验组BDNF、Trkb、CREB蛋白表达水平均显著高于对照组(P<0.05)。见表2。各组小鼠海马 BDNF、Trkb、CREB 蛋白表达水平见图1。

图1 两组蛋白免疫印迹分析结果
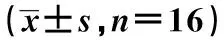
表2 2组蛋白免疫印迹分析结果比较
2.3 2组小鼠氧化应激因子水平比较
与对照组比,实验组小鼠海马组织中MDA水平降低,GSH-Px和SOD水平升高(P<0.05)。见表3。
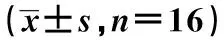
表3 2组小鼠氧化应激因子水平比较
2.4 2组海马组织HE染色比较
结果显示,实验组小鼠海马组织结构完整,神经细胞排列整齐有序,血管丰富,未见炎性细胞浸润、水肿等现象。对照组小鼠海马组织结构破坏严重,可见大量变性和坏死的神经细胞,且有大量炎性细胞浸润。见图2。

图2 海马组织HE染色结果(A实验组;B对照组,×200)
3 讨论
人类神经系统发育的高峰期是妊娠后期三个月至出生后第一年,而小鼠则发生在出生后两周内,出生7 d的小鼠相当于36周的胎儿,故本实验选用新生7 d的SD小鼠作为研究对象。细胞凋亡是机体为了维持内环境稳定,由基因控制的细胞自主的程序性死亡,涉及一系列基因的激活、表达以及调控等作用。有研究大鼠大脑暴露七氟醚后引起显著的神经元凋亡,其中新皮层区域受损最严重,同时也引起了少突胶质细胞的凋亡,因为这个阶段的少突胶质细胞的轴突正处于髓鞘化阶段[9]。
小鼠吸入七氟醚后,机体通过一系列神经细胞表达的Toll受体来识别病原体启动免疫系统应答反应,产生大量炎性因子与活性氧化物,过度的免疫炎症反应会导致中枢神经系统感染过程中引发海马组织损伤,减少脑血流量[10]。如不能及时阻止过度炎症反应所导致的组织细胞破坏,可引发海马组织不可逆性损伤,甚至持续性恶化[11]。
在本研究中,模型组小鼠海马组织中BDNF/TrKb/CREB基因与蛋白表达水平均呈下降趋势,结合小鼠MDA、GSH-Px、SOD水平和脑血流指数的变化,提示模型组小鼠体内BDNF/TrKb/CREB通路受到抑制,氧化应激水平升高,脑血流指数降低。海马组织受到损伤,皮层的血流与供氧均会发生变化,正常生理条件下,为了维持离子水平与神经功能,大脑对能量的需求增加,为了维持代谢平衡,皮层神经元等细胞会释放各类神经递质调节血流变化。在接受处死处理的过程中,小鼠因神经系统的过度氧化应激反应,神经系统受到刺激,细胞通透性改变,脑血流量减少。当给予小鼠七氟醚干预后,小鼠BDNF/TrKb/CREB基因与蛋白表达水平均升高,表明七氟醚能够激活BDNF/TrKb/CREB信号通路,TrKb是一种器官保护因子,在细胞质中与CREB结合形成复合物。当机体内出现大量氧化因子,BDNF受到激活,与CREB解离进入细胞核,与抗氧化元件结合,高度激活多种抗氧化基因,CREB作为TrKb下游关键因子,在细胞应激过程中间接发挥着抗氧化作用[12-14]。
七氟醚对发育中大脑的促凋亡作用的机制尚不清楚,可能与其他吸入麻醉药有共同的作用机制,如GABA受体的激活,神经营养因子受体的激活。早期接触麻醉药物导致持久损害的原因可能是神经元受损的易感性不局限于新生期动物,可以延续至成年动物,如海马齿状回和嗅球[13-15]。有研究发现人类的一些脑区如海马,神经元在髓鞘形成的阶段受到伤害,此效应将持续到青春晚期[16-18]。有研究发现七氟醚可显著促进新生鼠海马神经元的凋亡,本研究结果与其一致[1-2]。海马神经细胞结构、功能、代谢活动受损伤将会造成学习记忆能力、行为能力等脑的高级功能活动能力降低[19]。
综上所述,七氟醚能够上调小鼠海马组织中 BDNF mRNA、Trkb mRNA、CREB mRNA水平,而该机制可能与小鼠海马组织抗氧化能力的提升以及保护小鼠海马组织结构不受损伤有关。

