光照强度对近视豚鼠的眼生物学参数、视网膜结构及巩膜组织lumican和MMP-2表达水平的影响
符俊达, 朱海萍, 杨婉晨, 贾 娜, 孙轶军
近视已成为全球公共卫生问题,近年来,其发病呈低龄化,且高度近视发病率呈增长趋势,不仅影响患者日常生活,而且会增加眼底病变风险,是致盲的主要危险因素之一[1-2]。因此,在各级医疗卫生机构全面开展近视的科学防控工作迫在眉睫。研究表明,光照不足和(或)户外活动减少与近视的发生、发展有密切关系,户外高强度光照可能具有延缓眼轴增长,控制近视进展的作用[3],但高强度光照延缓近视进展的效果和具体机制尚不清楚。据报道,巩膜细胞外基质(extracellular matrix,ECM)合成与降解失调可引起巩膜组织重塑,巩膜进行性变薄,眼轴增长,最终导致近视进展[4]。本研究通过透镜诱导方法构建光学离焦性近视豚鼠模型,模拟人眼近视的发展过程,旨在观察不同光照强度对近视豚鼠眼生物学参数、视网膜结构以及巩膜胶原合成与降解的标志物光蛋白聚糖(lumican)和基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)表达水平的影响。
1 材料与方法
1.1实验动物 选择健康英国种三色豚鼠80只,3周龄,雌雄不限,体重180~210 g,购自北京维通利华实验动物技术有限公司。将豚鼠饲养于透明塑料笼内,设置温度21~24 ℃,相对湿度40%~60%,光照度300 lux,每12 h昼夜交替。所有豚鼠自由饮水摄食,给予富含维生素的饲料,并补充新鲜蔬菜。本研究获秦皇岛市第一医院医学伦理委员会批准(批号:S20220128)。
1.2主要试剂与仪器 (1)主要试剂:过碘酸雪夫染液、末端标记法(terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling,TUNEL)细胞凋亡试剂盒、RIPA裂解液、电化学发光试剂购自北京索莱宝科技有限公司。Trizol试剂购自美国Sigma公司。lumican、MMP-2及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物由生工生物工程(上海)股份有限公司合成。逆转录试剂盒、SYBR Green荧光染料试剂盒购自上海罗氏制药有限公司。兔抗lumican、兔抗MMP-2、鼠抗β-actin蛋白一抗购自美国Abcam公司。过氧化物酶标记的山羊抗兔/鼠IgG蛋白二抗购自上海泽叶生物科技有限公司。(2)主要仪器:眼科A型超声仪购自法国光太公司。BX53型正置荧光显微镜购自日本奥林巴斯公司。HT7700型透射电子显微镜购自日本日立公司。实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪购自美国BioRad公司。
1.3光学离焦性近视豚鼠模型的建立[5]采用凹透镜诱导方法:用10寸白色不透明气球套住豚鼠头部,裁剪露出豚鼠左眼、口鼻、耳朵,将-10.0 D透镜固定于右眼处,制成诱导头套,所有豚鼠佩戴该头套造模,左眼暴露不戴镜作自身对照,共诱导3~5周。每日检查头套2次,避免移位或脱落。定期测定豚鼠右眼屈光度。同批次80只豚鼠造模,有74只屈光度符合要求(-1~-4 D),成功率为92.50%,随机选取60只模型豚鼠进行后续实验。
1.4实验动物分组与处理 将模型豚鼠随机分为A组、B组、C组、D组,每组15只。A组每日置于室外充足阳光下3 h,平均光照度60 000 lux;B组每日置于室外阴凉处3 h,平均光照度10 000 lux;C组每日置于室内北窗处3 h,平均光照度2 000 lux;D组每日室内正常饲养,平均光照度300 lux。其余时间统一室内饲养,平均光照度300 lux,正常摄食饮水,持续光照处理6个月后,每组随机选取10只豚鼠进行后续实验。实验中未出现豚鼠死亡。
1.5屈光度与眼轴测量 分别于光照前,以及光照后1个月、3个月、6个月进行屈光度与眼轴测量。用复方托吡卡胺滴眼液(参天制药株式会社)滴眼3次,1滴/次,待完全散瞳后,采用带状光检影验光测量右眼屈光度。采用眼科A型超声仪测量豚鼠右眼眼轴长度,用盐酸奥布卡因滴眼液(参天制药株式会社)滴眼3次,1滴/次,设置前房传播速度为1 557 m/s,玻璃体传播速度为1 540 m/s,晶状体传播速度为1 723 m/s,将探头置于角膜顶点测量眼轴长度[6]。
1.6显微镜观察视网膜病理变化 光照处理6个月后,脱颈处死豚鼠,摘取右眼球(带有部分视神经),沿视神经纵向切眼球,去除内容物,经固定、脱水、透明、浸蜡包埋后,取后极部黄斑区附近组织制成4 μm石蜡切片,进行TUNEL细胞凋亡染色,荧光显微镜下观察视网膜病理变化(空泡样改变、水肿等)。
1.7透射电子显微镜观察视网膜超微结构 光照处理6个月后,脱颈处死豚鼠,摘取右眼球,置于3%戊二醛溶液中固定3 h,沿后极部切出宽度为1~2 mm的长条,3%戊二醛溶液再固定2 h,1%四氧化锇避光固定90 min,再经脱水、浸透、包埋,铀铅双重染色后,透射电子显微镜下观察视网膜超微结构。
1.8实时荧光定量PCR法检测巩膜组织中lumican和MMP-2 mRNA相对表达量 光照处理6个月后,脱颈处死豚鼠,摘取右眼球,取后极部巩膜组织,采用Trizol法提取总RNA,应用逆转录试剂盒将其逆转录为cDNA,并以cDNA为模板进行实时荧光定量PCR扩增。引物序列见表1。扩增条件:95 ℃ 60 s,95 ℃ 15 s,58 ℃ 30 s,72 ℃ 5 min,共40个循环。以GAPDH为内参,通过2-△△Ct法计算lumican和MMP-2 mRNA相对表达量。
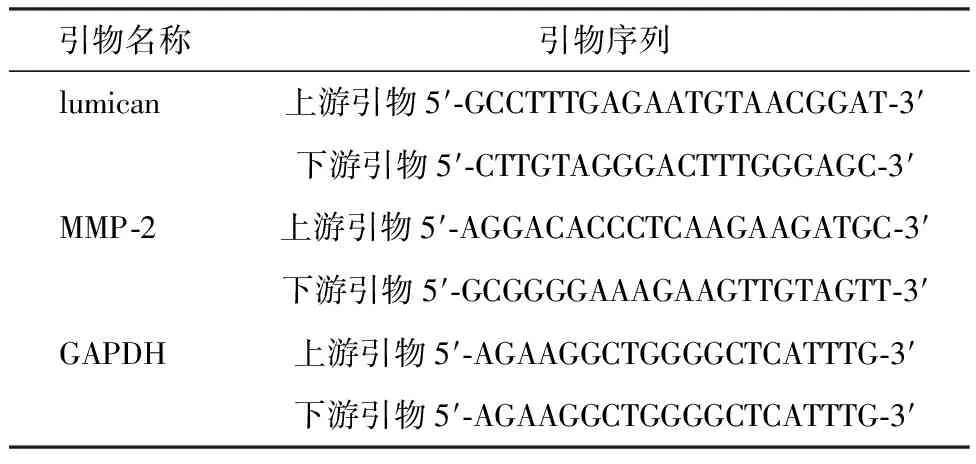
表1 引物序列
1.9蛋白印迹法检测巩膜组织中lumican和MMP-2蛋白相对表达量 光照处理6个月后,脱颈处死豚鼠,摘取右眼球,取后极部巩膜组织,应用RIPA裂解液提取总蛋白,测定浓度后,上样、电泳、电转,用5%脱脂牛奶封闭2 h,再加入兔抗lumican(1∶1 500)、兔抗MMP-2(1∶2 000)、鼠抗β-actin(1∶1 000)一抗,4 ℃孵育过夜,洗膜后,再加入过氧化物酶标记的山羊抗兔/鼠IgG蛋白二抗(1∶8 000),37 ℃孵育30 min,最后滴加发光液显影,扫描各蛋白条带灰度值。以β-actin为内参计算lumican和MMP-2蛋白的相对表达量。
2 结果
2.1四组豚鼠光照前后屈光度比较 光照前,各组豚鼠屈光度比较差异无统计学意义(P>0.05)。与光照前比较,光照1个月、3个月及6个月时各组屈光度有不同程度增加(P<0.05)。光照1个月时,A组和B组屈光度低于D组;光照3个月、6个月时,A组屈光度低于B组、C组和D组,B组屈光度低于D组,差异有统计学意义(P<0.05),见表2。
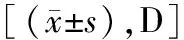
表2 四组豚鼠光照前后屈光度比较
2.2四组豚鼠光照前后眼轴长度比较 光照前,各组豚鼠眼轴长度比较差异无统计学意义(P>0.05)。与光照前比较,A组光照3个月、6个月,B组、C组和D组光照1个月、3个月及6个月时眼轴长度有不同程度增长(P<0.05)。光照1个月时,A组和B组眼轴长度低于D组;光照3个月、6个月时,A组眼轴长度低于B组、C组和D组,B组眼轴长度低于D组,差异有统计学意义(P<0.05),见表3。
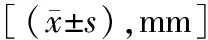
表3 四组豚鼠光照前后眼轴长度比较
2.3四组豚鼠光照后视网膜病理和超微结构情况
光照6个月后,TUNEL染色结果显示,各组豚鼠视网膜的神经节细胞层、内外核层及光感受器细胞层均有不同程度的细胞凋亡,可见散在未染色细胞、核裂解细胞、染色质浓缩边缘化。高倍镜视野下A组、B组、C组和D组视网膜凋亡细胞数量分别为(7.30±1.39)个、(15.40±3.25)个、(34.80±5.66)个、(37.20±5.14)个。A组和B组凋亡细胞数量少于C组、D组(A组 vs C组,t=14.601,P<0.001;A组 vs D组,t=15.875,P<0.001;B组 vs C组,t=10.300,P<0.001;B组 vs D组,t=11.574,P<0.001),且A组凋亡细胞数量少于B组(t=4.301,P<0.001)。透射电子显微镜显示,局部视网膜出现线粒体肿胀伴空泡样改变,微小皱褶和囊肿。A组和B组视网膜结构损伤程度较C组、D组轻,且A组损伤程度较B组轻,见图1。
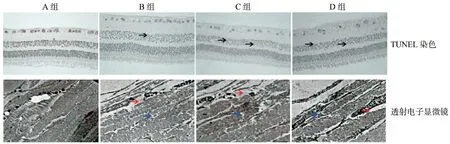
黑色箭头示黄棕色细胞为凋亡细胞;蓝色箭头示空泡样改变;红色箭头示水肿
2.4四组豚鼠光照后巩膜组织中lumican和MMP-2表达水平比较 光照6个月后,与C组、D组比较,A组和B组的lumican表达水平较高,MMP-2表达水平较低,且A组lumican表达水平高于B组,MMP-2表达水平低于B组,差异有统计学意义(P<0.05),见图2。
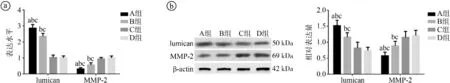
ⓐ巩膜组织中lumican和MMP-2 mRNA相对表达量比较。各组lumican mRNA相对表达量比较,F=293.565,P<0.001;各组MMP-2 mRNA相对表达量比较,F=93.530,P<0.001。ⓑ巩膜组织中lumican和MMP-2蛋白相对表达量比较。各组lumican蛋白相对表达量比较,F=55.974,P<0.001;各组MMP-2蛋白相对表达量比较,F=35.385,P<0.001。与B组比较,aP<0.05;与C组比较,bP<0.05;与D组比较,cP<0.05
3 讨论
3.1豚鼠常被用于建立近视动物模型,因其眼球解剖结构、功能及正视化机制与人类相似,便于测量眼生物学参数[6]。近视的诱导方法主要有形觉剥夺性诱导和光学离焦性诱导,而豚鼠对光学离焦性诱导更为敏感[7]。本研究采用凹透镜诱导光学离焦性近视豚鼠模型,结果显示,佩戴凹透镜诱导3~5周后,豚鼠开始出现不同程度的近视,屈光度范围为-1~-4 D,与既往研究结果一致[8]。
3.2近视的发生发展与环境因素密切相关,尤其是青少年近视,其中光暴露是影响眼球屈光发育的重要因素之一,光照强度、波长、时间、节律等因素均可产生影响[9]。临床观察发现,长期暴露于低强度光照环境会引发视疲劳,增加儿童近视风险,而高强度光照可延缓近视度数的增长[10]。有研究认为,儿童每日在光照度≥10 000 lux的自然光照环境下3 h,可有效预防近视[11-12]。朱秋蓉和刘陇黔[13]的研究显示,高强度光照刺激视网膜产生多巴胺等信号因子,信号因子通过作用视网膜相应位点、周边部视网膜、脉络膜或传递到巩膜等方式发挥调控作用,控制眼轴增长,减缓近视进展。本研究也观察到类似结果,将近视豚鼠每日置于不同光照强度环境下3 h,发现室外高强度光照可减缓近视进展,室内环境无干预效果。
3.3眼轴过度增长会导致视网膜扩张,结构紊乱,功能下降。本研究通过TUNEL细胞凋亡染色和透射电子显微镜观察视网膜结构变化,光照6个月后,各组豚鼠视网膜均伴有细胞凋亡表现,并出现不同程度的层次排列紊乱,组织间隙增大,线粒体胞质内空泡样改变,内、外核层细胞核固缩等结构变化以及细胞数量减少,局部视网膜出现微小皱褶和囊肿,A组视网膜凋亡细胞数量最少,病理损伤程度最轻。可见室外高强度光照可抑制眼轴增长,减缓近视进展,防止高度近视及视网膜病变的发生。
3.4巩膜成纤维细胞和ECM的重塑与眼轴增长密切相关。巩膜的主要功能是维持眼球形状和完整性,若ECM降解增多、合成减少,将引起巩膜变薄、巩膜ECM重塑,促进眼轴增长[14]。lumican是调节胶原纤维生成的因子,在巩膜组织中高表达,通过连接胶原分子调节胶原纤维直径,促进ECM的形成,增强巩膜结构的稳定性,减缓眼轴增长,控制近视进展[15]。MMP-2是调节ECM重塑的主要酶类,其高表达是增加巩膜ECM降解的主要原因,巩膜ECM重塑导致巩膜组织结构发生改变,诱导近视发生[16]。有研究显示,lumican基因突变可影响碱性成纤维细胞生长因子和转化生长因子β2表达,改变巩膜组织的ECM代谢,从而参与近视的发生发展[17]。李佳贤等[18]研究报道,下调MMP-2表达,可降低豚鼠近视屈光度,延缓眼轴增长,对形觉剥夺性近视的进展有干预作用。本研究发现,室外高强度光照组lumican表达上调,MMP-2表达下调,而室内低强度光照组对lumican和MMP-2的表达无明显影响,表明室外高强度光照有助于抑制巩膜重塑,延缓眼轴过快增长,从而减缓近视进展速度。
综上所述,室外高强度光照可上调近视豚鼠巩膜组织中lumican表达,下调MMP-2表达,间接调节胶原纤维合成与分解的平衡,防止巩膜过度重塑,从而控制眼轴增长,减缓近视进展,减轻视网膜病理损伤程度,可间接证实合理户外活动对控制近视进展具有积极作用,但本研究仅针对近视豚鼠模型进行对比分析,只能说明具有相关性,能否在儿童和青少年近视患者中也表现出类似效果,仍需要进一步研究。

