血根碱对患者源性结直肠癌类器官生长的影响
徐志东,周军伟,倪 超,柯希权,马振增,邓晓晶,赵 睿,顾 林,任 志,郑海伦
(1.蚌埠医科大学第一附属医院消化科,安徽 蚌埠 233030;2.伯桢生物类器官研究院,上海 200438)
结直肠癌(colorectal cancer,CRC)是常见的消化道恶性肿瘤之一,其发病率已上升至世界恶性肿瘤的第3位,严重威胁人类的身体健康[1]。尽管在早期诊断、手术切除、化疗和放疗等策略上取得了进展,但结直肠癌的复发率仍然很高,患者的生存率并没有提高[2]。此外,化疗和放疗往往与毒性和威胁生命的副作用有关,这明显影响患者的生活质量。鉴于这些因素,有必要开发更有效、副作用更少的针对结直肠癌通路的治疗方法,并协同提高化疗的疗效。各种研究报道,几种天然生物活性成分对结直肠癌细胞具有抗增殖和抗癌作用。血根碱(sanguinarine, SNG)是一种存在于白屈菜和博落回等罂粟科及芸香科植物中的苯并菲啶类生物碱[3],其药理具有多样性,近年来对SNG进行研究,发现SNG可以通过诱导细胞凋亡、抑制增殖以及抗侵袭、迁移等多方面发挥抗肿瘤功效[4],这些研究在多种类型肿瘤中已被证实,包括胰腺癌、肺癌、宫颈癌、乳腺癌等。有研究[5]发现,SNG可以抑制乳腺癌细胞的增殖而发挥抗肿瘤作用,并在乳腺癌细胞株MDA-MB-231中,SNG是腺苷酸激活蛋白激酶 (AMP-activated protein kinase, AMPK)的变构激活剂,可以引起细胞自噬和凋亡。AMPK不仅是调节细胞稳态和能量代谢的关键因子,同时还参与细胞在应激条件下,通过消化功能失调的细胞器和蛋白质,实现自噬的过程,这在肿瘤发生和转移方面起重要的作用[6]。
类器官是指在体外实现干细胞的3D培养和扩增,形成结构和功能与原组织高度相似的微型器官,拥有新陈代谢和自我组装的能力,是目前唯一的人源性组织水平的研究手段,患者源性的类器官是近来出现的新型临床前模型[7]。结直肠癌类器官是从患者手术切除的肿瘤组织内提取的结直肠癌细胞进行体外培养,这种模型可模拟患者体内环境,其对化疗药的敏感性也更强。与动物模型相比,类器官模型的优势体现在实验周期短,操作简便,且患者源性的类器官更具有人源性和近生理性[8],与细胞系相比,类器官模型是3D培养,研究人员可以更直接的观察细胞生长的形态学变化和特征[9],因此,在未来肿瘤领域的研究与应用方面,类器官模型具有重要的意义和价值。目前SNG在结直肠癌方面的报道较少,且在结直肠癌类器官上尚未见到研究。本研究中,主要探讨了SNG对结直肠癌类器官生长的影响,并探究与AMPK信号通路之间的关系,以期为SNG用于临床治疗结直肠癌提供理论依据。
1 材料与方法
1.1 标本来源本研究有关结直肠癌的实验过程均在蚌埠医学院第一附属医院临床医学研究伦理委员会的监督指导下完成(伦理批件号:2023YJS122)。结直肠癌肿瘤组织取自蚌埠医学院第一附属医院行手术切除的结直肠癌患者,样本的获取已获得患者的知情同意。
1.2 主要试剂和耗材SNG(MCE,HY-N0052)、3-MA(MCE,HY-19312)、CCK-8检测盒(MCE,HY-K0301),Advanced DMEM/ F12(Gibco,12634010)、PBS(Gibco,C10010500BT)、结直肠癌类器官培养基(海伯桢生物,K2103-CR-500)、Matrigel胶(上海伯桢生物,M315066)、ATP检测试剂盒(上海伯桢生物,E238003)、肿瘤组织消化液(上海伯桢生物,K601003-500)、红细胞裂解液(上海伯桢生物,E238010-100)、类器官消化液(上海伯桢生物,E238001-500)、RIPA裂解缓冲液(上海碧云天,P0013C)、BCA蛋白检测试剂盒(上海碧云天,P0012)、4%多聚甲醛固定液(上海碧云天,P0099)、苏木精-伊红染色试剂盒(上海碧云天,C0105M)、Ki67抗体(Mouse,BD)、CK20抗体(Mouse,Santa)、CK7抗体(Mouse,Santa)、Ep-CAM抗体(Mouse,Santa)、鼠二抗(Santa)、AMPK抗体(CST,2532)、p-AMPK抗体(CST,2531)、mTOR抗体(CST,2972)、p-mTOR抗体(CST,2971)、p62抗体(CST,5114)、Beclin1抗体(CST,3738)、GAPDH抗体(Abcam,ab8245)、HRP标记山羊抗兔(Abcam,ab6721)、HRP标记山羊抗小鼠(Abcam,ab6728)。
1.3 结直肠癌细胞分离及培养在无菌培养皿中,用含2%双抗的PBS溶液震荡洗涤结直肠癌手术切除肿瘤组织3~5次后,剪碎成0.5~1 mm3的组织碎片,加入10 mL的肿瘤原代消化液,37 ℃摇床消化30~40 min,使结直肠癌细胞逐渐从组织碎片中脱落,之后再加入终浓度为2%的FBS,终止消化。300 r·min-1离心3 min,弃上清,加入1 mL Advanced DMEM/F12溶液重悬。使用100 μm的滤网过滤,收集滤液,加入1 mL的红细胞裂解液吹打混匀,静置1 min,去除其中的红细胞,300 r·min-1离心3 min,弃上清,台盼蓝计数,用Matrigel胶包裹重悬的细胞沉淀,24孔板接种。接种密度:肿瘤细胞5×104个/孔,Matrigel胶25 μL/孔。将24孔板置于37 ℃培养箱中20 min,加入结直肠癌类器官培养基500 μL/孔,将24孔板放置在37 ℃培养箱中进行培养,每隔2 d观察细胞状态和类器官形成数量,3 d后给类器官换液,视类器官生长情况进行传代,一般7 d左右。
1.4 HE染色将肿瘤组织置于4%多聚甲醛溶液中固定48 h,并收集已培养7 d的成熟的结直肠癌类器官,固定于4%多聚甲醛溶液中1 h,固定成功后用3%琼脂糖包埋类器官。对组织和类器官进行乙醇梯度脱水,二甲苯透明(类器官10 min、肿瘤组织20 min),浸蜡(类器官2 h、肿瘤组织3 h)。石蜡包埋后,4 ℃过夜,再进行石蜡切片(5 μm)、摊片、烤片。样本切片进行脱蜡、复水、苏木精(60 s)、水洗(1 min)、伊红(5 min)、乙醇梯度脱水、二甲苯、封片、镜检。
1.5 免疫组化染色将肿瘤组织置于4%多聚甲醛溶液中固定48 h,并收集已培养7 d的成熟的结直肠癌类器官,固定于4%多聚甲醛溶液中1 h,固定成功后用3%琼脂糖包埋类器官。对组织和类器官进行乙醇梯度脱水,二甲苯透明(类器官10 min,肿瘤组织20 min),浸蜡(类器官2 h,肿瘤组织3 h)。石蜡包埋后,再进行切片(5 μm)、摊片、烤片。脱蜡水化后加入枸橼酸盐溶液,高温高压进行抗原修复15~20 min,室温冷却,3%过氧化氢室温孵育(15 min),水洗(10 min),加入4% BSA进行封闭,室温孵育1 h,敷一抗,4 ℃过夜。PBS 10 min/3 次,敷二抗1 h,PBS 10 min/3 次,DAB显色90 s,苏木精(90 s),盐酸酒精分化(2 s),水洗(1 min),温水返蓝(5 min),乙醇梯度脱水,二甲苯,封片,镜检。
1.6 CCK-8细胞活力将结直肠癌类器官去胶,消化成单细胞,用Matrigel胶包裹并接种于96孔板中,接种密度:2 000个细胞/孔,2 d后,用不同浓度SNG(0.1、0.3、1、3、9、27 μmol·L-1)处理类器官,每组3个复孔,并设置DMSO对照组,培养3d。CCK-8细胞活力检测试剂盒,加入CCK-8溶液(10 μL/孔),37 ℃孵育2 h,450 nm处检测吸光度,计算细胞存活率和药物半数抑制浓度(IC50)。检测的时间选择类器官生长的d 3、d 6、d 9。
1.7 Western blot检测将结直肠癌类器官消化成细胞团块,用Matrigel胶包裹并接种于24孔板中,接种密度:1×105个细胞/孔,0.5、1、2 μmol·L-1浓度SNG处理,培养3 d。分别收集不同处理组的类器官,消化1 min,吹打去胶,并制备成细胞悬液,加入RIPA裂解缓冲液(冰上裂解30 min),BCA蛋白定量法计算上样量,SDS-PAGE电泳分离蛋白,转移至PVDF膜,封闭1 h,与AMPK、p-AMPK、mTOR、p-mTOR、p62和Beclin1一抗孵育(4 ℃过夜),室温敷二抗(摇床1 h),ECL试剂盒显影,凝胶成像系统采集图像。
1.8 ATP含量检测将结直肠癌类器官去胶,消化成单细胞,用Matrigel胶包裹并接种于96孔板中,接种密度:2 000 个细胞/孔,2 d后,用3 μmol·L-1SNG单药组、3 mmol·L-1AMPK抑制剂单药组(3-MA)以及SNG协同3-MA联合组处理类器官,培养3 d。此外,用Matrigel胶包裹并接种于96 孔板中,2 000个细胞/孔,2 d后,设置SNG(1 μmol·L-1)分别与不同浓度临床化疗药组(奥沙利铂:0.21、0.62、1.85、5.56、15.56、50 μmol·L-1;伊立替康: 0.21、0.62、1.85、5.56、15.56、50 μmol·L-1;5-氟尿嘧啶:0.21、0.62、1.85、5.56、15.56、50 μmol·L-1)以及化疗药单药组(奥沙利铂:0.21、0.62、1.85、5.56、15.56、50 μmol·L-1;伊立替康: 0.21、0.62、1.85、5.56、15.56、50 μmol·L-1;5-氟尿嘧啶:0.21、0.62、1.85、5.56、15.56、50 μmol·L-1),协同处理结直肠癌类器官,培养3 d。使用ATP酶检测试剂盒,按照说明书,每孔中加入50 μL的ATP检测试剂和50 μL的Advanced DMEM/F12,充分混匀,37 ℃孵育30 min,通过化学发光法检测,计算ATP相对含量。检测的时间选择药物处理后的d 3。
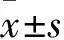
2 结果
2.1 患者源性结直肠癌类器官构建显微镜下观察原代结直肠癌类器官的构建过程,在结直肠癌培养基的培养下,肿瘤组织碎片和细胞团块不断的进行生长与扩增,48~72 h组织碎片就可以出现形态为囊腺样的三维细胞团,形成囊样结构,3~5 d后逐渐扩增并形成结直肠癌类器官(Fig1),d 7,类器官平均直径可以生长到150~250 μm,表明类器官完成初步构建。原代培养7 d后,形成成熟的结直肠癌类器官,可以进行传代。培养成熟的结直肠癌类器官能在体外维持其形态学特征的稳定性,并且可以维持传代10代以上(Fig2),此外,可以进行冻存,复苏后的类器官仍具有良好的细胞活性。

Fig1 Growth of patient-derived colorectal cancer organoids in primary culture

Fig2 Subculture and resuscitation of colorectal cancer organoids over 10 generations
2.2 患者源性结直肠癌类器官的形态特征类器官是可以自我组装的细胞集合体,HE染色显示(Fig3),类器官中细胞自我组织的细胞排列形态与结直肠癌原组织的细胞排列形态几乎一致。肿瘤细胞形态的异质性高,排列不规则,细胞多核,细胞核染色大而深。通过免疫组化染色(Fig4),检测肿瘤标志物CK20、CK7、Ki67、Ep-CAM的表达。肠癌标志物CK20在上皮性肿瘤组织和类器官中表达,CK7表达阴性,Ki67促进肿瘤细胞的增殖,Ep-CAM阳性显示,对肿瘤发生和转移具有作用。通过HE和免疫荧光的鉴定,提示结直肠癌类器官已构建成功。

Fig3 HE staining of colorectal cancer tissues and organoids

Fig4 Immunohistochemical staining of colorectal cancer tissue and organoids
2.3 SNG对患者源性结直肠癌类器官生长影响CCK-8实验结果显示,随着SNG浓度的升高,结直肠癌类器官的细胞存活率逐渐下降(P<0.05),在光镜下(Fig5),类器官的生长状况也随SNG浓度的增加,细胞生长抑制作用明显,类器官逐渐碎裂,6例患者结直肠癌类器官经药物作用并计算出IC50(72 h):CRC1为2.818 μmol·L-1,CRC2为2.285 μmol·L-1,CRC3为2.571 μmol·L-1,CRC4为2.457 μmol·L-1,CRC5为2.091 μmol·L-1,CRC6为2.877 μmol·L-1。在SNG 2 μmol·L-1的浓度处理下(Fig6),随着培养天数的延长,类器官细胞的存活率也逐渐下降(P<0.05)。以上表明,SNG可以抑制结直肠癌细胞的增殖,并且结直肠癌类器官的生长,在SNG的浓度和处理时间上都有依赖性。

Fig5 Effect of different concentrations of sanguinarine on organoid growth in colorectal cancer

Fig6 Effect of sanguinarine treatment time on organoid growth in colorectal Effe)
2.4 SNG对结直肠癌类器官相关蛋白的影响Western blot检测结果显示(Fig7),与DMSO对照组相比,低浓度SNG组(0.5 μmol·L-1)处理可使类器官中p-AMPK的表达升高,调控生长代谢的mTOR和p-mTOR的表达下降,而高浓度SNG组(2 μmol·L-1)的p-AMPK、mTOR和p-mTOR蛋白水平变化最大,提示SNG抑制结直肠癌类器官的生长形成可能与p-AMPK和p-mTOR表达有关,且自噬相关蛋白p62和Beclin1的蛋白表达水平随着SNG的剂量增加也逐渐升高,提示SNG可能与结直肠癌类器官的自噬有关。
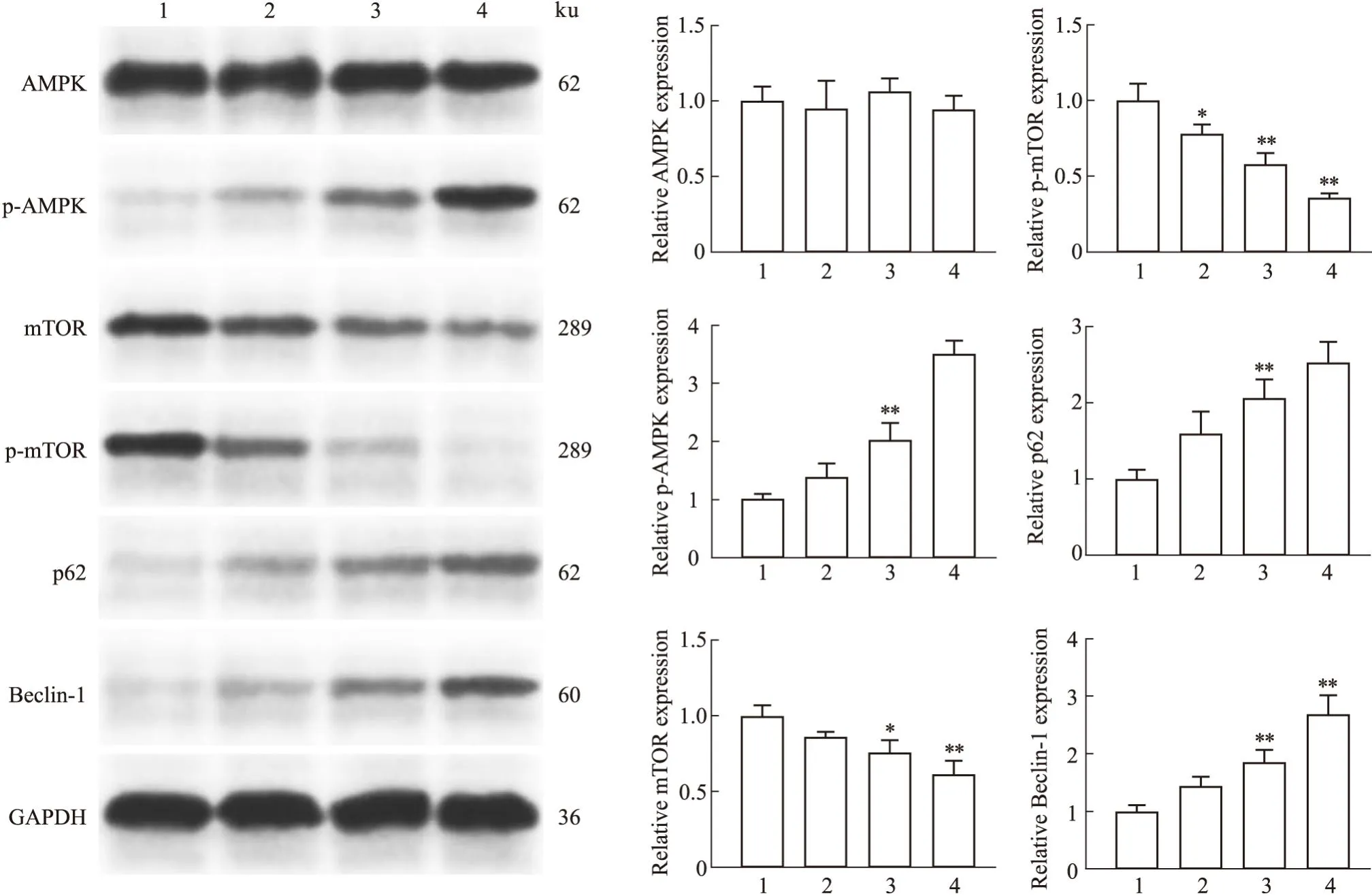
Fig7 Effect of sanguinarine on expression of APMK/mTOR-related proteins in colorectal cancer
2.5 SNG联合AMPK抑制剂对结直肠癌类器官生长的影响3-MA作为AMPK的抑制剂,可以抑制AMPK的磷酸化,通过ATP含量检测(Fig8),与2 μmol·L-1SNG处理组相比,联合组中3-MA减缓了SNG导致的结直肠癌细胞生长的抑制,细胞存活率明显增加,提示SNG抑制结直肠癌类器官的生长形成可能是通过促进p-AMPK表达导致的。
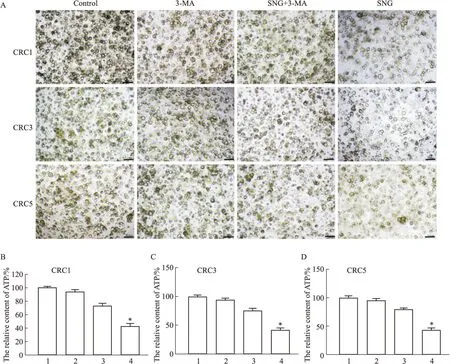
Fig8 Effect of 3-MA combined with sanguinarine on organoid growth
2.6 临床化疗药单用及联合SNG应用对结直肠癌类器官的影响SNG和临床化疗药联合应用对结直肠癌细胞的增殖抑制作用明显高于临床化疗药单用药组(Fig9)。通过ATP含量检测,计算联合药物组和单药组的IC50,通过3例患者的药敏检测结果显示,联合用药普遍可以增强单药组对结直肠癌类器官生长的抑制性,当奥沙利铂或伊立替康在患者来源的结直肠类器官上出现耐药情况时,SNG的联合作用仍可以有效抑制类器官的生长,SNG具有协同临床化疗药对结直肠癌的抑制作用。

Fig9 Effect of sanguinarine combined with clinical chemotherapeutic agents on organoid growth in colorectal cancer
3 讨论
类器官拥有类似真实器官的复杂结构,并可以模拟出来源组织或器官的部分生理结构和功能[10]。患者源性的肿瘤类器官因其更接近来源肿瘤和组织的生理结构,保留来源肿瘤的部分特定功能,并且结果也可以得出与临床上患者更加相似的药物反应,因此,肿瘤类器官进入了研究人员的视野。肿瘤类器官的研究和应用是最近的10年里,肿瘤关键的进展之一。由于部分类器官模型存在许多活性干细胞群,并且能够在体外实现极大地扩增,因此,类器官也可以被构建成各类发育或疾病模型[11],具有潜力无穷的科学研究价值和广阔和临床诊断治疗应用前景。通过类器官模型,研究人员可深入观察人体的组织变化,更好地模拟疾病发生,发展的过程[12]。应用结直肠癌类器官模型,探究天然生物活性成分对结直肠癌及癌前病变的作用与机制是一个相当有前景的方向。SNG是一种苯并菲啶类生物碱,主要存在于芸香科及蓝堇科植物中,如博落回、白屈菜等[3],其药理作用具有多样性,近年来开发这种生物碱成为癌症选择性药物是医学科研的热点。
在本研究中,我们通过类器官3D模型探究SNG对结直肠癌类器官生长的影响及可能的机制。患者来源的结直肠癌类器官更具有人源性和近生理性,收集患者术后样本,原代构建结直肠癌类器官,培养成熟的结直肠癌类器官能在体外维持其形态学特征的稳定性。通过HE染色,类器官中细胞自我组织的细胞排列形态与结直肠癌原组织的细胞排列形态几乎一致,排列不规则,细胞多核,细胞核染色大而深。免疫组化染色观察,结直肠癌肿瘤标志物Ki67、CK20、CK7、Ep-CAM表达,通过鉴定,肠癌标志物CK20在上皮性肿瘤组织和类器官中表达,CK7表达阴性,Ki67促进肿瘤细胞的增殖,Ep-CAM阳性显示,对肿瘤发生和转移具有作用,提示结直肠癌类器官成功构建。CCK-8结果表明,随着SNG浓度的升高,结直肠癌类器官的细胞活力呈剂量和时间依赖性降低,说明SNG可以抑制结直肠癌细胞的增殖。自噬是细胞内一种保守的自我降解系统,在应激条件下,对维持细胞内环境的稳定起着重要的作用,可以将细胞器、蛋白质和其他大分子传递到溶酶体中进行降解,以满足能量的供应需求[13]。近几年来,Beclin1、p62是研究较多的自噬相关蛋白,Beclin1是自噬与肿瘤关联的重要纽带,参与自噬体膜形成,同时还可以诱导凋亡的发生,在肿瘤中发挥重要作用[14]。p62的主要功能是参与蛋白泛素化及衰老、受损细胞器的循环周转,并随降解产物包裹进入自噬泡而被降解[15]。我们通过Western blot探究了不同浓度SNG对结直肠癌类器官蛋白表达的影响,结果显示,SNG可以上调p62和Beclin1的表达,且呈浓度依赖性。自噬主要受AMPK/mTOR信号通路、PI3K/Akt/mTOR信号通路和其他相关自噬信号通路的调控[16]。AMPK/mTOR信号通路作为调节自噬的经典信号通路之一,为许多肿瘤提供了潜在的治疗靶点。AMPK是真核细胞中高度保守的蛋白质,是细胞的“代谢和能量感受器”,可以在生理水平的代谢应激下维持细胞内的稳态和能量平衡,细胞通过调控自身的新陈代谢以满足能量供应的需求[17]。mTOR是生长因子和营养信号的整合器,其主要功能是调节蛋白质合成和细胞周期,它能整合上游的多种信号调控细胞的凋亡和自噬[18]。3-MA作为AMPK的抑制剂,可以抑制AMPK的磷酸化,我们使用3-MA处理肠癌类器官,通过ATP含量检测发现,AMPK抑制剂可以减缓SNG对结直肠癌细胞的生长抑制作用,提示3-MA可能通过抑制SNG促进的p-AMPK表达增加的作用。为了进一步探究SNG对结直肠癌类器官的抑制作用是否通过靶向AMPK/mTOR信号通路,因此,我们研究了不同浓SNG对类器官所表达的AMPK、p-AMPK、mTOR和p-mTOR蛋白影响,Western blot的结果显示,AMPK的表达基本没有变化,而p-AMPK蛋白表达含量升高,且呈浓度依赖性。mTOR和p-mTOR的表达明显降低,这个结果表明,SNG抑制结直肠癌类器官生长的作用可能与AMPK/mTOR信号通路磷酸化有关。SNG联合临床化疗药实验结果显示,SNG与结直肠癌临床化疗药奥沙利铂、伊立替康、5-氟尿嘧啶协同对结直肠癌细胞的抑制作用不仅在药物浓度上有依赖作用,而且SNG联合组明显高于化疗药单用药组。当奥沙利铂或伊立替康在患者来源的结直肠类器官上出现耐药情况时,SNG的联合作用仍可以有效抑制类器官的生长,说明SNG可以协同临床化疗药治疗结直肠癌。
综上所述,SNG可能是一种很有前途的化疗增敏剂,可以为将来开发结直肠癌新型候选药物提供理论和实验依据。

