UCHL1调控NF-κB信号通路在单核细胞驯化免疫中的作用
王洪民,马子涵,潘雅颖,高晓明,龚方苑
(苏州大学基础医学与生物科学学院,江苏 苏州 215123)
固有免疫和适应性免疫是两类相对独立又互相协同的免疫应答方式。经典的免疫学理论认为免疫记忆是适应性免疫区别于固有免疫的重要特征之一。然而,近年来研究发现,固有免疫细胞在接受病原体及其代谢产物刺激产生初次免疫应答后,可以通过表观遗传和代谢重编程等方式改变细胞表型及功能,当再次接触不同病原体时,可以产生更强的非特异性免疫反应,这种现象被称之为驯化免疫[1]。驯化免疫是由固有免疫细胞(包括单核/巨噬细胞、中性粒细胞和NK细胞等)所介导的,独立于T细胞和B细胞的记忆样功能。驯化免疫中固有免疫细胞的应答反应性增强,会产生类似免疫记忆样的特性,这对于机体发挥宿主防御及抗感染等功能具有重要意义[2]。
在我们的前期研究中发现,免疫复合物可以诱导单核细胞产生敏感性增强状态,即固相化-IVIG(coated-IVIG, c-IVIG)处理的单核细胞再次接受LPS刺激时其敏感性明显增强[3]。通过差异富集分析c-IVIG处理的单核细胞组及对照组的转录组测序(RNA-seq)结果,发现差异基因主要在泛素-蛋白酶体系统(ubiquitin proteasome system, UPS)明显富集。因单核细胞在驯化免疫中的反应性增强主要体现为炎性细胞因子如TNF-α,IL-6等的分泌水平增加,由NF-κB通路所介导;而UPS通路同样与NF-κB信号通路密切相关[4],因此,我们认为NF-κB信号通路中的UPS可能影响了c-IVIG处理的单核细胞的驯化作用。
UPS是所有细胞中蛋白质质量控制的基本调节器,其通过对底物蛋白的多聚泛素化并经蛋白酶体降解影响或调节多种细胞活动,如转录、免疫反应、炎症过程及肿瘤生长等[5]。UPS由El泛素活化酶、E2泛素偶联酶、E3泛素连接酶和去泛素化酶(deubiquitinating enzymes,DUBs)组成,而DUBs作为UPS中的重要组成部分,可通过切割多聚泛素链或者从修饰的底物蛋白中去除泛素来逆转泛素化过程,发挥去泛素化作用,逆向调节蛋白降解过程,从而影响细胞内蛋白质的功能。DUBs的存在使泛素化修饰成为一个被严格调控的可逆过程。在细胞中DUBs发挥维持游离泛素水平稳态的作用,而稳定的游离泛素水平是UPS正常调节的重要前提[6]。基于上述我们认为的NF-κB信号通路的泛素-蛋白酶体系统途径可能影响了c-IVIG驯化作用的推测,我们进一步分析了单核细胞驯化处理后基因表达改变量较大的DUBs,发现去泛素化酶UCHL1在单核细胞驯化免疫中的作用最为明显。
UCHL1是一个由223个氨基酸组成的半胱氨酸水解酶,也称为PGP9.5蛋白,在大脑的神经元细胞中大量表达,其同时具有水解酶和连接酶的活性,这种双重功能使UCHL1与其他DUBs区别开来,并使其成为UPS功能的特殊靶点[7]。UCHL1主要细胞功能被认为与其阻止多肽蛋白酶体降解的单体泛素结合有关,其通过维持细胞内可用的泛素池,调节多种细胞泛素依赖性的生物过程,如细胞周期、信号转导、物质代谢、发育分化等[8]。已有的研究还表明,UCHL1参与了一些炎症反应,UCHL1在多种炎症性肾小球疾病中的表达明显升高;抑制UCHL1可减少小鼠心脏炎症细胞浸润;UCHL1通过NF-κB和MAPK信号调节LPS活化的巨噬细胞诱导的炎症反应等[9-11]。因此,UCHL1可能是治疗多种炎症性疾病的潜在靶点。
驯化免疫诱导增强的非特异性免疫应答更多的是炎症反应。越来越多的证据表明,训练有素的免疫在广泛的(病理)生理条件下发挥着重要作用,目前已经在多种自身免疫性疾病中发现了驯化免疫的参与。在自身免疫性疾病患者体内存在大量自身抗体,可以参与免疫病理过程。通常,自身抗体可识别组织抗原形成抗原-抗体复合物,或直接沉积于炎症部位,如在类风湿性关节炎患者滑膜内[12]。因此,探究免疫复合物诱导驯化免疫的机制对自身免疫病的预防及治疗尤为重要。本研究我们采用c-IVIG模拟自身免疫疾病中自身抗体的堆积效应对单核细胞进行驯化处理,通过在293T细胞中构建NF-κB信号通路模型,探究c-IVIG诱导单核细胞驯化作用的机制,以期为解释自身免疫病发病的机制提供新的依据,为疾病的预防和治疗提供新的策略。
1 材料与方法
1.1 材料
1.1.1细胞与质粒 293T细胞系由本实验室保存;单核细胞从人外周血分离得到;NF-κB质粒购自碧云天公司;UCHL1、USP2a、USP2b、OTUB2、OTUD4、PSMD14由苏州大学免疫系郑慧教授惠赠;pSuper质粒由苏州大学免疫学王帅副教授惠赠;pcDNA3.1、RL-TK、GFP质粒由本实验室保存;UCHL1-S18Y、UCHL1-H161Q由本实验室构建。
1.1.2试剂 人TNF-α酶联吸附测定试剂盒(eBioscience);人单核细胞CD14磁珠(Miltenyi Biotec);HP Total RNA Kit (Omega);1st-Strand cDNA 合成试剂及TB Green® Premix Ex TaqTM(TliRNaseH Plus)(TaKaRa);DUBs广谱抑制剂PR619、UCHL1特异性抑制剂LDN57444 (Selleck);LongTrans转染试剂(Ucallm);兔抗UCHL1多克隆抗体(Thermo Scientific);GAPDH单克隆抗体(Santa Cruz);双荧光素酶报告基因检测试剂盒(原平皓生物)。
1.1.3仪器 StepOne Plus Q-PCR仪(Life Technologies);Spark多功能酶标仪(Tecan);AttuneTMNxT 声波聚焦流式细胞仪(Thermo Scientific)。
1.2 方法
1.2.1单核细胞的获取 收集健康人外周血,将外周血与PBS按 1 ∶1进行稀释,然后将稀释的外周血缓慢加入等体积的淋巴细胞分离液上层,500×g离心30 min;离心结束后,离心管内液面由上至下依次为血浆层、单个核细胞层、分离液层与红细胞层;用无菌吸管吸取单个核细胞层的细胞置于新的离心管中,加入PBS缓冲液,以400×g离心10 min洗涤去除血小板和死细胞等成分,获得的细胞即为单个核细胞。将收集到的单个核细胞按107细胞数加80 μL预冷的分选缓冲液的比例进行重悬,按107细胞数加20 μL抗CD14磁珠标记抗体的比例加入抗体,冰上孵育15~30 min,孵育结束加入20 mL分选缓冲液以500×g离心10 min对细胞进行洗涤。将细胞沉淀重悬于500 μL分选缓冲液中,LS柱置于磁珠分离架上,细胞悬液过柱,并用分选缓冲液冲洗分离柱以去除未结合的细胞,而后将LS柱从分离架上移开,将吸附在磁场中的细胞推出经流式鉴定即可获得纯度达90%以上的单核细胞。
1.2.2细胞培养 富集得到的人单核细胞采用RPMI 1640(含5%自体血清、1%双抗)完全培养基进行培养;293T细胞采用DMEM高糖(含10%胎牛血清、1%双抗)完全培养基培养。细胞置于37 ℃ CO2培养箱中培养。
1.2.3单核细胞的驯化处理 将从人外周血中分离得到的单核细胞以1×105个接种于96孔板中,先经c-IVIG处理24 h,吸出上清,加10 μg·L-1LPS刺激,48 h收集细胞上清进行后续检测。
1.2.4293T细胞转染 转染前1 d将5×104个细胞接种于48孔板中,待细胞融合度达到80%以上时进行转染。转染前30 min更换成300 μL新鲜的完全培养基。将0.25 μg的质粒DNA稀释到15 μL无血清的DMEM培养基中,混匀;将0.75 μL LongTrans转染试剂稀释到15 μL无血清的DMEM培养基中,混匀;然后将DNA悬液加入LongTrans悬液中,轻轻混匀后室温静置15 min。将混合液加入孔板中然后置于培养箱中培养。转染12 ~ 18 h后,去除含LongTrans和DNA复合物的培养基,替换为0.5 mL完全培养基对细胞进行换液。转染24 h后用50 μg·L-1TNF-α作为激活剂进行刺激,48 h收集细胞进行后续检测。
1.2.5实时荧光定量PCR(Q-PCR) 收集细胞,使用HP Total RNA Kit 提取试剂盒提取细胞总RNA,按照1st-Strand cDNA 逆转录试剂盒进行合成cDNA;采用TB Green®Premix Ex TaqTM和引物进行扩增反应。引物序列为:GAPDH:上游5′-GAACGGGAAGCTCACTGG-3′,下游5′-GCCTGCTTCACCACCTTCT-3′;UCHL1:上游5′-GAAGGCCAATGTCGGGTAGA-3′,下游5′-GCCATGGTTCACCGGAAAAG-3′;USP2a:上游5′-TTCGACTCGTCCATACTCCA-3′,下游5′-TGGCACTCAGTGGGGACT-3′;USP2b:上游5′-GCTGCTCTCCACCTTCGT-3′,下游5′-GACCCTGGGCACTCTTAGAA-3′;OTUB2:上游5′-GCACTCACGAAGTAGAGCCC-3′,下游5′-CTTTGCCCAAAAGGCTGCAC-3′;OTUD4:上游5′-TGCTTTGCGTCTGAAAGGTG-3′,下游5′- TGTCCTACCCATTCCTGTGGA-3′;PSMD14:上游5′-CACAGTCAGGAACAGGTGTCA-3′,下游5′-CAAAGCCAGGGTGACTGTGA-3′。扩增体系为:上下游引物(10 μmol·L-1)各0.2 μL,cDNA 1 μL,TB Green 5 μL,ROX 0.2 μL,RNase Free ddH2O 3.4 μL。反应条件:95 ℃ 10 min,95 ℃ 15 s,55 ℃ 1 min,循环40次。采用2-ΔΔCT法计算目的基因mRNA相对表达量。
1.2.6酶联免疫吸附ELISA分析 收集细胞上清液,检测细胞分泌TNF-α的水平。包被抗体(TNF-α),4 ℃过夜;PBST洗板3次;用5% BSA封闭液37 ℃封闭2 h;加入稀释的样品或标准品,100 μL每孔,4 ℃过夜;PBST洗板3次,每次1 min;每孔加入100 μL稀释后的 Biotin-标记检测抗体,37 ℃ 1 h; PBST 洗涤 3次;每孔加入100 μL 稀释后的 Avidin-HRP,37 ℃ 30 min;PBST 洗涤5次;每次洗涤后静置2 min;每孔加入100 μL底物,置于室温15 min;每孔加入50 μL终止液进行终止;酶标仪检测吸光值,选择450 nm和570 nm 双波长进行检测。
1.2.7双荧光素酶报告基因试剂盒检测 将收集的细胞加入报告基因细胞裂解液进行充分裂解,15 000×g离心5 min,收集细胞上清用于后续测定;设置多功能酶标仪测定时间为10 s,取100 μL萤火虫萤光素酶检测试剂加入测试管底部,然后加入20 μL 待测样品,混匀后放入仪器进行检测。测定完成后,取100 μL海肾萤光素酶检测工作液加入上述测定管中,轻轻混匀后进行检测。
1.2.8Western blot检测 收集细胞,加入适量的RIPA裂解液(含体积分数为1%的蛋白酶抑制剂),置于冰上摇动裂解30 min,4 ℃ 12 000×g离心15 min之后收集细胞总蛋白。用BCA蛋白浓度测定试剂盒进行定量测定。用10%的分离胶和5%的浓缩胶进行SDS-PAGE,电泳结束后将蛋白转移到PVDF膜上,5% BSA在室温对膜进行封闭2 h,加入适当浓度的一抗:UCHL1或GAPDH,4 ℃孵育过夜。孵育结束后,用TBST洗4次,每次10 min,加入HRP标记的相应兔或鼠二抗,室温孵育1 h后,TBST洗4次,每次10 min,加入ECL发光试剂显色,在全自动凝胶成像系统中显影成像。
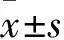
2 结果
2.1 单核细胞驯化对去泛素化酶表达的影响我们对前期研究的coated-IVIG处理单核细胞组(c-IVIG)与对照组(Medium)细胞的RNA-seq测序结果进行分析,显示差异基因在泛素-蛋白酶体途径通路明显富集。对该途径相关基因表达分析得到表达变化较大的几种去泛素化酶(USP2、UCHL1、OTUB2、OTUD4和PSMD14)(Fig1A)。接下来我们提取经过驯化处理的单核细胞RNA,通过Q-PCR对上述基因的表达做了进一步的验证,得到与RNA-seq一致的结果,即经驯化处理的单核细胞,去泛素化酶USP2(USP2b)、UCHL1、OTUB2和OTUD4的表达水平明显升高,差异具有统计学意义(Fig1B)。
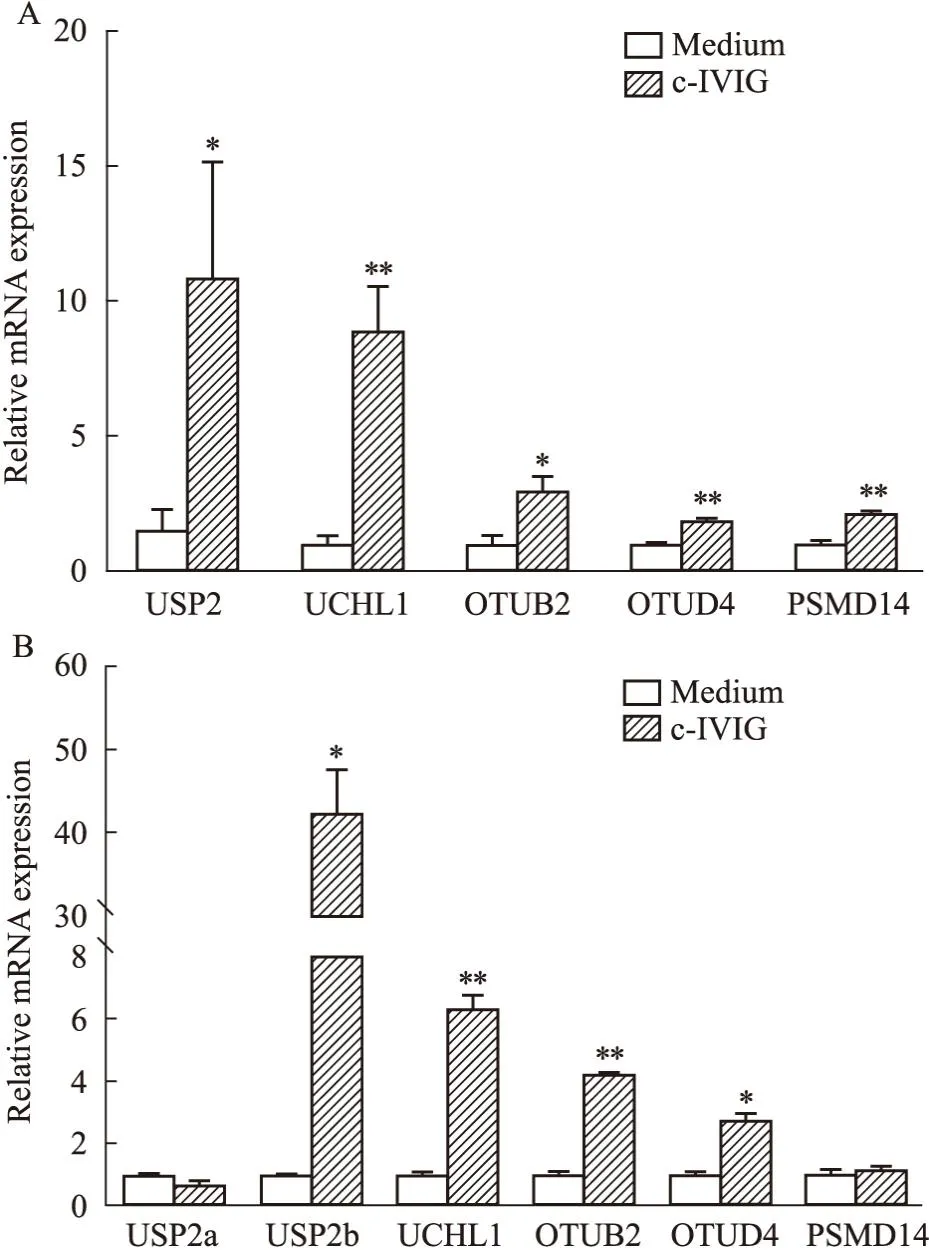
Fig1 c-IVIG enhanced expression of deubiquitinase-related genes in trained monocytes
2.2 去泛素化酶对单核细胞驯化作用的影响在c-IVIG处理阶段或LPS刺激阶段加入不同浓度的去泛素化酶广谱抑制剂PR619处理单核细胞;收集上清检测TNF-α的分泌水平,分析去泛素化酶对单核细胞驯化免疫作用的影响。在c-IVIG处理阶段加入抑制剂的结果显示(Fig2A),TNF-α的分泌水平随抑制剂浓度的增加而明显降低,差异具有统计学意义,且抑制作用呈剂量依赖性。在LPS刺激阶段加入抑制剂的结果显示(Fig2B),TNF-α的分泌水平也明显降低,差异具有统计学意义,但抑制作用并未呈现出剂量依赖性,结果说明,去泛素化酶主要在c-IVIG处理阶段发挥作用。
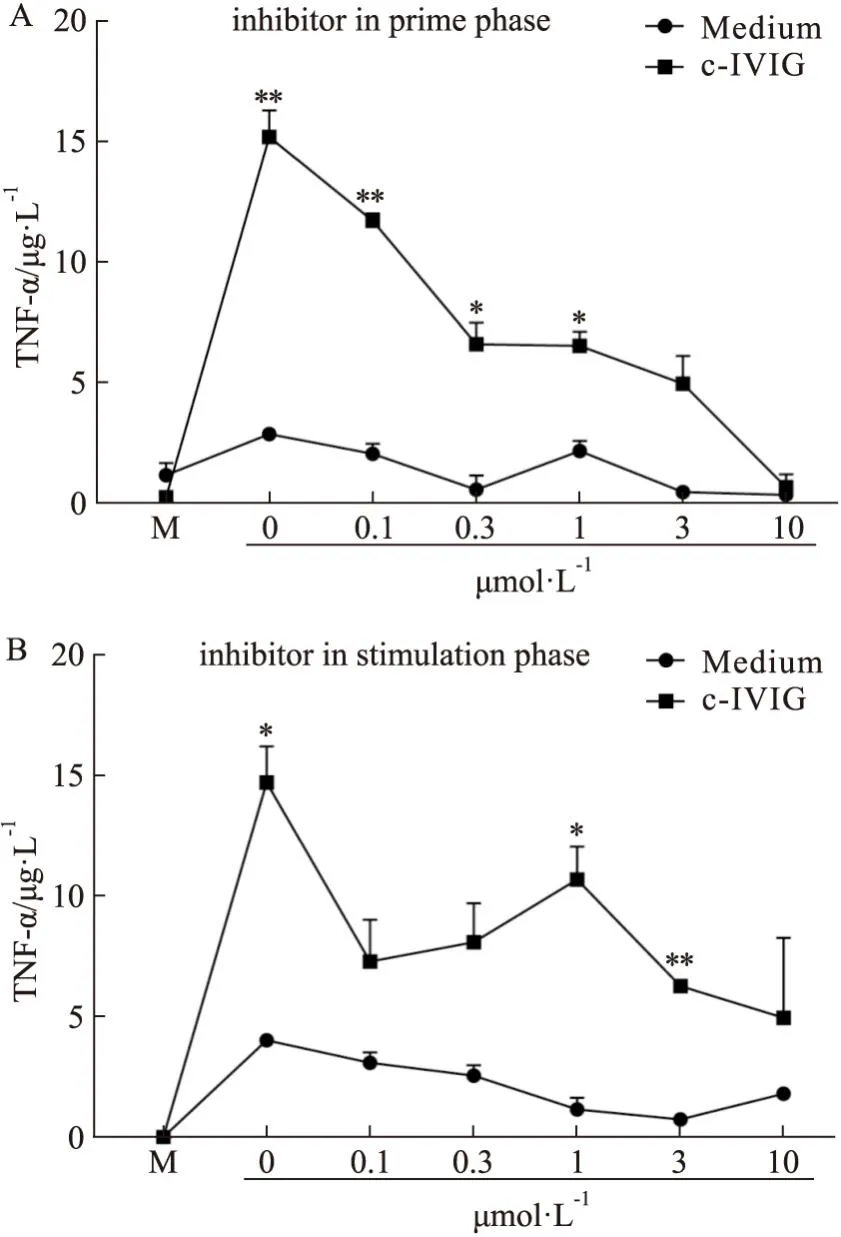
Fig2 Deubiquitinating enzyme inhibitor inhibited trained immunity of monocytes
2.3 去泛素化酶对NF-κB信号通路的影响在经典的NF-κB信号通路中,单核细胞经LPS刺激后产生TNF-α。因此,我们以TNF-α作为激活剂,在293T细胞中过表达结果2.1中几种去泛素化酶,构建了NF-κB信号通路模型。双荧光素酶报告基因检测系统检测NF-κB信号通路的激活情况。结果如Fig3所示,与对照组(Medium)相比,几种去泛素化酶的过表达均可明显激活NF-κB信号通路,差异具有统计学意义,其中UCHL1对NF-κB信号通路的激活效果最为明显。因此,后续我们将围绕UCHL1进行研究。
Fig3 Deubiquitinating enzymes activated NF-κB signaling pathway
2.4 UCHL1的表达对NF-κB信号通路的影响我们在293T细胞中对UCHL1进行干扰和过表达,TNF-α作为激活剂,双荧光素酶报告基因检测系统检测UCHL1的表达对NF-κB信号通路激活的影响。结果显示:干扰UCHL1可明显抑制UCHL1的表达,并且干扰UCHL1的表达可明显降低NF-κB信号通路的激活,差异具有统计学意义(Fig4A、4B);而过表达UCHL1后,NF-κB信号通路的激活明显增强,差异具有统计学意义,且随着UCHL1表达量的增加,对NF-κB信号通路的激活作用也相应增强(Fig4C、4D)。结果表明,UCHL1正向调控NF-κB信号通路的激活。
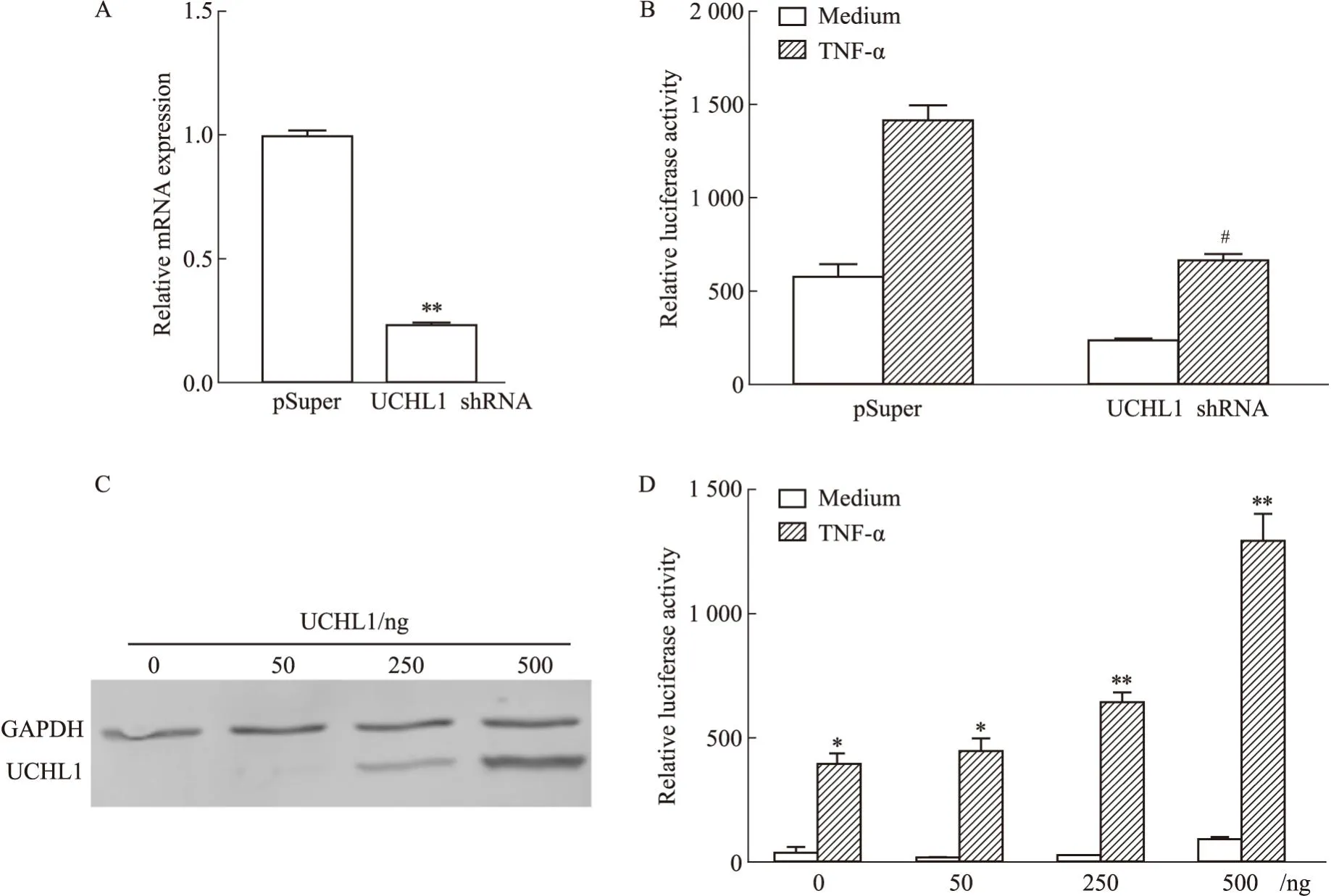
Fig4 UCHL1 enhanced activation of NF-κB signaling
2.5 UCHL1与NF-κB通路中关键信号分子之间的作用我们在过表达或者干扰UCHL1的情况下,同时过表达NF-κB通路中的关键信号分子(IκB-α、IKK-α、IKK-β、IKK-ε、p65),通过双荧光素酶报告基因检测系统测定NF-κB信号通路的激活情况,从而确定UCHL1作用于NF-κB信号通路中的步骤。结果如Fig5A、5B所示,当过表达几种信号分子时,均能激活NF-κB信号通路;但在过表达p65或IKK-ε的情况下,过表达或干扰UCHL1对NF-κB信号通路的激活无明显影响;而在过表达IκB-α、IKK-α、IKK-β的情况下,过表达UCHL1可明显激活NF-κB信号通路,干扰UCHL1则可明显抑制NF-κB信号通路的激活,差异具有统计学意义。表明UCHL1的表达可明显促进由IκB-α、IKK-α或IKK-β介导的NF-κB的活化,但不影响p65或IKK-ε诱导的NF-κB激活。

Fig5 UCHL1 expression promoted activation of NF-κB induced by IKK-α, IKK-β or
2.6 UCHL1酶活性对NF-KB信号通路的影响UCHL1同时具有泛素水解酶和泛素连接酶活性,我们将其连接酶位点(S18Y)或水解酶位点(H161Q)进行突变,双荧光素酶报告基因检测分析UCHL1表达对NF-κB信号通路的激活是否依赖于其酶活性。结果如Fig6A所示,与对照组相比,突变体UCHL1-S18Y及UCHL1-H161Q对NF-κB信号通路的激活效果与UCHL1相一致,且上调作用更为明显;但突变体UCHL1-S18Y及UCHL1-H161Q在未经TNF-α刺激的情况下,本底也明显升高,差异具有统计学意义,因此我们将各组TNF-α激活后的荧光素酶活性与本底做比进行分析,结果如Fig6B,显示UCHL1-H161Q突变体的相对荧光素酶活性值明显低于UCHL1,即UCHL1水解酶活性受到抑制的情况下,UCHL1对NF-κB信号通路的调控水平会也受到明显抑制。因此,我们认为,UCHL1的泛素水解酶活性在调节NF-κB信号通路中起重要作用。
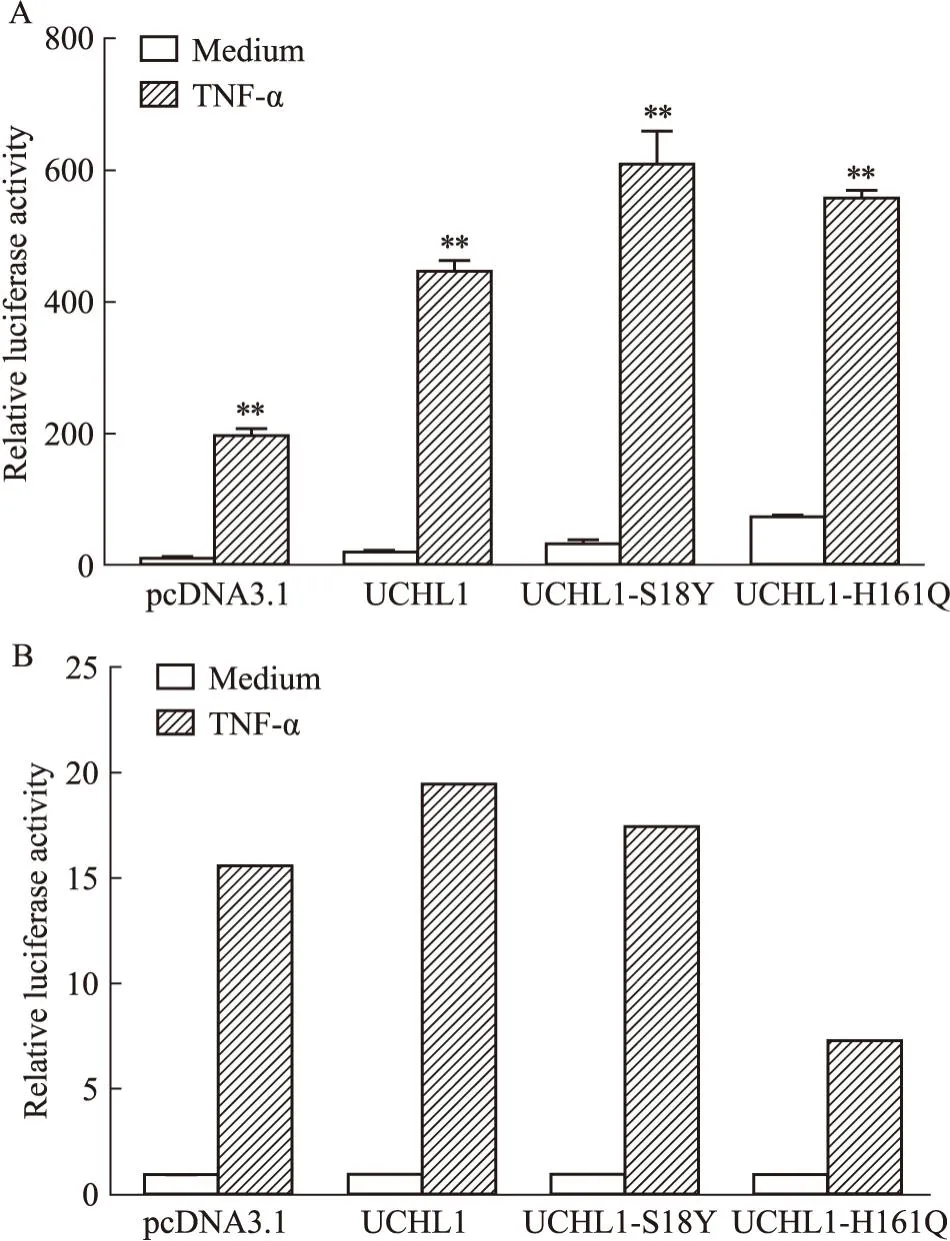
Fig6 Regulation of NF-κB signaling pathway by UCHL1 depended mainly on activity of ubiquitin hydrolase (H161Q site)
2.7 UCHL1对单核细胞驯化免疫的影响基于上述UCHL1对NF-κB通路的明显激活作用,我们推测UCHL1可能是单核细胞驯化免疫调控的关键分子。通过在c-IVIG处理阶段或LPS刺激阶段加入不同浓度的UCHL1特异性抑制剂LDN-57444对单核细胞进行处理,收集细胞上清,ELISA检测TNF-α的分泌水平,分析驯化作用受UCHL1的影响。Fig7A结果显示,在c-IVIG处理阶段加入UCHL1抑制剂,TNF-α的分泌水平随抑制剂浓度的增加而明显降低,差异具有统计学意义,但是抑制效果并未呈现出剂量依赖性;在LPS刺激阶段加入UCHL1抑制剂的结果显示(Fig7B),TNF-α的分泌水平也明显降低,差异具有统计学意义,且抑制效果呈现出剂量依赖性,表明在LPS刺激阶段加入UCHL1抑制剂比在c-IVIG处理阶段加入的抑制作用更有效。

Fig7 UCHL1 inhibitor inhibited trained
3 讨论
驯化免疫可发生于多种固有免疫细胞中,在接种过卡介苗的健康志愿者外周鉴定出具有驯化免疫特征的单核细胞,当这群细胞再次受到刺激时,可以增强其炎性细胞因子的分泌能力,发挥对机体的保护作用;在暴露过低毒力白色念珠菌的小鼠巨噬细胞上,再次接受病原体感染时其固有免疫反应性增强,可以发挥免疫保护作用;病毒感染诱导的自然杀伤细胞的训练免疫也显示出类似于T细胞记忆反应的受体依赖性病原体特异性记忆效应;注射白色念珠菌的小鼠显示出与退行性疾病恶化相关中性粒细胞胞外诱捕网的增加,这种记忆反应可能归因于训练的中性粒细胞[13]。驯化免疫进化为提供抗感染的保护,但过度激活的驯化免疫可诱导有害炎症并促进炎症性疾病的发展。
目前,已经在多种疾病中发现了驯化免疫的参与:在慢性炎症性心脏代谢疾病如动脉粥样硬化中,训练有素的免疫可能起到有害作用;在炎症性肠病中,先天免疫记忆兼具有益或有害的双重作用;在神经退行性疾病如阿尔茨海默病中,小胶质细胞的免疫记忆被认为是神经炎症的潜在原因;癌症和某些感染也是由驯化免疫缺陷引起的疾病[2]。除上述疾病外,自身炎症性疾病或过敏的患者在驯化免疫的情况下也会遭受过度炎症的有害影响,以类风湿关节炎(rheumatoid arthritis, RA)为例:RA 患者中分离的单核细胞表现为驯化免疫表型,这些高度敏感的单核细胞可以在受到刺激时产生TNF-α,IL-6和IL-1β等大量炎性细胞因子;驯化免疫相关的通路,如PI3K-mTOR和MAPK通路都被激活[14];这种细胞高反应性可以导致机体长期处于慢性炎症状态下,产生慢性病发作,且有证据表明,RA患者外周单核细胞具有较正常人群更高的反应性。巨噬细胞作为先天免疫的重要组成部分在炎症和宿主防御中亦发挥重要作用,其主要来源于单核细胞。研究表明,巨噬细胞同样可以被训练并持久发挥作用:经过训练的巨噬细胞在对抗原暴露的反应中也可获得记忆样的特性,进而靶向自身免疫性风湿病如系统性硬化病的治疗;训练的巨噬细胞也可促进炎症性动脉粥样硬化病变的发展等;RA患者滑膜中的巨噬细胞在炎症时同样会分泌大量TNF-α和IL-6等炎性细胞因子,其反应性也呈现出较高的敏感态[15]。在RA和SLE等自身免疫性疾病患者体内存在大量自身抗体,可以在局部病灶(如骨关节处)发生沉积,导致局部微环境改变。结合免疫复合物及自身抗体多参与自身免疫病的事实,进一步研究免疫复合物诱导的单核细胞驯化作用机制可为解释相关疾病的发病机制提供新的依据。
在本实验室的前期研究中,我们采用固相化-IgG(c-IVIG)模拟自身免疫病中自身抗体的堆积效应诱导单核细胞发生驯化免疫。通过差异基因富集及蛋白互作网络对coated-IVIG处理的单核细胞组及对照组的转录组测序(RNA-seq)结果进行分析发现,驯化免疫的差异基因主要富集在泛素-蛋白酶体系统途径通路;蛋白网络互作分析结果也提示,泛素化是USP2、OTUB2、UCHL1等多种去泛素化酶差异基因的关键调控节点。以上结果提示我们泛素化在参与调控驯化免疫中发挥重要作用。通过在RNA-seq结果中筛选出表达量变化较大的几种DUBs(USP2、OTUB2、OTUD4、PSMD14、UCHL1)并在单核细胞上进行了验证。通过在单核细胞驯化过程中加入UDBs的广谱抑制剂,发现驯化作用受到明显抑制,说明DUBs在单核细胞驯化免疫中发挥着重要的作用。研究表明,单核细胞驯化处理后其炎性因子的释放显著增加为NF-κB通路介导,而NF-κB信号通路的作用主要通过影响其上游因子的泛素化过程来实现[16-17]。因此,我们推测 NF-κB 信号通路的UPS在c-IVIG 的驯化作用中可能发挥重要作用,并且我们的实验结果也验证了这一假设,即在NF-κB信号通路体系中,以TNF-α为NF-κB信号通路激活剂,DUBs(USP2、OTUB2、UCHL1、PSMD14)对NF-κB信号通路的激活均有明显促进效果,其中UCHL1的影响效果最为突出。
接下来我们通过对UCHL1进行干扰或者过表达,发现干扰或过表达UCHL1可抑制或促进NF-κB信号通路的激活,表明UCHL1正向调控NF-κB信号通路。通过对NF-κB信号通路中与泛素化相关的分子(IκB-α、IKK-α、IKK-β、IKK-ε、p65等)进行分析,发现UCHL1的表达对由IKK-α、IKK-β或IκB-α介导的NF-κB的活化具有明显促进作用,而对p65及IKK-ε介导的NF-κB激活却没有影响。因此,我们认为UCHL1 对NF-κB信号通路的调控作用可能通过p65 NF-κB因子上游和NEMO/IKK复合体下游相关信号分子的泛素化而影响NF-κB信号通路的激活。研究表明[18]UCHL1同时具有泛素水解酶和泛素连接酶活性,其H161催化位点发挥水解酶作用,18号位点发挥连接酶作用,将H161位点突变(H161Q)或18号位点突变(S18Y)后其水解酶活性或连接酶活性受到抑制。因此,我们还探究了UCHL1的酶活性对NF-κB信号通路的调控影响。通过对结果的分析发现,在H161Q位点突变的情况下,UCHL1对NF-κB信号通路的调控受到明显抑制。因此,我们认为UCHL1的泛素水解酶活性在调节NF-κB信号通路中起重要作用。此外,我们还用UCHL1的特异性抑制剂LDN-57444抑制c-IVIG模拟的自身抗体效应诱导的单核细胞驯化免疫,结果显示抑制UCHL1可明显减弱单核细胞的驯化作用。
综上,我们认为自身免疫性疾病患者体内的免疫复合物可以通过去泛素化酶UCHL1调节NF-κB信号通路的激活从而驯化单核细胞,增强其敏感性,进而导致疾病的发生与进展。通过抑制UCHL1可降低单核细胞的驯化免疫,以此来减少自身免疫相关炎症性疾病的发生。此研究可为自身免疫病的预防和治疗提供一定的理论依据和新靶点。

