顺-3-己烯醇乙酸酯对大蜡螟的驱避作用
连雅琴 付童 李一然 刘巧 周令霞 门丽娜 张志伟


摘要:利用植物挥发物监测和调控害虫行为已逐渐成为害虫绿色防控的重要途径。顺-3-己烯醇乙酸酯广泛存在于瓜果及绿色植物的叶片中,具有环境友好、无残留的优点。大蜡螟是养蜂产业中常见的害虫,严重影响蜂产业和蜜蜂资源保护。为生产中应用顺-3-己烯醇乙酸酯调控大蜡螟的行为控制其对蜂群的危害提供依据,为开发新型昆虫行为调控剂以及大蜡螟的绿色防控提供支持,利用Y-型嗅觉仪研究大蜡螟不同虫态的个体对不同浓度、同一浓度不同剂量顺-3-己烯醇乙酸酯的行为趋性。结果表明,大蜡螟幼虫对顺-3-己烯醇乙酸酯表现出显著的负趋性,浓度为0.5 mol/L 时,大蜡螟幼虫总选择率为79.33%,并表现为极显著的负趋性;雄成虫对顺-3-己烯醇乙酸酯的选择率为8.33%,具有显著的负趋性;不同剂量的顺-3-己烯醇乙酸酯对大蜡螟成虫的选择行为影响不显著,但对幼虫均具有明显的驱避效果。
关键词:顺-3-己烯醇乙酸酯;行为趋性;Y-型嗅觉仪;大蜡螟;驱避
中图分类号:S895.9文献标识码:A文章编号:1002?2481(2024)01?0131?06
我国是蜂产业大国,蜂群的稳定和巢脾的完整对提高蜂产品产量、促进产业收入和维护生态平衡具有十分重要的意义。大蜡螟(Galleria mellonellaL.)属鳞翅目(Lepidoptera)螟蛾科(Pyralidae)蜡螟亚科(Galleriidae)的昆虫[1],是严重影响养蜂产业发展的重要害虫。大蜡螟产卵量大[2]、幼虫蛀食毁坏巢脾,常造成中华蜜蜂群势减弱、群蜂飞逃,造成严重的经济损失[3-4]。生产上常使用化学杀虫剂防治它[5],用药不当不仅会导致蜂产品受到污染[5],还会影响重要传粉昆虫蜜蜂资源的保護。
通过调节植物挥发物来控制害虫种群可以减少化学农药的使用,对“3R”问题的减少具有重要意义[6-7]。大部分植物挥发物沸点高,不溶于水但可溶于乙醇[8],可降解[9]。因合成成本较低,便于量产[10],已广泛应用于日化和食品中,在害虫的防治中常与性信息素结合使用[11-12]。通过使用无残留的挥发性化合物使害虫产生趋近(拉)[5] 或趋避(推)[13]的行为使其远离寄主,能有效的对害虫进行绿色防治[14],减少经济损失,在生产上具有重要的实践意义。研究发现,顺-3-己烯醇乙酸酯是通过一系列酶促反应产生的具有挥发性的植物次生代谢物[15-16],在遭受机械损伤、病虫害过程中产生的一种具有防御作用的化合物[17],天然存在于苹果、桃子等瓜果以及绿色植物的叶片中[7],干旱、高温等非生物胁迫也会促进植物挥发物的释放[18],对植物害虫具有引诱或驱避效果[19-21]。更重要的是,顺-3-己烯醇乙酸酯对蜜蜂不存在引诱或驱避的作用[22]。
本研究利用Y-型嗅觉仪研究不同虫态大蜡螟对不同浓度、不同剂量顺-3-己烯醇乙酸酯的行为趋性,探讨顺-3-己烯醇乙酸酯对于调控大蜡螟行为的有效性和可用性,旨在为大蜡螟的绿色防控提供依据,同时为“推—拉”策略的发展和完善提供科学参考。
1材料和方法
1.1 试验材料
供试大蜡螟种群由山西农业大学林学院森林保护实验室提供,该种群建立于2017 年,已连续饲养30 代以上,饲养种群未出现退化现象[23]。大蜡螟成虫交尾产卵后,将卵放置在方形塑料盒中(13.5 cm×13.5 cm×6.5 cm),在培养箱(GXZ-3000,宁波乐电)中全暗饲养,温度(30±1)℃、相对湿度设置60%~70%,幼虫进行人工饲料[24]饲喂,每日19:00 观察虫体生长状态,及时添加饲料,直至大蜡螟化蛹、羽化。由于成虫虹吸式口器退化,不饲喂。
大蜡螟的趋性行为应用传统组装型Y-型嗅觉仪来测定。Y-型嗅觉仪材质为无色透明玻璃管,内径3.0 cm,适应臂长6 cm,两选择臂长16.5 cm,选择臂夹角75°。以大气采样器(QC-1B,北京市劳动保护科学研究所)作为供气驱动装置,空气依次经蒸馏水、活性炭过滤后,经玻璃转子气体流量计(LZB-3WB,余姚市振兴流量仪表厂)通过味源瓶进入Y-型嗅觉仪的2 个选择臂。Y-型嗅觉仪连接顺序如图1 所示。
1.2 研究方法
分别设置不同浓度(0.5、1.0、5.0 mol/L)顺-3-己烯醇乙酸酯对大蜡螟的行为趋性进行探究,以选取最佳的试验浓度,在最佳浓度基础上,分别设置不同剂量(0.005、0.010、0.015 mmol)顺-3-己烯醇乙酸酯对大蜡螟的趋性行为进行探究。按照图1所示连接试验装置,大气采样器作为气流动力系统,流量计流速设定为500 mL/min[24],经过蒸馏水、活性炭将过滤的空气通向味源瓶,把携带味源的气体吹向Y-型嗅觉仪。2 个选择臂分别连接液体石蜡(Control)和顺-3- 己烯醇乙酸酯的味源瓶(Treatment),经预试验,确定以虫体越过选择臂靠近适应臂方向的5.5 cm 处作为大蜡螟行为选择的判定点(图1)。从大蜡螟进入适应臂开始计时,观察其行为反应,若大蜡螟虫体超过3 min 仍无明显趋性行为,则记为无反应;根据幼虫和成虫行为差异,幼虫以越过选择臂5.5 cm 并持续2 min,记为做出选择反应;成虫以越过选择臂5.5 cm 并持续1 min,记为做出选择反应。
将含有液体石蜡的滤纸片(2 cm×1 cm)放入其中一个味源瓶作为对照,另一味源瓶放入含有与液体石蜡等体积的顺-3-己烯醇乙酸酯滤纸片作为处理,空吹3 min 以上,待装置内气体达稳定状态后进行试验[25],随机取10 只大蜡螟雄成虫、雌成虫或七龄幼虫分别试验,每个处理重复5 组,测定行为并收集数据。为避免采光不均等的干扰,每组试验后调换Y 管2 个选择臂方向,再次分别进行试验;每组试验后用蒸馏水和95% 乙醇清洗嗅觉仪并将其放入干燥箱中烘干备用,以避免大蜡螟幼虫吐丝行为及成虫翅面上鳞片残留或虫体挥发物等对后续研究产生干扰。
1.3 数据分析
使用Microsoft Excel 2016 对原始数据进行统计整理;采用SPSS 13.0 进行t 检验,综合分析大蜡螟对不同浓度、不同剂量顺-3-己烯醇乙酸酯的行为趋性。
正趋率= 选择顺-3-己烯醇乙酸酯的总虫体数/试验虫体总数×100% (1)
负趋率=选择液体石蜡的总虫体数/试验虫体总数×100% (2)
未选择率= 未选择的总虫体数/试验虫体总数×100% (3)
2结果与分析
2.1 不同浓度顺-3-己烯醇乙酸酯对大蜡螟幼虫、雌雄成虫的驱避作用
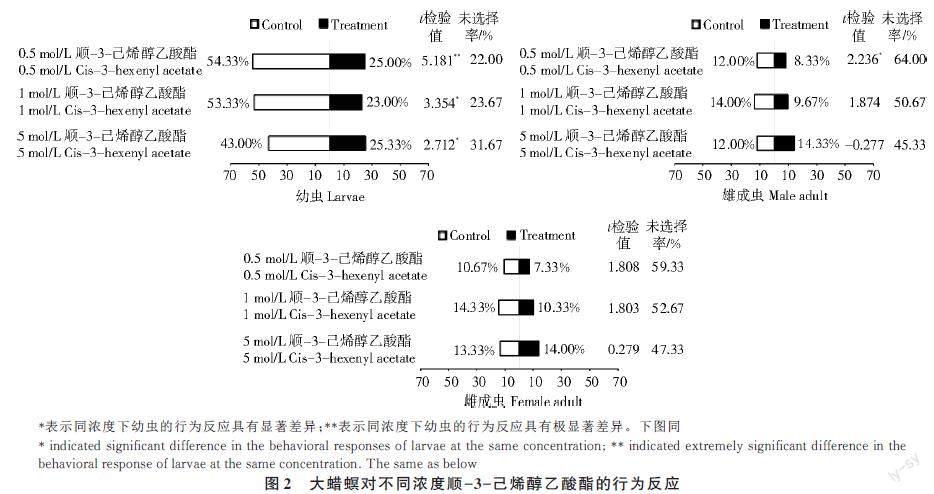
从图2 可以看出,不同浓度顺-3-己烯醇乙酸酯对大蜡螟幼虫的驱避率> 引诱率,幼虫产生正趋、负趋、未选择行为的比例约为1∶2∶1。在顺-3-己烯醇乙酸酯浓度为0.5 mol/L 时,具有选择反应的幼虫数量占试验幼虫个体数的79.33%,该浓度顺-3-己烯醇乙酸酯极显著地驱避了大蜡螟幼虫(P<0.01),当顺-3-己烯醇乙酸酯浓度增加到1、5mol/L 时,顺-3-己烯醇乙酸酯也会显著驱避大蜡螟幼虫(P<0.05),但随着顺-3-己烯醇乙酸酯的浓度增加,顺-3-己烯醇乙酸酯对大蜡螟幼虫的驱避作用逐渐减弱。
由图2 可知,产生选择行为的大蜡螟雄成虫的个体数约占试验个体总数的50%。在0.5 mol/L 和1.0 mol/L 浓度的顺-3-己烯醇乙酸酯处理中,顺-3-己烯醇乙酸酯对具有选择行为的大蜡螟雄成虫的驱避率> 引诱率。当顺-3-己烯醇乙酸酯浓度为0.5 mol/L,顺-3- 己烯醇乙酸酯显著驱避大蜡螟雄成虫(P<0.05),但顺-3-己烯醇乙酸酯浓度为1 mol/L 和5 mol/L 时对大蜡螟的引诱或驱避作用差异不显著(P>0.05)。5 mol/L 浓度下大蜡螟雄成虫对顺-3-己烯醇乙酸酯的正趋性>负趋性,但差异不显著(P>0.05);随着浓度的增加,顺-3-己烯醇乙酸酯对大蜡螟雄成虫的驱避作用逐渐减弱。
在0.5 mol/L 和1 mol/L 顺-3-己烯醇乙酸酯的处理下,顺-3-己烯醇乙酸酯对大蜡螟雌成虫驱避率>引诱率,随着顺-3-己烯醇乙酸酯浓度的增加,顺-3-己烯醇乙酸酯对大蜡螟雌成虫的驱避作用逐渐减弱。在顺-3-己烯醇乙酸酯浓度为0.5 mol/L和1 mol/L 处理下,雌性大蜡螟对顺-3-己烯醇乙酸酯的选择率低于对照组,在浓度为5 mol/L 时,雌性大蜡螟对顺-3-己烯醇乙酸酯的趋性略高于对照组,3 种浓度下顺-3-己烯醇乙酸酯对大蜡螟的行为影响均不显著(P>0.05)。
综上可见,0.5 mol/L 的顺-3-己烯醇乙酸酯对大蜡螟的驱避作用最强,因此,以该浓度再设置不同的劑量处理进一步研究大蜡螟对不同剂量顺-3-己烯醇乙酸酯的行为趋性。
2.2 不同剂量顺-3-己烯醇乙酸酯对大蜡螟幼虫、雌雄成虫的驱避作用
大蜡螟幼虫对不同剂量的顺-3-己烯醇乙酸酯趋性行为试验中,超过63% 的大蜡螟幼虫具有选择行为,至少逾44% 的幼虫对顺-3-己烯醇乙酸酯表现出负趋行为,可见顺-3-己烯醇乙酸酯对大蜡螟幼虫均产生较强的驱避作用。由图3 可知,随着顺-3-己烯醇乙酸酯剂量的增加,对大蜡螟幼虫的驱避作用逐渐减弱,最高驱避率为66%,但各处理间差异不显著(P>0.05)。
在不同剂量的顺-3-己烯醇乙酸酯对大蜡螟成虫趋性行为的试验中,有近1/2 的大蜡螟成虫产生选择行为。当0.5 mol/L 顺-3-己烯醇乙酸酯剂量为0.005 mmol 时,对成虫的趋性行为影响具有显著差异(P<0.05),其中对雄性成虫驱避率为22.00%,对雌性成虫驱避率为24%;但0.010、0.015 mmol 剂量的顺-3-己烯醇乙酸酯对成虫的趋性行为影响均无显著差异(P>0.05)。与幼虫表现不同的是,随着顺-3-己烯醇乙酸酯剂量的增加,顺-3-己烯醇乙酸酯对大蜡螟雄成虫的驱避作用呈现先降低后增强的趋势。
3结论与讨论
挥发物是昆虫接收和识别环境及寄主植物的重要媒介,部分植物在遭受昆虫危害时会迅速释放特定挥发物影响昆虫的取食、产卵、交配等行为[15];其类型和浓度对昆虫的寄主定向、选择的过程起到至关重要的作用[26]。顺-3-己烯醇乙酸酯存在于桃、棉花、玉米等多种植物的挥发物中,会使部分鳞翅目昆虫产生一定的趋性行为[26-27],使用其对大蜡螟行为进行调控,由于无毒害、合成原料易得等特点,可以避免驱避剂的使用对蜂产品以及环境造成污染,达到绿色防控的效果。
吴健等[28]研究表明,应用0.13 mol/L 顺-3-己烯醇乙酸酯对橘小实蝇成虫(瓜果类害虫)具有显著的引诱效果。对小菜蛾来说,顺-3-己烯醇乙酸酯与性信息素等混合物可增加其田间的诱捕量[29]。N?LIA 等[30]研究发现,顺-3-己烯醇乙酸酯等5 种挥发性混合物对梨小食心虫雄虫对性信息素的反应有协同作用,因此,挥发物对昆虫生命活动的作用会影响昆虫的觅食、交配、产卵、传粉等行为。本研究发现,0.5 mol/L 顺-3-己烯醇乙酸酯驱避大蜡螟不同虫态的个体,在研究浓度区间内,顺-3-己烯醇乙酸酯浓度越低驱避效果越强,可能与不同浓度顺-3-己烯醇乙酸酯在大气中的挥发和与OH 自由基、NO3 自由基和O3 的反应降解速率有关[9],也可能与大蜡螟对顺-3-己烯醇乙酸酯的嗅觉识别阈值有关,当水分的含量低于15.57% 时,其引诱的效果会大幅度降低[31];大蜡螟成虫对顺-3-己烯醇乙酸酯整体表现出趋避行为,与顺-3-己烯醇乙酸酯对性成熟桔小食蝇成虫的引诱作用不同[28],可能是由于同一种植物挥发物对不同昆虫的作用机理不完全相同;不同浓度的顺-3-己烯醇乙酸酯对大蜡螟雌成虫的行为趋性差异不显著,可能原因是雌成虫对顺-3-己烯醇乙酸酯的嗅觉感知不敏感,如果在生产上应用则需要与其他类型化合物混合使用,以达到良好的防治效果[11]。综上可见,不同剂量的植物挥发物对大蜡螟雌成虫的驱避具有一定的效果,但对大蜡螟幼虫和雌成虫的驱避效果更为显著,可能与产卵的场所选择有关。
本研究采用植物挥发物顺-3-己烯醇乙酸酯对大蜡螟(蜜蜂害虫)的行为反应统计,发现顺-3-己烯醇乙酸酯对其幼虫的行为影响差异显著,对成虫的影响差异不显著,其中,0.5 mol/L 顺-3-己烯醇乙酸酯对幼虫驱避率最高,为54.33%;进一步对该浓度下不同剂量进行探究,发现随剂量的增加,对幼虫的驱避率逐渐降低,但各处理间差异不显著;对成虫的驱避率则表现为先降低后增加的趋势,且在低剂量0.005 mmol 时对大蜡螟成虫的驱避效果更显著。说明顺-3-己烯醇乙酸酯在大蜡螟的绿色防治中具有参考价值和实践意义。
参考文献:
[1] 刘奇志,田里,蒲恒浒. 大蜡螟作为试验昆虫资源的利用现状[J]. 昆虫知识,2009,46(3):485-489.
LIU Q Z,TIAN L,PU H H. Utilization status of the greaterwax moth,Galleria mellonella,as an experimental insect[J].Chinese Bulletin of Entomology,2009,46(3):485-489.
[2] 张俊俊,王桂珍,尹志龙,等. 大蜡螟卵粒快速计数法[J]. 中国蜂业,2020,71(7):24-26.
ZHANG J J,WANG G Z,YIN Z L,et al. High-efficiency count?ing method for greater wax moth eggs[J]. Apiculture of China,2020,71(7):24-26.
[3] KWADHA C A,ONGAMO G O,NDEGWA P N,et al. Thebiology and control of the greater wax moth,Galleria mellonella[J]. Insects,2017,8(2):61.
[4] 韩博,张丽,代平礼. 大蜡螟及苏云金芽孢杆菌防治研究概述[J]. 中国蜂业,2022,73(8):51-55.
HAN B,ZHANG L,DAI P L. Bacillus thuringiensis againstGalleria mellonella[J]. Apiculture of China,2022,73(8):51-55.
[5] 苏晓玲,陈道印,赵东绪,等. 大蜡螟防控技术研究进展[J]. 环境昆虫学报,2021,43(3):651-659.
SU X L,CHEN D Y,ZHAO D X,et al. Progress on preventionand control technology of greater wax moth(Galleria mellonellaL.)[J]. Journal of Environmental Entomology,2021,43(3):651-659.
[6] TURLINGS T C,TON J. Exploiting scents of distress:theprospect of manipulating herbivore-induced plant odours to en?hance the control of agricultural pests[J]. Current Opinion inPlant Biology,2006,9(4):421-427.
[7] 相会明,李先伟,曹敏,等. 寄主植物挥发物对梨小食心虫产卵选择的影响[J]. 山西农业科学,2020,48(8):1301-1304.
XIANG H M,LI X W,CAO M,et al. Effect of host plant vola?tiles on oviposition selection of oriental fruit moth[J]. Journal ofShanxi Agricultural Sciences,2020,48(8):1301-1304.
[8] SELL,CHARLES S. The chemistry of fragrances[M]. Springer:Springer Verlag,2006.
[9] 张启磊. 叶醇酯类挥发性有机物的大气氧化反应动力学和机理研究[D]. 合肥:中国科学技术大学,2018.
ZHANG Q L. Study on kinetics and mechanism of atmosphericoxidation of volatile organic compounds of leaf alcohol esters[D].Hefei:University of Science and Technology of China,2018.
[10] 张卫卫. 乙酸叶醇酯生产工艺研究及中试设计[D]. 河北:燕山大学,2014.
ZHANG W W. Leaf acetate production echnology researchand pilot test design[D]. Hebei:Yanshan University,2014.
[11] 于海利,张青文,徐环李. 乙酸叶醇酯对梨小食心虫性信息素的增效作用[J]. 果树学报,2015,32(3):469-473.
YU H L,ZHANG Q W,XU H L. (Z)- 3- Hexenyl acetatesynergizes the response of oriental fruit moth,Grapholita mo?lesta(Busck)(Lepidoptera:Tortricidae) to female sex phero?mone[J]. Journal of Fruit Science,2015,32(3):469-473.
[12] LIGHT D M,FLATH R A,BUTTERY R G,et al. Hostplantgreen-leaf volatiles synergize the synthetic sex phero?mones of the corn earworm and codling moth(Lepidoptera)[J].Chemoecology,1993,4(3):145-152.
[13] 罗丽林,黄振兴,杨广明,等. 30 种非寄主植物对黑腹果蝇的趋避效果研究[J]. 中國南方果树,2022,51(4):171-176.
LUO L L,HUANG Z X,YANG G M,et al. Study on the re?pellent effect of 30 non-host plants on Drosophila melanogaster[J]. South China Fruits,2022,51(4):171-176.
[14] 吕蔷. 推拉策略对昆虫的调控作用研究进展[J]. 现代农业科技,2008(11):177-179.
L? Q. Research progress on the regulatory effect of push-pullstrategy on insects[J]. Modern Agricultural Sciences and Tech?nology,2008(11):177-179.
[15] 贾志飞,仇延鑫,赵永超,等. 植物挥发物对昆虫的驱避和引诱作用研究进展[J]. 山东农业科学,2022,54(7):164-172.
JIA Z F,QIU Y X,ZHAO Y C,et al. Advances of research onrepellency and attraction of plant volatiles to insects[J]. Shan?dong Agricultural Sciences,2022,54(7):164-172.
[16] 张杰,张艳,刘伟,等. 橘小实蝇化学通讯机制与引诱剂开发策略[J]. 昆虫学报,2023,66(1):108-120.
ZHANG J,ZHANG Y,LIU W,et al. Chemical communica?tion mechanism and strategy for attractant development in Bac?trocera dorsalis(Diptera:Tetriphitidae)[J]. Acta EntomologicaSinica,2023,66(1):108-120.
[17] 陈书霞,陈巧,王聪颖,等. 绿叶挥发物代谢调控及分子机理研究进展[J]. 中国农业科学,2012,45(8):1545-1557.
CHEN S X,CHEN Q,WANG C Y,et al. Progress in re?search on the metabolic regulation and molecular mechanism ofgreen leave volatiles(GLVs)[J]. Scientia Agricultura Sinica,2012,45(8):1545-1557.
[18] 孙海峰,李震宇,武滨,等. 绿叶挥发物产生特征及其生态生理作用研究进展[J]. 植物生态学报,2013,37(3):268-275.
SUN H F,LI Z Y,WU B,et al. Review of recent advances onthe production and eco-physiological roles of green leaf volatiles[J]. Chinese Journal of Plant Ecology,2013,37(3):268-275.
[19] NIU Y Q,HAN S J,WU Z H,et al. A push-pull strategy forcontrolling the tea green leafhopper(Empoasca flavescens F.)using semiochemicals from Tagetes erecta and Flemingia mac?rophylla[J]. Pest Management Science,2022,78(6):2161-2172.
[20] 胡双玲. 绿叶挥发物和组蛋白H3K4 甲基化在茶树干旱胁迫响应中的功能研究[D]. 武汉:华中农业大学,2019.
HU S L. Function of green leaf volatiles and histone H3K4methylation in response to drought stress in tea plants[D]. Wu?han:Huazhong Agricultural University,2019.
[21] 张续周,李金秋,陈雪津,等. 低温胁迫下乙酸叶醇酯对茶树耐寒性生理生化的影响[J]. 江苏农业科学,2021,49(24):127-132.
ZHANG X Z,LI J Q,CHEN X J,et al. Influences of Z-3-hex?enyl acetate on cold resistance and physiological and biochemi?cal parameters of tea plant under low temperature stress[J]. Ji?angsu Agricultural Sciences,2021,49(24):127-132.
[22] HENNING J A,PENG Y S,MONTAGUE M A,et al.Honey bee(Hymenoptera:Apidae)behavioral response to pri?mary alfalfa(Rosales:Fabaceae) floral volatiles[J]. Journal ofEconomic Entomology,1992,85(1):233-239.
[23] 张刚应,杨怀文. 大蜡螟室内饲养技术[J]. 贵州农学院学报,1996(1):46-49.
ZHANG G Y,YANG H W. A study on the mass rcaring ofgreater wax moth,Galleria mellonella(Lepidoptera: Galer?hade)[J]. Journal of Guizhou Agriculture,1996(1):46-49.
[24] 吴艳艳,周婷,王强,等. 大蜡螟饲料配方的优化[J]. 昆虫知识,2010,47(2):409-413.
WU Y Y,ZHOU T,WANG Q,et al. Optimization of artificialdiets for Galleria mellonella[J]. Chinese Bulletin of Entomol?ogy,2010,47(2):409-413.
[25] 李婷,王成盼,蒋娜娜,等. 水稻挥发物对稻虱缨小蜂的引诱效果研究[J]. 应用昆虫学报,2018,55(3):360-367.
LI T,WANG C P,JIANG N N,et al. Attractiveness of riceplant volatiles to Anagrus nilaparvatae Pang et Wang[J]. Chi?nese Journal of Applied Entomology,2018,55(3):360-367.
[26] 钦俊德. 昆虫与植物关系的研究进展和前景[J]. 动物学报,1995,41(1):12-20.
QIN J D. Studies on insect-plant relationships:recent trendsand prospect[J]. Acta Zoologica Sinica,1995,41(1):12-20.
[27] 杜袁文,陈功. 蚜虫寄主识别与搜索的研究进展[J]. 华中昆虫研究,2019(15):133-138.
DU Y W,CHEN G. Advances in host identification and searchof aphids[J]. Insect Research of Central China,2019(15):133-138.
[28] 吴健,宋学森,胡碗晴,等. 8 种寄主植物挥发物对橘小实蝇的引诱作用[J]. 福建农林大学学报(自然科学版),2018,47(6):655-660.
WU J,SONG X S,HU W Q,et al. The attractiveness of eighthost volatile compounds to Bactrocera dorsalis Hendel[J]. Jour?nal of Fujian Agriculture and Forestry University(Natural Sci?ence Edition),2018,47(6):655-660.
[29] DAI J Q,DENG J Y,DU J W. Development of bisexual attrac?tants for diamondback moth,Plutella xylostella(Lepidoptera:Plutellidae) based on sex pheromone and host volatiles[J]. Ap?plied Entomology and Zoology,2008,43(4):631-638.
[30] VARELA N,AVILLA J,ANTON S,et al. Synergism ofpheromone and host-plant volatile blends in the attraction ofGrapholita molesta males[J]. Entomologia Experimentalis etApplicata,2011,141(2):114-122.
[31] 曹兰,谢和芳,刘佳霖,等. 不同引诱剂对大蜡螟幼虫的引诱效果研究[J]. 现代农业科技,2020(19):198-201.
CAO L,XIE H F,LIU J L,et al. Study on the attractive effectof different attractants on the larvae of Cercospora mellifera[J].Modern Agricultural Science and Technology,2020(19):198-201.

