致死剂量咪唑乙烟酸处理对冀谷25苗期生理生化特性的影响
史慎奎 祁东梅 王春芳 王玉芳 杨锐佳

摘要:为探究谷子品种冀谷25 的除草剂致死剂量,并研究除草剂对其生理生化特性的影响,以冀谷25 为试验材料,采用育苗盘培养方法,利用不同浓度除草剂咪唑乙烟酸处理3 叶期谷子幼苗,在不同处理浓度和时间下,筛选出冀谷25 幼苗的致死剂量;同时测定谷子幼苗在除草剂处理后叶绿素含量、电解质渗透率、丙二醛(MDA)含量、过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性等生理指标的变化。结果表明,谷子幼苗除草剂咪唑乙烟酸的致死剂量为3 375 mL/hm2,同时发现随除草剂浓度(2 250、3 375、4 500 mL/hm2)的升高和处理时间的延长,谷子幼苗的相应生理指标叶绿素含量、电解质渗透率、MDA 含量、POD、SOD 和CAT 活性与对照相比在不同时间节点出现显著变化。研究结果显示,在喷施致死剂量的3 375 mL/hm2 的咪唑乙烟酸后,谷子幼苗受到胁迫从而启动生理保护机制。
关键词:冀谷25;咪唑乙烟酸;生理指标;谷子
中图分类号:S515 文献标识码:A 文章编号:1002?2481(2024)01?0037?06
谷子(Setaria italica)属禾本科作物,又名粟,俗称小米,起源于我国,有悠久的栽培历史,在我国北方农业和牧业生产中具有重要地位。谷子具有耐瘠薄、抗逆性强、适应性广等优良特点,且营养价值丰富,富含多种氨基酸,食用对身体健康有益,是干旱、半干旱地区的重要粮食作物之一[1]。因此,谷子具有良好的种植前景。但是,在田间种植过程中,杂草对谷子的生长发育有很大影响,需要喷洒除草剂。而不可忽视的是使用除草剂同时也会对谷子生长产生影响,且农田的土壤生态及生物群落也会受到影响[2-4],如杂草群落演替、多样性下降、大地覆盖物和地下生物量减少等。不同谷子品种对除草剂耐药性的研究表明,同一种谷子的生理指标受不同除草剂的影响是有差异的,即使在常规剂量下,使用除草剂对作物来说也是一种非生物胁迫,该非生物胁迫一定会在抑制杂草生长的同时,对作物本身的生理生化指标也产生诸多影响[5]。近年来,已有学者针对不同生态型谷子品种对除草剂的耐药性和抗咪唑乙烟酸谷子品种除草剂安全使用剂量等方面进行了研究[6-7]。冀谷25 是河北省农林科学院谷子所近年研究出的抗咪唑乙烟酸谷子品种之一[8-9]。咪唑乙烟酸能根治谷田的各种杂草,且价格低廉,为乙酰乳酸合成酶(ALS)抑制剂。对茎叶进行喷施处理后,敏感的杂草立即停止生长,经2~4 周全株死亡。
本研究旨在探究过量除草剂对谷子生理生化指标的影响,以期为谷子除草剂的使用提供指导。因此,本研究利用抗咪唑乙烟酸谷子品种(冀谷25)为材料,通过观察比较不同咪唑乙烟酸浓度处理下谷子幼苗的白化现象和死亡率,筛选出冀谷25 的致死剂量,同时分析喷施咪唑乙烟酸除草剂对冀谷25 幼苗造成的胁迫影响,并测定致死剂量下的生理生化指标叶绿素含量、电解质渗透率、丙二醛(MDA)含量、过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性的变化情况,不仅能够为探究冀谷25 对除草剂咪唑乙烟酸的抗性机理奠定基础,同时也为后续抗除草剂基因的分离和验证提供一定的参考依据[10]。
1 材料和方法
1.1 供试材料
试验材料为抗咪唑乙烟酸谷子品种冀谷25,由河北省农科院谷子所提供。所使用除草剂牧草净(含5% 咪唑乙烟酸),由山东先达农化股份有限公司生产。
1.2 试验方法
1.2.1 谷子幼苗培养
谷子种子用水冲洗多次,去除杂质和漂浮空瘪的谷子,再用蒸馏水冲洗1~2 次。在4 个相同的育苗盘中放入混合后的普通土壤和营养土(3∶1 混合比例),均匀放入等量的冀谷25 种子,浇水浸湿种子和土壤,将育苗盘放在有少量水的托盘中,并放于26 ℃光照培养箱中进行培养。
1.2.2 除草剂处理谷子幼苗
当冀谷25 幼苗长到三叶一心时,用不同剂量的咪唑乙烟酸处理谷子幼苗,处理剂量依次设置为0、2 250 mL/hm2 (除草剂推荐使用剂量[7])、3 375 mL/hm2 (1.5 倍除草劑推荐使用剂量)、4 500 mL/hm2 (2 倍除草剂推荐使用剂量)。将4 个育苗盘分别用标签标号,用小型喷雾器在谷子幼苗的整株叶片上分别均匀喷洒各剂量的除草剂溶液1 次,喷洒到叶片上开始往下滴液为止。空白对照组(CK)喷等量水,喷洒到叶片上开始往下滴液为止。在除草剂处理谷子幼苗的1、2、3、4、5、6 d 后,观察谷子茎叶的白化情况并分别测定死亡率。筛选出对冀谷25 对除草剂咪唑乙烟酸的致死剂量,即达到25% 植株死亡的剂量[7],再测定谷子幼苗叶片在该致死剂量下的各项生理生化指标。
1.3 测定指标及方法
采用乙醇丙酮法测定叶绿素含量[11]、使用DDS-11A 型电导率仪测定电解质渗透率[12]、采用硫代巴比妥酸法测定丙二醛(MDA)含量[13]、采用愈创木酚氧化法测定过氧化物酶(POD)活性[13]、采用氮蓝四唑(NBT)还原法测定超氧化物歧化酶(SOD)活性[14]、采用紫外分光光度法测定过氧化氢酶(CAT)活性[14]。
1.4 数据分析
所有试验数据均采用Excel 2010 和SPSS 20.0进行统计分析处理。
2 结果与分析
2.1 冀谷25 除草剂致死剂量的选择
在除草剂咪唑乙烟酸处理谷子幼苗的5 d 时,对照和除草剂推荐剂量处理后的谷子,死亡率均为0;在3 375 mL/hm2 和4 500 mL/hm2 剂量下谷子叶片出现明显的白化现象,并出现死亡现象(图1),统计育苗盘中幼苗死亡数目并计算出死亡率,死亡率分别达到25% 和31%,而后选择在25% 的死亡率的除草剂咪唑乙烟酸剂量为3 375 mL/hm2 的情况下测定相应的生理生化指标。
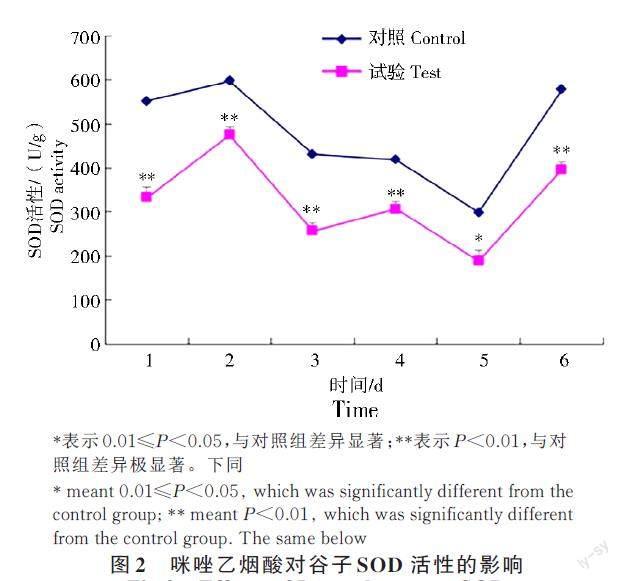
2.2 咪唑乙烟酸对冀谷25 超氧化物歧化酶(SOD)活性的影响
咪唑乙烟酸处理后的冀谷25 叶片中的超氧化物歧化酶(SOD)活性与对照的变化趋势基本相同(图2),处理后SOD 活性相比对照显著降低(P<0.05),经咪唑乙烟酸处理1 d 到6 d 的活性分别比对照低39.67%、20.40%、40.39%、26.73%、36.62%、31.43%。处理后1 d 到处理后2 d,SOD 活性有较大幅度上升,2 d 时活性达到最高值。2 d 开始到5 d,SOD 活性整体呈逐渐下降趋势,其中3 d 到4 d 中出现微小上升,但从4 d 到5 d,又呈现出小幅度的下降,在5 d 时,SOD 活性达到最低值,最后在5~6 d 出现较大幅度的上升。未经咪唑乙烟酸处理的冀谷25 与试验组相同,也呈先升后降再升的趋势,在处理后6 d 中有5 d,试验组与对照组的SOD 活性呈极显著差异(P<0.01)。
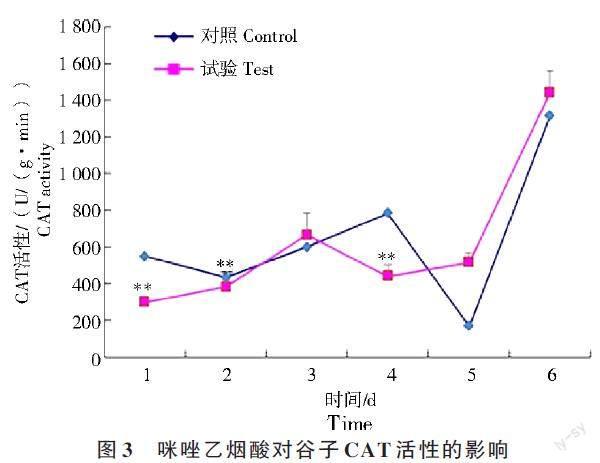
2.3 咪唑乙烟酸对冀谷25 过氧化氢酶(CAT)活性的影响
咪唑乙烟酸对冀谷25 叶片中过氧化氢酶(CAT)活性与对照的变化趋势基本相同(图3)。经过咪唑乙烟酸处理的冀谷25 叶片中CAT 活性在连续6 d 的测定中呈一定的波动,与SOD 的变化趋势相似,具体也表现为先升后降再升的变化趋势,1~2 d CAT 活性呈小幅度上升,但前2 d CAT的活性与对照相比均极显著降低(P<0.01),其中1 d 出现CAT 活性的最低值,从处理后3 d 到处理后5 d,整体呈下降趋势,其中在3 d 和5 d CAT 的活性与对照相比极显著升高(P<0.01),4 d 时试验组CAT 的活性与对照相比极显著降低(P<0.01),最后在5~6 d 中出现较大幅度的上升,并在6 d 达到最高值。未经咪唑乙烟酸处理的冀谷25 与试验组相同,也呈现先升后降再升的趋势。
2.4 咪唑乙烟酸对过氧化物酶(POD)活性的影响
咪唑乙烟酸处理的冀谷25 叶片过氧化物酶(POD)活性与对照的变化趋势基本相同(图4)。咪唑乙烟酸处理的冀谷25 POD 活性在连续6 d 的测定中,呈一定的波动,与SOD 的变化趋势相似,也表現为先升后降再升。处理后1 d 到处理后3 dPOD 活性呈较大幅度的上升,其中1 d 出现POD 活性的最低值,处理后3 d 到处理后5 d,整体呈下降趋势,其中3 d 到4 d 下降幅度较大,在4 d 时POD活性与对照相比显著降低(P<0.05),而4~5 d 上升的趋势很小,几乎趋于平缓。最后在5~6 d 中出现较大幅度的上升趋势,POD 的活性与对照相比均极显著提高(P<0.01),并在6 d 达到POD 活性的最高值。未经咪唑乙烟酸处理的冀谷25 与试验组相同,也呈现先升后降再升趋势。1~4 d 整体呈上升趋势,其中,1~2 d 的上升幅度大于2~4 d 的上升幅度,在4 d 达到POD 活性的最高值。4~5 d 出现较大程度下降趋势,在5 d 达到POD 活性的最低值,最后5~6 d 出现较小幅度的上升。
2.5 咪唑乙烟酸对冀谷25 叶绿素含量的影响
咪唑乙烟酸处理的冀谷25 叶片叶绿素含量与对照的变化趋势基本相同(图5)。咪唑乙烟酸处理的冀谷25 叶片叶绿素的含量在连续6 d 测定中呈一定的波动,具体也表现为先升后降再升,从处理后1 d 到处理后2 d 叶绿素的含量增加,并在2 d 时达到叶绿素含量的最高值,从2 d 到4 d 整体呈下降趋势,其中2~3 d 的下降幅度大于3~4 d 下降幅度,3、4 d 中叶绿素含量与对照相比均显著降低(P<0.05),并在4 d 叶绿素含量达到最低值,从4 d到6 d 呈上升趋势,5、6 d 中叶绿素含量与对照相比均极显著降低(P<0.01)。未经咪唑乙烟酸处理的冀谷25 与试验组相同,也呈先升再降再升的趋势,从1 d 到2 d 叶绿素含量增加,其2 d 叶绿素含量低于试验组2 d 叶绿素含量,从2 d 到3 d 呈较大幅度的下降趋势,并在3 d 达到叶绿素含量的最低值,从3 d 到6 d 整体呈上升趋势,在6 d 达到叶绿素含量的最大值。
2.6 咪唑乙烟酸对冀谷25 丙二醛(MDA)含量的影响
咪唑乙烟酸对谷子丙二醛含量的影响如图6所示。
由图6 可知,经咪唑乙烟酸处理谷子叶片中丙二醛(MDA)含量与对照的变化趋势不一致,但是都呈现一定的波动。咪唑乙烟酸处理的冀谷25 叶片丙二醛含量在连续5 d 的测定中整体表现为先升后降,处理后1 d 到处理后2 d,呈较大幅度上升趋势,1 d 时丙二醛含量达到最低值,2 d 达到丙二醛含量最高值,并且2 d 时丙二醛含量与对照相比极显著升高(P<0.01)。从2 d 到5 d 整体呈下降趋势,但其中3~4 d 出现小幅度的上升,4 d 时丙二醛含量与对照相比显著升高(P<0.05),而2~3 d 下降幅度远大于4~5 d 的下降幅度。未经咪唑乙烟酸处理的冀谷25 在连续5 d 的测定中,表现为先降后升,从1 d 到2 d 呈下降趋势,1 d 达到丙二醛含量的最高值,但在2 d 达到丙二醛含量的最低值,随后从2 d 到5 d 整体呈上升趋势,不过在3 d 到4 d 出现小幅度下降,而2 d 到3 d 的上升幅度大于4 d 到5 d的上升幅度。
2.7 咪唑乙烟酸对冀谷25 电解质渗透率的影响
咪唑乙烟酸处理冀谷25 后叶片中电解质渗透率与对照的变化趋势不一致(图7)。咪唑乙烟酸处理的冀谷25 叶片中电解质渗透率在连续6 d 测定中呈一定的波动,表现为先升后降再升的趋势。处理后1 d 到处理后2 d 电解质渗透率呈上升趋势,并在2 d 达到电解质渗透率的最高值,2 d 到3 d 呈下降趋势,并在3 d 达到电解质渗透率的最低值,从第3 d 到6 d,整体呈上升趋势,但在5 d 到6 d 中出现小幅度下降。未经咪唑乙烟酸处理的冀谷25 在连续6 d 的电解质渗透率测定中波动较大,1 d 到2 d呈小幅度下降,其中2 d 达到电解质渗透率的最低值,随后2 d 到3 d 呈大幅度上升,而在3 d 到4 d 就出现大幅度下降,并在4 d 到5 d 再次出现大幅度上升,达到电解质渗透率的最高值,最后在5 d 到6 d呈下降趋势。同时,本研究发现,在处理后6 d 试验组与对照组的电解质渗透率在第2 d 和第3 d 呈极显著差异(P<0.01),第5 d 和第6 d 呈显著差异(P<0.05)。
3 结论与讨论
当前国内许多研究更注重于探讨谷子产量和影响产量的因素,而关于过量喷施除草剂对谷子的复杂生理影响的研究仍然不足。谷子除草剂的使用需要在安全剂量下使用,过量除草剂会对谷子幼苗产生不可逆的损害,甚至死亡[6-7]。本研究发现,在咪唑乙烟酸达到安全剂量1.5 倍浓度时即可引起幼苗的死亡并启动生理生化保护机制[10]。
叶绿素是植物重要的光合色素,能够吸收并传递光量子。李贵等[15]在除草剂对作物光合作用影响的研究中发现,大部分除草剂在使用后会对作物的光合作用产生一定影响,除草剂处理大豆、水稻时都造成叶绿素含量降低。同样,本研究表明,与对照相比,施加除草剂后从第3 天开始叶绿素含量显著降低,因而导致谷子出现白化现象。
当植物受到不利环境影响时,其细胞质膜通透性出现相应变化,造成细胞膜结构与功能不同程度受损。丙二醛作为膜脂过氧化产物,当植物受到胁迫后会显著增加。本研究表明,与对照相比,冀谷25 在喷施除草剂后的第2 天丙二醛含量显著增加,可能是由于植物受到除草剂造成的胁迫引起膜透性的改变,而后随着除草剂胁迫时间的延长,谷子对于除草剂的适应性增加,丙二醛含量又逐渐降低。
叶亚新等[16]研究除草剂胁迫对萝卜幼苗生理指标的影响,结果表明,酶系统中SOD 等酶的活性增加能够增强胡萝卜清除氧自由基的能力,避免其过量积累对细胞的伤害[17-19]。本研究发现,谷子在过量除草剂胁迫下出现与萝卜幼苗相似的防御反应,SOD、POD、CAT 酶活性均有增强趋势,并表现为相似变化规律,说明在应答除草剂胁迫时各指标间出现协同性。相比较处理后与对照组无显著性差异的电解质渗透率来说,其中酶系统中的CAT 和SOD 在处理后第1 天就开始与对照组出现显著性差异,可能共同参与了对活性氧的清除,来保护膜损伤,可推测酶系统在谷子应对过量除草剂逆境时起主要作用,能在过量除草剂处理下迅速做出防御反应来保护自身,而酶系统发挥作用的机制与抗除草剂基因之间关系有待进一步深入研究。
本研究发现,冀谷25 幼苗在致死剂量除草剂胁迫下,其葉绿素、电解质渗透率、MDA 含量、POD、SOD 以及CAT 的活性等指标与对照相比,在不同时间节点呈现显著差异或极显著差异。本研究有助于对谷子除草剂抗性机理的探索,同时为谷子抗除草剂基因的分离与验证奠定基础。
参考文献:
[1] 周汉章,任中秋,刘环,等. 谷田杂草化学防除面临的问题及发展趋势[J]. 河北农业科学,2010,14(11):56-58.
ZHOU H Z,REN Z Q,LIU H,et al. Problems and develop?ment trend of chemical weeding in millet field[J]. Journal of He?bei Agricultural Sciences,2010,14(11):56-58.
[2] 黄顶成,尤民生,侯有明,等. 化学除草剂对农田生物群落的影响[J]. 生态学报,2005,25(6):1451-1458.
HUANG D C,YOU M S,HOU Y M,et al. Effects of chemicalherbicides on bio-communities in agroecosystems[J]. Acta Eco?logica Sinica,2005,25(6):1451-1458.
[3] 郑世英. 农药对农田土壤生态及农产品质量的影响[J]. 石河子大学学报(自然科学版),2002,20(3):255-258.
ZHENG S Y. The effect of pesticide to farmland soil ecologyand farm produce[J]. Journal of Shihezi University(Natural Sci?ence),2002,20(3):255-258.
[4] 袁树忠,吴进才. 稻田除草剂对水稻生长生理影响的初步研究[J]. 杂草科学,2002,20(4):13-15.
YUAN S Z,WU J C. Preliminary study on the effect of herbi?cide on rice growth physiology in paddy field[J]. Weed Science,2002,20(4):13-15.
[5] 李萍,杨小环,王宏富,等. 不同谷子(Setaria italica(L.)beauv)品种对除草剂的耐药性[J]. 生态学报,2009,29(2):860-868.
LI P,YANG X H,WANG H F,et al. The tolerance of differentmillet(Setaria italica(L.)Beauv)cultivars to herbicides[J]. ActaEcologica Sinica,2009,29(2):860-868.
[6] 解丽丽. 除草剂对谷子生长特性和产量性状的影响[D]. 太原:山西农业大学,2014.
XIE L L. Effect of Herbicides on the growth characteristics andyield characteristics of foxtail millet[D]. Taiyuan:Shanxi Agri?cultural University, 2014.
[7] ZHANG T,SHI Z G,CHEN Y,et al. Study on safe dosage ofimazethapyr for an imazethapyr resistant millet variety and its ef?fect on weed control[J]. Agricultural Science & Technology,2013,14(6):911-914.
[8] 师志刚,夏雪岩,刘正理,等. 谷子抗咪唑乙烟酸新种质的初步研究[J]. 河北农业科学,2010,14(11):133-134,136.
SHI Z G,XIA X Y,LIU Z L,et al. Preliminary study on newimazethapyr resistant foxtail millet germplasm[J]. Journal of He?bei Agricultural Sciences,2010,14(11):133-134,136.
[9] 程汝宏,师志刚,刘正理,等. 抗除草剂简化栽培型谷子品种冀谷25 的选育及配套栽培技术研究[J]. 河北农业科学,2010,14(11):8-12.
CHENG R H,SHI Z G,LIU Z L,et al. Breeding of foxtail mil?let cultivar jigu 25 resistant to herbicide,suitable for simplifiedcultivation and corresponding cultivation techniques[J]. Journalof Hebei Agricultural Sciences,2010,14(11):8-12.
[10] 李志江. 谷子抗除草剂基因的发现及其应用[J]. 基因组学与应用生物学,2010,29(4):768-774.
LI Z J. Discovery and application of herbicide resistant gene infoxtail millet[J]. Genomics and Applied Biology,2010,29(4):768-774.
[11] ARNON D I. Copper enzymes in isolated chloroplasts.polyphe?noloxidase in beta Vulgaris[J]. Plant Physiology,1949,24(1):1-15.
[12] SONG L L,DING W,ZHAO M G,et al. Nitric oxide protectsagainst oxidative stress under heat stress in the calluses fromtwo ecotypes of reed[J]. Plant Science,2006,171(4):449-458.
[13] 张治安. 植物生理学实验指导[M]. 北京:中国农业科学技术出版社,2004.
ZHANG Z A. Experimental instruction of plant physiology[M]. Beijing:China Agricultural Science and TechnologyPress, 2004.
[14] 王韶唐. 植物生理学实验指導[M]. 西安:陕西科学技术出版社,1986.
WANG S T. Experimental supervision of plant physiology[M]. Xi?an:Shaanxi Science and Technology Press,1986.
[15] 李贵,吴竞仑. 除草剂对作物生理生化指标的影响[J]. 安徽农业科学,2007,35(29):9157-9159.
LI G,WU J L. Effect of herbicide on crop physiology and bio?chemistry[J]. Journal of Anhui Agricultural Sciences,2007,35(29):9157-9159.
[16] 叶亚新,栗冠珍. 除草剂对萝卜幼苗逆境生理指标的影响[J].江苏农业科学,2012,40(10):146-149.
YE Y X,LI G Z. Effect of herbicide on stress physiology indexof radish seedlings[J]. Jiangsu Agricultural Sciences,2012,40(10):146-149.
[17] 王建华,刘鸿先,徐同. 超氧物歧化酶(SOD)在植物逆境和衰老生理中的作用[J]. 植物生理学通讯,1989,25(1):1-7.
WANG J H,LIU H X,XU T. The role of superoxide dis?mutase(SOD) in stress physiology and senescence physiologyof plant[J]. Plant Physiology Communications,1989,25(1):1-7.
[18] 黄玉山,罗广华,关棨文. 镉诱导植物的自由基过氧化损伤[J]. 植物学报,1997,39(6):522-526.
HUANG Y S,LUO G H,GUAN Q W,et al. Peroxidationdamage of oxygen free radicals induced by cadmium to plant[J].Journal of Integrative Plant Biology,1997,39(6):522-526.
[19] 杜秀敏,殷文璇,赵彦修,等. 植物中活性氧的产生及清除机制[J]. 生物工程学报,2001,17(2):121-125.
DU X M,YIN W X,ZHAO Y X,et al. The production andscavenging of reactive oxygen species in plants[J]. ChineseJournal of Biotechnology,2001,17(2):121-125.

