缺氧微环境中HIP68/RAP1B信号通路对乳腺癌侵袭转移的作用*
屈航英 闫鹏云 张佳 陈强
(1.西安交通大学第一附属医院心外科,陕西 西安 710061;2.西安市第三医院放疗科,陕西 西安 710000;3.西安交通大学第一附属医院胸外科,陕西,西安 710061)
在我国,乳腺癌是女性常见的肿瘤之一,其死亡率仅次于肺癌、胃癌、肝癌、结直肠癌,严重威胁着女性的身心健康及生活质量。近年来我国乳腺癌的发生逐年增加而且更趋于年轻化,而且也是年轻女性的主要死因。缺氧区域的存在为局部进展期乳腺癌的常见特征,而在正常乳腺组织中是不存在的[1]。缺氧与乳腺癌复发和转移明显相关[2-3]。前期课题组发现缺氧模型下低氧诱导因子-1α(Hypoxia-inducible factor-1α,HIF-1α)与HIP68在乳腺癌组织中表达明显正相关且促进乳腺癌细胞增生及侵袭转移[4-5]。HIP68在乳腺癌组织中高表达并促进细胞增殖、侵袭及迁移,本研究我们将进一步探讨HIP68通过何种途径参与乳腺癌细胞增殖、迁移及侵袭。
1 资料与方法
1.1 一般资料 选取西安交通大学第一附属医院2012—2013年乳腺癌组织标本共73例,均经术后病理诊断且临床资料详实。所有标本均选取自女性乳腺癌患者,年龄37~69岁,其中23例为乳腺小叶癌标本,50例为乳腺导管癌标本。所有标本在手术前患者均未经过系统治疗。标本使用获我院伦理委员会批准。
1.2 细胞与主要试剂 两种乳腺癌细胞系(MCF-7和MDA-MB-231)和人正常乳腺上皮细胞SK-BR-3购自中科院上海细胞库。si-HIP68、si-RAP1B及对照shRNA(上海吉凯),Lipofectamine2000(Invitrogen,CA,USA),PVDF膜(Millipore公司),HIP68兔抗人单克隆抗体(Abcam公司),RAP1B兔抗人单克隆抗体(Abcam公司),β-actin兔抗人单克隆抗体(GAPDH),辣根过氧化酶(HRP)标记的山羊抗兔IgG(Abcam公司)。
1.3 细胞培养及分组 用化学药物CoCl2·6H2O构建细胞缺氧模型,用MTT实验筛选合适的CoCl2·6H2O浓度,确认最终的药物作用梯度为0、50、100、150、200、250 μg/mL,0 μg/mL为对照组。缺氧乳腺癌细胞系MDA-MB-231、MCF-7用含有10%FBS(Gibco)的Dulbecco改良的Eagle培养基(DMEM,1640)中培养,乳腺正常上皮细胞系SK-BR-3细胞用DMEM培养基,含10% 胎清培养,3种细胞都在37 ℃、5% CO2培养箱中培养。培养基每隔一天交换一次,细胞每3天传代(1∶3)。通过将HIP68、RAP1B编码序列克隆到pIRES/Red载体中实现过表达,当80%~90%汇合时,基于所提供的方向,通过Lipofectamine 2000用适当的构建体转染所有细胞。在转染后6 h用新鲜的完整环境替换环境,并在转染后24~48 h收集细胞用于下一次使用。Control组不做任何处理,转染不带目的基因的空载体细胞为NC组,转染相应的shRNA为实验组。
1.4 免疫组化染色 将盖玻片先泡酸处理后洗涤干净、高压灭菌后放入24孔培养板中,取对数生长期细胞,以1×105个/孔接种于24孔,待培养的细胞汇合度达到60%~80%,取出细胞爬片,1×PBS漂洗,3 min×3次;4%多聚甲醛固定细胞,于4 ℃放置30 min;1×PBS漂洗,3 min×3次;0.5%TritonX-100(1×PBS配制)孵育,室温10 min;1×PBS漂洗3 min×3次;3%H2O2室温孵育10 min;1×PBS漂洗,3 min×3次;封闭血清室温孵育10 min,倾去不洗;一抗孵育(阴性对照用1×PBS孵育),于湿盒中4 ℃过夜;1×PBS 漂洗5 min×3 次;生物素标记二抗工作液室温孵育30 min ;1×PBS 漂洗5 min×3 次;辣根酶标记链霉卵白素工作液室温孵育 30 min;1×PBS 漂洗5 min×3次;DAB 显色;自来水充分冲洗;苏木素复染;盐酸酒精分化,淡氨水反蓝;75%、95%、无水乙醇梯度脱水,二甲苯透明,中性树脂封片;显微镜下观察,采用 DeltaPixViewer 软件对图像进行采集。
1.5 Western blot检测蛋白表达水平 提取处理后肿瘤细胞蛋白,BCA法测定样品的蛋白浓度。SDS-PAGE对蛋白进行分离,之后转至PVDF膜,5%脱脂奶粉封闭,一抗4 ℃孵育过夜,洗膜,二抗孵育1~2 h,洗膜,用ECL化学发光试剂检测,显影曝光得到目的蛋白表达条带。
1.6 Real-time PCR检测靶基因mRNA表达 应用Lipid RNeasy Mini Kit RNA(QAIGEN公司)提取不同细胞中的总RNA,使用M-MLV反转录酶(Invitrogen)进行逆转录,利用SYBR Green I Master Mix(TAKARA)试剂盒在BioRad公司的iQ5实时定量PCR仪进行PCR扩增,检测mRNA的表达。
1.7 MTT检测细胞的增殖能力 将不同细胞(2×103个/孔)接种至96孔板中,37 ℃培养24 h后,不同干预后继续孵育48 h。每孔加入20 μL的MTT(5 mg/mL),37 ℃孵育4 h。然后吸去培养基,加入150 μL的DMSO,振荡10 min至甲瓒结晶完全溶解。利用分光光度计测量572 nm处吸光度,计算细胞的相对增殖率。
1.8 Transwell法检测细胞侵袭能力 使用预先铺好Matrigel孔隙大小为8 μm的24孔Transwell板(BD),待细胞消化好后,用无血清培养液重悬细胞,离心去培养液后再使用无血清培养液重悬细胞,对细胞进行计数,调整细胞浓度为5×105。Transwell板上室加入200 μL细胞悬液,下室加入0.6 mL含10% FBS的培养液,置于培养箱中培养36 h。将上室置于多聚甲醛中固定15 min,然后用结晶紫染色5 min,用棉签擦去上室室内未穿过膜的细胞,在高倍显微镜下观察、拍照并计数。每个样本取5个高倍视野进行计数最后取均值。

2 结果
2.1 HIP68、RAP1B在乳腺癌组织中的表达情况 免疫组化染色结果显示,HIP68蛋白和RAP1B蛋白表达均位于细胞核或细胞核和细胞质,见图1、2。HIP68和RAP1B蛋白在乳腺癌组织中的表达水平高于癌旁组织(P<0.001),见表1。

表1 HIP68和RAP1B在乳腺癌组织和癌旁组织中的表达差异
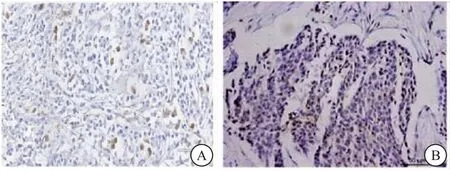
图1 HIP68在乳腺癌组织中的表达 (40×)
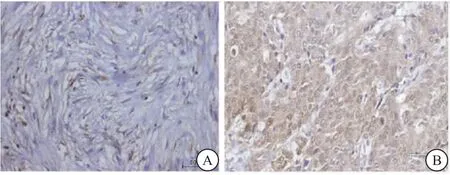
图2 RAP1B在乳腺癌组织中的表达 (40×)
2.2 HIP68、RAP1B在乳腺癌中的表达与临床病理特征的关系 73例乳腺癌患者组织中HIP68表达与TNM分期、淋巴结转移相关(P<0.05),与患者的肿瘤类型、年龄、肿瘤位置等无关(P>0.05);RAP1B表达与TNM分期、淋巴结转移、ER、PR状态相关(P<0.05),与患者的肿瘤类型、年龄、肿瘤位置等无关(P>0.05),见表2。Spearman’s相关性分析结果显示,HIP68表达与RAP1B表达呈正相关(r=0.427,P<0.001),见表3。
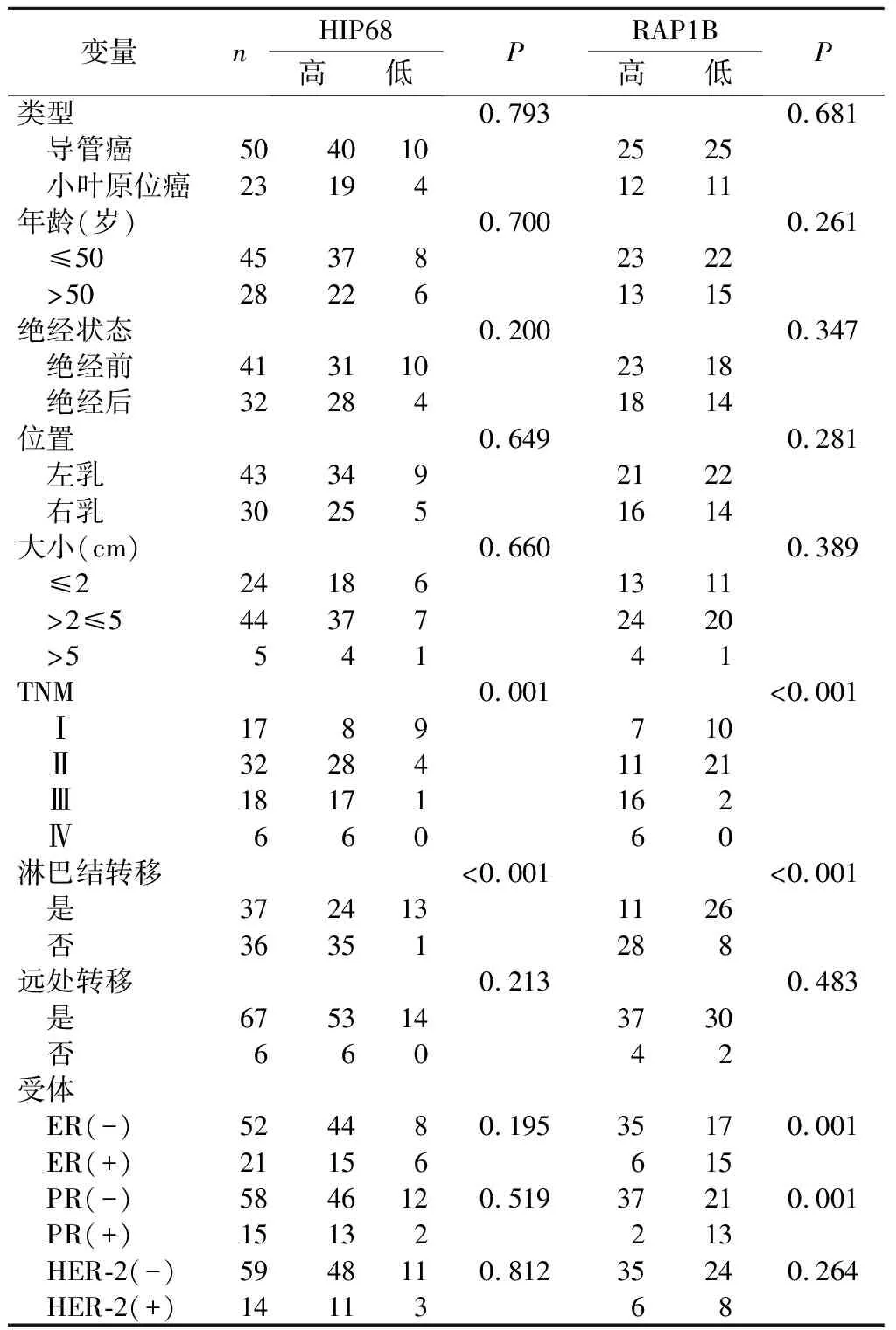
表2 HIP68和RAP1B与乳腺癌临床病理数据相关性分析

表3 HIP68和RAP1B表达相关性分析
2.3 细胞水平检测HIP68和RAP1B表达情况 用不同浓度的CoCl2·6H2O作用乳腺癌细胞系24 h后,采用Western blot及qRT-PCR检测各组HIP68、RAP1B表达情况显示,随着CoCl2·6H2O药物浓度的增高,RAP1B的表达在3种乳腺癌细胞系中也在逐渐增加,同时HIP68表达水平随着缺氧程度的增加而逐渐增高(P<0.05);HIP68在MCF-7、MDA-MB-231的表达水平高于SK-BR-3细胞(P<0.05),见图3。

图3 缺氧模型中HIP68/RAP1B蛋白和mRNA在3种乳腺癌细胞中的表达情况
2.4 沉默HIP68对RAP1B蛋白的影响及对细胞生物学行为的影响 缺氧环境下应用si-HIP68转染MDA-MB-231和MCF-7 24 h后进行RAP1B测定蛋白表达情况和肿瘤细胞迁移、侵袭能力的测定,未转染的细胞为Control组,转染不带目的基因的空载体为NC组,转染si-HIP68为si-HIP68组。结果显示沉默HIP68蛋白后可以显著的抑制RAP1B蛋白的表达(P<0.05),见图4。细胞增殖和侵袭实验结果表明,si-HIP68转染的乳腺癌细胞后,肿瘤细胞增殖及侵袭能力较Control组明显降低,低表达HIP68可以显著抑制MDA-MB-231和MCF-7的增殖及侵袭能力(P<0.001),见图5。
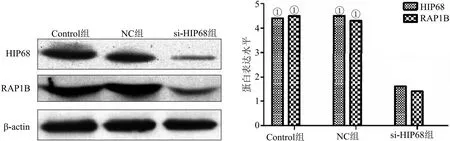
图4 沉默HIP68抑制RAP1B蛋白表达
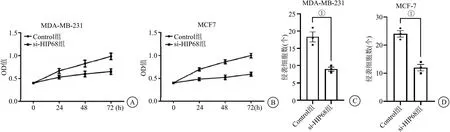
图5 沉默HIP68抑制乳腺癌细胞增殖与侵袭转移
2.5 过表达HIP68对RAP1B蛋白的影响及对细胞生物学行为的影响 缺氧环境下应用pIRES/Red-HIP68转染MDA-MB-231和MCF-7 24 h后进行RAP1B测定蛋白表达情况和肿瘤细胞增殖、侵袭能力的测定,未转染的细胞为Control组,转染不带目的基因的空载体为NC组,转染pIRES/Red-HIP68为pIRES/Red-HIP68组。结果显示过表达HIP68蛋白后RAP1B蛋白也明显高表达(P<0.05),见图6。细胞增殖和细胞侵袭实验结果表明,pIRES/Red-HIP68转染的乳腺癌细胞后,肿瘤细胞的增殖和侵袭能力较Control组明显增强,过表达HIP68可以显著增强MDA-MB-231和MCF-7的增殖和侵袭能力(P<0.05),见图7。
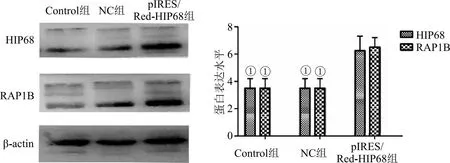
图6 过表达HIP68促进RAP1B蛋白表达
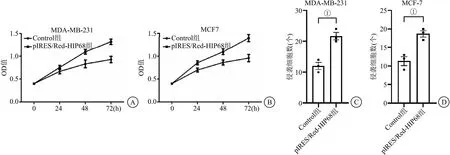
图7 过表达HIP68促进乳腺癌细胞增殖与侵袭转移
2.6 沉默RAP1B对HIP68蛋白的影响及对生物学行为的影响 缺氧环境下应用si-RAP1B转染MDA-MB-231和MCF-7 24 h后进行HIP68测定蛋白表达情况和肿瘤细胞迁移、侵袭能力的测定,未转染的细胞为Control组,转染不带目的基因的空载体为NC组,转染si-RAP1B为si-RAP1B组。结果显示沉默RAP1B蛋白后对HIP68蛋白影响不大(P=0.13),见图8。细胞增殖、侵袭实验结果表明,si-RAP1B转染的乳腺癌细胞后,肿瘤细胞增殖、迁移和侵袭能力较Control组明显降低,低表达RAP1B可以显著抑制MDA-MB-231和MCF-7增殖及侵袭能力(P<0.05),见图9。
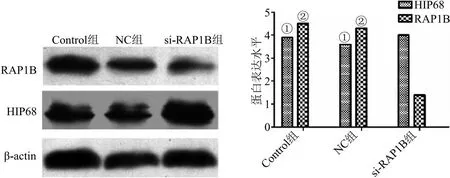
图8 沉默RAP1B蛋白表达情况
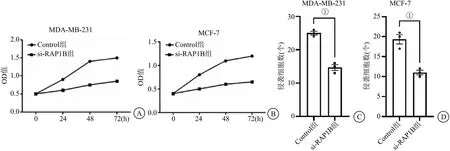
图9 沉默RAP1B抑制乳腺癌细胞增殖及侵袭转移
2.7 过表达RAP1B对HIP68蛋白的影响及对生物学行为的影响 缺氧环境下应用pIRES/Red-RAP1B转染MDA-MB-231和MCF-7 24 h后进行HIP68测定蛋白表达情况和肿瘤细胞增殖、侵袭能力的测定,未转染的细胞为Control组,转染不带目的基因的空载体为NC组,转染pIRES/Red-RAP1B为PIRES/Red-RAP1B组。结果显示过表达RAP1B蛋白后对HIP68蛋白影响不大(P=0.13),见图10。细胞增殖和细胞侵袭实验结果表明,pIRES/Red-RAP1B转染的乳腺癌细胞后,肿瘤细胞的增殖和侵袭能力较Control组明显增强,过表达 RAP1B可以显著促进MDA-MB-231和MCF-7的增殖和侵袭能力(P<0.05),见图11。

图10 过表达RAP1B蛋白表达情况

图11 过表达RAP1B促进乳腺癌细胞增殖及侵袭转移
2.8 HIP68/RAP1B免疫共沉淀结果 进一步免疫共沉淀结果提示HIP68与RAP1B可特异性结合,乳腺癌组织中研究发现HIP68与RAP1B表达呈正相关,且沉默RAP1B对HIP68无影响,低表达或高表达HIP68相应地会引起RAP1B低表达或高表达,见图12。提示RAP1B可能为HIP68基因的下游。
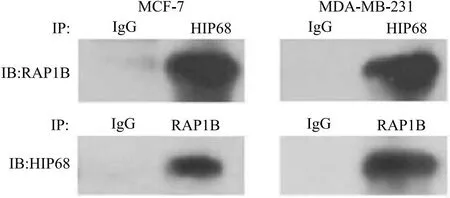
图12 HIP68/RAP1B免疫共沉淀结果
3 讨论
乳腺癌作为全球女性发病率最高的恶性肿瘤,具有增长快、易转移等特点,其病死率约占全球恶性肿瘤的25%,严重威胁着女性健康[6]。目前乳腺癌的治疗逐步形成个体化的综合治疗,积极寻找分子靶向治疗提高无病生存期和乳腺癌的总生存期至关重要。
课题组一直致力于乳腺癌的研究,前期也已证实HIP68在乳腺癌组织中高表达,HIP68高表达可促进乳腺癌细胞生长增殖、迁移和侵袭。
1999年,我们课题组开始用cDNA microarrays技术研究缺氧对基因表达的影响,发现缺氧能强烈诱导EST表达序列EST 188825(GenBank Accession Number:AA799328,基因名称为FAM111A)。这项研究结果与2002年Bernaudin等[7]的研究结果一致,同样显示在缺氧再氧合时通过基因芯片筛查技术发现EST 188825基因在新生鼠的各个组织(脑组织、心脏组织、肾脏组织、肺组织、肝组织等)中均呈现不同程度(数倍到几十倍不等)的高表达状态。随后课题组根据EST 188825 的核苷酸序列设计了引物,用RACE技术克隆了EST 188825的全长cDNA 序列,用体外蛋白翻译技术证实该基因表达分子量为68 kDa的蛋白。该cDNA是在缺氧环境中高表达被发现的,且编码的蛋白分子量为68 kDa,因此把其命名为HIP68。到目前为止,HIP68(FAM111A)基因的功能是未知的,国内外对该基因的研究也很少,大多是近几年研究报道的。HIP68位于常染色体11q12附近16kb处,编码含有611个氨基酸的核表达蛋白[8-10]。2012年有报道称SV40病毒的LT抗原可以与HIP68特异性的相互作用,LT抗原通过损耗HIP68来稳固和重建病毒在宿主中的表型,提示HIP68可能具有抗病毒的特性;该研究还发现HIP68的表达具有细胞周期依赖性[11]。2012年Nature Genetics报道称HIP68基因的突变可能与日本男性前列腺癌易感性有关[8];随后在2014年有学者发现这可能是由于HIP68基因可以调控雄激素受体有关[12]。2013年有研究发现HIP68的高表达与糖尿病的发病有关,可能是由于HIP68的高表达影响了胰岛B细胞的存活[13]。Kenny-Caffey氏综合症是一种相当罕见的遗传性骨骼疾病,一般表现为出生后生长迟滞,身材短小,大头,脸部有轻微的畸形,前额微凸,高的发际线,眉毛与睫毛较不明显;且骨质较硬,长骨的骨干较为狭窄,皮层较厚而髓质腔狭窄,常伴有低钙血症[10,14]。2013年之后有报道称Kenny-Caffey氏综合症可能是因为HIP68基因的突变引起的[9-10,15],HIP68基因的突变可导致骨骼系统发育异常[16]。从这些文献报道来看,HIP68可能与基因的转录有关[11],对调控骨骼的生长增殖、甲状旁腺激素分泌、体内钙水平稳定、男性生殖系统发育等起重要作用[10,14]。
RAP1B是RAP1的异构体,是一种小的Ras样GTP酶,在调控多种信号通路如增殖、分化、形态形成以及凋亡中起分子开关的作用[17]。RAP1B在内皮迁移与血管生成的作用相对明确。在RAP1B基因敲除的裸鼠动物模型研究证实,RAP1B缺失可以导致血管生成、内皮细胞迁移及增殖的功能受损以及MAPK信号通路的受阻,无论是血管发生、内皮迁移以及MAPK通路都在肿瘤的发生发展中发挥重要作用[18]。虽然RAP1B在很多肿瘤中的突变不多,但其癌基因的功能已在多种肿瘤中被证实,也是肿瘤治疗的潜在位点[19-21]。Infante等[22]研究发现RAP1B可以作为预防急性淋巴细胞白血病组织侵袭的有效手段,与本实验结果一致。以往报道在结肠癌肝转移瘤、黑色素瘤、甲状腺乳头状癌、胶质瘤等的研究中也发现RAP1B参与了肿瘤的增殖与远处转移[23-26]。课题组前期研究也发现,RAP1B与食管癌增殖和侵袭相关,且为miR-518b的下游[27];在胃癌中RAP1B高表达,且与胃癌患者预后相关,缺氧可诱导RAP1B在胃癌细胞中高表达,且与胃癌侵袭明显相关[28]。
本研究中乳腺癌缺氧组织IHC结果显示,HIP68、RAP1B蛋白高表达于乳腺癌细胞,而前期已经证实HIP68高表达于乳腺癌,RAP1B参与肿瘤的发生,且有报道高表达RAP1B促进乳腺癌转移,但具体机制尚未报道。本研究我们设想HIP68与RAP1B可能共同参与乳腺癌的恶行生物学行为,且证实RAP1B为HIP68的下游作用靶点,促进乳腺癌的生物学行为,通过免疫共沉淀实验表明HIP68与RAP1B结合并作为下游靶点促进乳腺癌侵袭转移及细胞增殖,这与Bischoff等[29]报道的结果一致,高表达RAP1B可以促进乳腺癌远处转移及定植, RAP1B通过上游分子激活形成活性形式促进肿瘤细胞群体性的聚集及延伸促进癌细胞远处转移,RAP1B通过促进细胞外张力作用参与肿瘤的进一步发展。本研究未在动物水平验证HIP68/RAP1B促进乳腺癌恶行生物学行为的机制,接下来我们将进一步在体内及动物实验中验证HIP68/RAP1B在乳腺癌侵袭转移中的机制,为乳腺癌的防治提供新的依据。
4 结论
HIP68/RAP1B信号通路在缺氧乳腺癌组织中高表达并促进乳腺癌细胞迁移和侵袭。

