黑斑息肉综合征合并肠套叠1例报道
葛同军 丁伟山 迟敬涛 孔艳玲


【摘要】 现报道1例黑斑息肉综合征(Peutz-Jeghers syndrome,PJS)合并肠套叠的中年女性患者,因“反复发作腹痛2年,加重1小时余”入院,查腹部CT、腹部彩超均显示肠套叠,行腹腔镜探查,术中发现小肠肿物伴肠套叠,考虑小肠肿瘤,行小肠部分切除术,术后病理显示(小肠)Peutz-Jeghers错构瘤性息肉伴假性浸润。仔细查体,患者有口唇色斑,详问家族史,患者父亲有口唇色斑、2个儿子中大儿子有口唇色斑、孙子(患者大儿子之子)有口唇色斑,明确诊断为PJS。提示对于长期腹痛的患者,应考虑到PJS的可能,需查皮肤黏膜有无黑斑、查胃肠镜、详问家族史,以确保早期诊治。
【关键词】 黑斑息肉综合征;肠套叠;口唇色斑;色素沉着
文章编号:1672-1721(2024)01-0042-04 文献标志码:A 中国图书分类号:R735
黑斑息肉综合征(PJS)又称家族性黏膜皮肤色素沉着胃肠道息肉病,是一种罕见的常染色体显性遗传疾病,主要临床特征为皮肤黏膜色素沉着、胃肠道多发性息肉、家族遗传性。
1 病例简介
患者,女性,54岁,因“反复发作腹痛2年,加重1小时余”于2018年11月27日12:30就诊于曲阜市人民医院。患者2年来曾多次发作腹痛,一直未做系统检查,应用消炎药治疗后均能逐渐缓解。1个多小时前早餐后突然出现左下腹持续性剧烈疼痛,伴恶心、呕吐,呕吐物为胃内容物,未呕吐鲜血及咖啡样液体,无腰背部放射性疼痛,无血尿,无腹泻,无便血,无发热,无头痛,无鼻塞流涕,无咽痛,无咳嗽咯痰,无胸闷胸痛。查体显示,腹部平坦,左下腹腹肌紧张,有明显压痛、反跳痛。拍腹部平片考虑肠梗阻并穿孔,遂收入院。患者发病前未饮酒,未进食高脂肪餐,未生气,未受凉。既往体健,否认糖尿病、胰腺炎病史,无吸烟、饮酒嗜好。
入院查体:体温36.5 ℃,脉搏84次/min,呼吸21次/min,血压135 mmHg/80 mmHg(1 mmHg=0.133 kPa)。神志清醒,精神差,言语流利。头颅无畸形,双眼球运动自如,双瞳孔等大等圆,直径约3 mm,对光反应灵敏。口角无歪斜,伸舌居中。颈软,无抵抗感。心率84次/min,律齐,音可,各瓣膜听诊区未闻及病理性杂音。双肺呼吸音清,未闻及干、湿啰音。腹部平坦,左下腹腹肌紧张,有明显压痛、反跳痛。腹部无包块,肝脾肋下未触及。莫菲氏征阴性,无移动性浊音。肠鸣音正常,4次/min。双肾区无压痛及叩击痛。双下肢无凹陷性水肿。四肢肌力5级,肌张力正常。四肢腱反射(++),病理征(-)。初步诊断为腹痛待查、肠梗阻、肠穿孔。
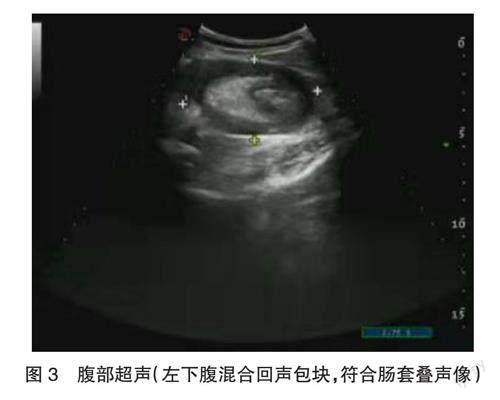
患者入院后禁饮食,持续胃肠减压,给予替硝唑、哌拉西林他唑巴坦抗感染,奥美拉唑抑制胃酸分泌,给予氨基酸、葡萄糖等营养支持治疗,完善血常规、尿常规、大便常规、肝肾功、血脂、电解质、葡萄糖(GLU)、凝血功能、D-二聚体、肌酶谱、血淀粉酶、尿淀粉酶、血脂肪酶、超敏C-反应蛋白(hs-CRP)、降钙素原(PCT)、肿瘤标志物、心电图、腹部彩超、腹部CT等检查。结果显示,血常规中白细胞(WBC)计数5.96×109/L[参考范围(4~10)×109/L],中性粒细胞(NEUT)百分比86.2%(参考范围40%~75%),红细胞(RBC)计数4.23×1012/L[参考范围(3.8~5.1)×1012/L],血红蛋白浓度(HGB)132 g/L(参考范围115~150 g/L),血小板(PLT)计数286×109/L[参考范围(125~350)×109/L]。尿常规中尿白细胞(LEU)+。GLU 6.76 mmol/L。肌酶谱中乳酸脱氢酶(LDH)254 U/L(参考范围103~227 U/L),羟丁酸脱氢酶(HBDH)231.6 U/L(参考范围72~182 U/L)。PCT 0.1 μg/L(参考范围0~0.5 μg/L)。hs-CRP 4.51 mg/L(参考范围0~10 mg/L)。D-二聚体0.32 mg/L(参考范围0~0.5 mg/L)。肝肾功、血脂、电解质、凝血功能、血淀粉酶、尿淀粉酶、血脂肪酶等均在正常范围。全腹部CT显示,肝左叶实质见结节状低密度区,大者大小约3.1 cm×1.9 cm,边缘尚清;左侧中下腹可见部分小肠及肠系膜套入小肠内,近端小肠明显扩张,内可见液平;盆腔内见少量积液影。结论,肝内低密度灶,性质待定;符合小肠套叠小肠梗阻;盆腔少量积液(见图1、图2)。腹部彩超显示,肝脏形态大小正常,表面光滑,于左葉探及数个无回声区,大者测值2.0 cm×1.9 cm,形态规则,边界清,内回声可,后方回声增强;左侧中下腹部腹腔内探及一范围约10.0 cm×7.2 cm×4.5 cm混合回声包块,形态规则,横切面呈靶环征,纵切面呈套筒征,彩色多普勒血流显像(color Doppler flow imaging,CDFI)示内血流信号较丰富。结论,肝内多发囊肿;左下腹混合回声包块(符合肠套叠声像,见图3)。患者腹痛明显,查体显示左下腹腹肌紧张,有明显压痛、反跳痛,全腹部CT、腹部彩超检查均符合肠套叠,故于16:00全麻下行腹腔镜下探查术。镜下探查示左下腹见小肠套叠肿块,近端小肠扩张增粗。腹腔镜下于套叠处向相反方向缓慢牵拉小肠,套叠逐渐整复。拉出的小肠可见肠内肿物,质硬,不能推动,考虑小肠肿瘤。于脐上切口向上延口,长约5 cm,依次切开皮肤、皮下组织,切开腹白线,进入腹腔,将肿瘤所在的小肠提出,见肿瘤直径约
5 cm,远端、近端分别距肿瘤边缘5 cm楔形切除病变肠管,近端扩张肠管给予减压。用切割吻合器行小肠侧侧吻合,闭合小肠残端,间断减张缝合吻合口及残端。确认吻合口通畅且血运好。间断缝合封闭小肠系膜。于吻合口处置腹腔引流管1根从左侧腹壁引出,检查无活动性出血及其他异常,清点器械敷料无误,医用几丁糖注入腹腔预防肠粘连,依次缝合关闭切口各层。手术顺利,术中出血约10 mL,术后安返病房。切除小肠及肿物送病理检查。术后给予患者抗感染、营养支持、对症治疗。肿瘤标志物甲胎球蛋白(AFP)、癌胚抗原(CEA)、糖类抗原19-9(CA19-9)、糖类抗原125(CA125)、糖类抗原153(CA153)均无异常。切除肠管大体巨检,切除肠管长10 cm,直径3~5 cm,剖开距一端切线4 cm见一息肉状肿物,体积5 cm×5 cm×3 cm,切面灰白灰褐色,可见树状分枝结构,局部黏滑。肠周未查见肿大淋巴结(见图4)。病理结果回示,(小肠)Peutz- Jeghers错构瘤性息肉伴假性浸润。免疫组化,固有肌层内的腺体P53(野生型),Syn散在神经内分泌细胞阳性,Ki67局灶阳性高表达,CEA局灶弱阳性(见图5)。看到病理结果后,复习相关文献资料,仔细查体,患者口唇可见散在点状黑斑,大小1~5 mm,界限不清晰,不融合,压之不褪色(见图6)。详问家族史,患者的父亲有口唇色斑、2个儿子中大儿子有口唇色斑、孙子(患者大儿子之子)有口唇色斑,明确诊断为PJS。术后3 d,患者恢复饮食;术后10 d,患者康复出院。
2 讨论
PJS于1921年由Peutz首先报道,1949年Jeghers再次对该病进行报道并系统总结。1954年Bruwer等把该病正式命名为“Peutz-Jeghers syndrome”,之后越来越多的临床医生开始关注该病。1998年Hemminki等从分子生物水平研究提出,PJS致病基因定位于19号染色体短臂(19p13.3)的丝氨酸/苏氨酸激酶(STK11/LKB1)基因[1]。STK11是调节细胞极性的抑癌基因,在调节细胞周期中起重要作用。PJS患者中50%~80%检测到STK11突变[2]。PJS发病率1/200 000~1/50 000,无种族及性别差异[3]。PJS主要临床特征为皮肤黏膜色素沉着、胃肠道多发性息肉、家族遗传性。
典型的皮肤黏膜色素沉着多集中在口周及口腔黏膜,少数出现于眼周、鼻周、手指及肛周。色素沉着活检表现为表皮、真皮连接处黑色素细胞增多,基底细胞内的黑色素增多,黑色素堆积形成直径1~5 mm的深蓝色至深棕色的色素斑疹,边界不清晰,不隆起于皮肤,压之不褪色,无瘙痒,无疼痛。皮肤黏膜色素沉着在出生时很少出现,大多数孩子会在5岁之前出现,但青春期和成年后可能消失,也有成年以后出现者,多先出现口唇黑斑,数年后才逐渐出现手足及其他部位黑斑。95%的PJS患者会出现色素斑[4],但色素斑无恶变风险。
PJS息肉的出现多晚于色素斑,最常见于小肠,尤其是空肠,其次为结肠、胃和直肠,罕见于肠外,如鼻、呼吸道、胆道、膀胱等。息肉数目在数个至上百个不等,有蒂或无蒂,表面光滑,呈桑椹状、分叶状,有充血、水肿、糜烂、出血等。起初息肉较小,常无明显症状,随着息肉增大,患者临床主要表现为消化道症状,如腹痛、腹泻、便血、继发性贫血、肠套叠、肠梗阻、胆道梗阻(壶腹部息肉)、直肠脱垂等,这些症状通常在20岁之前出现。本研究中患者50多岁才出现腹痛、肠套叠、肠梗阻,消化道症状出现相对较晚,可能与患者息肉生長较慢或体质耐受有关。PJS息肉随年龄增长而逐渐增大,数量逐渐增多。王志青[5]统计的133例PJS患者息肉数量均在10枚以上,多者达数百枚,64%的PJS患者曾经经历过至少
1次外科剖腹手术(1~5次),首次手术的平均年龄为17.29岁(3~68岁),多发息肉或体积较大的息肉引起的小肠套叠或肠梗阻是导致外科手术的主要原因。肠套叠是外科急症,如果不及时治疗,可能导致患者局部肠管坏死或穿孔。本研究中患者入院时剧烈腹痛,腹部CT、腹部彩超均显示肠套叠,故立即全麻行腹腔镜下手术治疗。
PJS是一种常染色体显性遗传病,患者子女有50%患病的概率[6]。本研究中患者父亲有口唇色斑、2个儿子中大儿子有口唇色斑、孙子(患者大儿子之子)有口唇色斑,亦有明显的遗传学特征。
2019版消化系统肿瘤WHO分类中推荐的PJS诊断标准[7]正是根据PJS的3个临床特征制定的。该标准具体内容:(1)组织学上证实存在3个或3个以上的
Peutz-Jeghers(PJ)息肉;(2)具有PJS家族史,出现任何数目的PJ息肉;(3)具有PJS家族史,存在典型、显著的皮肤黏膜色素沉着;(4)存在典型、显著的皮肤黏膜色素沉着,出现任何数目的PJ息肉。本研究中患者存在典型的皮肤黏膜色素沉着,有PJ息肉,有遗传家族史,明确诊断为PJS。
由于PJ息肉大体呈桑椹状、粗糙分叶状,多发,且10%的肠道PJ息肉存在上皮在肠壁各层的异位(假浸润),易与高分化腺癌及黏液腺癌相混淆,极易误诊为PJ息肉恶变。有文献报道,成年人中约有63%的肠套叠与肿瘤相关,其中50%的病例为恶性[8]。本研究中患者54岁出现小肠套叠,故首先考虑小肠肿瘤,且病理切片检查显示存在假浸润,极易误诊为恶性。假浸润与腺癌又有不同之处,PJ息肉细胞缺乏异型性、存在各种正常细胞类型、常出现黏液性囊腔、常伴有含铁血黄素沉积、腺体周围缺乏纤维间质反应等。
尽管PJ息肉与腺癌有不同之处,但PJS患者存在恶性肿瘤易感性,国外报道PJS患者总的癌变率高达20%[9]。随着年龄的增长,PJS患者不仅消化道息肉有恶变潜能,还可伴发生殖系统和其他许多器官的良性或恶性肿瘤,其家族癌症发病率也较普通人群高。与普通人群相比,PJS患者发生恶性肿瘤风险明显增加,PJS患者胃肠道和非胃肠道癌的发生率是一般人群的18倍[10]。袁柏思等[11]报道了207例PJS患者,合并恶性肿瘤发生率为13.8%。HEARLE N[12]等对419例PJS患者肿瘤风险进行评估发现,20岁、30岁、40岁、50岁、60岁、70岁PJS患者恶性肿瘤累积风险分别为2%、5%、17%、31%、60%、85%,50岁以后PJS患者恶性肿瘤发生风险迅速增加。因此,临床工作中遇有面部及手、足等特殊部位黑色素沉着患者时应提高警惕,询问患者有无PJS家族史,必要时建议患者做基因检测、胃肠镜检查及肿瘤标志物检查。
对于黑斑,因目前未见有癌变报道,除非患者有美容需求,一般无需特殊治疗。胃肠道息肉是PJS的病理基础,是引起消化道症状的直接原因,可引起肠套叠、肠梗阻、出血等,甚至发生息肉癌变。因此,对于PJS患者的胃、十二指肠、结直肠息肉,不论大小,均应及早行内镜下息肉切除。小肠息肉以手术治疗为主,辅以内镜下治疗,术中在内镜引导下行息肉切除。随着单(双)气囊电子小肠镜技术不断发展,单(双)气囊电子小肠镜不仅可进行全小肠段的检查,还便于镜下行切除或电凝治疗,已经成为PJS小肠息肉主要治疗手段。虽然PJS息肉首选内镜下治疗,但当出现肠梗阻、肠套叠、消化道出血、癌变等并发症或者息肉较大无法内镜下切除时常需手术治疗。对于PJS患者,应争取早期诊断、全程随访,在肿瘤恶变发生前进行预防性手术或内镜干预,显著减少紧急手术和短肠综合征的发生,改善患者预后,提高患者生活质量。
目前尚无根治PJS,预防息肉出现、增大、增多及恶变的有效干预措施,因此早期的筛查及随访尤为重要。临床对PJS的随访建议如下。(1)无症状的PJS患者,8岁时进行胃肠镜检查,如果在内窥镜检查中发现息肉,则间隔1~3年做1次胃肠镜检查;如果检查是阴性的,建议在18岁时进行常规内窥镜检查。(2)无症状PJS患者从8岁开始进行小肠检查,建议间隔l~3年行磁共振成像(magnetic resonance imaging,MRI)或胶囊内镜检查。(3)女性PJS患者18岁时开始乳房自我检查,25岁开始每6~12个月进行1次临床乳房检查,25~30岁每年进行MRI筛查或乳房超声检查,30~50岁可行乳房X射线、超声或MRI检查,75岁以上应考虑个人管理。(4)女性PJS患者从25岁开始接受妇科检查,包括宫颈涂片细胞学检查、妇科超声等[13]。对于PJS患者的一级亲属,应检测STK11基因是否突变,以便进行筛查和随访。对于有PJS家族史的生育人群,在孕期进行绒毛或羊水取材行STK11基因筛查可以避免患儿出生,这是对PJS最有效的预防方法[14]。
本例提示,对于长期腹痛的患者,应考虑患黑斑息肉综合征的可能,需查皮肤黏膜有无黑斑、查胃肠镜、详问家族史,以确保早期诊治。PJS具有肠套叠、肠梗阻及癌变风险,一旦确诊,应定期进行全消化道息肉筛查,及早处理胃肠道息肉,预防出现并发症,同时预防可能的恶变。基层医生应关注PJS,加强对PJS的认识。
参考文献
[1] 曹强坚,李威.黑斑息肉综合征临床诊治进展[J].现代生物医学进展,2011,11(11):2190-2193.
[2] SIGNORETTI M,BRUNO M J,ZERBONI G,et al.Results of surveillance in individuals at high-risk of pancreatic cancer:a systematic review and metaanalysis[J].United European Gastroenterol J,2018,6(4):489-499.
[3] GIARDIELLO F M,TRIMBATH J D.Peutz-Jeghers syndrome and management recommendations[J].Clin Gastroenterol Hepatol,2006,4(4):408-415.
[4] BEGGS A D,LATCHFORD A R,VASEN H F,et al.Peutz-Jeghers syndrome:a systematic review and recommendations for management[J].Gut,2010,59(7):975-986.
[5] 王志青.中國Peutz-Jeghers综合征患者STK11/LKB1基因突变筛查及PJ息肉蛋白质组学分析[D].广州:南方医科大学,2013.
[6] 李楠,王一平,韩永,等.Peutz-Jeghers综合征家族性发病报告[J].中华消化内镜杂志,2003,20(4):271-272.
[7] WHO Classification of Tumours Editorial Board.WHO classification of tumours:digestive system tumours[M].5th ed.Lyon:IARC Press,2019:545-546.
[8] 周天宇,何亮,穆剑锋,等.成人肠套叠150例诊治分析[J].中华普外科手术学杂志(电子版),2019,13(6):571-574.
[9] GIARDIELLO F M,BRENSINGER J D,TERSMETTE A C,et al.Very high risk of cancer in familial Peutz-Jeghers syndrome[J].
Gastroenterology,2000,119(6):1447-1453.
[10] GIARDIELLO F M,WELSH S B,HAMILTON S R,et al.Increased risk of cancer in the Peutz-Jeghers syndrome[J].N Engl J Med,1987,316(24):1511-1514.
[11] 袁柏思,朱人敏,汪芳裕.我国Peutz-Jeghers综合征患者合并恶性肿瘤的临床分析[J].胃肠病学,2009,14(6):351-354.
[12] HEARLE N,SCHUMACHER V,MENKO F H,et al.Frequency and spectrum of cancers in the Peutz-Jeghers syndrome[J].Clin Cancer Res,2006,12(10):3209-3215.
[13] WAGNER A,ARETZ S,AURANEN A,et al.The management of Peutz-Jeghers syndrome:European Hereditary Tumour Group(EHTG)guideline[J].J Clin Med,2021,10(3):473.
[14] 杨治宇,吴庆华,信艳萍,等.黑斑息肉综合征一例基因分析及临床诊治[J].郑州大学学报(医学版),2018,53(2):261-264.
(编辑:徐亚丽)

