板栗花抑制植物病原真菌成分提取及活性研究
靳长迎 谢巧玲 彭飞,2,4 王秀平 杨越冬,2,4,*
(1河北省天然产物活性成分与功能重点实验室,河北 秦皇岛 066004;2板栗产业技术教育部工程研究中心,河北 秦皇岛 066004;3河北科技师范学院分析测试中心,河北 秦皇岛 066004;4河北省板栗产业协同创新中心,河北 秦皇岛 066004)
在板栗(Castaneamollissima)工业生产过程中,通常会产生大量副产品,如花、栗蓬、叶子和壳[1]。对这些废弃物进行开发,将其转化为有价值的生物资源,既能获得经济效益、生态效益和社会效益,又能促进板栗产业的良性发展[2]。其中,板栗花具有抗炎[3]、抗氧化[4]、抗肿瘤[5]、抗疲劳[6]、抗菌[7]等多种生理活性,酚类、黄酮类[8]化合物作为其主要活性成分,具有潜在的研究价值。
植物病原真菌所引起的植物病害,如小麦赤霉病[9]、油菜菌核病[10]以及黄瓜枯萎病[11]等会导致作物产量和质量降低。化学杀菌剂是控制植物病害的主要手段,但长期、大量使用单一杀菌剂会导致环境污染及病原物抗药性的产生[12]。开发新型植物源天然抗菌剂是解决这些问题的有效手段,有研究表明,欧洲栗(Castaneasativa)水提液对哈维弧菌(Vibrioharvey)、损伤弧菌(V.damage)、轮状弧菌(Vibriorotunda)、苏云金芽孢杆菌(Bacillusthuringiensis)具有抑菌效果[13]。板栗花中富含黄酮类化合物,且大部分为水溶性和醇溶性[14],作为板栗废弃物的一种,板栗花产量巨大且具有可观的开发利用价值。以往研究大都集中在板栗花中黄酮类物质的提取研究上,且提取过程较繁琐,未见对板栗花中抑菌活性成分提取工艺优化的研究。
本研究采取乙醇水溶液提取板栗花中的活性成分,结合单因素-响应面法对板栗花活性成分进行提取工艺优化,并对板栗花各相萃取物进行活性成分含量测定,比较其抑菌活性,得到活性最强的组分,旨在为作物病害防治、植物源抗菌剂开发提供参考。
1 材料与方法
1.1 材料与试剂
新鲜板栗雄花采自河北省秦皇岛市抚宁区大新寨镇柳树沟村板栗示范园,所有材料均于2021年6月收获。样品洗净,室外晒干,打粉过40目筛备用;小麦赤霉病菌(Fusariumgraminearum,FG)由华中农业大学微生物资源发掘与利用全国重点实验室(湖北省武汉市)提供,油菜菌核病菌(Sclerotiniasclerotiorum,SS)由中国农业科学院油料作物研究所(湖北省武汉市)提供,黄瓜枯萎病菌(Fusariumoxysporum.sp.cucumebriumOwen,FO)由海南省农业科学院农业环境与植物保护研究所提供,以上真菌于4 ℃马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)上储存;二甲基亚砜(dimethyl sulfoxide,DMSO),购自上海埃彼化学试剂有限公司;无水乙醇(分析纯),购自上海泰坦化学有限公司。
1.2 主要仪器与设备
HH-4数显恒温水浴锅,江苏金坛市荣华仪器制造有限公司;3-18KS冷冻离心机,德国SIGMA公司;EYELAN-1100旋转蒸发仪,日本东京理化公司;Alpha 2-4 LD plus冷冻干燥机,德国CHRIST公司。
1.3 试验方法
1.3.1 板栗花活性成分的提取 精确称取板栗花粉末10.00 g,以15∶1 mL·g-1的液料比加入50%(V/V)体积分数乙醇水溶液,在60 ℃水浴下提取60 min,重复提取两次,提取液在8 000 r·min-1下离心5 min,抽滤,减压浓缩,真空冷冻干燥12 h,得到板栗花粗提物。
1.3.2 板栗花提取物对3种真菌的抑菌活性 将真菌菌饼接种到含有不同浓度板栗花提取物的PDA上,使得每个培养皿中板栗花样品最终浓度为0.50、1.00、2.00、4.00、8.00 mg·mL-1。每个处理设4个培养皿作为重复,试验重复3次。以含有200 μg·mL-1农药吡唑醚菌酯的PDA作为阳性对照;含有1% (V/V)DMSO的PDA作为溶剂对照。在(28±1)℃培养3~5 d后,观察到真菌菌丝在PDA表面扩散生长,此时测量菌丝生长平均直径的减少,根据公式(1)计算板栗花活性成分对FG、SS、FO的菌丝生长抑制率:
式中,dc为空白组菌丝生长平均直径(cm);dt为处理组菌丝生长平均直径(cm)。
1.3.3 单因素试验 称取10.00 g板栗花样品,利用单因素试验考察不同乙醇体积分数[0%、10%、30%、50%、70%、90%(V/V)]、提取时间(20、40、60、80、100 min)、提取温度(40、50、60、70、80 ℃)、液料比(10∶1、15∶1、20∶1、25∶1、30∶1 mL·g-1)对板栗花活性成分抑菌活性的影响。菌丝生长抑制率按公式(1)计算。
1.3.4 Box-Behnken响应面设计 根据单因素试验结果,以乙醇体积分数(A)、提取时间(B)、提取温度(C)、液料比(D)为考察因素,以菌丝生长抑制率为响应值,采用Box-Behnken设计法进行响应面试验设计,用Design Expert 8.0.6进行数据分析,进一步优化板栗花活性成分提取工艺条件。
1.3.5 板栗花提取物萃取分离 在最佳提取工艺下进行提取,得到板栗花提取物总膏200 g,用蒸馏水溶解,依次用石油醚、乙酸乙酯、正丁醇萃取2 d,得到水相、石油醚相、乙酸乙酯相和正丁醇相萃取物。
1.3.6 板栗花各相萃取物总酚和总黄酮含量测定总酚含量根据福林酚法[15]测定。精确称取1.00 mg没食子酸(gallic acid,GA)加入无水乙醇中,配成100 μg·mL-1的没食子酸储备液。分别取5、10、15、20、25、30 μL没食子酸储备液于96孔板中,用去离子水定容至120 μL,加入0.5 mol·L-1的福林酚试剂 20 μL,放置10 min,加入60 μL的Na2CO3水溶液(100 g·L-1),20 ℃避光放置2 h。使用酶标仪在765 nm处测定溶液的吸光度值。绘制没食子酸的标准曲线,样品的多酚含量按公式(2)计算,结果以没食子酸质量的平均值(mg GA·g-1)表示:
式中,W为每克干重提取物的没食子酸质量(mg GA·g-1);c为没食子酸质量浓度(μg·mL-1);V为原料液的体积(mL);M为取样量(g);N为稀释倍数。
总黄酮含量用NaNO2-Al(NO3)3法[16]测定。首先,精确称取1.00 mg芦丁(rutin),配制质量浓度为0.20 mg·mL-1的芦丁标准溶液,向容量瓶中分别加入0.00、1.00、2.00、3.00、4.00、5.00 mL芦丁标准溶液,加入蒸馏水定容至5.00 mL,再加入0.30 mL质量分数为5%的NaNO2水溶液,静置6 min。加入0.30 mL质量分数为5%的Al(NO3)3水溶液,混匀,室温静置6 min。加入4.40 mL质量分数为5%的NaOH溶液,混匀放置12 min。取200 μL混合液至96孔板中,使用酶标仪在510 nm处测定溶液的吸光度值。绘制芦丁的标准曲线,样品的黄酮含量按公式(3)计算,结果以每克干重提取物的芦丁质量的平均值(mg rutin·g-1)表示:
式中,W为每克干重提取物的芦丁质量(mg rutin·g-1);c为芦丁质量浓度(g·L-1);V为原料液的体积(mL);M为取样量(g);N为稀释倍数。
1.3.7 板栗花各相萃取物的抑菌活性比较 采用菌丝生长速率法,将真菌菌饼接种到含有不同浓度板栗花萃取物的PDA上,使得各相萃取物的最终浓度都为1.00、2.00、3.00、4.00、5.00 mg·mL-1。后续操作同1.3.2。计算板栗花各相萃取物的菌丝生长抑制率。
1.4 数据分析
使用Data Processing System 7.05软件进行数据分析,得到抑制中浓度值(50% effective concentration,EC50)。采用方差分析检验组间差异。
2 结果与分析
2.1 板栗花提取物对3种真菌的抑菌活性
板栗花提取物对FG、SS、FO菌丝生长抑制率的结果见表1。在高浓度下,FG、SS、FO菌丝生长均受到抑制,板栗花提取物浓度为0.50~8.00 mg·mL-1,对FO的菌丝生长抑制率为0.77%~22.56%,在0.50~4.00 mg·mL-1各相邻两个浓度之间不显著;对SS的菌丝生长抑制率为1.83%~48.83%,0.50与1.00 mg·mL-1之间不显著;对FG的菌丝生长抑制率为18.54%~62.68%,各浓度处理间均差异显著。上述结果表明,相对于FO、SS,板栗花提取物对FG具有更好的抑菌活性。

表1 板栗花提取物对FG、SS、FO的菌丝生长抑制率Table 1 Inhibition rate of mycelium growth of FG,SS and FO from chestnut flower extract/%
板栗花提取物对FG、SS、FO菌丝生长的毒力回归方程见表2。提取物对FG、SS、FO的抑制中浓度(EC50)分别为4.88、7.65、27.48 mg·mL-1。导致这些差异的原因,可能是浸提的有机溶剂不同导致提取的有效抑菌成分不同,或是不同菌种对药物的敏感基线不同。

表2 板栗花提取物对FG、SS、FO菌丝生长的毒力回归方程Table 2 Toxicity regression equation of chestnut flower extract on mycelium growth of FG,SS and FO
综上可知,在以上3种真菌中,板栗花活性成分对FG的菌丝生长抑制效果最优,抑制中浓度值最小,因此选取FG作为后续试验菌株。
2.2 单因素试验结果
2.2.1 乙醇体积分数对板栗花提取物抑菌活性的影响 由图1-A可知,板栗花活性成分对FG的菌丝生长抑制率随乙醇体积分数的增加呈先增加后降低趋势。当乙醇体积分数为50%时,抑制率达到最大值(39.76%)。根据试验结果,选取乙醇体积分数为30%、50%、70%三个条件进行响应面试验设计。

图1 不同条件对菌丝生长抑制率的影响Fig.1 Effects of different conditions on the growth inhibition rate of mycelium
2.2.2 提取时间对板栗花提取物抑菌活性的影响 由图1-B可知,板栗花活性成分对FG的菌丝生长抑制率随提取时间的增加呈先增加后降低趋势。当提取时间为60 min时,抑制率达到最大值(42.75%)。根据试验结果,选取提取时间为40、60、80 min三个条件进行响应面试验设计。
2.2.3 提取温度对板栗花提取物抑菌活性的影响 由图1-C可知,板栗花活性成分对FG的菌丝生长抑制率随提取温度的增加呈先迅速增大后又迅速降低的趋势。当提取温度由40 ℃升高到50 ℃过程中,抑制率由15.61%迅速升高至36.59%;当提取温度为60 ℃时,抑制率达到最大值(40.24%)。根据试验结果,选取提取温度为50、60、70 ℃三个条件进行响应面试验设计。
2.2.4 液料比对板栗花提取物抑菌活性的影响 由图1-D可知,板栗花活性成分对FG的菌丝生长抑制率随液料比的增大呈先迅速增大后缓速下降的趋势。当液料比为15∶1 mL·g-1时,抑制率达到最大值(40.00%)。根据试验结果,选取液料比为10∶1、15∶1、20∶1 mL·g-1三个条件进行响应面试验设计。
2.3 响应面试验结果
2.3.1 响应面试验设计 采用Design-Expert 8.0.6软件对表3的数据进行试验设计,试验设计方案与结果见表4。

表3 响应面试验因素及水平设计Table 3 Experimental factors and level design of response surface

表4 响应面试验设计方案与结果Table 4 Design and results of response surface experiment
根据表4数据进行拟合,得到各个影响因素对响应值的二次多项回归方程关系(公式4):
回归方程中的系数大小代表各因素对响应值的影响能力。由表5可知,二次多项式拟合模型F值为46.03(P<0.000 1),说明模型整体具有显著性;失拟项不显著(P=0.277 6)(P>0.05),即在试验范围内模型与数据的拟合度较好,说明方差分析具有统计学意义。决定系数R2为0.978 7,说明该模型可以解释97.87%的响应值变化;调整决定系数(R2adj)为0.957 5,预测决定系数(R2pred)为0.891 3,说明该模型预测性良好且拟合度较好,可对板栗花提取物抑菌率进行分析和预测。其中,各因素对板栗花提取物生物活性的影响大小为A(乙醇体积分数)>D(液料比)>C(提取温度)>B(提取时间)。
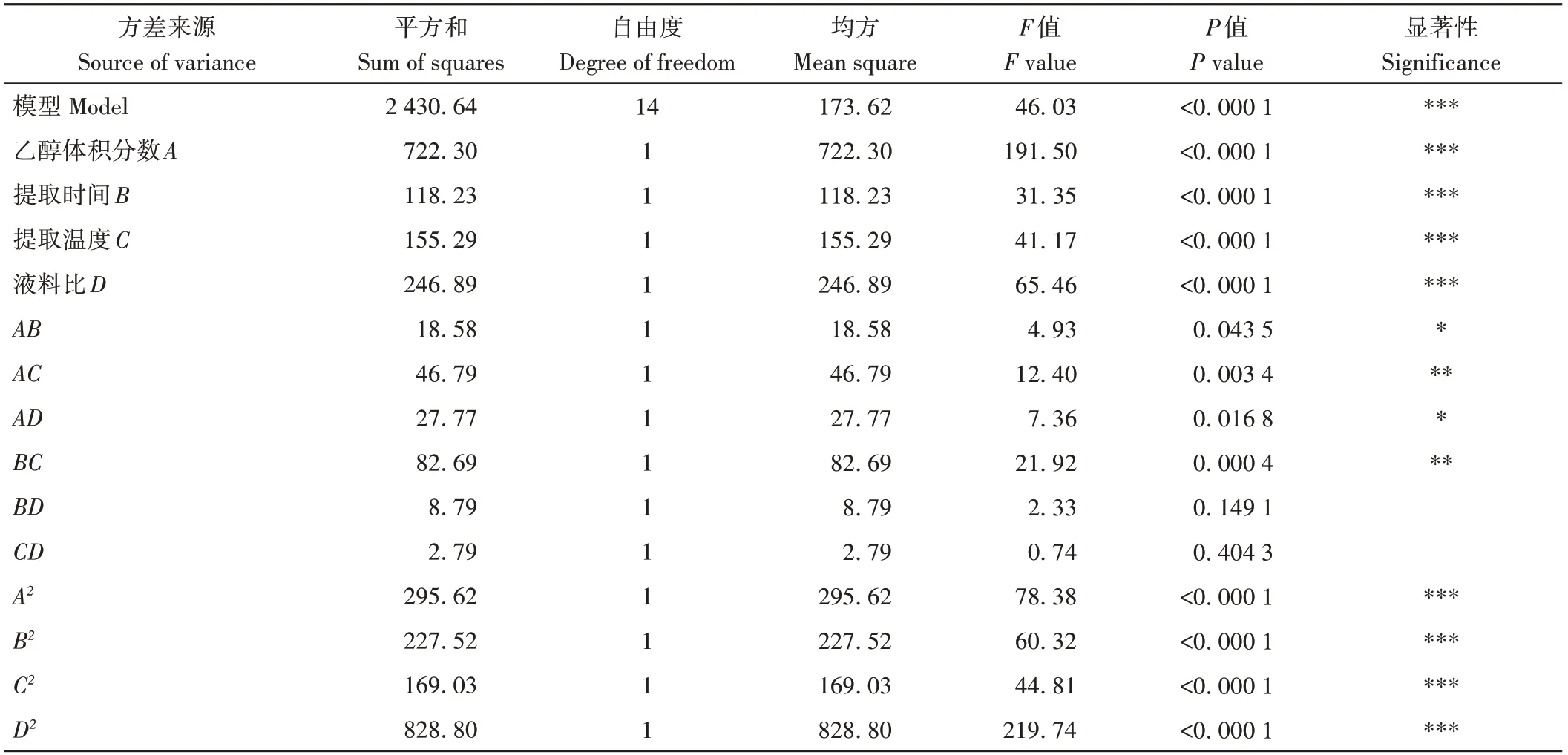
表5 方差分析Table 5 Variance analysis
2.3.2 响应面交互作用分析 响应面试验中,四因素交互作用对板栗花提取物生物活性的影响见图2。图中等高线形状的椭圆化程度与两因素交互作用的显著程度呈正相关,椭圆化程度越大,说明交互作用越显著。图2-A~F的响应面图均为开口向下的凸形曲线,说明响应值存在极高值,表现在等高线的圆心处。等高线中心均位于-1~1水平,表明因素AB(乙醇体积分数-提取时间)、AC(乙醇体积分数-提取温度)、AD(乙醇体积分数-液料比)、BC(提取时间-提取温度)、BD(提取时间-液料比)、CD(提取温度-液料比)交互作用以抑菌活性为提取最优条件在所涉及因素范围内。
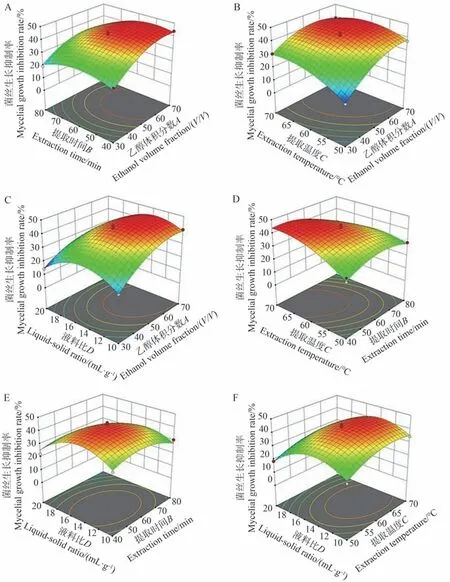
图2 3D响应面分析Fig.2 3D response surface analysis
2.3.3 最佳提取条件的确定及验证 采用Design-Expert软件分析预测的板栗花抑菌活性成分最佳提取条件为乙醇体积分数56.77%(V/V)、提取时间52.78 min、提取温度64.95 ℃、液料比12.49∶1 mL·g-1,该条件下的菌丝生长抑制率达到46.05%。为方便试验操作条件取近似整数值,即乙醇体积分数55.00%(V/V),提取时间50.00 min,提取温度65.00 ℃,液料比15.00∶1 mL·g-1。在此条件下进行验证,平行3次得到实际菌丝生长抑制率为45.27%,达到预测值的98.31%,说明该参数可靠,具有可信度。
2.4 板栗花各相萃取物中总黄酮、总多酚含量
由1.3.5方法得到板栗花各相萃取物,其中得率为石油醚相0.63%、乙酸乙酯相6.88%、正丁醇相23.26%、水相56.13%。
参考1.3.6方法,经Origin 2022软件分析,得到没食子酸标准曲线方程(公式5):
芦丁标准曲线方程(公式6):
依据酶标仪ABS值计算得到板栗花各相萃取物总黄酮、总多酚含量。由表6可知,在各相萃取物中,乙酸乙酯相总酚和总黄酮含量最高,分别为47.71 mg GA·g-1、121.93 mg rutin·g-1;总膏与水相总酚、总黄酮含量接近,分别为30.19、23.71 mg GA·g-1和42.38、38.45 mg rutin·g-1;石油醚相的总酚、总黄酮含量最低,分别为2.43 mg GA·g-1、5.83 mg rutin·g-1。

表6 板栗花各相萃取物总黄酮、总多酚含量Table 6 Content of total flavonoids and total polyphenols of various phase extracts from chestnut flower
2.5 板栗花各相萃取物抑菌活性比较
对板栗花各相萃取物进行菌丝生长速率试验,筛选出抑菌效果最优的组分,考虑试验用量问题,排除提取得率以及活性物含量过低的石油醚相,对总膏、乙酸乙酯相、正丁醇相、水相进行试验。如图3所示,各相萃取物在浓度为1.00~5.00 mg·mL-1时对FG菌丝生长均有抑制作用,且表现出浓度依赖性。当乙酸乙酯相浓度为3.00 mg·mL-1时,对FG菌丝生长表现出较好的抑制效果,但当乙酸乙酯相浓度达到5.00 mg·mL-1时,菌丝形状受到破坏,此时菌丝直径相较于浓度为3.00 mg·mL-1时并未继续减小。此外,通过Data Processing System 7.05软件计算各相萃取物的抑制中浓度值(EC50),如表7所示。各相萃取物之间抑菌活性由高到低依次为乙酸乙酯相>水相>总膏>正丁醇相,在95%置信区间下,其EC50分别为2.51、4.88、5.54、15.67 mg·mL-1。结合表6可知,板栗花各相萃取物的总黄酮含量越高,其对FG菌丝生长的抑制效果越好。

图3 板栗花各相萃取物菌丝生长抑制试验Fig.3 Mycelium growth inhibition experiment of various phase extracts from chestnut flower

表7 板栗花各相萃取物EC50Table 7 EC50 values of extracts of various phases from chestnut flower
3 讨论
在实验室研究或工业生产中,优化提取工艺可以提高提取物的有效成分含量及活性、减少操作成本。本研究考察了溶剂乙醇体积分数、提取时间、提取温度及液料比对提取物抑菌活性的影响。结果发现,当乙醇体积分数小于50%时,提取物抑菌率较低,可能是板栗花提取物的抑菌活性成分还未完全溶出,之后随乙醇体积分数增加而逐渐下降,可能由于一些醇溶性非活性物质含量增大[17],从而影响了整体抑菌活性[18]。选择合适的提取时间既可以解决时间成本,又能保证大部分活性成分被溶出。当提取时间为60 min时,提取物中有效抑菌成分占比最高,之后随提取时间增加而逐渐下降,主要是由于提取时间会影响溶剂与抗真菌物质的接触与溶解,时间过短或过长都会影响有效成分含量[19]。提取温度直接影响提取物的有效成分及活性,当提取温度由40 ℃升高到50 ℃过程中,抑制率迅速升高,代表板栗花活性物质被大量溶出,之后随提取温度增加而快速下降,温度过高会使得部分物质发生化学反应或分解而失去活性甚至发生变性导致有效成分含量降低[20],部分黄酮类化合物在高温条件下会分解[21]。因此,提取温度为60 ℃时板栗花提取物的抑菌有效成分含量最大。适合的液料比加快了活性成分物质的溶出,之后溶出量随液料比增加而逐渐下降,可能是由于液料比增大使板栗花成分充分溶出,导致抑菌有效成分占比减小,且在工业上可避免因液料比过高而存在不易浓缩、溶剂消耗量大的问题[22]。
不同植物提取物抗真菌活性的差异,可归因于这些植物提取物中活性成分含量大小。本研究以乙醇水溶液为溶剂提取板栗花中的抑菌活性成分,但其提取物中除去活性成分外,还含有大量的糖类、蛋白质等杂质。以乙酸乙酯作萃取剂,由于乙酸乙酯本身具有的高溶解性和非极性,可有效分离出总膏中的非极性成分,如多酚以及总黄酮类物质,且这些物质的生物活性会得到保留,因此乙酸乙酯相萃取物具有含量最多的活性成分以及最高的菌丝生长抑制率。刘婷等[23]在研究广金钱草不同极性部位时,指出乙酸乙酯中含有较多的多酚和黄酮成分,且在抗菌作用上表现出最好的抑菌活性;韦坚芬等[24]在研究草珊瑚内生真菌抗植物病原真菌时表明,抗菌活性物质存在于乙酸乙酯萃取物中,且分离鉴定出一种活性化合物。此外,活性物质是植物抑菌活性的主要来源,在抑制细胞生长的各个方面发挥着不同的作用。如Siregar等[25]发现白草根的类黄酮成分会干扰细胞壁或细菌细胞膜的通透性,使细胞活体活动受限,从而导致其生长受到抑制甚至死亡;Amin等[26]发现,在可食用包衣液添入极少量的百里酚可显著抑制圆霉菌丝的生长和孢子的萌发;Chatrath等[27]从柠檬草中得到的柠檬醛可在较低浓度下抑制念珠菌生物膜的形成,增加活性氧簇(reactive oxygen species,ROS)的产生,导致DNA受损并破坏修复机制。本研究中乙酸乙酯相萃取物在高浓度时对菌体生长形状具有明显的破坏,推测乙酸乙酯相萃取物可能通过破坏菌丝细胞壁,抑制菌丝生长代谢等方式抑制菌丝生长。
乙酸乙酯相萃取物具有复杂的成分,因此对真菌生长抑制起决定作用的并非是活性成分的浓度。虽然板栗花乙酸乙酯相萃取物对小麦赤霉病菌有良好的菌丝生长抑制活性,但当浓度大于等于3.00 mg·mL-1时,其抑制率不再明显增加,可能是FG产生了耐药性或乙酸乙酯相萃取物本身含有的大量复杂物质间产生了拮抗作用。Badr等[28]通过研究柑橘副产物粗提物与两种单体化合物反式阿魏酸和橙皮苷的抑菌作用,证明反式阿魏酸和橙皮苷具有一定的拮抗作用。因此,为了探究乙酸乙酯相萃取物对FG在高浓度下菌丝生长抑制率不再显著增加的原因,在以后的研究中有必要对乙酸乙酯相萃取物的生化成分进行分析,探索更高效的抑菌活性成分,对这些化合物之间是否具有协同或拮抗作用进行探索,并在作用机理方面进行深入研究,为防治植物真菌病害,保护作物安全提供理论基础。
4 结论
本研究比较了板栗花提取物对3种植物病原真菌FG、SS、FO的抑制活性,选择小麦赤霉病菌(FG)为试验菌种,板栗花提取物对其菌丝生长抑制的EC50为4.88 mg·mL-1。以菌丝生长抑制率为指标对板栗花抑菌活性成分的提取工艺进行了优化,在最佳条件下提取物中活性成分抑菌率达到了45.27%,达到理论值的98.31%,具有可信度,其中乙醇体积分数对结果影响最大。板栗花提取物经过萃取分相后,乙酸乙酯相总酚、总黄酮含量最高,因此具有较好的抑菌活性。可见,板栗花提取物具有较好的植物真菌抑菌活性,是一种具有潜在价值的天然抗菌剂。

