小麦黄花叶病抗性研究及育种应用进展
范德佳 王汝琴 何震天 张容 王建华 韩燕 陈士强
(江苏里下河地区农业科学研究所,江苏 扬州 225007)
小麦黄花叶病是一种在世界各地广泛发生的土传病毒病,可导致小麦产量大幅度降低,其中中国有约200万公顷冬小麦的生产受到小麦黄花叶病的威胁。该病害在我国最早发现于四川省雅安市,目前已扩展至长江中下游以及淮河流域,在山东、河南、江苏、安徽、湖北、陕西等地相继发生[1-3]。其症状与非生物胁迫(营养缺乏、霜冻或涝渍等)导致的老叶褪绿不同,黄化斑点在小麦幼苗的新生叶上即可表现出来。一般而言,受感染小麦植株在营养生长期新生叶呈现黄色,在拔节期生长发育迟缓或成熟延迟,最终导致产量下降,病害严重时小麦加工和烘焙品质也会大幅降低。我国的小麦黄花叶病主要由小麦黄花叶病毒(wheat yellow mosaic virus,WYMV)和中国小麦花叶病毒(Chinese wheat mosaic virus,CWMV)侵染导致,WYMV在中国和日本均有分布,而CWMV仅分布在中国的山东、河南、河北、江苏等地[1]。为解决小麦黄花叶病造成的小麦减产、品质下降等问题,国内外研究人员从小麦黄花叶病的病原学、发病规律、抗源筛选、抗性遗传和抗病育种等方面进行了大量研究。本文将重点介绍WYMV及其抗性遗传相关研究进展,并对抗性基因在小麦抗病育种中的应用进行展望。
1 小麦黄花叶病毒(WYMV)
1.1 结构特征
WYMV属于马铃薯Y病毒科(Potyviridae)大麦黄花叶病毒属(Bymovirus),和同属的小麦梭条花叶病毒(wheat spindle streak mosaic virus,WSSMV)在发病症状、传毒特性、粒子形态、外壳蛋白、基因序列等方面非常相似。最开始我国的小麦黄花叶病被认为是由WSSMV引起的,但是RNA序列分析表明中国和日本的小麦黄花叶病是由WYMV引起,两者是不同的物种。WYMV是一种由外壳蛋白包裹RNA组成的丝状粒子,其基因组为2条正义单链RNA(图1),其中RNA1长约7.3 kb,编码8个非结构蛋白和1个外壳蛋白,即P3、PIPO(pretty interestingPotyviridaeORF)、7K、细胞质内含体(cytoplasmic inclusion,CI)、14K、基因组连接蛋白(viral protein genome-linked,VPg)、细胞核内含体A-蛋白酶(nuclear inclusion protein A-proteinase,NIa-Pro)、细胞核内含体B(nuclear inclusion protein B,NIb)和C端的外壳蛋白(coat protein,CP);RNA2约为3.5 kb,编码病毒蛋白P1和P2[4]。病毒RNA在5'端与VPg蛋白相连,3'端有一个poly(A)尾,与真核生物中成熟mRNA类似,有助于RNA在宿主细胞中复制[5]。
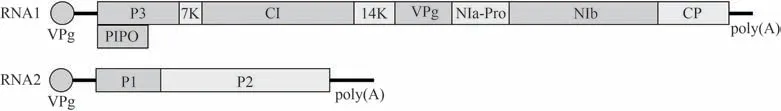
图1 小麦黄花叶病毒(WYMV)的基因组结构Fig.1 Genomic organization of wheat yellow mosaic virus (WYMV)
1.2 宿主及其分布
WYMV的宿主主要是小麦属(Triticum),也能够侵染山羊草属(Aegilops)和少数大麦属(Hordeum)物种[6]。由于其复制依赖宿主真核翻译起始因子4E(eukaryotic translation initiation factor 4E,eIF4E)和病毒VPg之间的相互作用,所以eIF4E-VPg交互模块是宿主特异性的一个决定因素。例如,WYMV在大麦原生质体中不能复制,因此不侵染大麦,而在表达了小麦eIF4E后却能够复制;同样,将大麦黄花叶病毒(barley yellow mosaic virus,BaYMV)的VPg替换成WYMV的VPg,也导致BaYMV病毒不能在大麦原生质体中复制[7]。此外,病毒RNA2编码的P1蛋白是植株系统感染所必需的,WYMV与BaYMV的P1蛋白只有60%的相似性,可能也是宿主特异性的决定因素之一[8]。
WYMV主要分布于中国和日本。Sun等[2]分析了中国五个省的11个不同地点的小麦植株上的WYMV蛋白CP(297个序列)和VPg(87个序列)的核苷酸序列,发现所有序列之间存在密切的系统发育关系,不同族群的聚类与其来源地高度一致,表明WYMV种群遗传结构与起源地密切相关。Ohki等[9]根据小麦品种是否被系统侵染,将来自日本各地的14种WYMV分离株划分为致病型Ⅰ、Ⅱ或Ⅲ,进一步分析发现不同分离株的RNA1和RNA2编码的氨基酸序列均存在差异,三种致病型分布于日本不同地区。上述对于该病毒致病型和分布差异的分析有利于宏观掌握小麦黄花叶病的发生规律和流行特点,并针对性地采取有效防控措施。
1.3 传播特性
大麦黄花叶病毒属病毒可从禾谷多黏菌(Polymyxa graminis)的游动孢子转移到幼苗根细胞,表明该类病毒以禾谷多黏菌为介体通过土壤传播。禾谷多黏菌分布于世界各地,主要在谷类作物及其野生近缘种的根部繁殖,产生可移动的初级和次级游动孢子、休眠厚垣孢子。目前已知大麦黄花叶病毒属(Bymovirus)、真菌传杆状病毒属(Furovirus)和花生丛簇病毒属(Pecluvirus)的14种土传植物病毒以禾谷多黏菌为传播载体[10]。禾谷多黏菌传播病毒的能力受到土壤水分和温度的影响,土壤水分对游动孢子到达宿主根部至关重要。而病毒从根部感染部位移动到叶片需要低于20 ℃的温度。当平均温度超过20 ℃时,病害症状会在受感染的叶子上停止发展;但在适宜条件下,在新叶上会重新出现症状。由此可见,该病毒一旦发生就会对受侵染的田地构成持久的威胁。另外,此类病毒经常与其他病毒同时感染宿主,如WYMV与中国小麦花叶病毒(Chinese wheat mosaic virus,CWMV)混合侵染且后具有协同作用[11]。目前通过特异性逆转录重组酶聚合酶扩增技术(reverse transcription-recombinase polymerase amplification,RT-RPA)或高通量测序的方法可有效鉴定病毒种类[12-13],为病害的精准防治提供参考依据。
1.4 病毒的复制与扩散
病毒在宿主中的完整生命周期涉及多个生物过程,由于RNA病毒只编码少数蛋白质,成功的病毒感染取决于病毒和宿主之间复杂的相互作用网络。首先,病毒需要招募一系列宿主蛋白来完成复杂感染周期中的所有步骤,包括病毒颗粒分解、病毒翻译、病毒复制复合体(viral replication complex,VRC)的形成、病毒粒子组装、细胞间移动和长距离运输。
病毒复制与细胞质中病毒诱导的细胞内膜结构形成相关,植物细胞被感染后会产生由内质网(endoplasmic reticulum,ER)聚集形成的膜状体(membranous body,MB),成为病毒复制复合体进行组装的支架[14]。利用免疫电镜观察WYMV侵染的细胞发现,病毒蛋白P1、P2及P3是膜状体的重要组成部分,而且P2能够重新排列ER并形成大的聚合结构,与其他病毒蛋白互作并将它们招募到聚合体中[15]。由于病毒基因组较小且编码能力有限,病毒需要借助宿主因子来合成自身成分。在真核生物中,宿主蛋白eIF4E与mRNA的5'-末端m7G帽子结构结合,形成蛋白质翻译起始复合物[16]。而马铃薯Y病毒科病毒的VPg与病毒RNA的5'-末端连接,模拟m7G帽子结构与eIF4E互作结合,以促进病毒蛋白的翻译起始。在体外试验中,WYMV中RNA1的5'-UTR有一个独特的内部核糖体进入位点(internal ribosome entry site,IRES)可以调节病毒翻译水平,而3'-UTR的多聚腺苷酸化可抑制病毒基因组RNA互补链的合成[17-18]。此外,病毒外壳蛋白除了精确组装病毒颗粒外,还协助WYMV的VPg获得适当的构象以进行核质穿梭,促进病毒RNA的翻译[19]。
一般情况下,病毒可以通过胞间连丝移动到相邻细胞,导致系统性感染。马铃薯Y病毒科病毒的VPg除了参与复制外,还与宿主中一种富含半胱氨酸的蛋白质,即马铃薯Y病毒属VPg互作蛋白(PotyvirusVPg-interacting protein,PVIP)相互作用,促进病毒在细胞间的移动[20]。WYMV的细胞质内含体CI蛋白也被证明介导了病毒的细胞间或长距离运动,而且CI导致了致病型Ⅰ和Ⅱ的致病性差异[21]。WYMV的P3NPIPO是一种致病性决定簇,通过转录滑移在保守的G2A6位点表达[22]。由于P3N-PIPO对马铃薯Y病毒的胞间移动非常重要,推测该蛋白可能参与WYMV的细胞间扩散[23]。WYMV的7K和14K蛋白都含有一个中心疏水跨膜结构域,可能参与病毒复制囊泡的形成、内质网输出及细胞间移动[1]。
另外,WYMV的外壳蛋白与小麦热休克蛋白家族蛋白TaHSP23.6发生相互作用,影响WYMV的感染[24]。病毒NIb蛋白与宿主光诱导蛋白(light induced protein,LIP)相互作用通过扰乱小麦中的脱落酸途径促进其感染[25]。WYMV还可以通过m6A甲基化破坏免疫相关基因的表达,从而抑制宿主的抗病毒反应[26]。总之,WYMV和宿主相互作用的研究还很缺乏,需要继续深入研究,以期为小麦黄花叶病抗性育种提供理论支撑。
2 小麦黄花叶病的抗性遗传
2.1 抗病种质资源筛选
我国较早开展了小麦黄花叶病抗源的筛选,鉴定和创制出许多抗性资源。如何震天等[27]选育出的扬辐麦9311对小麦黄花叶病免疫。李鹏等[3]育成了高抗小麦黄花叶病的小麦品种鲁原502。阮义理等[28]、周益军等[29]采用田间自然诱发鉴定出免疫材料52份、高抗材料41份,包括仪宁小麦、西风等。孙炳剑等[30]在河南省主要推广品种中筛选到对小麦黄花叶病免疫的品种新麦208。魏玮等[31]从国内外收集了527个小麦品种(系),经WYMV病圃鉴定,发现有10个品种(系)的抗性相对比较稳定,并以抗病和感病品种为亲本筛选出具有多态性的SSR标记。吴斌等[32]对山东80个小麦生产品种进行了WYMV抗性评价,发现济麦22等15个品种达“抗”级。刘迪等[33]在河南省漯河市两个重病田块对146个小麦品种(系)进行了抗性鉴定,检测到存麦16号等免疫品种(系)12个,周麦26等高抗品种(系)37个。Fouchard等[34]鉴定了158份法国品种在SBWMV和WYMV复合侵染条件下的抗性,三分之一的品种表现抗病性,其中仅1%表现WYMV感病症状。此外,研究发现高抗品种(系)多为广谱抗性品种,如侯庆树等[35]在9个病区毒源接种地发现宁丰小麦、西风、苏麦3号等品种(系)高抗所有毒源;岳绪国等[36]研究表明西风、仪宁小麦、RF-1等品种对6种毒源均表现高抗。上述研究发现的抗病种质资源为小麦黄花叶病的抗性研究及抗病品种选育奠定了基础。
2.2 抗性基因的挖掘
在小麦染色体2A、2DL、3BS、4D、5AL、6DS、7BS上共鉴定到14个小麦黄花叶病抗性基因或数量性状位点(quantitative trait locus,QTL)(表1)。小麦2D染色体长臂上具有一个抗性基因热点区域,包含来自中国小麦种质扬辐麦9311的YmYF[37]和仪宁小麦的QYm.nau-2D[38],来自欧洲种质Ibis的Ym1b[39],来自美国种质Madsen的Qym1[40]和YmMD[41]以及来自日本种质Yumechikara的Q.Ymym[42]等。其中,QYm.nau-2D在杂交育种中由于重组而以六种不同的状态存在,序列分析表明该片段来源于山羊草属(Aegilops)N基因组的渗入[43]。然而,染色体2DL上这些基因之间的等位性还不清楚,也没有研究进行分离和归类,以上有待后续研究。

表1 已鉴定出的抗小麦黄花叶病基因及数量性状位点Table 1 Identified resistance genes and QTLs against WYMV
小麦其他染色体上也有抗病位点分布,如在染色体2A上有YmNM[44],3BS上有Qym2[40]和QYm.njau-3B.1[45],4D上有Wss1(来源于簇毛麦)[46]和Qym3[40],5AL上有QYm.njau-5A.1[45],6DS上有Qym4[47],7BS上有QYm.njau-7B.1[45]。
2.3 抗性基因的克隆和验证
Ym2是首个图位克隆的显性抗WYMV基因,编码一种CC-NBS-LRR蛋白,位于小麦3BS染色体上主效QTL区域(Qym2),来源于小麦的近缘物种——沙融山羊草(Aegilopssharonensis)[48]。Ym2可以限制WYMV在根中的积累,通过回交方法将该基因转入感病小麦品种可增强其抗病性,提高发病麦区小麦产量,具有重要的应用价值。TaPDIL5-1基因是小麦中首个被证实的抗病毒基因,该基因是大麦HvPDIL5-1的同源基因,编码一种蛋白二硫键异构酶,利用CRISPR/Cas9同时敲除小麦A、B、D亚基因组上TaPDIL5-1的3个拷贝可显著增强小麦黄花叶病抗性,而不影响株高、穗数、千粒重等农艺性状,具有主要的育种利用价值[49]。同时敲除小麦eIF4E基因的3个拷贝,也可赋予小麦对黄花叶病的完全抗病性,表明TaeIF4E作为感病因子基因参与WYMV感染[50]。TaVTC2同样对WYMV侵染具有正调控作用,NIb与TaVTC2的互作抑制了TaVTC2的酶活性从而触发植物免疫反应,过表达TaVTC2显著增加了WYMV在小麦植株中的积累;而利用RNAi技术敲除TaVTC2可抑制WYMV的侵染,此外,敲除植株对CWMV和大麦条纹花叶病毒(BSMV)以及白粉病菌也表现出较好的抗性[51]。上述基因中,Ym2已广泛应用于抗WYMV小麦种质创制及品种选育,TaPDIL5-1、TaeIF4E、TaVTC2是基因编辑技术创制抗病种质的可用靶标,具有很大的潜在应用价值。
2.4 抗病毒机制研究
RNA沉默是植物中重要的先天抗病毒防御机制,具有高效性、快速性和特异性。外源基因整合到宿主细胞产生的双链RNA(double-Standed RNA,dsRNA)会被核糖核酸内切酶Dicer切割生成小干扰RNA(small interfering RNA,siRNA),siRNA与宿主AGO蛋白结合形成RNA诱导沉默复合物(RNA induced silencing complex,RISC),RISC可以靶向病毒RNA导致其降解或翻译停滞[52]。植物中病毒感染会导致细胞内病毒衍生小干扰RNA(virus-derived small interfering RNA,vsiRNA)积累,vsiRNA可靶向病毒RNA使其特异性降解。利用RNA干扰技术使病毒基因沉默可赋予植株对病毒的持久抗性,如WYMVNIb8基因反义序列的小麦转基因株系N12-1对小麦黄花叶病的抗性增强[53];转CP蛋白基因的转基因株系P8-T2对WYMV表现高抗[54]。WYMVNIb基因衍生的vsiRNA不仅可以通过诱导RNA沉默来抑制植物中的病毒感染,还可以靶向小麦基因TaAAED1以降解其转录产物,从而抑制活性氧(reactive oxygen species,ROS)清除,激活植物免疫[55]。小麦植株不同部位WYMV vsiRNA谱显示叶和根中vsiRNA在病毒基因组中的分布不同,而且来自根的vsiRNA在5'末端的A/U偏好性较低,表明针对WYMV的RNA沉默在根和叶之间的作用模式是不同的[56]。然而,病毒也已经进化出各种策略来对抗植物的病毒防御反应,WYMV可能调节DCL4的表达以减少vsiRNA的生物发生,从而促进病毒感染[57];WYMV P1蛋白可发挥RNA沉默抑制活性,促进病毒在小麦植株中的感染[58]。
在抗性小麦品种中,土传病毒在根部和茎叶之间的运动被阻止或延缓[59]。Haufler等[60]利用免疫吸附电子显微镜观察抗病品种的抗性反应发现病毒只存在植株根部,表明抗性品种可抑制病毒复制和扩散。目前在小麦中已鉴定出一些调节病毒转运的抗性基因,如Wss1[61]可以阻止WSSMV从根到分蘖的移动。抗病品种Madsen(含有Qym1、Qym2)的抗性在根部起作用,可以阻止人工接种的病毒从叶部进入根部[48,62],已克隆的Ym2基因在小麦根中发挥功能,抑制病毒的积累[48]。但目前尚无分子证据表明宿主因子参与WYMV或WSSMV病毒的细胞间或长距离移动。根系土壤微生物群落可以刺激植物激素的合成,与病原菌竞争营养物质,从而对植物的抗病性产生显著影响[63-64]。与感WYMV的品种相比,抗WYMV的小麦品种在土壤中可检测到更高的微生物多样性和更稳定的群落结构。WYMV抗性品种在其根际土壤中大量招募许多已知的有益细菌和真菌类群,包括黄单胞菌目、放线菌目、鞘氨醇单胞菌属等,而敏感品种根际土壤中具有更多的潜在病原体[65]。由此可见,构建良好的根际微生物群落可提高植物对土传病害的抗性。
此外,植物抗病机制与转录组和蛋白组的调控相关。Zhang等[26]通过m6A-seq发现抗性相关基因的转录后修饰(N6-甲基腺苷甲基化)在小麦对WYMV的抗性中发挥重要作用,沉默甲基转移酶基因(Triticum aestivumm6A methyltransferase B,TaMTB)可以显著降低宿主植物中的WYMV积累。小麦组蛋白乙酰转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)的表达在受到大麦条纹花叶病毒(barley stripe mosaic virus,BSMV)、中国小麦花叶病毒(CWMV)和小麦黄花叶病毒(WYMV)等侵染后表达量显著增加,表明两者在抗性调控中发挥着一定作用[66-67]。WYMV感染后,小麦一些泛素特异性蛋白酶(ubiquitin-specific protease,UBP)家族基因表达发生显著变化,这些基因可以响应水杨酸(salicylic acid,SA)信号,参与小麦对病毒的防御反应[68]。WYMV NIb通过干扰脱落酸(abscisic acid,ABA)信号通路促进病毒感染,表明ABA信号途径在小麦抗WYMV反应中发挥重要作用[25]。miR168是植物中最丰富和高度保守的miRNA之一,它可以直接调节AGO1的表达[69]。Wu等[70]在未感病小麦和WYMV感染的小麦之间鉴定出了131个差异表达的miRNA,对应的85个靶基因涉及植物激素信号转导和单环菌素生物合成。糖基化是一种重要的蛋白质翻译后修饰,涉及蛋白质的折叠、稳定性和酶活性,在植物的抗病反应中也发挥重要作用,如小麦几丁质触发子受体激酶(Triticumaestivumchitin elicitor receptor kinase,TaCERK)的过度表达减少了WYMV的积累,TaCERK的N-糖基化可以调节小麦对WYMV的抗性[71]。目前利用多组学技术挖掘抗性基因、探索抗性调控机制已成为常规方法,随着人们对病原体与植物互作机制的深入了解,小麦抗病育种进程将不断加快。
3 小麦黄花叶病的防治
3.1 综合防治策略
禾谷多黏菌是WYMV等多种病毒的传播媒介,通过栽培管理抑制真菌繁殖可有效防治病毒侵染和传播。目前主要的防治措施有:(1)轮作倒茬:通过与非寄主作物油菜、马铃薯等蔬菜轮作,能够改变禾谷多黏菌的生活条件,达到减少病原菌、减轻病害的目的;(2)选用抗病品种:能经济有效地预防病害的发生;(3)加强田间管理:前茬收获后及时深耕灭茬,避免病菌通过带病残体、病土、农事机具等途径传播,适时迟播以避开禾谷多黏菌的最适侵染时期;(4)农药处理:种子播前消毒、包衣,对于发病田块用杀菌剂进行土壤消毒(图2)。
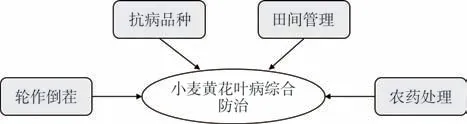
图2 小麦黄花叶病的综合防治策略Fig.2 Strategies for the control of wheat yellow mosaic disease
3.2 抗病品种的推广与应用
目前,一批高抗小麦黄花叶病、丰产性好的小麦品种已成功选育并推广应用。如江苏省农业科学院以抗病品种西风为父本育成了宁麦9号,后续又育成宁麦13、宁麦17、宁麦26等抗病品种。江苏太湖地区农业科学研究所以西风为母本,采用系谱法育成了抗病的苏麦5号,后续又育成抗病品种苏麦6号。江苏省大华种业集团有限公司以苏麦6号为亲本选育出抗病品种华麦6号。江苏丘陵地区镇江农业科学研究所育成了抗WYMV的镇麦5号、镇麦9号、镇麦12、镇麦15等。江苏里下河地区农业科学研究所利用抗病品种宁麦9号选育出超高产抗病品种扬辐麦4号,以其为亲本育成扬辐麦6号、扬辐麦8号、扬辐麦9号等品种;以免疫种质扬辐麦9311育成抗病高产品种扬辐麦5号、扬辐麦7号、扬辐麦8167等一系列新品种(系)。其中,宁麦13连续多年为江苏省淮南麦区第一大品种,扬辐麦4号连续多年为江苏省主推品种、“江苏好品种”。这些品种在江苏省小麦黄花叶病发病区的推广应用,对控制病害流行、挽回产量损失起到了十分重要的作用。
3.3 利用现代生物技术进行抗病种质创制及抗病品种选育
小麦对WYMV的遗传抗性受多种因素的影响,开发和利用分子标记准确筛选WYMV抗性育种材料具有重要意义。如南京农业大学开发的11个QYm.nau-2D诊断标记为小麦WYMV抗性的改良提供了重要参考[43];最近日本学者利用与Madsen的Qym1和Qym2连锁的分子标记育成了一个新的小麦育种系Kitami-94[72]。另外,近年来基因编辑技术在小麦的抗病育种中的应用备受关注,同时编辑小麦A、B、D亚基因组上TaPDIL5-1基因的3个拷贝和eIF4E的3个拷贝,都可赋予小麦对WYMV的抗性[49-50]。由此可见,通过基因编辑技术可以创制具有抗病性的小麦材料,为小麦的抗病毒病育种提供新思路。
4 总结与展望
近年来,小麦黄花叶病的抗性育种取得了许多进展,筛选出了一批高抗甚至免疫的种质资源,育成了一批抗病小麦品种(系),在小麦遗传改良和生产应用方面发挥了重要作用。而且随着小麦基因组测序完成、基因组功能的深入解析,小麦育种技术得到了快速发展。
目前,在小麦黄花叶病毒的抗病机理、抗性基因的挖掘与利用等方面需要进一步深入研究:
(1)病毒-宿主间互作机理研究。植物抗病性的可持续利用需要更深入地阐明病毒与宿主间的互作机制。虽然WYMV等大麦花叶病毒属病毒的结构和基因组研究已较为充分,但病毒侵染小麦的分子基础仍然不明,充分利用基因组学、蛋白组学等方法,可加快分子机制的解析。
(2)抗病资源筛选。目前育成品种的抗源遗传基础较狭窄,利用野生品种或近缘物种挖掘新的抗病基因资源已成为当务之急。因此,必须加强新抗源筛选,并结合现代分子育种技术高效培育小麦抗病新品种。
(3)数据库建设和分子育种。一个整合小麦基因组功能和全基因组多态性标记的信息平台,可以帮助人们更好地利用有育种价值的基因。通过表型筛选和标记辅助选择相结合,育种家可以在更短的时间内培育出新的抗性小麦品种。
(4)基因编辑。基于CRISPR/Cas系统的基因编辑技术是目前最热门的新兴生物技术,许多研究团队已利用CRISPR/Cas9成功编辑小麦的基因组,实现了小麦的抗病性改良。基因编辑技术可进行基因的敲除、表观修饰、碱基编辑等多种基因修饰,在作物抗病性的遗传改良中具有非常大的应用潜力。

