斑点叉尾鮰ZBTB38的原核表达、多克隆抗体制备及应用
张世勇 刘洪岩 钟立强 赵彦华 王明华 陈校辉 ,
(1江苏省淡水水产研究所,江苏 南京 210017;2江苏省农业种质资源保护与利用平台,江苏 南京 210014)
ZBTB38(又被称为CIBZ、ZNF921或PPP1R171)属于ZBTB蛋白家族(zinc finger and BTB domain-containing protein family),是分子量最大、结构最复杂的蛋白之一,其N端具有1个BTB结构域(Broad-Complex,Tramtrack and Bric a brac domain)(约115 个氨基酸),C 端一般具有5~10 个锌指结构域(zinc finger domain)。该蛋白家族C 端的锌指结构分为两种类型,即C2H2 型和C2HC型,识别固定的顺式作用元件或与DNA 甲基化位点结合[1],N 端的BTB 结构域一般介导同源或异源蛋白形成二聚体或多聚体,改变染色质构象,从而起到调控基因转录的目的[2]。ZBTB 蛋白家族中部分成员已证实在精子发生[3]、性别决定[4]、神经和器官发育[5]、肿瘤发生[6]等多种生物学过程中发挥重要作用。
斑点叉尾鮰(Ictaluruspunctatus)是我国特色淡水鱼类的重要组成部分。自1984 年从美国引入我国后,先后突破苗种繁育、养殖技术、质量安全控制与产品加工等技术难关,形成了完整的产业链条,备受烤鱼市场和预制菜行业的青睐。自“十三五”以来,斑点叉尾鮰产业的发展持续向好,是我国目前最为热门的淡水鱼养殖品种之一,随着其养殖面积和总产量不断增加,2022 年全国总产量已突破40 万吨[7],养殖规模和产量实现了对美国的全面反超[8],促使我国成为斑点叉尾鮰的主产国和主消费国。
关于斑点叉尾鮰性别决定机制,目前普遍认为其为雄性异配子型(XX/XY)[9],且不存在异形性染色体[10]。迄今,国内外学者对斑点叉尾鮰性别决定基因以及性染色体鉴定已做过较多的研究。Bao 等[10]通过对YY 型和XX 型斑点叉尾鮰的基因组序列进行比较研究,证实性别决定座位遗传距离小于0.5 cM,物理距离为8.9 Mb,但X 和Y 染色体上并未发现与哺乳动物Y染色体性别决定区基因(sex-determining region of Ychromosome,SRY)和鸟类double-sex 和mab-3 相关转录因子(double-sex and mab-3 related transcription factor,DMRT)类似的性别特异基因。在之前的研究中,江苏省淡水水产研究所斑点叉尾鮰课题组(本课题组)从斑点叉尾鮰性染色体上的zbtb38基因的编码区鉴定到13 个性别连锁单核苷酸多态性(single nucleotide polymorphisms,SNPs)标记,其中6 个替换分别导致X和Y 染色体上zbtb38基因氨基酸编码发生改变[11],推测其为斑点叉尾鮰重要的性别决定候选基因。
由于多克隆抗体具有多个抗原识别表位,能够与特异性抗原紧密结合,在研究基因功能过程中发挥了重要的作用。目前,ZBTB38蛋白的商业多克隆抗体主要应用于人(Homosapiens)、小鼠(Musmusculus)等哺乳动物[12],而在鱼类中缺乏特异性高、稳定性强的该蛋白抗体,因此在鱼类中开展ZBTB38 蛋白多克隆抗体制备研究,对于进一步探究该基因的功能具有重要的意义。ZBTB38蛋白是一类分子量较大的蛋白(超过150 kDa),过大的分子量在原核生物中一般难以被诱导表达,或表达效率降低,且更容易形成包涵体[13]。为解决这一问题,通常的做法是利用较大蛋白的部分保守序列制备多克隆抗体,如人谷氨酰胺果糖6 磷酸氨基转移酶1(GFPT1)[14]、鲤鱼SLC15A1[15]、环形泰勒虫DnaJ[16]等蛋白多克隆抗体均是通过该策略制备而成。在本研究中,将zbtb38基因部分序列经密码子优化后连接至pET32a(+)载体以构建重组质粒pET32a(+)-zbtb38,利用原核表达系统诱导表达融合蛋白,免疫新西兰白兔制备高效价兔源多克隆抗体,并使用该抗体利用免疫印迹(Western blot)技术检测ZBTB38 蛋白在斑点叉尾鮰性腺组织中的表达水平,旨在为进一步在蛋白水平研究斑点叉尾鮰zbtb38基因的功能建立基础。
1 材料与方法
1.1 试验材料
EscherichiacoliDH5α、E.coliBL21(DE3)、中分子质量蛋白标记(Marker)(14.4~94 kDa),购自北京天根生化科技有限公司;山羊抗兔-辣根过氧化物酶(horseradish peroxidase,HRP)二抗、质粒pET32a(+),购自南京钟鼎生物公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、异丙基硫代半乳糖苷(Isopropyl β-D-Thiogalactoside,IPTG)、丙烯酰胺-甲叉双丙烯酰胺(acrylamide-bisacrylamide,Acr-Bis)、三羟甲基氨基甲烷[Tris(hydroxymethyl)aminoethane,Tris]、弗氏佐剂,购自美国Sigma公司;透析袋和0.22 μm无菌滤器,购自美国Millipore 公司;四甲基乙二胺,购自美国伯乐公司;Ni-NTA琼脂糖亲和填料,购自德国QIAGEN公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒,购自江苏碧云天生物技术研究院;RNA提取试剂盒、DNase I、PrimeScriptTMRT 试剂盒、SYBR®PrimeScript®Plus RT-PCR 试剂盒,购自大连TaKaRa 公司;新西兰实验兔由江苏省农业科学院提供;斑点叉尾鮰试验鱼为本课题组培育。
1.2 试验仪器
Allegra 21R台式高速冷冻离心机(美国BECKMAN);Centrifuge 5810 R 台式高速离心机(德国Eppendorf);320-S pH计(美国Mettler Toledo);AR5120电子天平(美国AHOΜS);MultiTemp Ⅲ恒温水浴锅(美国Amersham Pharmacia);SIM-F140AY65 雪花状制冰机(日本SANYO);SW-CJ-1FD 超净工作台(中国苏净);龙ETC-811 PCR 仪(中国东胜);CFX96 荧光定量PCR 仪器;Mini-PROTEAN Tetra Cell 电泳仪(美国Bio-Rad);Wellwash 4 MK2洗板机、Model 705超声波细胞破碎仪、Q Exactive 质谱仪、Dionex Ultimate 3000 RSLCnano 液相色谱、Multiskan FC酶标仪(美国Thermo)等。
1.3 pET32a(+)-zbtb38重组表达载体的构建
由于原核生物蛋白表达具有密码子偏好性,在构建斑点叉尾鮰zbtb38基因原核表达载体前,利用MaxCodonTMOptimization Program(v13)软件将其开放阅读框(open reading frame,ORF)前1 239 bp序列优化为适于原核表达的基因序列,且翻译的蛋白序列不变,利用SMART软件(http://smart.embl-heidelberg.de/)分析并绘制ZBTB38蛋白结构域示意图。密码子优化的总原则为用宿主细胞中使用频率高的同义密码子替换外源mRNA序列中的密码子,保证外源mRNA序列中的密码子和宿主细胞的密码子使用偏向性更加契合,避免出现稀有密码子,同时规避目标限制性内切酶位点。使用Clustal Omega多序列比对软件(https://www.ebi.ac.uk/Tools/msa/clustalo/)比较优化前后zbtb38基因序列。直接合成优化后的基因序列,在两端添加含有NdeⅠ和XhoⅠ酶切位点序列,并在基因序列3′端添加6× Histag 序列,基因合成委托南京金斯瑞公司完成,1%琼脂糖凝胶电泳检测基因序列大小。用NdeI和XhoⅠ限制性内切酶对pET-32a(+)质粒和合成的基因序列进行双酶切,之后将zbtb38基因连接到pET-32a(+)载体中。将pET32a(+)-zbtb38 原核表达载体转化至大肠杆菌DH5α中,并进行PCR菌落鉴定和测序验证。
1.4 重组ZBTB38蛋白诱导表达与纯化
将测序正确的重组表达载体转化至E.coliBL21(DE3)中,菌落PCR 鉴定阳性菌落后,取含重组质粒的菌液50 μL,接种至溶菌肉汤(lysogeny broth,LB)培养基中(含卡那霉素),在37 ℃、200 r·min-1条件下培养4 h 后,用0.2 mmol·L-1IPTG 在16 ℃、200 r·min-1条件下过夜诱导融合蛋白表达。收集诱导表达后的菌体,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)鉴定成功表达后,对菌体进行超声破碎;4 ℃、12 000 r·min-1条件下离心30 min 后收集沉淀,使用12% SDS-PAGE鉴定,考马斯亮蓝染色。
利用低压层析系统,上清溶液以0.5 mL·min-1流速上样至Ni-IDA-Sepharose Cl-6B亲和层析柱(上样前层析柱经Ni-IDA Binding-Buffer 预平衡),以0.5 mL·min-1流速冲洗,直至流出液的280 nm 吸光值(OD280)到达基线。然后用Ni-IDA Washing-Buffer 以1 mL·min-1流速冲洗,至流出液的OD280值到达基线。再用Ni-IDA Elution-Buffer 以1 mL·min-1流速洗脱目的蛋白,收集流出液。收集上述蛋白流出液加入透析袋中,并用磷酸缓冲盐溶液(phosphate buffer saline,PBS)缓冲液透析过夜,最后使用12% SDS-PAGE鉴定目的蛋白。
1.5 重组ZBTB38蛋白鉴定
采用三种方法对纯化后的重组蛋白进行鉴定:(1)以0.5 mg·mL-1牛血清白蛋白(bovine serum albumin,BSA)作为蛋白质标准品,使用12% SDS-PAGE 鉴定纯化后的ZBTB38 蛋白;(2)使用Western blot 方法,以Anti-His Tag抗体检测带有His标签的重组ZBTB38蛋白,从而实现对重组蛋白的敏感检测;(3)使用液相色谱-质谱联用(liquid chromatograph-mass spectrometer,LCMS)精准鉴定重组ZBTB38 蛋白,具体过程为重组蛋白切胶回收后经水洗、脱色、脱水、烷基化、水洗、脱水等系列步骤后,用胰蛋白酶酶切重组ZBTB38 蛋白,进一步超声破碎后并提取肽段,肽段用样品溶解液(0.1%甲酸、2%乙腈)溶解,用冷冻离心机在4 ℃、13 200 r·min-1条件下离心20 min,取上清液利用LCMS 技术进行进一步鉴定。使用MM File Conversion软件处理质谱原始下机文件,然后用MASCOT 软件(http://www.matrixscience.com/)在uniprot 数据库中进行检索。肽段在质谱仪中离子化后,会带上一定量的电荷,通过检测器分析,可得到各肽段的质荷比(m/z),从而得知各肽段的相对分子质量。
1.6 重组ZBTB38蛋白多克隆抗体的制备及鉴定
已纯化的重组ZBTB38蛋白进行二喹啉甲酸(BCA)浓度测定后,与等量的完全弗氏佐剂混合,充分乳化后,进行兔源多克隆抗体制备。分3 次免疫,14~21 d免疫1 次,每次400 μg 皮下免疫。第3 次免疫后,于第7 天采血,并根据间接酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)方法确定抗血清针对斑点叉尾鮰ZBTB38 蛋白的效价,当抗血清效价大于1∶50 000时采血制备最终抗血清。制备成抗原亲和纯化层析柱:ZBTB38 重组蛋白与琼脂糖介质偶联,将上述抗血清与PBS溶液等量混合后缓慢上样;用甘氨酸洗脱缓冲液洗脱层析柱,收集洗脱液。在PBS溶液中4 ℃过夜透析层析柱,隔日检测抗体的纯度、浓度以及效价。
采用BCA 浓度测定试剂盒测定抗体浓度;使用12% SDS-PAGE电泳后进行考马斯亮蓝染色,以鉴定抗体纯度。通过间接ELISA 检测纯化抗体的效价,操作过程参见文献[17]。将相应稀释度的稀释液在450 nm吸光值/阴性吸光值>2.1定为抗体的效价。
1.7 性腺组织ZBTB38蛋白和基因表达检测
分别取斑点叉尾鮰精巢和卵巢组织各0.5 g,用RIPA 裂解液提取总蛋白,经BCA 法测定蛋白浓度后,加入上样缓冲液后煮沸5 min,14 000 r·min-1离心5 min,取上清液进行Western blot检测,使用H3组蛋白作为内参[18]。
分别取斑点叉尾鮰精巢和卵巢组织50 mg,使用RNA 提取试剂盒提取总RNA;使用DNase I 去除基因组DNA,并检测RNA 浓度和质量。使用PrimeScriptTMRT reagent Kit 将肝脏中提取的总RNA 进行反转录获得cDNA。通过Primer 5.0软件设计实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)引物,以αtubulin基因作为内参基因[19],引物序列如表1所示。使用SYBR®PrimeScript®Plus RT-PCR 试剂盒进行qRTPCR。根据2-ΔΔCT法分析数据,定量数据以“平均值±标准差”表示,利用t检验进行基因表达差异性分析。
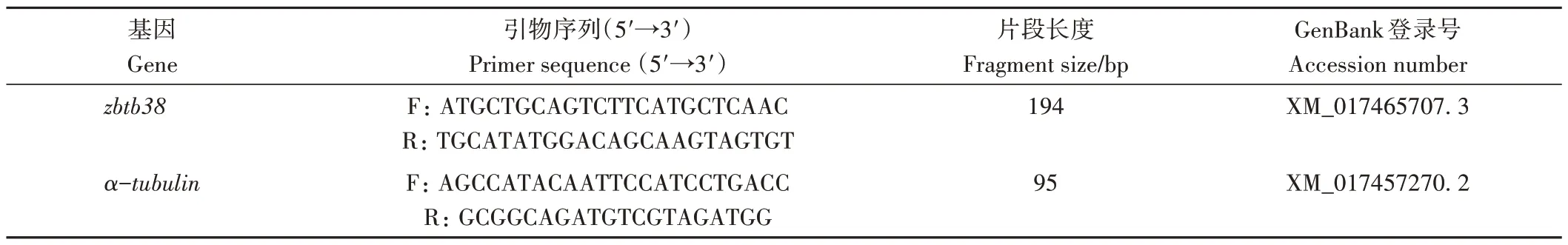
表1 qRT-PCR反应检测基因表达所用的引物信息Table 1 The primers for qRT-PCR used in this study
2 结果与分析
2.1 原核表达载体的鉴定
斑点叉尾鮰zbtb38基因ORF 前1 239 bp 序列编码的蛋白序列包含BTB结构域、2个锌指结构(图1-A),优化后的zbtb38基因序列与原序列的比对情况如图1-B所示。其中,236个密码子的1个碱基发生改变(第1位11 个、第3 位225 个),19 个密码子的两个碱基发生改变(第1 和第2 位9 个、第1 和第3 位10 个),27 个密码子的3 个碱基均发生改变。人工合成优化后的斑点叉尾鮰zbtb38基因片段,并与pET32a(+)载体一同进行NdeⅠ和XhoⅠ限制性内切酶双酶切,酶切过后的载体与目的基因形成重组质粒。重组质粒经菌落PCR和测序验证,测序结果与设计的序列一致,说明重组载体pET32a(+)-zbtb38 质粒构建成功,两种序列的部分测序峰图如图1-C所示。
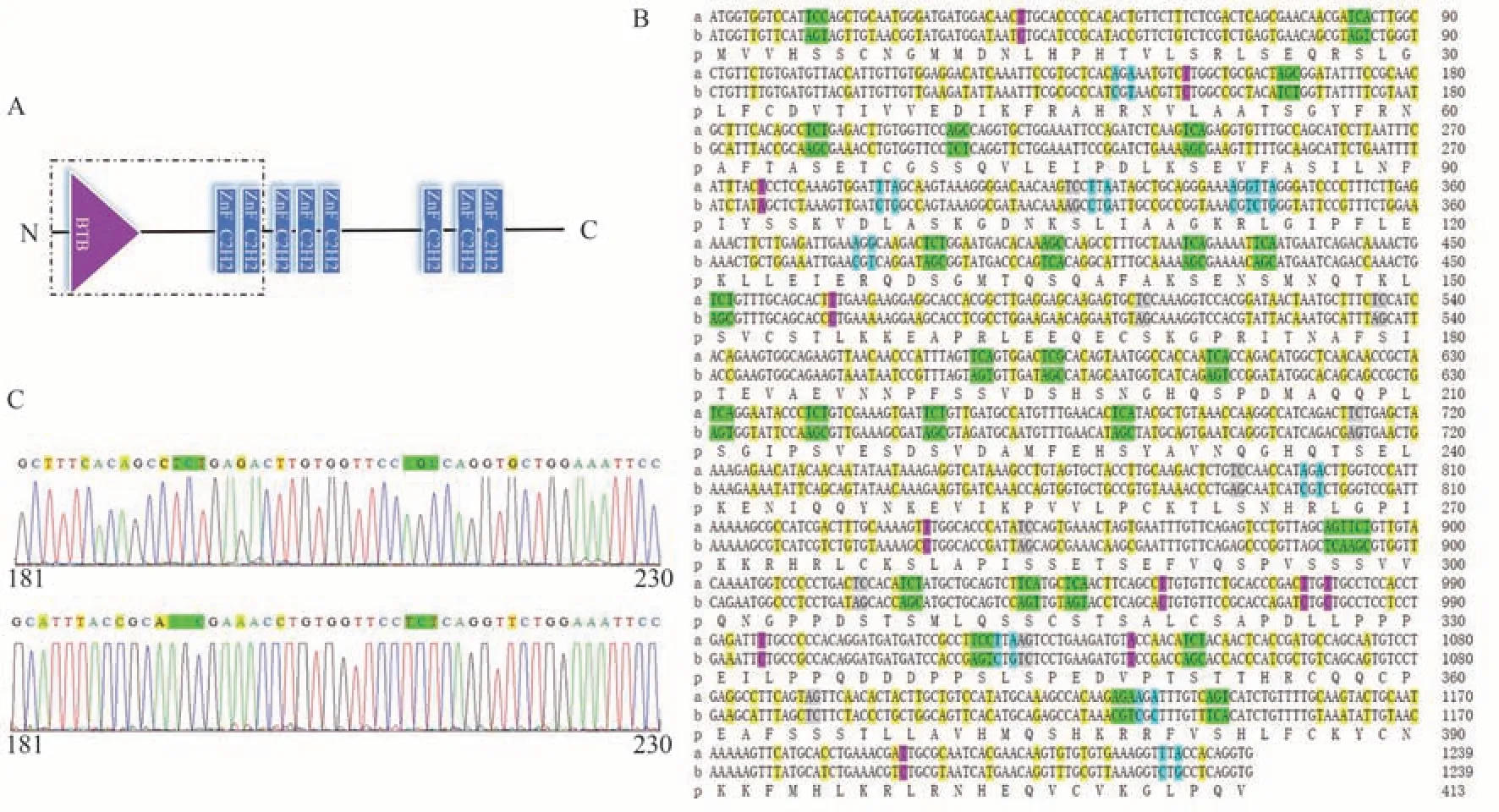
图1 斑点叉尾鮰zbtb38基因及蛋白序列Fig.1 zbtb38 gene and protein sequence of channel catfish
2.2 重组蛋白的表达与纯化
将测序正确的pET32a(+)-zbtb38 重组表达载体转化至E.coliBL21(DE3)表达菌株中,以空载体pET32a(DE3)作为对照。SDS-PAGE 结果显示相对于未经IPTG 诱导的E.coliBL21(DE3)大肠杆菌,经过IPTG 诱导后,在45 kDa 上方出现特异性目的条带(图2-A),但目的蛋白比预测的分子量(46.34 kDa)略大,可能是蛋白表达后进行了翻译后修饰或蛋白质折叠。大批量诱导后的E.coliBL21(DE3)大肠杆菌经过高压破碎和纯化,得到了特异的单一条带(图2-B),表明成功表达出重组ZBTB38蛋白。
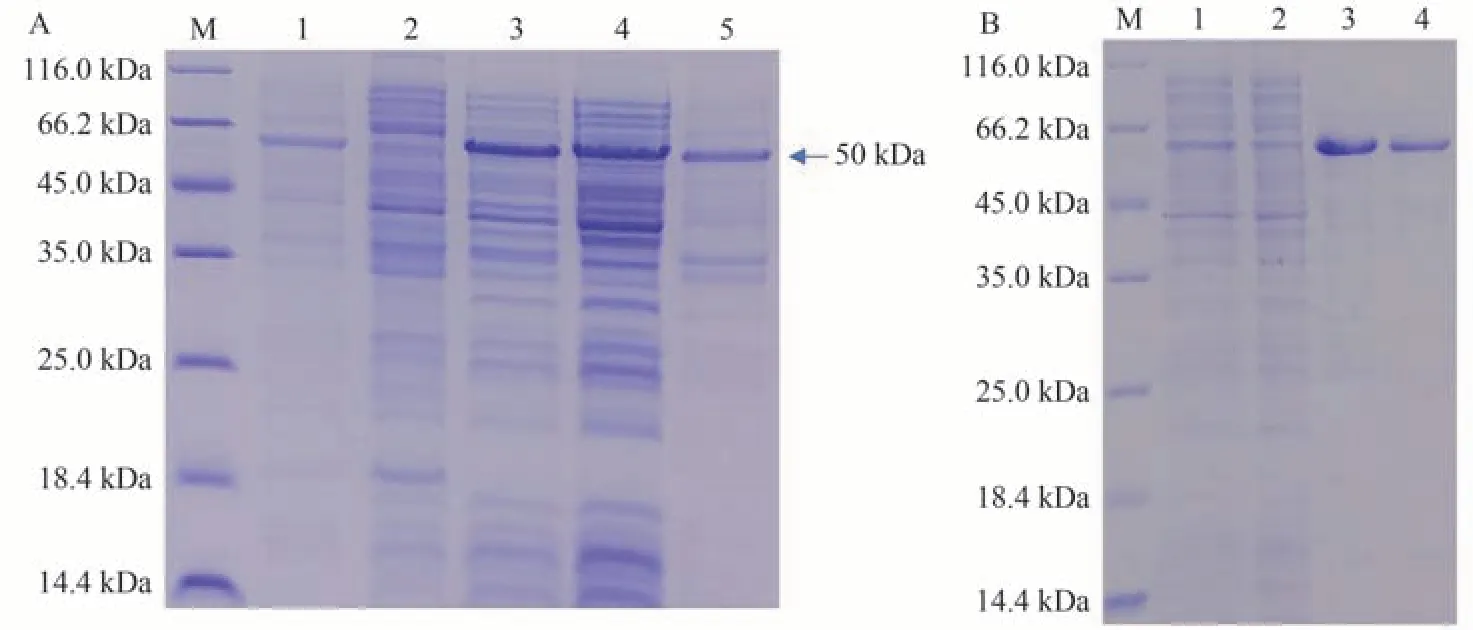
图2 重组蛋白表达与纯化的SDS-PAGE分析Fig.2 SDS-PAGE analysis of expressed and purified recombinant ZBTB38 protein
2.3 重组蛋白的鉴定
根据SDS-PAGE(图3-A)和Western blot(图3-B)鉴定结果进一步证明了重组ZBTB38 蛋白分子量比理论分子量偏大,故采用LC-MS 进行进一步鉴定。检索软件根据肽段二级质谱信息与数据库比对,结合匹配度打分及错配过滤,得到肽段的确切序列,进而拼接出蛋白的完整序列。经液相质谱检测,重组ZBTB38 蛋白序列与预期一致。
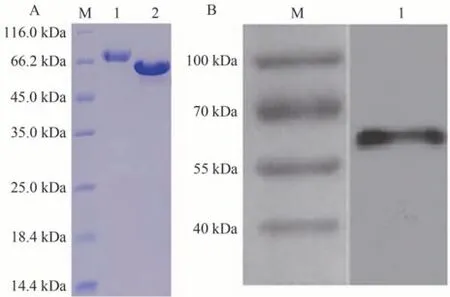
图3 重组蛋白质检分析Fig.3 Quality control of recombinant ZBTB38 protein
2.4 重组ZBTB38蛋白多克隆抗体鉴定
第3 次加强免疫后,采集兔血清,间接ELISA 检测检测血清中特异性抗体的效价,当样品吸光值/阴性吸光值>2.1 即认为是阳性。结果发现,所得血清效价可达1∶512 000(图4-A)。已纯化的抗体进行SDS-PAGE电泳和考马斯亮蓝染色,可见兔抗斑点叉尾鮰ZBTB38蛋白多克隆抗体重链为55 kDa(图4-B),纯度在85%以上。BCA 法测得抗体浓度为0.42 mg·mL-1,抗体得率达到5.04 mg。表明以斑点叉尾鮰重组ZBTB38 蛋白为免疫原,制备出了高效价的特异性多克隆抗体。
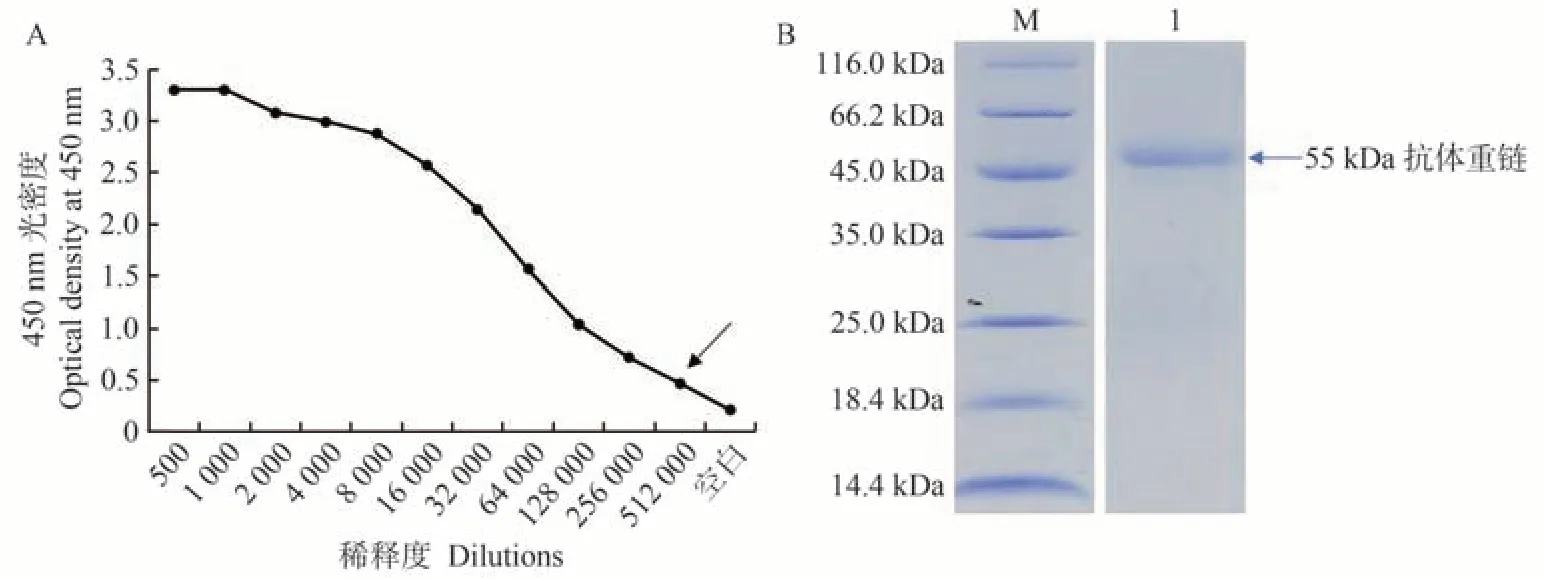
图4 重组ZBTB38蛋白多克隆抗体鉴定Fig.4 Identification of polyclonal antibody of recombinant protein
2.5 qRT-PCR 和Western blot 对zbtb38 基因的比较分析
为进一步验证制备的抗体的有效性,用兔抗斑点叉尾鮰ZBTB38 抗体检测斑点叉尾鮰精巢和卵巢组织中ZBTB38 蛋白的表达水平,结果如图5-A 所示。ZBTB38蛋白在精巢组织中表达量最高,而在卵巢中的表达量最低。同时,为了验证上述结果,采用qRTPCR 方法检测了精巢和卵巢组织中zbtb38基因的表达水平,精巢组织中zbtb38基因的表达水平极显著高于卵巢,结果与Western blot检测结果一致(图5-B)。
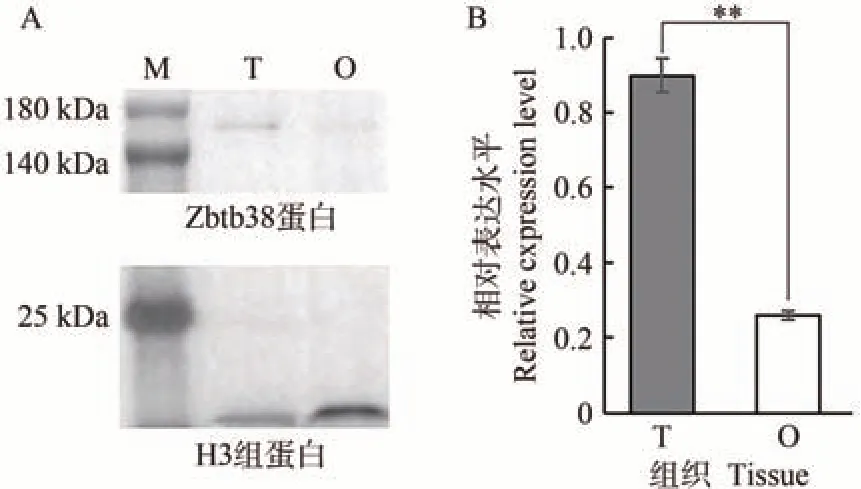
图5 斑点叉尾鮰zbtb38基因在精巢和卵巢组织中的表达分析Fig.5 Expression patterns of zbtb38 gene and protein in testis and ovary of channel catfish
3 讨论
为了深入研究斑点叉尾鮰zbtb38基因的功能,本研究首先制备了含有ZBTB38 蛋白N 端413 个氨基酸序列的重组蛋白,并以此重组蛋白作为抗原免疫动物获得了特异性较强、效价较高的多克隆抗体。制备的兔抗斑点叉尾鮰ZBTB38 蛋白多克隆抗体能特异性识别性腺组织中的ZBTB38蛋白。
在本研究中,将斑点叉尾鮰zbtb38基因序列优化为适于原核表达的基因序列,因为不同物种对同义密码子的使用频率往往不同。在外源基因的同义密码子使用频率与表达宿主相匹配的情况下,外源基因的表达水平会显著提高[20]。因此,利用原核生物表达真核生物基因时进行密码子优化是十分必要的,经过优化的基因序列能提高mRNA 二级结构的稳定性,避免因tRNA不充足导致翻译延迟、移码、终止,以及氨基酸错配等情况发生。赵茜[21]在进行金鱼(Carassiusauratus)Tgf2 转座酶原核表达研究时,依据大肠杆菌对密码子的简并性和偏好性对金鱼Tgf2 转座酶的密码子进行优化,不仅增加了重组蛋白表达量,而且纯度也得到了提高。
本研究通过牛血清白蛋白(BSA)标准品SDS-PAGE以及Western blot 等方法对表达的目标蛋白进行鉴定,发现其实际分子量相较于理论分子量偏大,进一步的质谱鉴定证明获得的蛋白确实为目标蛋白。对于分子量偏差的原因可能是:(1)ZBTB38 蛋白N 端413 个氨基酸与6×His-tag 组成的重组蛋白等电点为7.45,碱性蛋白与SDS 形成复合物后,仍含有大量紧密的螺旋结构[22],而不是松散的无规则卷曲,较为紧密的构型使复合物在凝胶中有更小的阻力,因此迁移更快;(2)重组蛋白具有两个锌指结构域,仍具有锌离子结合能力[23],从而使其带有较高的正电荷,为中和正电荷,蛋白通常会经历蛋白修饰(如糖基化、乙酰化修饰等),结合的大量锌离子和各种修饰导致分子量偏大。
多项研究表明,ZBTB 家族基因在哺乳动物性腺分化和发育过程中具有重要的作用。哺乳动物性别决定基因SRY上游调控区序列包含一个BTB-zinc finger 结合位点,这意味着SRY基因受到ZBTB 蛋白家族的调控[24]。利用同源重组技术将小鼠plzf(zbtb16)基因第二外显子敲除后,其睾丸变小,成年期精原细胞逐渐消失,精子形成过程发生阻断[25]。而bcl6(zbtb27)基因缺陷型小鼠精子数目比plzf缺陷小鼠更少,且精母细胞在减数分裂中期的I 时期凋亡程度更大[26]。同为ZBTB 家族的fru基因能够调控果蝇(Drosophila melanogaster)的求偶行为,fru基因的变异会导致果蝇求偶对象发生改变[27]。与ZBTB38高度同源的Kaiso蛋白(ZBTB33)在调控细胞凋亡时,与野生型p53 蛋白结合会激活细胞凋亡通路上的相关基因[28],而与突变型p53 蛋白结合会抑制细胞凋亡通路上的相关基因[29]。Kaiso 蛋白通过其锌指结构域识别并调控N-CoR[30]、Rapsyn[31]、BRCA1[32]等蛋白,以及WNT/β-Catenin[33]、TGF-β[34]等信号通路参与的生物学过程,其中大多数蛋白和信号通路均参与不同物种的性别决定过程。在本研究中,使用制备的兔抗斑点叉尾鮰ZBTB38蛋白抗体并结合qRT-PCR 技术检测了zbtb38基因及其编码的蛋白在斑点叉尾鮰性腺组织中的表达水平,结果表明精巢组织中zbtb38基因的表达水平极显著高于卵巢,结果与Wu 等[35]在点带石斑鱼(Epinephelus coioides)中关于zbtb40基因的研究结果较为一致。说明zbtb38基因及其家族基因在鱼类性别决定和维持等方面具有重要的作用。
4 结论
本研究基于密码子的简并性和偏好性原则,优化斑点叉尾鮰zbtb38基因部分编码序列,成功构建了其原核表达载体pET32a(+)-zbtb38。通过原核表达系统E.coliBL21 (DE3)诱导表达出ZBTB38 重组蛋白,利用重组蛋白制备了效价高、特异性强的兔抗斑点叉尾鮰ZBTB38 蛋白多克隆抗体。应用该抗体检测了ZBTB38蛋白在斑点叉尾鮰性腺组织中的表达水平,证明其在精巢中的表达水平显著高于卵巢。

