内质网-线粒体互作在卒中后认知障碍中的研究进展
陈露露 罗萌 苏凯奇 高静 冯晓东
1河南中医药大学(郑州 450046 );2河南中医药大学第一附属医院康复中心(郑州 450000 )
卒中后认知障碍(post-stroke cognitive impairment, PSCI)是指由卒中引起的注意力、记忆力、执行力、理解力等多方面认知功能的下降,包括了从卒中后非痴呆型认知障碍到卒中后痴呆的一系列临床表现[1-2]。由于人口老龄化和中风幸存者数量的增加,每年将有超过100 万的PSCI 患者出现[3]。持续性和进展性的PSCI 严重影响患者日常生活能力,阻碍患者康复进程,现已成为当下临床干预的重点和难点。PSCI 发病机制复杂,与多种病理过程密切相关,而内质网和线粒体作为细胞内的核心细胞器,其异常的功能状态是许多病理过程发生的关键环节[4]。研究[5-6]发现内质网和线粒体通过线粒体相关内质网膜(mitochondria-associated endoplasmic reticulum mem-branes, MAMs)进行广泛而频繁的互作,不仅在维持内质网和线粒体功能中扮演重要角色,更成为整合细胞内Ca2+信号和调节脂质代谢的核心枢纽。尽管目前对于内质网-线粒体互作的报道主要集中在神经退行性疾病[7-8],但不少研究已证实内质网-线粒体间的交互串扰可通过上述途径介入PSCI 发生发展的多个环节。因此,调控内质网-线粒体互作或许可成为防治PSCI 的新策略。本文将重点阐明内质网-线粒体互作与PSCI 的关系,以期为今后PSCI 靶向药物的开发提供新的理论依据和参考。
1 内质网-线粒体互作相关概述
1.1 内质网-线粒体互作的结构基础内质网-线粒体的交互作用是通过它们间的膜接触位点(membrane contact sites, MCSs)来实现的。长期以来细胞器被认为是细胞中独立的单元,但实际上彼此间可通过MCSs 形成结构和功能上的联系,特别是具有广阔膜面积的内质网与线粒体两大细胞器,早已在进化过程形成了MAMs 这一动态膜偶联区域[9]。MAMs 是内质网和线粒体外膜(outer mitochondrial membrane, OMM)之间形成的物理连接平台,最早由COPELAND 等[10]于1952 年使用电子显微镜观察大鼠肝细胞时发现;随着技术的发展,VANCE 等[11]于1990 年从大鼠肝脏中首次分离出MAMs。现代研究已证实MAMs 是由内质网膜与OMM 间高度共定位的蛋白质连接形成的5%~20%膜偶联区域。构成MAMs 的蛋白众多且复杂,迄今为止,在哺乳动物中已经鉴定出包括电压依赖性阴离子通道(voltage-dependent anion channel, VDAC)、钙联接蛋白(calnexin, CNX)、肌醇1,4,5-三磷酸受体(inositol 1,4,5-trisphosphate receptor, IP3R)、葡萄糖调控蛋 75(glucose-regulated protein 75, Grp75)、动力相关蛋白 1(dynaminrelated protein-1, Drp1)、线粒体分裂蛋白(mitochondrial fission protein 1, Fis1)线粒体融合蛋白( mitofusin-2, Mfn2)、突触融合蛋白17(syntaxin-17, Stx17)等1 300 种以上的相关蛋白[12]。更重要的是,细胞内的MAMs 并不是静态恒定的,细胞的功能状态决定着MAMs 招募的蛋白质种类与数量;而MAMs招募的蛋白质种类与数量又可以影响MAMs 接触面积与间距。因此,在不同的组织细胞中,同一细胞的不同功能状态下MAMs 可有明显的差异。
1.2 内质网-线粒体互作的生物学功能内质网-线粒体互作的生物学功能主要由MAMs 实现,而MAMs 上蛋白质的广泛富集,提示内质网-线粒体互作可能存在多样的生物学功能。事实也的确如此,如MAMs 上招募的Mfn2、Drp1、Fis1、Stx17 等线粒体动力学相关蛋白,可以调节线粒体分裂/融合的过程来维持线粒体的形态的稳定与mtDNA的完整性;而富集的其他蛋白如PINK1(PTEN induced putative kinase 1)和Parkin 蛋白则与线粒体自噬密切相关[13]。更值得一提的是,为了完成更复杂的生物学功能,MAMs 上富集的蛋白质往往以蛋白质复合体的形式存在,如VDAC1 通过Grp75 与IP3R 形成的VDAC1-GRP75-IP3R 复合体、Mmm1/Mdm10/Mdm12/Mdm34 形成的内质网线粒体联接复合物以及蛋白酪氨酸磷酸酶相互作用蛋白51(protein tyrosine phos-phatase-interacting protein 51, PTPIP51)和囊泡相关膜蛋白相关蛋白 B
(vesicle-associated membrane proteinassociated protein B, VAPB)形成的VAPB-PTPIP51 复合体[12]。其中VDAC1-GRP75-IP3R 和VAPB-PTPIP51 复合体在局部内质网-线粒体Ca2+转移递中发挥重要作用,内质网线粒体联接复合物则被认为与脂质代谢相关。内质网-线粒体的互作除了在上述生物学过程中发挥作用外,也有研究报道其在炎症反应和其他方面的功能,见表1。
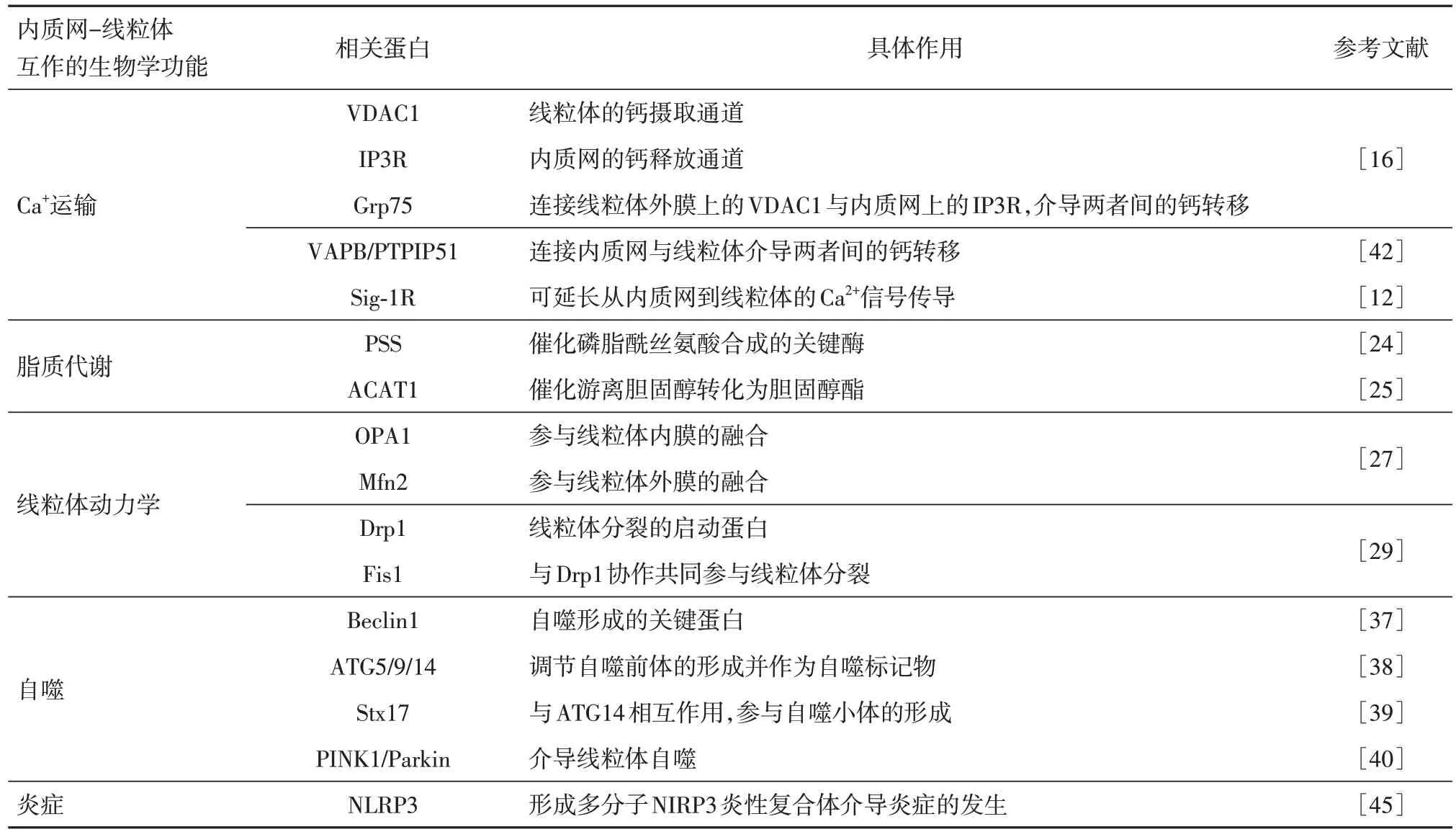
表1 内质网-线粒体互作的生物学功能及其相关蛋白Tab.1 Biological functions of endoplasmic reticulum-mitochondrial interactionsand their associated proteins
2 内质网-线粒体互作与PSCI
PSCI 发病机制尚未完全阐明,但不少研究证实促进或抑制MAMs 的连接,介导内质网-线粒体互作的加强和减弱,可通过调控Ca2+稳态、脂质代谢平衡、线粒体动力学、自噬、神经炎症进而对PSCI 的发生发展产生重要影响。
2.1 Ca2+稳态与PSCICa2+作为细胞内重要的信息传递者,其稳态的维持对于神经元功能的正常发挥至关重要。先前的研究早已证实脑缺血缺氧后,由于ATP 合成减少,兴奋性氨基酸毒性等多种原因相互作用可导致大量的Ca2+内流,而胞内过多Ca2+触发一系列的有害代谢反应被认为是脑缺血再灌注损伤的重要途径[14]。同时,一项动物实验发现[15]电针通过下调Ca2+浓度可以减少MCAO模型大鼠的脑梗死体积并改善其学习和记忆能力,这也从侧面印证了钙超载引起神经元的广泛损伤可能是PSCI 发生的主要原因。
内质网-线粒体互作通过MAMs 形成的“高钙通道”在维持Ca2+稳态方面发挥重要作用,其中VDAC1-GRP75-IP3R 复合体、VAPB-PTPIP51 复合体以及sigma-1 受体是MAMs 上调控钙释放与转运,实现Ca2+平衡的关键蛋白。正常情况下,其可将适当的Ca2+转运至线粒体基质,从而激活三羧酸(TCA)循环,刺激线粒体ATP 合成,这对于能量需求较大的神经元来说尤为重要。此外,HUTCHINS 等[16]发现抑制VDAC1-GRP75-IP3R 复合体介导的局部内质网-线粒体钙转移可降低突触的可塑性与轴突的生长速度,这也进一步揭示了内质网-线粒体间的钙离子调控对神经元的功能有重要影响。然而,在缺氧或者内质网应激的条件下,内质网和线粒体对Ca2+调控的紧密配合将会被打破,线粒体内不断积累的Ca2+会触发线粒体膜通透性的改变,致使大量细胞色素C(Cytoc)释放介导细胞凋亡程序的启动,而大量神经元的凋亡又会加重神经功能缺损[17]。CHANG等[18]研究发现糖尿病小鼠的认知缺陷与异常的MAMs 形成有关,而SIRT3 通过限制异常MAMs 的形成,减少VDAC1-GRP75-IP3R 复合物引起的线粒体Ca2+超载,可改善糖尿病小鼠的认知功能障碍。此外,有研究[19]发现金丝桃昔通过调控内质网-线粒体钙信号转导可减轻痴呆小鼠海马区β淀粉样蛋白的毒性和神经元凋亡进而改善其学习记忆缺陷。综上所述,Ca2+稳态与内质网-线粒体交互密切相关,内质网-线粒体交互的异常可能通过影响Ca2+稳态而阻碍轴突的生长和神经元过度凋亡而参与PSCI 的发生与发展。
2.2 脂质代谢与PSCI大脑是仅次于脂肪组织的第二大脂质聚集地,脂质含量丰富已成为大脑的结构特征之一。大脑内丰富的脂质不仅参与构成细胞膜和髓鞘膜在维持大脑结构稳定方面发挥作用,更介导了神经的发生和突触的连接在维持大脑功能方面有突出贡献[20]。SABOGAL-GUÁQUETA 等[21]的研究发现脑缺血大鼠海马体中与神经传递有关的磷脂(主要是磷脂酰胆碱)大大减少,而外源性补充这类物质将对痴呆患者的记忆、情绪和认知有积极影响。与此同时,LIU 等[22]的脂质组学分析揭示了银杏叶提取物很可能是通过恢复脂质代谢平衡来发挥其对痴呆小鼠神经保护作用。此外,一项荟萃分析显示[23],脂质代谢紊乱引起的动脉粥样硬化与卒中后痴呆风险增加有关;且卒中后使用他汀类降脂药物可以降低认知障碍风险,这也进一步证明了PSCI 的发生可能与脂质代谢紊乱密切相关。
正常的脂质代谢依赖于各种脂质代谢酶的广泛参与,而MAMs 上丰富的脂质代谢酶以及介导脂质在内质网和线粒体之间转运的特性,使其在维持脂质正常代谢中发挥重要。研究[24]发现内质网-线粒体结构偶联解离,可以引起磷脂合成过程受阻,并且一些脂质合成的关键限速酶如磷脂酰丝氨酸(phosphatidylserine,PS)合酶、N-甲基转移酶2(phosphatidylethanolamine N-methyltransferase 2,PEMT2)仅在MAMs 存在更加证实了上述观点。此外,多项研究[25-26]已证明阻断是一种在MAMs 轴上富集的胆固醇储存酶-胆固醇酰基转移酶1/甾醇O-酰基转移酶1(ACAT1/SOAT1)是可以减少淀粉样蛋白病理并挽救AD 小鼠模型中的认知缺陷。因此,我们有理由相信脂质的代谢异常是PSCI 发病的机制之一,而内质网-线粒体交互作用调控脂质代谢可能为PSCI 的治疗提供了新的靶点。
2.3 线粒体动力学与PSCI线粒体动力学是线粒体内独特的质量控制体系,包括了融合与分裂两大基本事件。异常的融合与分裂往往会引起线粒体的损伤,而线粒体损伤介导的氧化应激、能量缺陷以及细胞凋亡等病理过程与卒中后神经元损伤密切相关[27]。LAI 等[28]的研究发现无论在体内还是在体外,脑缺血均会引起视神经萎缩蛋白1(optic atrophy protein-1, OPA1)(介导线粒体内膜融合的关键蛋白)的过度切割,并伴随着大量的神经元凋亡和线粒体的形态异常,相反上调OPA1 的表达可有效缓解上述现象并减少脑缺血带来的认知的损伤。除了线粒体融合障碍外,线粒体分裂异常也是引起PSCI 的重要因素。Drp1 催化的线粒体裂变是线粒体生物发生和维持健康线粒体所必需的。然而,在脑缺血期间,Drp1 的过度激活一方面可导致线粒体破碎而加重线粒体功能障碍;另一方面又可诱导Tau 的磷酸化而加重神经元毒性,特异性Drp1 抑制剂mdivi-1 已被证明可有效减少MCAO 小鼠体内海马神经元的损伤而提高其学习记忆能力[29-30]。并且有研究[31]发现瘦素的神经保护作用是通过抑制Fis1 的上调和Mfn2 的下调,进而平衡线粒体动力学和改善线粒体功能来实现的,这又进一步证实了线粒体动力学的失衡是可能是PSCI 发生的关键环节。
内质网-线粒体互作在调控线粒体融合/分裂中有着举足轻重的作用。FRIEDMAN 等[32]通过荧光显微镜观察发现线粒体往往在与内质网接触点处收缩,并随后在此位点招募分裂蛋白,进而介导线粒体分裂的启动。OUYANG 等人[33]发现双侧颈总动脉闭塞会引起大鼠海马CA1 区MAMs 结构疏松和Mfn2 蛋白减少,而辣椒素可通过上调Mfn2、改善MAMs 结构疏松来提高大鼠学习记忆能力。此外,JIANG 等人[34]通过敲除小鼠海马神经元中的Mfn2 从反面验证了MAMs 调控的线粒体动力学在保护海马神经元以及维持大脑认知功能方面的重要作用。因此,我们不难得出这样一个结论:内质网-线粒体互作形成的偶联域不仅是线粒体分裂/融合启动的关键位点,更重要的是通过调控内质网-线粒体互作改善卒中神经元的线粒体动力学异常可成为治疗PSCI 有效新途径。
2.4 自噬与PSCI自噬是指细胞在自噬相关基因的调控下利用溶酶体降解自身受损细胞器和大分子物质的过程。目前学界普遍认为自噬在缺血性中风的病理过程中扮演了双刃剑的角色。LIU 等[35]的一项基础实验发现双侧颈动脉闭塞大鼠的学习记忆障碍与海马CA1、CA3 区锥体神经元内大量的自噬体的形成有关,但是也有报道发现敲低自噬蛋白(如Beclin 1)也可加重脑缺血引起的损伤。此外,自噬抑制剂消除了缺血预处理的神经保护作用[36]。由此可见,自噬的激活在脑缺血损伤中是有益还是有害在很大程度上取决于细胞的自噬能力与自噬需求是否平衡,适度的自噬流量可清除细胞内受损细胞器来促进神经元存活,而自噬的过度激活会导致神经元的大量凋亡而加重认知缺陷。那如何利用好自噬这把双刃剑呢?内质网-线粒体互作的出现或许给出了我们答案。
先前的研究[37]发现前自噬体标记ATG14 和自噬体形成标记ATG5 定位于MAMs。并且有研究[38]发现敲低STX17 或Mfn2 干扰MAMs 的形成可形阻断自噬小体的发生,这也再次印证了MAMs 可能是细胞内促进自噬体形成与成熟的关键平台。调控线粒体自噬以保护细胞免受线粒体代谢紊乱引起的损伤是目前治疗缺血再灌注损伤的主流干预靶点。一项基础研究[39]表明,调控线粒体自噬可明显减少缺氧/复氧引起的心肌细胞凋亡。ZHAO 等[40]研究也证实了紫参活血汤改善痴呆患者的临床表现与激活海马CA1 区PINK1/Parkin 介导的线粒体自噬,挽救海马神经元的线粒体结构损伤密切相关。有研究指出在线粒体自噬过程中,PINK1 通常是在MAMs 上富集,进而促进内质网-线粒体接触和自噬体形成。更有趣的发现是,MAMs 除了能直接参与线粒体的自噬外,还可通过VAPB/PTPIP51 蛋白复合体影响Ca2+的信号传递间接介导线粒体自噬的发生。所以说,尽管如何调控自噬平衡,最大程度地发挥其优势效应尚不明确;但毋庸置疑的是,MAMs 在自噬/线粒体自噬的发生发展过程中有着举足轻重的地位。因此,通过MAMs 调节自噬平衡或许是未来治疗PSCI 的研究热点。
2.5 神经炎症与PSCI卒中后的神经炎症是PSCI 发生的关键病理生理途径。一方面,其可引起大脑内常驻免疫细胞(如小胶质细胞、星形胶质细胞)的活化和外周免疫细胞的浸润,导致白细胞介素-1β、肿瘤坏死因子、NO、超氧化物、活性氧等大量炎性介质的释放而加重血脑屏障破坏、神经元损伤和脑水肿,最终加剧神经元凋亡并损害神经可塑性。另一方面,其又可通过扰乱全身免疫平衡,破坏自身免疫微环境而阻碍认知修复[41]。陈虹茹等[42]研究发现电针联合重复经颅磁刺激改善痴呆大鼠的学习记忆能力与抑制神经炎症反应有关。并且最近的一项Meta 分析发现全身性免疫炎症指数与卒中后不良结局呈正相关,这也进一步证实了神经炎症带来的级联损伤已成为PSCI发生的重要因素。
核苷酸结合寡聚化结构域样受体蛋3(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)是介导上述炎症反应的关键途径之一。生理状态下,其以游离的形式存于细胞质中,但在缺血缺氧的刺激下,NLRP3 以及其衔接子,即含有CARD(ASC)的凋亡相关斑点样蛋白可被重新定位到MAMs 上,并在此位点进行组装和激活。激活的NLRP3 炎症小体不仅能加剧小胶质细胞的活化还能介导神经元的焦亡进而损害海马神经元的发生,相反腹腔注射NLRP3 的抑制剂可逆转上述过程改善认知损伤[43]。此外,一项miRNA 的量化分析[44]显示炎症反应性microRNA主要富集在MAMs,并且SHA 等[45]的研究证实电针可通过上调炎症相关的miRNA-223 的水平来抑制NLRP3 炎症小体的活化,从而改善MCAO 大鼠神经功能障碍。以上证据均表明,MAMs 功能异常引起的NLRP3 炎症小体的激活可介导神经炎症加重海马损伤,而适当的调控则有可能促进缺血后神经元的恢复并减轻认知障碍,见图1。
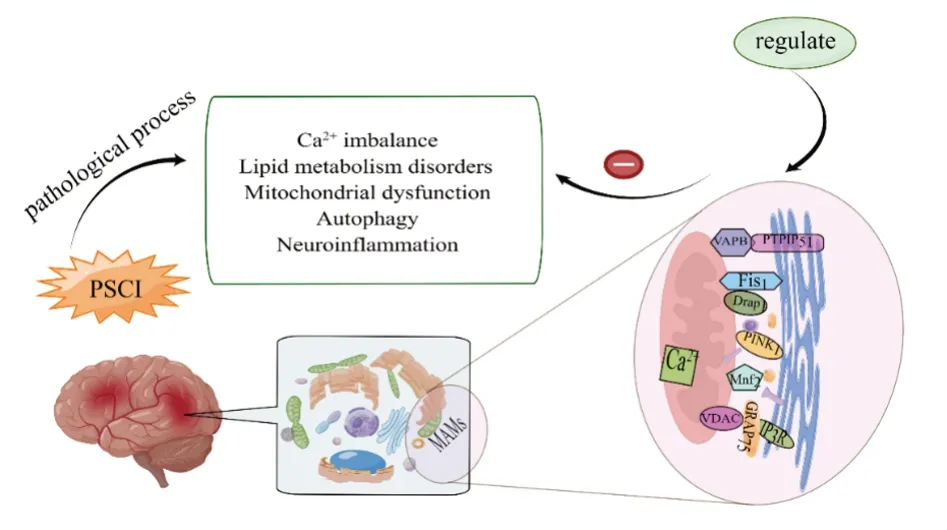
注:MAMs=线粒体相关内质网膜图1 内质网-线粒体互作治疗PSCI 的潜在靶点(本图由Figdraw 绘制)Fig.1 Potential targets of endoplasmic reticulummitochondrial interactions for PSCI treatment(By Figdraw)
3 总结与展望
内质网和线粒体通过MAMs 实现的交互作用在维持细胞的正常生命活动中扮演着重要角色。尽管目前通过调控内质网-线粒体互作改善PSCI的直接证据还比较少,但从当今对PSCI 发病机制的研究上来看,内质网-线粒体互作调控的多种生物学过程与PSCI 复杂的病理机制密切交织。本文从Ca2+稳态、脂质代谢、线粒体动力学、自噬、神经炎症等方面总结了内质网-线粒体互作异常可能PSCI 发生发展的潜在途径,并提出了调控内质网-线粒体互作可能是治疗PSCI 的有效手段这一观点。然而,考虑到MAMs 蛋白的复杂性与多样性,内质网-线粒体交互的生物学功能还尚未阐明,内质网-线粒体互作与PSCI 的治疗策略之间可能还存在新的交叉靶点,内质网-线粒体互作在PSCI 发挥作用的具体调节机制仍需进一步探讨。未来,随着对内质网-线粒体互作更深入的研究,我们将进一步揭示其在PSCI 病理过程的变化机制,以期为精准调控内质网-线粒体互作,靶向开发治疗PSCI 的临床药物提供新的参考资料。
【Author contributions】CHEN Lulu was responsible for the overall conception and writing of the paper; LUO Meng was contributed to the literature search and organisation; SU Kaiqi organised and produced the figures and tables of the paper; GAO Jing revised the first draft ;FENG Xiaodong was responsible for the revisions of the final draft of the paper, the quality control of the paper and its proofreading, and was responsible for the paper as a whole; all the authors confirmed the final draft of the paper.
【Conflict of interest】The authors declare no conflict of interest.

