苜蓿提取物不同极性部位抗氧化活性研究
李倩,孙勇康,安琼,王贞香,张振,梁艳婷
河西学院医学院,甘肃省河西走廊特色资源利用重点实验室(张掖 734000)
自由基是机体内正常的物质代谢所产生的中间代谢产物[1],化学性质极为活泼,氧化性强,体内蓄积会氧化蛋白质、脂质、核酸,导致细胞膜受损,引起心血管系统、免疫系统及神经系统疾病[2],并加速衰老,直至死亡[3]。抗氧化剂可降低自由基的活性,通过有效清除自由基起到预防疾病的目的[4]。因此,从天然产物中开发安全、绿色的抗氧化组分,并将其应用于医疗、保健品、食品等,成为当前研究的热点[5]。查阅文献,目前常用的天然抗氧化剂主要来自包括黄酮、多酚和糖类等代谢产物[3]。
苜蓿(Medicago sativaL.)是豆科苜蓿属的通称,为多年生草本植物,是一种被世界各国公认的可持续发展的绿色能源。苜蓿具有蛋白质种类丰富、能适应各种不同的生长环境、产量高、再生快等优点[6-7],是优良的豆科饲料,在很多国家作为牧草大量种植,有着“牧草之王”的美称[8]。苜蓿的地上部分富含多种有益于人类健康的营养成分,主要包括黄酮类、多糖、皂苷类、香豆素类、氨基酸以及其他活性成分[9-11]。研究表明,苜蓿具有抗氧化、抗动脉粥样硬化、消炎、降血脂、增强免疫力等多种功效[12-13],是极具发展前景的植物。但目前对苜蓿不同极性部位的黄酮类、酚类和多糖类含量的测定及抗氧化活性的研究很少报道。
我国的苜蓿资源虽然十分丰富,但目前主要是作为动物饲料,应用在农业与畜牧业方面,并未得到充分开发与利用,且市面上可以见到的苜蓿类功能食品也十分少[14]。如果把苜蓿应用于食品,不仅可以增加市面上的功能食品的类型,也将大大增加苜蓿的利用价值。此研究首次对苜蓿不同极性部位的活性成分及抗氧化活性进行分析,为以后进一步开发苜蓿资源,充分挖掘天然抗氧化产品提供依据。
1 材料与方法
1.1 材料与试剂
苜蓿(2023年4月份采自甘肃省天水市秦州区),经河西学院张勇教授鉴定为豆科苜蓿属的紫花苜蓿。
芦丁标准品(博美生物科技,LC202007);没食子酸标准品(上海源叶,C17D10C105997);葡萄糖标准品(致远化学试剂,20211101810);无水乙醇(利安隆博华医药化学公司,20230113);石油醚(致远化学试剂,2019091062);乙酸乙酯(致远化学试剂,2019091042);正丁醇(致远化学试剂,2019092085);福林酚(上海源叶,F15IS207169);萘酚(上海麦克林生化科技,C14490323);苯酚(成都科隆化学品,2021032301);硝酸铝(成都科隆化学品,2021060403);亚硝酸钠(天津百世化工,20200603);镁粉(天津大茂化学试剂厂,20220701);DPPH试剂(上海麦克林生物科技有限公司,C12998355);ABTS试剂(上海麦克林生物科技有限公司,C12824507);抗坏血酸(致远化学试剂,20220303)。
1.2 设备与仪器
UV-2600紫外可见分光光度计(日本岛津公司);JC-QX-10L超声波清洗器(青岛聚创环保设备有限公司);HH-4数显恒温水浴锅(常州国华电器有限公司);PT-124/85S分析天平(福州华志科学仪器有限公司);SY-2000旋转蒸发仪(上海亚荣生化仪器厂)。
1.3 研究方法
1.3.1 制备苜蓿醇提物不同极性部位
参考刘学贵等[15]紫花苜蓿提取物的方法。将200 g苜蓿粗粉,在70%乙醇、80 ℃、2 h、提取次数2次、料液比1∶10(g/mL)的提取条件下回流提取,将提取液进行合并、过滤,使用旋转蒸发仪将滤液减压浓缩至无醇味,将得到的溶液进一步浓缩。将浓缩到一定程度的溶液以1∶3混合于蒸馏水中,以石油醚、乙酸乙酯、正丁醇为溶剂,按极性由小到大的顺序等量萃取7次,得到石油醚部位、乙酸乙酯部位、正丁醇部位和水部位。
1.3.2 不同极性部位黄酮类、酚类、糖苷的鉴别
取石油醚部位、乙酸乙酯部位、正丁醇部位、水部位溶液各1 mL于试管中,备用。根据标准方法对植物粗提物进行植物化学评估,通过颜色的变化以确定是否存在黄酮类、多酚类和糖苷[3,16-18]。
1.3.2.1 黄酮类
在供试品溶液中加入适量镁粉,振摇之后加入几滴浓盐酸,1~2 min之后观察颜色变化。若含有黄酮类物质,溶液一般显红色到紫红色,个别显蓝或绿。
1.3.2.2 酚类
在供试品溶液中加入少量FeCl3溶液,若有蓝紫或紫红色出现,表明该溶液中有酚类物质的存在。
1.3.2.3 糖苷
在供试品溶液中加入0.2 mL的乙醇-萘酚(20%)溶液,混匀,沿试管壁缓缓加入2 mL浓硫酸,试管中的溶液分成2层,在两层的交界处出现紫红色环,则说明有糖苷的存在[19]。
1.3.3 芦丁标准曲线的制备
参考江春阳等[20]绘制芦丁标准曲线的方法,精确称取10.89 mg的芦丁标准品,置于25 mL的容量瓶中,以60%乙醇溶于其中,定容至刻度,分别取0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9和1.0 mL芦丁标准品的溶液,放入10 mL容量瓶中,各加入0.9 mL亚硝酸钠溶液(5%),振摇使其混合均匀,放置3 min,再加入0.6 mL硝酸铝溶液(10%),振摇使其混合均匀,4 min后加入4.8 mL氢氧化钠溶液(4%),用60%的乙醇定容至刻度线,混匀,放置11 min。用蒸馏水作为空白对照,在波长510 nm处测吸光度,平行3次,取平均值。以吸光度为纵坐标,芦丁对照品溶液的浓度为横坐标,制作标准曲线,得到回归方程:Y=0.012 3X+0.001 1,R2=0.999 4,浓度和吸光度线性关系良好,可用于黄酮含量的测定。
1.3.4 没食子酸标准曲线的制备
参考谭晓舒等[21]绘制没食子酸标准曲线的方法。精确称取12.18 mg没食子酸标准品置于10 mL容量瓶中,以蒸馏水溶解并定容到刻度,精密量取0.1,0.2,0.3,0.4,0.5,0.6,0.7和0.8 mL放入不同的棕色容量瓶中,将溶液稀释并定容至刻度,再分别精密量取0.7 mL不同浓度的没食子酸对照品溶液放入不同试管中,每个试管中加入2.5 mL 0.1 mol/L的福林酚溶液,10 min后量取2.5 mL 7%的碳酸钠溶液加入各个试管中,将其放在暗处,避光反应1 h。用对应试剂作为空白对照,在波长765 nm处测吸光度,平行3次,取平均值。将吸光度作为纵坐标,没食子酸对照品溶液浓度作为横坐标,绘出标准曲线,得到回归方程:Y=0.012 5X-0.002 7,R2=0.999 4,浓度和吸光度线性关系良好,可用于多酚含量的测定。
1.3.5 葡萄糖标准曲线的制备
参考李萧娜等[22]绘制葡萄糖标准曲线的方法。精确称取10.66 mg葡萄糖标准品,置于100 mL容量瓶内,用蒸馏水定容至刻度,精密量取0.2,0.4,0.6,0.8,1.0,1.2,1.4和1.6 mL的葡萄糖标准品溶液于试管中,补加蒸馏水至2 mL各试管中再分别加入1 mL 5%的苯酚溶液和5 mL浓硫酸,室温下放置10 min,沸水浴20 min,冷却至室温。用对应的试剂作空白对照,于490 nm波长处测吸光度,平行3次,取平均值。以吸光度作为纵坐标,葡萄糖对照品溶液浓度作为横坐标,绘制标准曲线,得到回归方程:Y=0.060 8X-0.004 5,R2=0.999 6,浓度和吸光度线性关系良好,可用于糖含量的测定。
1.3.6 不同极性部位成分的含量测定
根据对各极性部位成分鉴别的结果,使用可见分光光度法测定不同极性部位所含黄酮、酚酸和糖的浓度,并按式(1)计算苜蓿各成分质量(%)。
式中:C为根据标准曲线计算得到的质量浓度,μg/mL;D为稀释倍数;V为萃取液体积,mL;M为苜蓿质量,g。
1.3.7 抗氧化活性检测
将2.1小节中得到的不同极性部位的提取物溶液浓缩成浸膏。将各极性部位的浸膏配制成质量浓度为5 mg/mL的溶液,精密量取0.5,1.0,1.5,2.0和2.5 mL配制好的提取物溶液,置于5 mL的容量瓶中,将其稀释定容至刻度,备用。配制5 mg/mL的维生素C溶液,作为阳性对照组。精密量取0.5,1.0,1.5,2.0和2.5 mL维生素C对照品溶液,放入5 mL的容量瓶中,定容至刻度线,备用。
1.3.7.1 ABTS自由基清除能力测定
ABTS工作液:准确量取5.0 mL 7.0 mmoL/L的ABTS溶液,5.0 mL 2.45 mmoL/L的过硫酸钾水溶液,将其混匀,在室温下,放置在黑暗处反应12~16 h后,用无水乙醇进稀释,当它在波长734 nm处测定的吸光度为0.70±0.03时,停止稀释,该溶液可以进行抗氧化活性试验。
参考刘敏卓等[23]的体外抗氧化活性分析方法。取0.1 mL的不同浓度的不同极性部位溶液与不同浓度的维生素C对照品溶液,分别加入0.9 mL的ABTS工作液,振摇,混均,于30 ℃水浴5 min。在波长734 nm处测定吸光度。平行3次,求平均值。ABTS自由基清除率按式(2)计算。
式中:A0为0.1 mL无水乙醇溶液+0.9 mL ABTS工作液的吸光度;A1为0.1 mL供试品溶液+0.9 mL ABTS工作液的吸光度。
淮河流域多年平均降水量的地区分布很不均匀,大致从流域东南部向西北部递减,而地表径流的分布受地形的影响,在地域上变化幅度较大。因为水资源的禀赋与旱灾的形成具有密切的关系,因此,在进行干旱分区时应将该因素纳入考虑范畴。
1.3.7.2 DPPH自由基清除能力测定
参考陈建双等[24]的方法。量取0.2 mL的不同浓度的不同极性部位溶液、不同浓度的维生素C对照品溶液,在各个溶液中分别加入0.2 mL DPPH溶液,振摇使其混合均匀,在室温下暗处放置30 min。在517 nm波长处测定吸光度,平行3次,取平均值。DPPH自由基清除率按式(3)计算。
式中:A0为无水乙醇和DPPH各0.2 mL混匀后溶液的吸光度;A1为供试品溶液和DPPH溶液各0.2 mL混匀后溶液的吸光度。
1.3.7.3 羟自由基清除能力测定
参考陈建双等[24]的方法。分别取1.0 mL H2O2(8.8 mmol/L)、FeSO4(10.0 mmol/L)和水杨酸(10.0 mmol/L,溶于无水乙醇),放入37±2 ℃水浴中,加入1.0 mL待测样品,再加入1.0 mL H2O2用以启动反应,计时30 min,反应结束后,迅速将反应液放置于波长510 nm处测定吸光度,并以蒸馏水代替样品作空白对照。羟自由基清除率按式(4)计算。
式中:A1为供试品溶液+试剂的吸光度;A0为蒸馏水+试剂的吸光度。
1.3.7.4 铁离子还原能力测定
参考徐晨晨等[25]的测定方法。取不同浓度的不同极性部位溶液与不同浓度的维生素C对照品溶液各1.0 mL,加入1%的铁氰化钾、PBS缓冲液(pH 6.6)各1 mL,在50 ℃的水浴中静置20 min,快速冷却后加入1.0 mL 10%的三氯乙酸溶液,混匀后按3 000 r/min离心10 min,取1 mL的上清液,加入等体积的蒸馏水和0.05%三氯化铁,混匀,在波长700 nm处测吸光度,平行3次,取平均值。一定程度上吸光度与还原能力呈正比。总还原能力(A)按式(5)计算。
式中:A1为加入样品后的吸光度;A0为溶剂本身的吸光度。吸光度越大,表明该样品还原能力越强。
2 结果与分析
2.1 不同极性部位黄酮类、酚类、糖苷的鉴别结果
盐酸-镁粉是最常见的鉴别黄酮的反应之一,大部分黄酮、黄酮醇、二氢黄酮及二氢黄酮醇类化合物在盐酸-镁粉体系中会显橙红到紫红色,还有少数显紫~蓝色,而且当B环上存在—OH取代时,颜色变化会更加明显。试验结果显示,石油醚部位显示出绿色,在乙酸乙酯部位显示出红色,表明黄酮主要分布在石油醚部位和乙酸乙酯部位。
大多数具有羟基和SP2杂化的碳原子结构的化合物(碳碳双键上的碳原子)都能与三氯化铁溶液发生显色反应。酚羟基直接连在芳环上,相当于烯醇结构,所以也可以与三氯化铁溶液发生显色反应。试验结果显示,乙酸乙酯部位和正丁醇部位出现了明显的紫红色,表明酚类主要分布于乙酸乙酯部位和正丁醇部位。
硫酸-萘酚反应可以识别提取物中的糖,在浓硫酸或浓盐酸的作用下,糖类脱水形成糠醛及其衍生物,后者与α-萘酚反应生成紫红色络合物,在含有糖的溶液和浓硫酸溶液的液面交界处形成紫红色环。Molisch反应是鉴别糖的最常见的反应。试验结果显示,在水部位与石油醚部位出现了紫红色环,表明糖主要分布在水部位与石油醚部位部位。
2.2 不同极性部位成分的含量测定
不同极性部位黄酮、酚酸和糖的含量测定结果如表1所示。
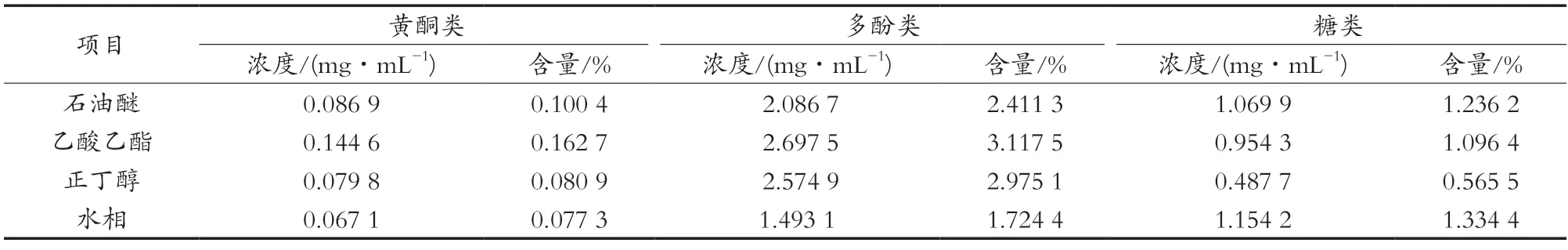
表1 不同极性部位黄酮、酚酸和糖的含量
由芦丁标准曲线可得,黄酮在乙酸乙酯部位浓度最高为0.144 6 mg/mL,水部位浓度最低为0.067 1 mg/mL,由公式(1)可知,黄酮在乙酸乙酯部位含量为0.100 4%,在水部位含量为0.077 3%。
由没食子酸标准曲线可得,酚类在乙酸乙酯部位和正丁醇部位的浓度为2.697 5和2.574 9 mg/mL,由公式(1)可知,多酚在乙酸乙酯部位和正丁醇部位的含量为3.117 5%和2.975 1%。
由葡萄糖标准曲线可得,糖类在水部位的浓度为1.154 2 mg/mL,在石油醚部位浓度为1.069 9 mg/mL。由公式(1)可知,糖类在水部位含量为1.334 4%,在石油醚部位的含量为1.236 2%。
2.3 抗氧化活性测定
2.3.1 ABTS自由基清除率
ABTS+是被用来测定纯度较高的物质或水溶液的总抗氧化能力的基础。ABTS会被一些氧化剂氧化,如MnO2或H2O2等试剂,生成呈现蓝绿色的自由基阳离子ABTS+。在一些可以提供电子的抗氧化剂(如酚类物质)存在的情况下,则生成没有颜色的ABTS[26]。采用过硫酸钾氧化法制备的ABTS+,这种自由基的强吸收出现在波长734 nm附近。苜蓿不同极性部位萃取液对ABTS自由基的清除率结果见图1。石油醚部位的清除能力最低,乙酸乙酯与正丁醇部位清除能力高于石油醚部位,都比对照品维生素C的清除率低,随着浓度的增大,乙酸乙酯部位与正丁醇部位的清除能力越来越接近。水相部位在浓度低于2.986 2 mg/mL时,清除能力低于对照品维生素C的清除能力,随着浓度逐渐增大,水部位的清除能力也逐渐升高,超过了对照品VitC的自由基清除能力,并在浓度大于2.986 2 mg/mL时,上升趋势逐渐趋于平缓。水相、正丁醇部位、乙酸乙酯部位、石油醚部位清除能力相比:水>正丁醇>乙酸乙酯>石油醚。

图1 苜蓿醇提取物不同极性部位的ABTS清除率
2.3.2 DPPH自由基清除率
在乙醇溶液中,DPPH是一种相对稳定的自由基,在乙醇溶液中显紫红色,添加抗氧化剂之后,DPPH自由基溶液的颜色从紫红色变为黄色[27]。孤对电子的强吸收出现在波长517 nm附近,孤对电子与自由基清除剂配对以后,吸收将会减弱或消失。吸收减弱的多少可以反映出自由基清除剂活性的高低,DPPH清除率越高,说明抗氧化能力越强。
苜蓿不同极性部位萃取液对DPPH自由基的清除率结果见图2。石油醚组与乙酸乙酯组的清除能力基本无差异,正丁醇组清除率较强,但石油醚组,乙酸乙酯组,正丁醇组清除能力均低于对照品维生素C。水相部位在0.995 4 mg/mL的浓度时清除率低于对照品维生素C,1.990 8~3.981 6 mg/mL时高于对照品维生素C,4.997 mg/mL时清除率出现下降趋势。水相、正丁醇部位、乙酸乙酯部位、石油醚部位清除能力相比:水>正丁醇>乙酸乙酯>石油醚。
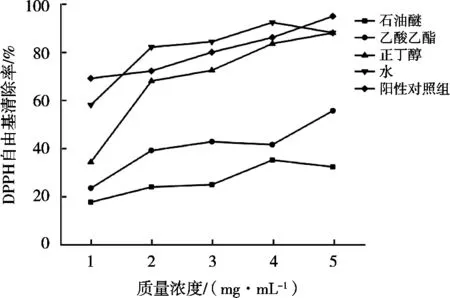
图2 苜蓿醇提取物不同极性部位的DPPH清除率
2.3.3 羟自由基清除率
利用Fenton反应先产生羟自由基:H2O2+Fe2+=·OH+H2O+Fe3+。若加入水杨酸,则羟自由基与水杨酸会反应生成2.3-二羟基苯甲酸,在510 nm波长处有吸收峰。如果向反应体系中加入能清除羟自由基的物质,则羟自由基的生成就会减少,从而使有色化合物的生成量相应减少[28]。采用固定反应时间法,在波长510 nm处测量含被测物反应液的吸光度,通过比较,判断被测物质清除羟自由基的能力。
苜蓿不同极性部位萃取液对羟基自由基清除率结果见图3。石油醚组清除能力最低,乙酸乙酯组与正丁醇组清除能力接近,正丁醇组在0.995 4~1.990 8 mg/mL时,清除率呈下降趋势,在1.990 8~4.977 mg/mL时为上升趋势,在1.990 8 mg/mL时清除率低于乙酸乙酯组,水相的清除能力最高。水相、正丁醇部位、乙酸乙酯部位、石油醚部位清除能力相比:水>正丁醇>乙酸乙酯>石油醚。

图3 苜蓿醇提取物不同极性部位的羟自由基清除率
2.3.4 铁离子还原能力测定
铁氰化钾的Fe3+被样品的抗氧化作用还原成Fe2+(亚铁氰化钾),生成的Fe2+(亚铁氰化钾)进一步和Fecl3反应,生成普鲁士蓝,在波长700 nm处有最大吸光度,因此测定此处吸光度值可以间接反映抗氧化剂的还原能力大小[3,29],二者大小呈正比。
苜蓿不同极性部位萃取液对铁离子还原能力结果见图4。石油醚组与乙酸乙酯组的清除能力相近,正丁醇组抗氧化能力强于石油醚组和乙酸乙酯组,石油醚组、乙酸乙酯组、正丁醇组的铁离子还原能力随浓度的增大,上升的趋势比较缓慢。水相的铁离子还原能力随浓度的增大,上升的趋势较快。水相、正丁醇部位、乙酸乙酯部位、石油醚部位还原能力相比:水>正丁醇>乙酸乙酯>石油醚。

图4 苜蓿醇提取物不同极性部位的总还原能力
3 讨论与结论
此研究采用了液-液萃取法,将苜蓿醇提物分为石油醚部位、乙酸乙酯部位、正丁醇部位和水部位。采用盐酸-镁粉法、三氯化铁试剂和硫酸-萘酚反应鉴别提取物中的黄酮类、酚类和糖。此研究结果表明,紫花苜蓿提取物各极性部位黄酮、多酚和糖类化合物的分布各不相同,其中乙酸乙酯部位含有黄酮和多酚类化合物最多,水部位含有糖类物质最多。
通过测定苜蓿的不同极性部位对DPPH自由基、ABTS自由基、羟自由基清除能力和总还原能力,结果表明紫花苜蓿不同极性部位均具有抗氧化能力,且在所测范围内有计量相关性,其抗氧化能力强弱顺序为水>正丁醇>乙酸乙酯>石油醚,由此可见,紫花苜蓿抗氧化的活性成分集中在水部位,而糖类主要分布在水相中,提示糖是紫花苜蓿抗氧化的主要成分,而酚羟基是构成多糖类化合物的主要基团之一,使其具备有效的抗氧化的能力[30]。另外,紫花苜蓿的抗氧化能力除了与活性物质的含量有关,也可能受到其他因素的影响。本试验通过萃取实现了紫花苜蓿醇提物中抗氧化成分的富集。
以上结果表明,紫花苜蓿各极性部位中活性成分差异较大,各部位抗氧化程度不同。此研究为苜蓿资源的进一步开发研究提供了理论支持,对天然抗氧化剂的开发提供更充分的理论依据。

