三维酰胺质子转移成像在原发性肝癌临床扫描可行性及图像质量评估中的初步研究
齐晓辉,王琦*,沈智威,段梦婷,刘响,潘江洋,范雪丽,贾丽涛,王亚宁,杜煜
0 引言
酰胺质子转移加权(amide proton transfer weighted,APTw)成像是一种基于化学交换饱和转移(chemical exchange saturation transfer, CEST)的新型分子MRI技术,通过检测位于3.5 ppm处酰胺质子与水的非对称性磁化转移率(magnetization transfer ratio asymmetry,MTRasym),进而从分子水平反映组织细胞内游离蛋白质及多肽的浓度特性及交换环境(包括pH,温度等)[1]。富含酰胺基质子的蛋白质不仅是细胞结构的组成部分,而且是细胞功能的执行者,因而相比现有的解剖像和弥散成像,APTw 成像提供的肿瘤蛋白质加权信息,更有助于了解肿瘤细胞的活动状态[2],进而用于疗效评估和术后复发预测[3-5]。近年来,已报道将APTw成像用于头颈部良恶性肿瘤鉴别[6-7]、脑胶质瘤[8-9]和其他恶性肿瘤的病理分级[10-12]、治疗反应评估[13-14]及预后预测[15]等,发现APTw 高信号与组织病理学赋值、细胞数、增殖指数呈显著正相关[16],可以提高肿瘤复发预测的敏感性和特异性。
虽然APTw 成像在肝癌上的应用已被报道[17-19],由于肝脏扫描容易受呼吸运动及心脏搏动的影响,APTw 技术在肝脏上还面临很多技术挑战。以往的肝脏APTw研究均采用二维扫描,得到的都是单层图像[17-19],难以反映整个肿瘤的APTw值及其异质性,而且成功率不高。
使用三维酰胺质子转移加权(3 dimensions-amide proton transfer weighted, 3D-APTw)技术进行肝脏肿瘤采集,覆盖肿瘤范围大大增加,有利于进行肿瘤组织异质性研究。经过参数优化,可提高图像信噪比,减轻呼吸等运动干扰,提高扫描成功率。但目前尚未发现有关评估3D-APTw成像序列在原发性肝癌临床应用中的价值。在进一步开展基于此技术的临床研究前,有必要进行原发性肝癌3D-APTw 成像临床可行性和图像质量评估研究。
因此本研究使用参数优化的3D-APTw 成像序列,通过分析图像质量的主观评分和客观指标评估原发性肝癌3D-APTw 图像质量和临床扫描的可行性,提高3D-APTw在原发性肝癌成像的成功率,为开展进一步的研究提供有力的技术基础。
1 材料与方法
1.1 研究对象
本研究遵守《赫尔辛基宣言》,经河北医科大学第四医院伦理委员会批准,批准文号:2021KY346,全体受试者均签署了知情同意书。于2020 年10 月至2022 年2 月前瞻性招募临床怀疑或诊断原发性肝癌患者共145 例。纳入标准:(1)CT 或超声诊断怀疑或诊断为原发性肝癌;(2)既往未进行介入、放化疗;(3)病灶大于等于1.5 cm;(4)非弥漫性病变。排除标准:(1)MRI禁忌证或未完成MRI检查;(2)影像或病理诊断为非原发性肝癌。
1.2 检查方法
所有患者在MRI 检查前禁食6~8 h。使用具有16 通道相控阵体部线圈的3.0 T MR(Philips Ingenia CX,飞利浦,荷兰)进行扫描。常规肝脏MRI 均采用横断位图像,包括T1WI像,T2WI像和弥散加权成像(diffusion-weighted imaging, DWI)像(b值=1 200 s/mm2),各序列扫描参数见表1。3D-APTw 成像采用SPIR 方式抑脂,多次激发快速自旋回波序列采集,饱和方案使用双源交替的高斯波饱和脉冲。选取在T2WI 横断面显示肿瘤最大层面,如有2个以上病变则选最大的病变进行APTw 扫描。优化的扫描参数包括:饱和脉冲功率=2 μT,饱和持续时间1.5 s;快速自旋回波(turbo spin echo, TSE)=100,并 行 采 集(SEN sitivity encoding, SENSE)=1,相位编码方向为前后方向,体积外抑制(reassenmbled saturation transfer,REST),平均采集次数(number of signal acquisitions,NSA)=3,成像采集时间约7 min。扫描前训练患者呼吸,嘱患者在自由呼吸状态下尽量保证呼吸均匀,机器响时处于呼气末状态。机器自动生成经过Dixon 生成的B0 图,并自动校正B0 不均匀。扫描机自动重建肝脏APTw图像。

表1 MRI各扫描序列参数Tab.1 Details of MRI imaging parameters
APTw 扫描结束后,采集多期动态增强图像。按0.2 mL/kg经肘静脉注入钆特酸葡胺(佳迪显,江苏恒瑞,批号H20153167),后追加生理盐水10 mL,注射速率均为3 mL/s,监测主动脉,采集双动脉期、静脉期及延迟期图像。
1.3 图像分析
APTw 图像分析分别由两名分别具有10 年(医师1,副主任医师)和5 年(医师2,主治医师)腹部影像诊断工作经验的放射科医师在双盲条件下进行。医师1在1个月后进行第二次图像分析。
在后处理工作站上将患者的T2WI图像及APTw图像进行融合,工作站自动进行图像配准,得到融合后的M 图和3D-APTw 图。首先认为病变区域无APTw信号视为扫描失败,计算肝脏3D-APTw成像的扫描成功率。然后对扫描成功患者的3D-APTw图像质量进行主观评分。参考文献[20],本研究将主观评分设为5分制,5分为扫描范围内肝脏及病变信号均匀,无伪影及信号缺失区域;4 分为扫描范围内肝脏及病变出现伪影或信号缺失,目测范围小于25%;3 分为肝脏内伪影及信号缺失范围达25%~50%,病变内无伪影或信号缺失;2 分为肝脏内伪影及信号缺失范围达50%~75%,或病变内出现少量伪影或信号缺失;1 分为肝脏伪影及信号缺失范围超过75%,或病变内出现大片的伪影或信号缺失(图1)。将三次评分平均值作为3D-APTw图像的最终评分。得到计算成功率=主观评分3 分以上的病例数/入组原发性肝癌病例数。

图1 3D-APTw 图像主观评分图像。1A~1E为APTw-T2WI融合图像,1F~1J为T2WI图像。1A、1F显示肝脏及病变信号均匀,无红色伪影及信号缺失区域,评分为5分;1B、1G 示病变内出现红色伪影,目测范围小于25%,评分为4分;1C、1H 示肝左叶信号缺失范围约25%~50%,病变内信号均匀,无红色伪影及信号缺失,评分为3分;1D、1I示肝脏内出现红色伪影及信号缺失,范围达50%~75%,评分为2分;1E、1J示肝脏及病变区域出现红色伪影及信号缺失,范围超过75%,评分为1分。3D-APTw:三维酰胺质子转移加权;APTw:酰胺质子转移加权。Fig.1 3D-APTw images with subjective scores.1A-1E are APTw-T2WI fusion image; 1F-1J are T2WI.1A, 1F show uniform liver and lesion signals, with no artifacts and signal loss areas; the score is 5.1B, 1G show artifacts in the liver and lesion with a range of <25% by visual observation; the score is 4.1C, 1H show a signal loss range of about 25%-50% in the left lobe of the liver and uniform signal in the lesion with no artifacts and signal loss; the score is 3.1D, 1I show a 50%-75%range of artifacts and signal loss in the liver; the score is 2.1E, 1J show an artifact range of above 75% in the liver, with large artifacts in the lesion; the score is 1.3D-APTw: 3 dimensions-amide proton transfer-weighted; APTw: amide proton transfer weighted.
在3D-APTw 和T2WI 融合图像,参照T2 图像沿肿瘤边缘勾画感兴趣区(region of interest, ROI),测量肿瘤APTw值(图2)。

图2 ROI示意图。2A:APTw-T2WI融合图像;2B:T2WI序列,沿肿瘤边缘画取ROI。ROI:感兴趣区;APTw:酰胺质子转移加权。Fig.2 ROI diagrammatic sketch.2A: APTw-T2WI fusion image; 2B:T2WI sequence, with the ROI drawn along the tumor margin.ROI: region of interest; APTw: amide proton transfer weighted.
最后进行图像质量的客观评估。将T2WI 图像作为解剖学参考,在肿瘤最大层面及上下两层的肿瘤实性部分手动选取病变区圆形ROI,沿肿瘤边缘画取ROI,参照T1WI及增强图像避开大面积的坏死、钙化、出血或大血管等,避开病变边缘区域及异常高信号的伪影。在肝组织手动选取面积为100~200 mm2的圆形ROI,避免大血管及大面积伪影。参考文献[21],分别在未饱和的M 图上测量肿瘤及肝实质ROI 在3.5 ppm 处非对称磁化传递率的均数和标准差,在3D-APTw 图上测量肿瘤及肝实质ROI 的APTw 值的均数和标准差,分别测量三次取的平均值。观察者1在一周后进行第二次测量。
参照文献[20],按照以公式(1)~(2)得出3D-APTw图像的信噪比SNRAPTw及肝癌的对比噪声比CNR肝癌。
其中,SNRI0为M 图病变均数/标准差,SNRAPTw为APT 图 信 噪 比,APTw肝癌为 肝 癌APTw 均 数,APTw肝质为肝实质APTw 均数,SD肝癌为肝癌APTw值标准差,SD肝质为肝实质APTw 值标准差,TR 为5.1,NSA 为3。
1.4 统计学分析
使用SPSS 25.0 软件(IBM Corporation,USA)进行统计分析。采用Kendall 一致性系数对观察者内及观察者间主观评分进行一致性分析。协调系数r<0.2 表示一致性较差,0.2~<0.4 表示一致性一般,0.4~<0.6 表示一致性中等,0.6~<0.8 表示一致性较强,0.8~1.0表示一致性很强。3D-APTw 图像SNR 及肝癌CNR 用均数±标准差表示。计算3D-APTw 图像SNR、肝癌CNR、肝癌和肝实质APTw 值的变异系数(计算方法为标准差/均数)。SNR、CNR、肝癌和肝实质APTw 值采用计算组内相关系数(intraclass correlation coefficient, ICC)分析观察者间和观察者内部的一致性。ICC>0.75 表示较高的一致性;0.60~0.75 表示一致性好;0.40~<0.60 表示一致性一般;<0.40 表示一致性差。采用非参数秩和检验的2 个独立样本Mann-WhitneyU检验分析肝癌和肝实质间APTw 值的差异性。P<0.05 为差异有统计学意义。
2 结果
145 名患者中影像或病理诊断为非原发性肝癌患者36 例(血管瘤18 例,转移16 例,脓肿2 例),最终纳入109例原发性肝癌患者,在109例患者中有11例患者3D-APTw 图像中病变区域无信号视为扫描失败,扫描成功率为89.91%(98/109)。其中8例患者病变位于肝脏边缘,2例患者扫描范围未包含病变,1例扫描范围内大部分均无信号。
2.1 主观评分
扫描成功的98 例患者的年龄为19~87(60.78±11.48)岁,男74 例,女24 例。肝细胞癌患者83 例,肝内胆管癌患者15 例。76 例患者有1 个病灶,11 例患者包含2 个病灶,11 例患者病变数目大于2 个。肿瘤长径平均数为(6.59±3.71)cm。手术切除者63 例,肝动脉灌注化疗栓塞或消融治疗21 例,化疗或靶向免疫治疗者12例,未治疗者2例。
医师1 及医师2 对3D-APTw 图像的主观评分见表2。观察者内及观察者间的主观评分一致性较强,协调系数分别为0.771 和0.692,P<0.001。共20 例3D-APTw 图像的主观评分为1 分及2 分,其中7 例病变位于肝顶,7例位于胆囊旁或肝脏大血管旁,6例位于肝脏边缘。3D-APTw 图像的主观评分为3 分以上者共有78名患者,计算成功率为71.56%(78/109)。

表2 两名医师对3D-APTw图像主观评分结果Tab.2 Evaluation results of two raters on the display effect of 3D-APTw images on lesions
2.2 主观评分3 分以上的肝癌和肝实质APTw 值、SNR和CNR及变异系数
将主观评分3 分以上的78 例肝癌患者纳入计算成功组,其中男58 例,女20 例,年龄19~87(60.62±11.61)岁,肿瘤最大径2~19(6.86±4.00)cm。经测量,原发性肝癌和肝实质APTw 值分别为(2.55±0.08)%、(1.45±0.07)%,两者间差异有统计学意义(P<0.01,Z=-8.247)(图3~5)。肝癌和肝实质APTw 值的变异系 数 分 别 为30.40% 和44.40%。SNR 和CNR 为25.92±18.50 和3.35±3.20,SNR 变异系数为71.40%,CNR变异系数为90.00%。
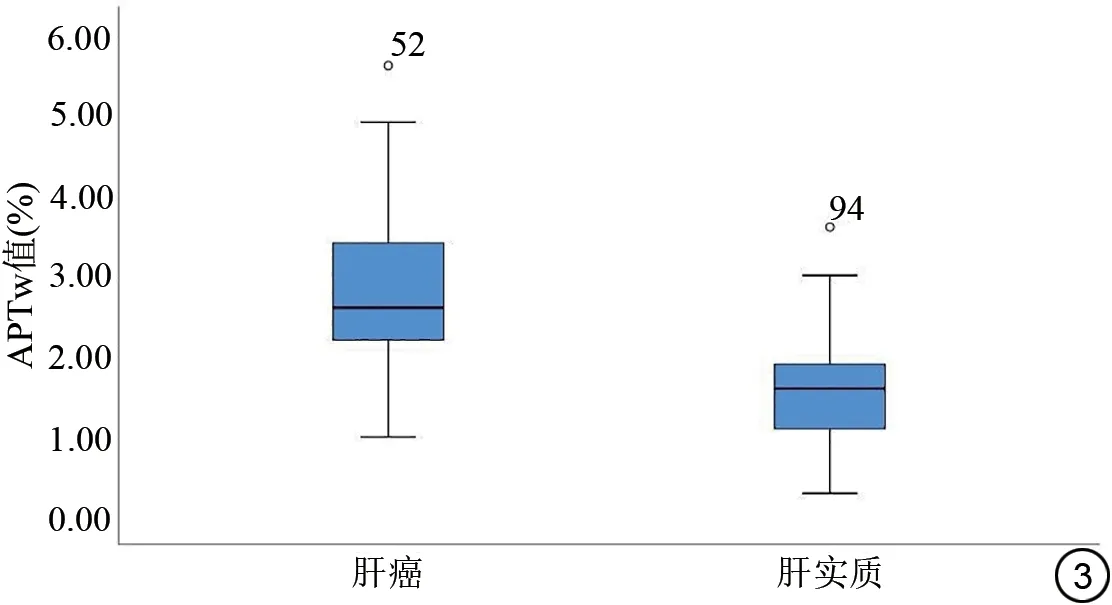
图3 肝癌及肝实质APTw值间比较。APTw:酰胺质子转移加权。Fig.3 Comparison of APTw value between primary liver cancer and liver parenchyma.APTw: amide proton transfer-weighted.

图4 男,53 岁,肝细胞癌。4A~4F 分别为T1WI、T2WI、动脉期、静脉期、延迟期及3D-APTw 图像。肿瘤组织APTw 值为2.3%,肝实质APTw 值为1.1%。 图5 女,66 岁,肝内胆管癌。5A~5F 分别为T1WI、T2WI、动脉期、静脉期、延迟期及APTw 图像。肿瘤组织APTw 值为3.0%,肝实质APTw 值为0.3%。3D-APTw:三维酰胺质子转移加权;APTw:酰胺质子转移加权。Fig.4 A 53-year-old man with hepatocellular carcinoma patient.4A-4F are T1WI, T2WI, arterial image, venous image, delayed image and 3D-APTw image.APTw value of hepatocellular carcinoma is 2.3%, APTw value of liver parenchyma is 1.1%.Fig.5 A 66-year-old woman with intrahepatic cholangio carcinomas patient.5A-5F are T1WI, T2WI, arterial image, venous image, delayed image and APT image.APTw value of intrahepatic cholangiocarcinomas is 3.0%, APTw value of liver parenchyma is 0.3%.3D-APTw: 3 dimensions-amide proton transfer-weighted; APTw: amide proton transfer-weighted.
2.3 肝癌和肝实质APTw 值、SNR 值和CNR 值的测量一致性分析
肝癌APTw 值观察者间及观察者内具有较高的一致性(ICC>0.75),肝癌3D-APTw 图像CNR 观察者间一致性一般,3D-APTw 图像SNR 观察者内一致性差,其余指标观察间及观察者内一致性好(表3)。

表3 肝癌APTw值、肝实质APTw值、SNR及CNR观察内和观察者间一致性Tab.3 Intra- and inter-observer consistency of liver cancer APTw value, liver parenchyma APTw value,SNR, and CNR
3 讨论
本研究探索了3D-APTw成像序列在原发性肝癌扫描的临床可行性,结果显示肝脏3D-APTw 扫描成功率为89.91%,计算成功率为71.56%。3D-APTw 图像主观评分观察内及观察者间一致性较强,肿瘤组织APTw 值的可重复性高于肝实质APTw 值、SNR 和CNR。肿瘤组织APTw 值高于肝实质。本研究是国内首次探讨3D-APTw成像序列在原发性肝癌临床扫描的可行性研究。
3.1 原发性肝癌3D-APTw 成像的成功率及图像质量评价
本研究得到的肝脏3D-APTw 扫描成功率为89.91%,计算成功率为71.56%,高于SEO 等[22]研究的62.1%,这是由于以往的APTw 成像在肝脏扫描可行性及肿瘤诊断方面的研究[15,22-23]采用的均是2D 扫描,只能采集得到一层图像,成功率比较低。本研究采用3D 扫描,扫描范围大,可以在一定程度上减少呼吸运动的影响,也和机器硬件及软件的改进有关系,这是3D-APTw成像在原发性肝癌或者肝脏病变扫描的优势所在。由于APTw图像分辨率低,无法显示病变的范围,因此本研究利用APTw 图像与T2WI 融合技术,由于两个序列均为自由呼吸,层厚也一致,借助于T2WI图像的解剖定位有助于病变的显示及ROI的画取。在本研究中大约10%的病例扫描失败,这些病例的病变主要位于肝脏边缘区域,这个位置更容易受到B0 磁场的不均匀性、空气或肋骨的影响导致信号缺失。
本研究对扫描成功病例的3D-APTw图像进行主观评分,观察者间及观察者内主观评分一致性较强。大约20%的病例在肝实质及病变内会存在不同程度的信号缺失或高信号伪影,在肝脏边缘区域、胆囊旁或大血管旁的区域其信号缺失或高信号伪影的发生率更高、所占的比例更大,可能是由于水与酰胺质子间的过度交换(比如血液、细胞质、或其他体液中的蛋白质和肽),也可能受到核奥式效应以及传统磁化传递效应的干扰导致APTw 高信号[21]。另外肝内的门脉系统及肝动脉具有较高的APTw 值[15],也会延伸至血管附近的肿瘤组织或肝质,从而出现高信号伪影。肝脏是运动器官,受患者呼吸运动影响较大,本研究在扫描前对患者进行了呼吸训练,但由于大部分患者为老年人,难以实现保证机器响时处于呼气末状态,这也会影响图像质量及APTw值。
3.2 APTw鉴别原发性肝癌及肝实质的价值
本研究结果显示原发性肝癌肿瘤组织的APTw值高于肝实质,且两者间的差异有统计学意义。这与APTw 在胶质瘤[24-25]、甲状腺癌[26]、子宫内膜癌及宫颈癌[27-28]的发现一致,先前的研究表明,APTw 值越高,细胞增殖率越高,而且与肝癌的病理分级存在正相关的关系。原发性肝癌的APTw 值升高可能是由于肿瘤组织增殖旺盛,肿瘤内蛋白质或多肽的含量明显增加,也可能是因为肿瘤组织生长活跃导致其微环境发生改变。以往的研究结果显示APTw 值在区分不同肿瘤方面有很大的潜力[29-31],由于本研究中肝内胆管癌样本量小,仅15例,本研究未对肝内胆管癌和肝细胞癌APTw值的差异进行进一步分析。
3.3 原发性肝癌、肝实质、3D-APTw SNR及CNR测量可重复性及一致性
CHEN 等[17]首次评价了3.0 T MRI APTw 成像技术在大鼠及人类肝脏扫描中的可重复性,结果显示健康志愿者的APTw成像两次扫描的可重复性良好。本研究结果显示肝癌APTw 值的测量可重复较高,ICC 大于0.75,表明肿瘤组织APTw 值的可重复性较高。然而肝实质APTw 值、SNR 和CNR 的重复测量一致性一般,并且肝脏APTw 图像的SNR 及原发性肝癌的CNR 变异系数比较大,不同患者的结果差异也较大,分析原因可能是本研究的患者均是原发性肝癌患者,大部分为中老年人,呼吸幅度和节律较健康志愿者稳定性差,另外肝脏实质APTw值容易受肝内血管、胆管、邻近胆囊或伪影的影响,为了减少这些影响,本研究肝实质的ROI 范围较小,测量结果与ROI 的位置及大小也有一定关系。也可能与患者肝硬化的程度及原发性肝癌的病理分级不同有关。
3.4 本研究的局限性
本研究还有一定的局限性:(1)本研究只是局限在3D-APTw成像在原发性肝癌中的扫描及诊断可行性,没有纳入其他肿瘤,且由于肝内胆管癌样本量小,未分析原发性肝癌病理亚型间APTw 值的差异性,后续将进一步扩大样本量研究3D-APTw 成像在肝脏肿瘤性病变诊断及鉴别诊断的价值;(2)肝脏的3D-APTw 成像仍处于起步阶段,在本研究的一些病例中,3D-APTw 成像容易受到运动伪影、胆囊或血液循环的影响,图像会有较重的伪影或信号缺失,在3D-APTw 成像技术或参数设置方面仍然需要进一步地改善;(3)本研究尚未结合MRI 信号及增强特点,也未分析原发性肝癌病理分级与肿瘤APTw 值的关系,下一步将探讨原发性肝癌APTw 值、MRI 信号及强化特点和病理特征之间的相关性。
4 结论
综上所述,可以使用3D-APTw 技术进行肝脏原发恶性肿瘤成像,提供了一种新的临床定量评估指标。但仍然有一些病例会受呼吸运动、胆囊或血管的影响而出现信号缺失或大面积高信号伪影,在参数设置及成像技术上仍有需要改进和提高的空间,以进一步优化其图像质量,为进一步挖掘该技术在原发性肝癌诊断及预后预测方面的潜能提供可靠且有力的技术基础。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:王琦设计本研究的方案,对稿件重要内容进行了修改;齐晓辉起草和撰写稿件,分析和解释本研究的数据,并获得河北省卫生和计划生育委员会科研基金项目资助;沈智威对本研究方案的技术进行指导,解释扫描参数及部分数据,对稿件重要内容进行了修改;段梦婷、贾丽涛和杜煜获取、分析本研究病例及数据、对稿件的重要内容进行了修改;刘响、潘江洋、范雪丽和王亚宁获取、分析或解释本研究的数据并进行统计,对稿件重要的内容进行了修改。全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

