子宫性不孕的多参数MRI、MR-HSG及临床特征分析
王洁,段娜,王绍娟,胡旭宇,任帅,殷燕云,王中秋*
0 引言
不孕症指1 年及以上无保护规律性生活后未能成功怀孕,其中35 岁及以上女性超过6 个月未孕即可诊断[1]。女性不孕症常见病因有输卵管疾病(约40%)、卵巢排卵障碍(20%~30%)、子宫异常(15%~20%)及不明原因不孕(10%)等[2-5]。子宫是胚胎着床及维持妊娠至足月的关键器官,而生育年龄的推迟、反复刮宫流产后子宫内膜的损伤、剖宫产盛行后的瘢痕子宫形成、受雌激素影响的子宫肌瘤等改变正损害育龄女性的生育潜力[6-7]。近年来子宫性不孕(uterine factor infertility, UFI)呈上升趋势[8]。因此,明确诊断有生育能力风险,甚至是不孕唯一原因的子宫疾病,及早采取临床干预措施,对不孕症患者的妊娠结局至关重要。
临床常用诊断子宫的方法有超声、MRI、腹腔镜或宫腔镜等。传统X 线子宫输卵管造影不能检查宫腔轮廓外及卵巢的病变,且有辐射;子宫输卵管超声造影从二维发展至四维,尽管可辨别不孕相关的宫腔病变,但是受限于对比剂及图像分辨率,且一定程度上依赖操作者的经验;而磁共振子宫输卵管造影(magnetic resonance hysterosalpingography, MR-HSG)一站式检查能准确评价子宫、输卵管及卵巢异常,而且安全无创、观察者依赖性小,在女性不孕症诊断中有良好的应用前景[9-10]。课题组前期研究表明MR-HSG技术对输卵管及卵巢性不孕有明确的诊断价值,但对不孕症相关子宫疾病的评价未予总结[2-3,10-11]。此外,目前文献多应用MR-HSG 技术聚焦输卵管的通畅性,对于不孕症相关的子宫异常缺乏深度研究[12-14]。而MRI 联合MR-HSG 既能多角度可视化子宫腔内异常如宫腔粘连、子宫内膜息肉、黏膜下肌瘤等,又能识别子宫外部轮廓及子宫肌层病变,尤其对先天性子宫畸形的鉴别诊断具有显著优势,是诊断器质性UFI 病因最准确的影像学检查技术[15-16]。因此,本研究应用多参数MRI 及MR-HSG 技术,随访UFI 患者经中西医治疗1 年后的妊娠情况,分析UFI相关的风险因素并建立妊娠预测模型,为临床诊疗提供影像学依据。
1 材料与方法
1.1 一般资料
本研究严格遵循《赫尔辛基宣言》,并经江苏省中医院(南京中医药大学附属医院)伦理委员会批准,免除受试者知情同意,批件号:2016NL-005-02。回顾性分析自2016 年9 月至2022 年8 月于江苏省中医院(南京中医药大学附属医院)行MRI及MR-HSG检查的1 835 例女性不孕症患者的临床及影像资料,排除卵巢、输卵管异常及不明原因不孕等病例后有312 例子宫器质性病变患者,经中西医治疗后1 年内随访妊娠结局,分析比较已孕组和未孕组患者的临床基线资料、性激素及影像资料。
纳入标准:(1)年龄20~45 岁;(2)规律且无保护性生活≥1 年无孕,≥35 岁女性超过6 个月未孕。排除标准:(1)男性伴侣不育;(2)生殖激素异常;(3)图像质量不合格即因推注对比剂患者疼痛产生运动伪影,影响图像观察及诊断;(4)卵巢性不孕(包括多囊卵巢综合征、卵巢子宫内膜异位症、卵巢萎缩、卵巢术后、卵巢良恶性肿瘤等);(5)MRI及MR-HSG 排除输卵管不孕(包括输卵管阻塞、积水、宫外孕史)、不明原因不孕及子宫先天畸形;(6)失访病例。UFI 的多参数MRI、MRI-HSG 表现及临床特征分析研究流程图见图1、图2。随访临床妊娠定义为人绒毛膜促性腺激素升高、超声检查宫内妊娠3个月以上。
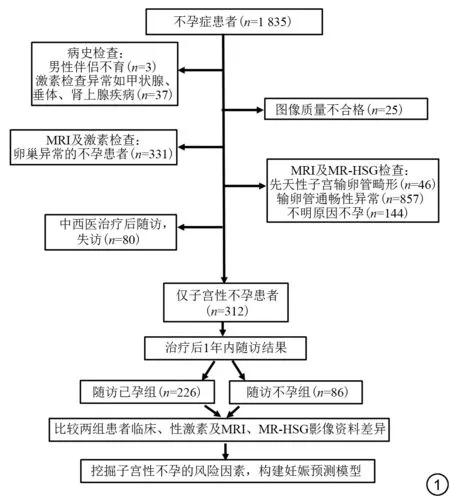
图1 UFI的多参数MRI、MR-HSG 及临床特征分析研究流程图。UFI:子宫性不孕;MR-HSG:磁共振子宫输卵管造影。Fig.1 Flowchart of multiparametric MRI, MR-HSG and clinical characteristics of UFI.UFI: uterine factor infertility; MR-HSG: magnetic resonance hysterosalpingography.
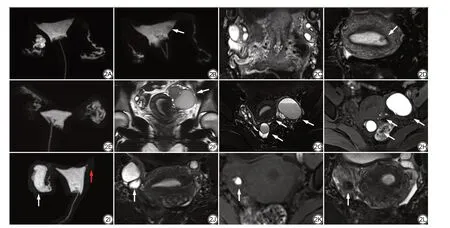
图2 UFI 患者纳入、排除的MRI 及MR-HSG 具体表现。2A~2D:25 岁,原发性不孕1 年。MR-HSG(2A)示双侧输卵管通畅,重建后多角度旋转示宫腔局部充盈缺损(2B,箭);冠状位T2-FS(2C)示双侧卵巢显示清晰,右侧卵巢见优势卵泡;轴位T2-FS(2D)示宫腔内低信号影(箭);经宫腔镜确诊左侧宫角息肉。本例仅有子宫异常,纳入研究。2E~2H:28岁,原发性不孕1年,3年前行右侧卵巢囊肿剥除术。MR-HSG(2E)示右侧输卵管通畅,左侧输卵管通而欠畅;2F~2H示左侧卵巢、子宫直肠窝、子宫后壁浆膜下异常信号影(箭),冠状位T2WI可见左侧卵巢高信号影(箭),子宫扭曲(2F),轴位T2-FS(2G)呈高信号,部分病灶内见阴影征(箭),轴位T1-FS(2H)呈均匀高信号(箭),提示左侧卵巢、子宫直肠窝、子宫后壁浆膜下多发子宫内膜异位灶。本例输卵管、卵巢、子宫均有异常,予以排除。2I~2L,34岁,继发性不孕1年余,备孕二胎,自诉近1年下腹疼痛间作。MR-HSG(2I)示右侧输卵管积水呈管状扩张(白箭),左侧输卵管近端堵塞(红箭);轴位T2-FS(2J)示右侧输卵管扩张积水扭曲(箭);2K~2L 示右侧卵巢类圆形异常信号影,轴位T1-FS(2K)呈高信号(箭),轴位T2-FS(2L)呈低信号(箭),提示右侧卵巢子宫内膜异位囊肿。本例输卵管、卵巢均有异常,子宫无器质性异常,予以排除。UFI:子宫性不孕;MR-HSG:磁共振子宫输卵管造影;FS:脂肪抑制。Fig.2 Manifestations of MRI and MR-HSG in inclusion and exclusion of UFI patients.2A-2D: A 25-year-old woman with primary infertility for 1 year.MR-HSG(2A) shows patent bilateral fallopian tubes, with a local filling defect in the uterine cavity after reconstruction (2B, arrow); coronal T2-FS image (2C) reveals clear visualization of both ovaries, with a dominant follicle on the right ovary; axial T2-FS image (2D) shows a low signal shadow in the uterine cavity (arrow); which is a polyp in the left uterine horn confirmed by hysteroscopy.The case is included in the study because only the uterus is abnormal.2E-2H: A 28-year-old woman with primary infertility for 1 year and a history of right ovarian cyst removal 3 years ago.MR-HSG (2E) shows a patent right fallopian tube and a patent but not smooth left fallopian tube; 2F-2H: There are multiple abnormal signal shadows on the left ovary, recto-uterine pouch, and the serosa of the uterus (arrows), coronal T2WI(2F) displays a high signal shadow in the left ovary (arrow) and the morphology of uterine cavity distortion, the shading sign is visible in some lesions on the axial T2-FS (2G, arrow) and all lesions show a uniform high signal on the axial T1-FS (2H, arrow), which suggest multiple endometriotic foci on the left ovary, recto-uterine pouch, and the serosa of the uterus.This case involves the fallopian tubes, ovaries, and uterus, and is therefore excluded.2I-2L: A 34-year-old woman with secondary infertility for more than 1 year, preparing for a second child, and complaining of intermittent lower abdominal pain for the last year.MR-HSG (2I) shows hydrosalpinx with tubal dilation in the right fallopian tube (white arrow) and proximal obstruction in the left fallopian tube (red arrow); axial T2-FS (2J) shows dilated and distorted right fallopian tube (arrow); 2K-2L: There is a circular abnormal signal on the right ovary, with high signal on T1-FS (2K, arrow) and low signal on T2-FS (2L, arrow),indicating an endometriotic cyst on the right ovary.The findings suggest abnormalities on the fallopian tubes and ovaries, while the uterus shows no organic abnormalities, leading to exclusion.MR-HSG: magnetic resonance hysterosalpingography; UFI: uterine factor infertility; FS: fat suppression.
1.2 临床病史及性激素检查
收集子宫异常不孕患者临床病史资料包括年龄、身体质量指数(body mass index, BMI)、不孕时间及类型(原发或继发不孕)、月经相关情况及性激素结果(MRI 检查当月),包括卵泡刺激素(follicle-stimulating hormone, FSH)、黄 体 生 成 素(luteinizing hormone, LH)、雌二醇(estradiol, E2)、睾酮(testosterone, T)、孕酮(progesterone, P)、泌乳素(prolactin, PRL)、抗苗勒氏管激素(anti-Müllerian hormone, AMH)。
1.3 MRI检查方法
所有研究对象均于月经结束后3~7 d内完成3.0 T盆腔MRI 及MR-HSG 检查,技术规范参照输卵管造影中国专家共识(2022 版)[17]。采用德国西门子(Siemens Magnetom Verio)3.0 T MRI 扫描仪,6 通道躯干相控阵列表面线圈。患者取仰卧位,行常规盆腔扫描,包括轴位T1WI(TR 712 ms,TE 12 ms,层厚4 mm)、轴位T2WI(TR 5 810 ms,TE 94 ms,层厚4 mm)、矢状位脂肪抑制T2WI(TR 3 000 ms、TE 85 ms,层厚3 mm)。后常规外阴消毒引入内窥器暴露宫颈,置输卵管造影导管于宫腔并注射生理盐水2~3 mL 固定。采用三维脂肪抑制T1WI 梯度回波动态增强序列扫描(TR 3.25 ms,TE 1.22 ms,层厚0.7 mm),共扫描4 期,每期16 s,同时手动注射20 mL MR-HSG 对比剂钆喷酸葡胺(马根维显,拜耳公司),每期注射5 mL,重建生成减影和最大信号投影图像。2 min 后采用快速T1WI 脂肪抑制轴位序列(TR 3.96 ms,TE 1.39 ms,层厚3 mm)评估对比剂盆腔弥散情况。
1.4 图像分析
图像由两名10年以上妇科影像诊断经验的副高级职称医师独立阅片。MR-HSG 排除输卵管相关异常,多参数MRI及临床病史排除卵巢性不孕、不明原因不孕及子宫先天畸形。UFI 因素包括子宫内膜厚度异常(<5 mm 或>10 mm),子宫肌瘤(单发或多发、大小及位置),子宫腺肌症(局灶或弥漫),子宫内膜息肉、瘢痕子宫、宫腔粘连、子宫颈管多发囊肿等,诊断结果有异议通过讨论达成一致。
1.5 统计学分析
采用SPSS 26.0 软件分析数据。计量资料用Kolmogorov-Smirnov 方法进行正态性检验,符合正态分布的计量资料以均值±标准差表示,两组间比较采用独立样本t检验;非正态分布计量资料以中位数( 四分位数间距)表示,两组间比较采用Mann-WhitneyU检验。计数资料用n(%)表示,组间比较采用χ2检验或Fisher 确切概率法。先后采用单因素、多因素logistic回归分析UFI的风险因素。根据单因素分析结果,将所有P<0.1的参数纳入多因素分析,差异有统计学意义的参数采用logistic回归输入法构建临床参数模型、临床与MRI 及MR-HSG 联合模型,进一步绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC)、敏感度和特异度。采用DeLong 检验比较模型间的预测效能。P<0.05 为差异有统计学意义。
2 结果
2.1 UFI 患者治疗后已孕组与不孕组临床表现、性激素比较分析
本研究共纳入病例312 例,年龄21~43(31.60±3.58)岁,MRI诊断黏膜下肌瘤、宫腔粘连及子宫内膜息肉均于本院行宫腔镜手术并病理证实。其余病例经药物调理治疗。一年后随访不孕组86例(27.6%),已孕组226 例(72.4%)。两组间的年龄、月经周期不规律差异有统计学意义(P<0.05),年龄与妊娠结局呈负相关,不孕组的年龄高于已孕组(34.00±4.24 vs.30.00±2.65),30 岁以上不孕组比例高于已孕组,其中>35 岁组尤为明显(27.91% vs.4.42%);不孕组月经周期不规律的比例高于已孕组(94.19% vs.83.19%);其他临床资料如BMI、不孕时间、月经期长、原发继发不孕及性激素检查(FSH、LH、E2、T、P、PRL、AMH)结果两组间差异均无统计学意义(P>0.05)(表1)。
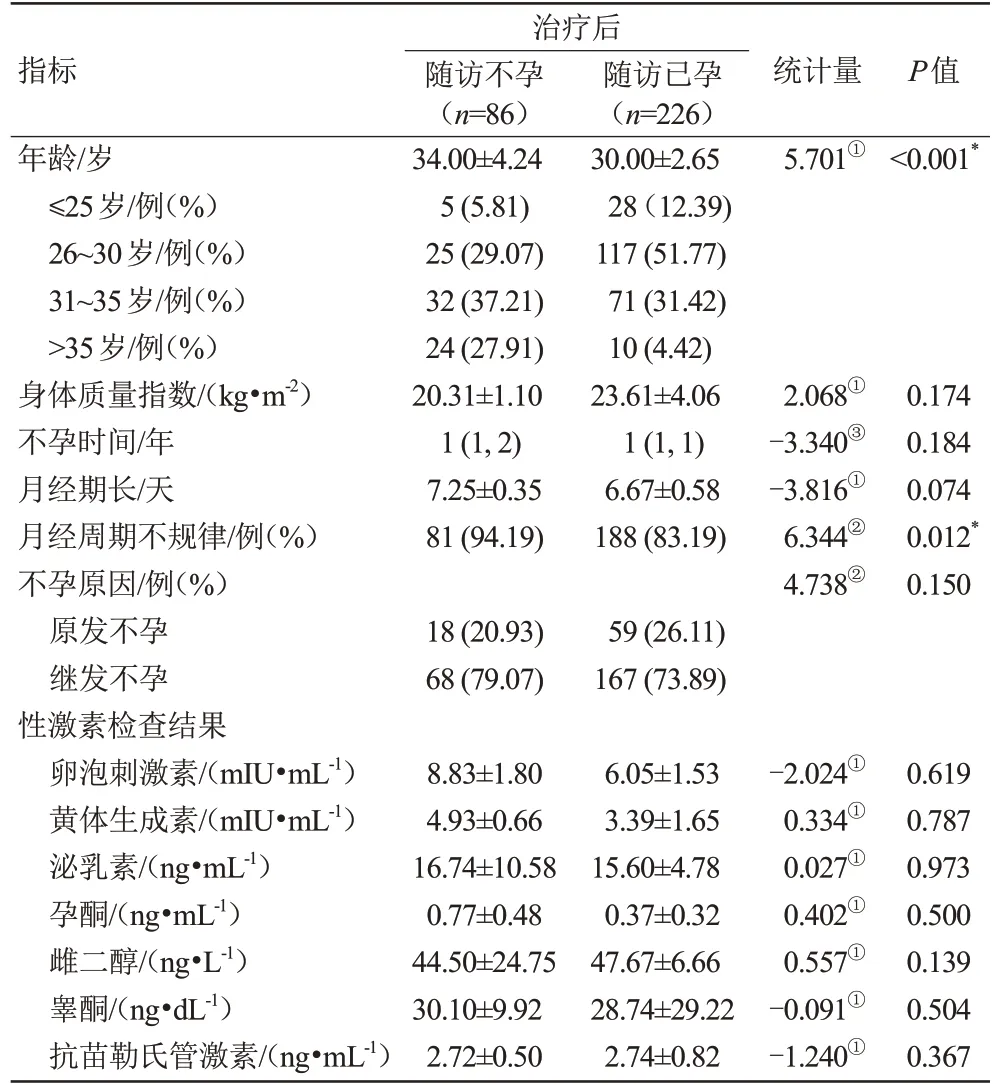
表1 UFI治疗后不孕组与已孕组临床表现、性激素比较分析Tab.1 Comparison of clinical data and sex hormones between the infertile group and the pregnant group after treatment of UFI patients
2.2 UFI 患者治疗后不孕组与已孕组影像资料比较分析
两组间子宫肌瘤的数量和位置、瘢痕子宫及宫腔粘连差异有统计学意义(P<0.05,表2)。子宫多发肌瘤不孕组的比例(17.44%,15/86)显著高于已孕组(4.87%,11/226);仅位于黏膜下的肌瘤均在不孕组(4.65%,4/86),仅位于肌壁间或浆膜下肌瘤的比例两组相近,两个位置同时出现肌瘤的不孕组显著高于已孕组。瘢痕子宫不孕组的比例(22.09%,19/86)高于已孕组(9.29%,21/226)。瘢痕残余肌层厚度不孕组[(0.53±0.09)mm]和已孕组[(0.62±0.15)mm]差异无统计学意义(P>0.05)。宫腔粘连比例不孕组(13.95%,12/86)高于已孕组(6.64%,15/226)。其他如子宫内膜厚度、子宫肌瘤大小、子宫腺肌症(局灶或弥漫)、子宫内膜息肉、子宫颈管纳氏囊肿两组间差异均无统计学意义(P>0.05,表2)。

表2 UFI患者治疗后不孕组与已孕组影像资料比较分析Tab.2 Comparison of imaging data between the infertile group and the pregnant group after treatment of UFI patients
2.3 UFI危险因素的logistic回归分析
单因素分析显示不孕与年龄、月经周期不规律、子宫肌瘤(肌瘤位置及肌瘤数量)、瘢痕子宫及宫腔粘连密切相关(P<0.05)。多因素分析证实年龄、子宫多发肌瘤、宫腔粘连差异有统计学意义,年龄[OR=0.822,95% 置信区间(confidence interval,CI):0.759~0.891;P<0.001]、子 宫 多 发 肌 瘤[OR=0.540(95%CI:0.375~0.777);P=0.002]、宫腔粘连[OR=0.367(95%CI:0.144~0.938);P=0.036]是UFI的独立危险因素(表3、图3)。

表3 UFI相关的危险因素logistic回归结果Tab.3 Logistic regression analysis to predict risk factors associated with UFI
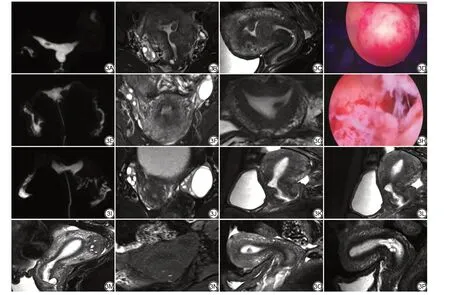
图3 UFI患者多参数MRI、MR-HSG影像及宫腔镜表现。3A~3D:27岁,原发性不孕1年。MR-HSG(3A)示双侧输卵管通畅,右侧宫角充盈缺损;轴位(3B)及矢状位(3C)T2-FS示子宫多发黏膜下及肌壁间多发低信号影,突向宫腔,提示为子宫多发黏膜下及肌壁间肌瘤;宫腔镜(3D)下肌瘤切除术所见,随访未孕。3E~3H:33岁,继发性不孕3年,3年前行清宫术。MR-HSG(3E)示双侧输卵管通畅;轴位T2-FS(3F)示双侧卵巢显示清晰,轴位T2-FS(3G)示左侧宫角条状低信号影;宫腔镜(3H)确诊宫腔粘连并行粘连松解术,随访未孕。3I~3L:34岁,继发性不孕1年余,备孕二胎。经间期点滴出血,MR-HSG(3I)示双侧输卵管通畅;轴位T2-FS(3J)示双侧卵巢显示清晰;矢状位T2-FS(3K~3L)示子宫前壁肌层不连续,部分缺如(3K),提示为子宫瘢痕憩室,残余肌层最薄处厚约5 mm(3L),随访已孕。3M~3N:32岁,原发性不孕1年。矢状位T2-FS(3M)示子宫底后壁类圆形低信号,内见囊状高信号,其内高信号灶轴位T1-FS(3N)亦呈高信号,提示子宫底后壁腺肌瘤,随访已孕。3O:29岁,继发性不孕2年。矢状位T2-FS示宫腔内低信号,宫腔镜证实为子宫内膜息肉并切除,随访已孕。3P:34岁,继发性不孕1年。矢状位T2-FS示宫颈内口多发囊状高信号,提示纳氏囊肿,随访已孕。UFI:子宫性不孕;MR-HSG:磁共振子宫输卵管造影;FS:脂肪抑制。Fig.3 Multiparametric MRI, MR-HSG images and hysteroscopic presentation of UFI patients.3A-3D: A 27-year-old with primary infertility for 1 year.MR-HSG(3A) shows patent bilateral fallopian tubes, with filling defect in the right uterine horn.There are multiple low-signal shadows protruding into the uterine cavity between the submucosa and the muscle layer of the uterus on axial T2-FS (3B) and sagittal T2-FS (3C), suggesting multiple submucosal and intramural fibroids in the uterus.The patient is still infertile after hysteroscopic myomectomy performed (3D).3E-3H: A 33-year-old with secondary infertility for 3 years, who underwent a hysterectomy 3 years ago.MR-HSG (3E) shows patent bilateral fallopian tubes; axial T2-FS image (3F) shows clear bilateral ovaries; axial T2-FS image (3G)shows linear low signal in the left uterine horn; intrauterine adhesion is confirmed by hysteroscopy (3H) and adhesion release is performed, but pregnancy does not occur on follow-up.3I-3L: A 34-year-old with secondary infertility for more than 1 year, preparing for the second child, experiencing intermenstrual spotting bleeding.MR-HSG (3I) shows patent bilateral fallopian tubes; axial T2-FS image (3J) shows clear bilateral ovaries; sagittal T2-FS image (3K) shows the discontinuity of the anterior wall muscle layer of the uterus, with partial absence, suggesting a uterine scar diverticulum, with the thinnest residual muscle layer measuring approximately 5 mm (3L).Despite this, the patient achieves a pregnancy on follow-up.3M-3N: A 32-year-old with primary infertility for 1 year.Sagittal T2-FS image (3M) shows a round low-signal lesion in the posterior wall of the uterine fundus, with cystic high-signal areas inside; the inside high signal areas also show high signal on the axial T1-FS (3N), suggesting adenomyoma.The patient achieves a pregnancy on follow-up.3O: A 29-year-old with secondary infertility for 2 years.Sagittal T2-FS image shows low signal within the uterine cavity.Hysteroscopy confirms endometrial polyp and resection.The patient achieves a pregnancy on follow-up.3P: A 34-year-old with secondary infertility for 1 year.Sagittal T2-FS image shows multiple high signal cysts in the endocervix, suggesting Nabothian cysts.The patient achieves a pregnancy on follow-up.UFI: uterine factor infertility; MR-HSG: magnetic resonance hysterosalpingography; FS: fat suppression.
2.4 各模型预测UFI的ROC结果
ROC 分析显示年龄预测模型AUC 为0.694(95%CI:0.592~0.795);年龄+宫腔粘连预测模型AUC为0.745(95%CI:0.656~0.845);年龄+子宫多发肌瘤预测模型AUC 为0.796(95%CI:0.714~0.876);年龄+子宫多发肌瘤+宫腔粘连联合预测模型AUC为0.809(95%CI:0.728~0.889)(图4)。多参数联合模型AUC 值超过0.8(为0.809),结果有一定准确性,DeLong 检验比较多参数联合模型与其余模型的AUC 值,与年龄模型差异具有统计学意义(P<0.05),而与年龄+宫腔粘连预测模型、年龄+子宫多发肌瘤预测模型差异无统计学意义(P>0.05)。
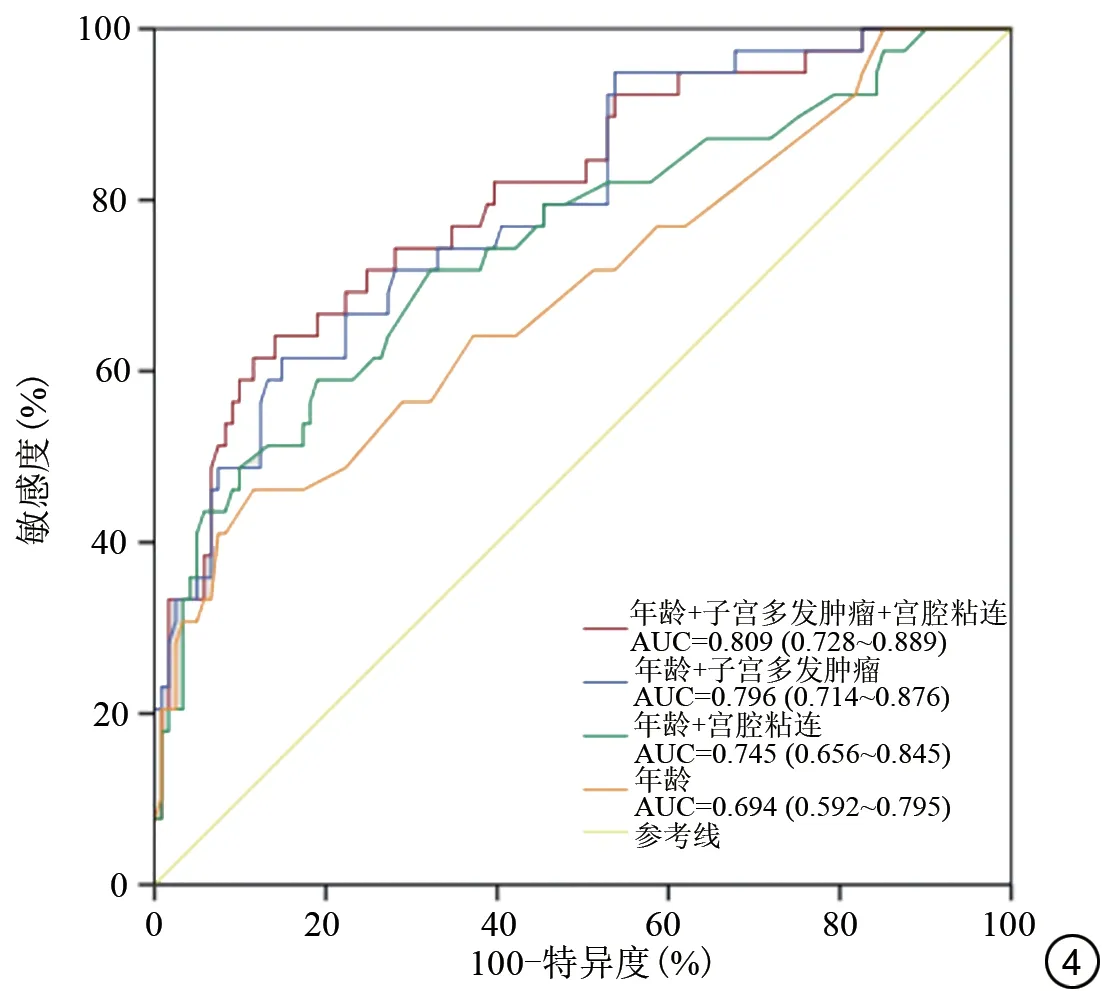
图4 各模型预测UFI 的受试者工作特征曲线。UFI:子宫性不孕;AUC:曲线下面积。Fig.4 The receiver operating characteristic curves of each model for predicting UFI.UFI: uterine factor infertility; AUC: area under the curve.
3 讨论
多参数MRI 及MR-HSG 技术安全无创、患者疼痛感轻、并发症少,有助于临床医生对育龄期女性不孕原因进行详细评估,在准确、有效可视化输卵管通畅性的同时,还能精准诊断宫腔内外及卵巢的器质性异常,尤其是不孕相关的子宫异常,敏感度、特异度可达腹腔镜标准[18-19]。本研究收集1 835 例不孕症患者的临床资料、生化检查指标、多参数MRI 及MR-HSG 特征,着眼其中312例仅有子宫异常的不孕患者,通过治疗后的怀孕情况,比较已孕组和不孕组的临床指标及子宫异常差异,分析子宫疾患与不孕的相关性,建立妊娠预测模型。本研究发现较大年龄、子宫多发肌瘤及宫腔粘连是女性UFI 的风险因素,进一步细化了影响女性不孕的子宫因素,为临床制订个体化的诊疗方案作参考,联合模型对UFI患者预测妊娠有较高价值。
3.1 年龄与UFI
不孕组女性年龄明显大于已孕组,年龄与妊娠结局呈明显负相关,与既往研究一致[20]。本研究中30岁以上不孕组比例高于已孕组,>35岁不孕组尤为明显,而随着年龄减小,经治疗1 年后怀孕比例明显增高。女性的生育能力在22~26岁之间达到顶峰,与年龄相关的生育能力下降在35 岁尤为明显,妊娠几率随着年龄的增长明显降低[21-22]。此外,随着年龄增长女性更易罹患子宫疾病如子宫肌瘤、子宫腺肌症、子宫内膜息肉等损害生育能力的疾患。因此,从优生优育层面,适龄婚育尤为重要。
3.2 子宫肌瘤与UFI
子宫肌瘤是导致女性不孕及反复流产的常见原因,MRI 诊断肌瘤的准确率高达92%[23-24]。目前有研究认为肌壁间肌瘤和黏膜下肌瘤影响生育,黏膜下肌瘤与大于4 cm 的扭曲宫腔的肌壁间肌瘤对胚胎植入有不利影响,而浆膜下肌瘤对生育无明显影响[8,25]。另一项研究表明,不侵犯子宫内膜腔的小肌瘤不影响女性的生育能力[26]。本研究中子宫多发肌瘤是UFI 的独立危险因素。子宫多发肌瘤可能通过导致子宫内膜腔扭曲、子宫收缩力异常、子宫内膜血供减少和子宫内膜容受性改变,从而影响生育力,导致不孕,该观点也见于其他研究报导[27]。本研究中黏膜下肌瘤经宫腔镜摘除,肌壁间肌瘤较小,无扭曲宫腔的改变,不影响受精卵着床,故子宫肌瘤的大小、位置在已孕组和不孕组间无显著性差异。
3.3 宫腔粘连与UFI
宫腔粘连与继发性不孕风险增加有关,MRI 具有较高的准确度(94.57%)、敏感度(98.8%)和特异度(42.9%)[28]。本研究中宫腔粘连是UFI的独立危险因素。宫腔粘连常继发于反复的宫腔操作,病理上以子宫内膜纤维化即子宫内膜明显变薄、宫腔缩短、结合带异常增厚为特征,子宫内膜基底层被破坏,即使行手术粘连松解后,仍然对生殖结果产生不利影响[29-30]。本组病例均接受宫腔镜粘连松解术,术后1 年随访宫腔粘连患者仍然不孕,宫腔粘连是UFI 的独立风险因素。MRI及MR-HSG 对宫腔粘连诊断的准确性较高,现有部分研究通过体素内不相干运动(intravoxel incoherent motion, IVIM)及扩散峰度成像(diffusion kurtosis imaging, DKI)评估宫腔粘连的细节特征[31-32],后期功能MRI技术有望能更精准评价宫腔粘连对生育力的影响。
3.4 其他因素与UFI
瘢痕子宫致女性不孕的风险可高达19%[33]。瘢痕内经血残留,血红蛋白降解后可能致胚胎毒性或影响其着床[34]。瘢痕子宫生育率低和瘢痕处残余肌层的厚度有关,修复瘢痕憩室后生育能力有明显改善[35]。残余肌层厚度是不孕症治疗中一个重要的观察指标,若残余肌层厚度<3 mm,行宫腔镜下肌层修复是非常有必要的[36]。本组瘢痕子宫残余肌层厚度均值为6.0 mm,对妊娠结局无明显影响。子宫内膜息肉在不孕症中发病率高达32%[37]。息肉导致甘油三酯、芳香化酶、炎症标志物水平升高以及与子宫内膜容受性相关的分子标志物(HOXA10、HOXA11)水平下调,对精子运输或胚胎植入产生不利影响[38-39]。此外,息肉还可通过机械干扰对生育能力产生不利影响,相较于简单的诊断性宫腔镜检查,宫腔镜下子宫内膜息肉切除后可能会提高受试者临床妊娠率[40]。本组MRI诊断为内膜息肉的患者均接受了宫腔镜切除,随访结果显示息肉切除后患者获益。腺肌症对生育有负面影响,尤其是辅助生殖技术的妊娠结局[41]。腺肌症病灶局部血小板聚集和缺氧,产生细胞因子、前列腺素并增加雌激素的合成,导致子宫内膜容受性下降及子宫蠕动过度,破坏精子运输和胚胎植入[42]。然而,有些研究中无症状腺肌症女性的妊娠结局与无腺肌症女性相似[43-44]。内生型腺肌症源于内膜基底层,不受月经周期及激素调节影响。外生型腺肌症源于内膜功能层,和卵巢子宫内膜异位症、腹膜型子宫内膜异位症及深部子宫内膜异位症相伴存在,受月经周期及激素调节[45]。本研究发现不伴有卵巢、输卵管及深部子宫内膜异位症的子宫腺肌症不是妊娠的风险因素。子宫腺肌症的表现多样,发生位置、累及范围、有无症状等都可能影响妊娠结局,值得进一步探索研究。
3.5 联合模型对预测UFI的效能分析
MRI 联合MR-HSG 评估致生育力低下的子宫器质性病变具有显著优势,本研究基于临床资料、MRI及MR-HSG 所示的子宫异常,建立年龄、子宫多发肌瘤、宫腔粘连多参数联合模型,AUC 值达0.809,明显优于单个年龄参数模型,联合模型预测效能优于年龄单参数模型。尽管多参数联合模型与年龄+宫腔粘连模型、年龄+子宫多发肌瘤模型差异无统计学意义,但多因素联合模型AUC 值较后两者有所提升。多参数联合模型对UFI预测效能较好,提供精准的诊断信息以及进一步的治疗方向,有助于临床制订规范的个体化治疗方案及助孕措施。
3.6 本研究的局限和展望
尽管MRI、MR-HSG 检查耗时较长、费用偏高,但是MR-HSG 一站式检查能较明确诊断不孕的可能原因,提高现有不孕症的诊疗水平。本研究也存在一些局限性:首先,单中心回顾性研究存在一定的选择偏倚;其次,本研究仅分析影响不孕症的重要子宫病变,合并输卵管、卵巢异常及不明原因不孕的病例未纳入分析,研究适用于不孕症仅有子宫疾病的评价,后期将对子宫和/或输卵管和/或卵巢疾病患者的妊娠结局进一步综合分析;最后,治疗方法是影响怀孕的关键因素之一,虽然本研究所有病例均严格按照临床规范进行标准化治疗,但纳入患者治疗方案间存在个体化差异,因此未对治疗方法进行深入分析。
4 结论
综上所述,多参数MRI及MR-HSG 可以全面、细致地分析影响不孕的子宫疾病。较大年龄、子宫多发肌瘤及宫腔粘连是UFI的危险因素,建立的多因素联合预测妊娠模型对辅助临床决策、制订个体化诊疗方案具有一定价值。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:王中秋设计本研究的方案,对稿件重要内容进行了修改;王洁起草和撰写稿件,获取、分析和解释本研究的数据;段娜、王绍娟、胡旭宇、任帅、殷燕云获取、分析或解释本研究数据,对稿件重要内容进行了修改,其中段娜获得了江苏省中医院院级课题面上项目资助;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

