多参数MRI影像组学在术前预测胰腺导管腺癌淋巴结转移中的价值
曾飘娥,曲超,崔景景,修典荣,刘剑羽,袁慧书*
0 引言
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)居我国总体恶性肿瘤发病率和死亡率的第9 位 和 第6 位[1]。PDAC 预 后 极 差,淋 巴 结 转 移(lymph node metastasis, LNM)是PDAC 预后较差的重要影响因素[2]。AJCC 更新的第八版TNM 系统更加强调了LNM 在预后评估中的意义。同时NCCN指南和中国胰腺癌诊疗指南(2022 年版)建议对伴有区域LNM 等高危因素的PDAC 可以考虑新辅助治疗[3-4]。因此,术前准确识别PDAC 的淋巴结状态对患者的预后评估和治疗方案制订具有重要意义。目前基于术前影像形态学对PDAC 淋巴结状态评估的能力较差。文献报道淋巴结大小不能作为术前LNM的可靠性指标[5-6]。表观扩散系数(apparent diffusion coefficient, ADC)可以定量评估组织内水分子扩散程度,从而间接反映肿瘤的组织学成分和侵袭性。影像组学可以提取肉眼无法识别的定量的、高通量的影像特征,反映病变的生物学行为[7]。先前的研究表明,基于CT 图像的影像组学在淋巴结状态评估及预后预测中有一定的价值。既往有研究探索MRI影像组学对PDAC 淋巴结状态评估价值,但基于ADC 图影像组学的附加价值尚不清楚,且无与临床及影像形态学预测模型的对比研究。本研究拟联合常规MRI 及ADC 图的影像组学特征构建多参数MRI 影像组学模型术前评估PDAC 淋巴结状态,并与建立的常规MRI 影像组学模型和临床模型比较,探索基于ADC图影像组学的附加价值。
1 材料与方法
1.1 研究对象
本研究遵守《赫尔辛基宣言》,已通过北京大学第三医院伦理委员会批准,免除受试者知情同意,批准文号:IRB00006761-LM2021120。
本研究为单中心、回顾性临床研究,连续性收集2012年1月至2021年6月在我院进行手术并病理确诊为PDAC患者的临床及影像资料。入组标准:(1)接受了手术切除和区域淋巴结清扫术;(2)术前2 周内的MRI 图像完整。排除标准:(1)因局部晚期胰腺癌行姑息性手术或R2 切除;(2)术前接受放疗或化疗;(3)图像伪影严重。按照LNM 以病理报告将PDAC分为伴有LNM 和不伴LNM。按照7∶3 的比例随机分为训练集与验证集。
1.2 MRI扫描
MRI 影像数据包含常规MRI 及扩散加权成像(diffusion-weighted imaging, DWI)。MRI 扫描采用3 T MRI 扫描仪(Discovery MR750, GE Healthcare,USA),8 通道体部相控阵线圈。扫描序列及参数:(1)轴位脂肪抑制T2WI 序列,重复时间(repetition time, TR)/回波时间(echo time, TE)15 000 ms/81 ms,层厚6.0 mm,层间距1 mm,视野32 cm×32 cm,矩阵320×320;(2)轴位肝脏快速容积成像T1WI序列,TR/TE 4 ms/2.4 ms,层厚5.0 mm,视野36 cm×36 cm,矩阵264×256;(3)轴位T1WI 动态增强MRI,高压注射器将钆对比剂(Beilu Pharmaceutical, Beijing, China)以2 mL/s 的速率及0.2 mmol/kg 的剂量团注到前臂静脉,注射对比剂后33~38 s 扫描动脉期,70~75 s 扫描门脉期图像;(4)用轴位、自由呼吸、单次发射回波平面成像进行DWI 序列扫描,TR/TE 7 500 ms/62 ms;层厚6.0 mm;层间距1.0 mm;带宽250 kHz;视野35 cm×35 cm;矩阵160×160,8 个b 值(0、25、50、100、200、500、800、1 000 s/mm2)。
1.3 临床及影像学特征的采集
临床特征:采集纳入患者的性别、年龄、是否黄疸、术前糖类抗原19-9(carbohydrate antigen19-9,CA19-9)、术前血清总胆红素值等临床特征。
原发肿瘤影像学特征包括(1)肿瘤大小;(2)肿瘤部位;(3)胰管扩张;(4)胰体尾萎缩;(5)强化程度(对比正常胰腺实质);(6)边缘强化:定义为不规则环状强化,在动态增强图像上具有相对低血供的中心区域;(7)胰腺周围肿瘤浸润;(8)动脉侵犯;(9)静脉侵犯。
淋巴结评估:测量最大淋巴结的短径和长径。
ADC 值测量:以常规和动态增强MRI 扫描为参考,在DWI 图像(b=1 000 s/mm2)上原发肿瘤最大横截面积手动勾画感兴趣区(region of interest, ROI),最大限度地排除囊变坏死区域。由两名分别具有7年和5年腹盆影像诊断经验的放射科医师不知晓病理淋巴结状态结果的情况分别独立测量,以平均值作为最终ADC值。
1.4 影像组学分析
影像组学分析流程包括:ROI 勾画;影像组学特征提取;影像组学特征选择;模型构建和评价。本研究中ROI 勾画和特征提取在Research Portal V1.1 平台(上海联影智能有限公司)完成。
ROI 勾画:沿着原发肿瘤边界逐层勾画,尽量避开明显囊变区域。最初由一名5 年诊断经验的放射科住院医师勾画所有图像ROI。一个月后,随机选择其中30 例患者图像,由另一位7 年诊断经验的放射科主治医师重新绘制ROI,计算组间相关系数(inter-class correlation coefficient, ICC),以评估从两名放射科医生绘制的ROI 中提取影像组学特征的可重复性。两名医师除了知晓勾画对象是PDAC 外,对LNM状态不知晓。
影像组学特征提取:图像预处理步骤包括像素归一化和重采样。每个ROI 中提取出1 094 个特征,包括从原始图像中提取的104个特征(基于形态和大小特征、一阶特征和纹理特征)和通过小波滤波器及高斯-拉普拉斯滤波器转换得到的990 个特征。本研究共提取了来自T1WI、T2WI、动脉期、门脉期及ADC图的共5 470(1 094×5)个影像组学特征。
影像组学特征选择:保留其中ICC≥0.75 的影像组学特征。采用最小绝对收缩和选择算子(least absolute shrinkage and selection operator, LASSO)回归选出最相关的特征用于下一步的模型构建。根据LASSO回归筛出的影像组学特征及其对应的相关系数相乘之总和得到Radscore。
模型构建:分别建立基于常规MRI 图像(T1WI、T2WI、动脉期及门脉期图像)影像组学模型(影像组学模型1)和联合常规MRI 及ADC 图的影像组学模型(影像组学模型2)。在训练集中,通过单因素和多因素向前逐步逻辑回归分析筛选出与LNM 相关的临床及影像学特征,建立LNM 的术前诊断临床影像学(clinical and radiographic, CR)模型。
模型效能评价:计算训练集和验证集中模型预测LNM 的受试者工作特征曲线下面积(area under the curve, AUC)值。以最大约登指数为最佳诊断截断值,计算其对应的敏感度、特异度、阳性预测值、阴性预测值和准确率等评价指标。使用DeLong 检验比较各预测模型的诊断效能。采用校准曲线和Hosmer-Lemeshow 检验评估模型的校准度。决策曲线分析(decision curve analysis, DCA)来评估模型的临床实用性。
1.5 统计分析
统计分析软件包括SPSS 22.0(SPSS Inc, Chicago,USA)、MedCalc Version 15.0(MedCalc Software Ltd.,Ostend, Belgium)和R软件包(version 3.5.2)。分类资料用频数(百分比)表示,其组间差异比较采用卡方检验或Fisher 精确检验。采用Kolmogorov-Smimov检验连续性变量的正态性。正态分布数据用均值±标准差来表示,组间差异比较采用独立样本t检验。非正态分布数据表示为中位数(四分位数间距),组间差异比较采用Mann-WhitaeyU检验。AUC 评估模型的诊断效能。P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料
本研究最终218例PDAC纳入,伴LNM 97例,不伴LNM 121 例。按照7∶3 的比例随机分为训练集(152例)和验证集(66例)。病例入组流程详见图1。
2.2 模型构建
在训练集中,临床及影像学特征单因素及多因素逻辑回归结果显示,术前CA19-9 升高、肿瘤大小、胰体尾萎缩及ADC 值是术前预测LNM 的独立因素(表1),根据这4 个因素构建出预测LNM 的CR 模型,并绘制了列线图(图2)。LASSO 回归选择出7个与LNM 最相关的影像组学特征(图3A),包括3 个来自T2WI 图像,3 个来自动脉期图像和1 个来自门脉期图像的组学特征构建影像组学模型1;选择出11个与LNM相关的影像组学特征,包括2个来自T2WI图像,3 个来自动脉期图像,1 个来自门脉期图像和5 个来自ADC 图的影像组学特征构建影像组学模型2(图3B)。
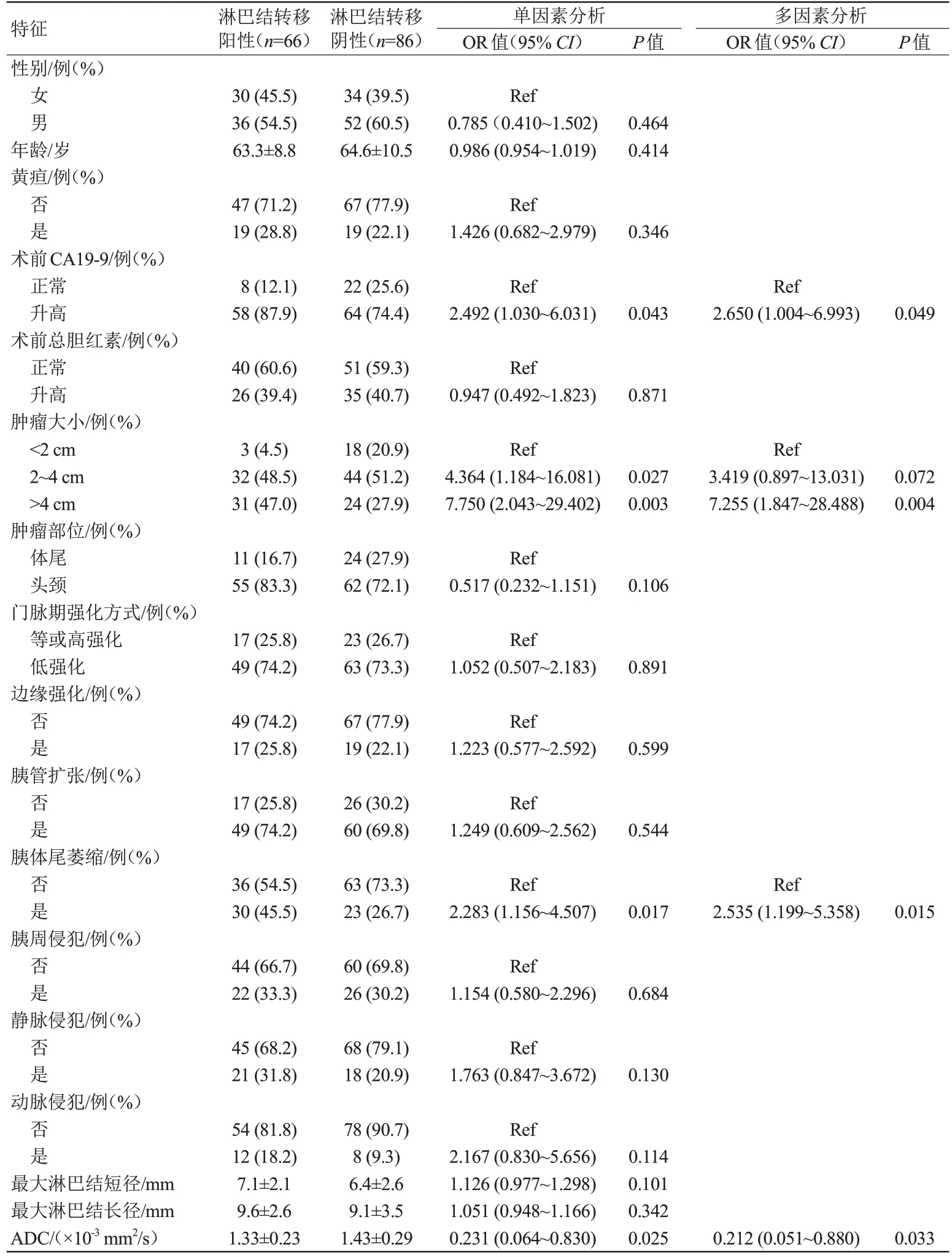
表1 预测胰腺导管腺癌淋巴结转移的临床及影像学特征单因素和多因素分析Tab.1 Univariate and multivariate analysis of clinical and radiological features of predicting lymph node metastasis in pancreatic ductal adenocarcinoma

图2 临床影像学模型术前预测胰腺导管腺癌淋巴结转移列线图。图3 LASSO回归分析结果。3A:基于T1WI、T2WI、动脉期和门脉期图像影像组学特征进行LASSO 回归,筛选出与淋巴结转移最相关的影像组学特征,构建影像组学模型1;3B:基于T1WI、T2WI、动脉期、门脉期图像和ADC 图的影像组学特征进行LASSO回归,筛选出与淋巴结转移最相关的影像组学特征,构建影像组学模型2。CA19-9:糖类抗原19-9;ADC:表观扩散系数;LASSO:最小绝对收缩和选择算子。Fig.2 Nomogram of clinical radiological model for preoperatively predicting lymph node metastasis in pancreatic ductal adenocarcinoma.Fig.3 Results of LASSO regression analysis.3A: LASSO regression is used to select radiomics features from T1WI, T2WI, arterial phase and portal venous phase images to develop radiomics model 1; 3B: LASSO regression is performed on the radiomics features derived from T1WI, T2WI, arterial phase, portal venous phase images and ADC maps to select to develop radiomics model 2.CA19-9: carbohydrate antigen 19-9; ADC: apparent diffusion coefficient; LASSO: least absolute shrinkage and selection operator.
2.3 模型效能评价
影像组学模型2 术前预测LNM 的AUC 值最高,高于CR 模型(训练集:0.854 vs.0.741,P=0.009;验证集:0.839 vs.0.674,P=0.023)及影像组学模型1(训练集:0.854 vs.0.818,P=0.044;验证集:0.839 vs.0.702,P=0.041),差异具有统计学意义;影像组学模型1 的预测效能高于CR 模型(训练集:0.818 vs.0.741,P=0.095;验证集:0.702 vs.0.674,P=0.759),但差异不具有统计学意义(表2、图4)。
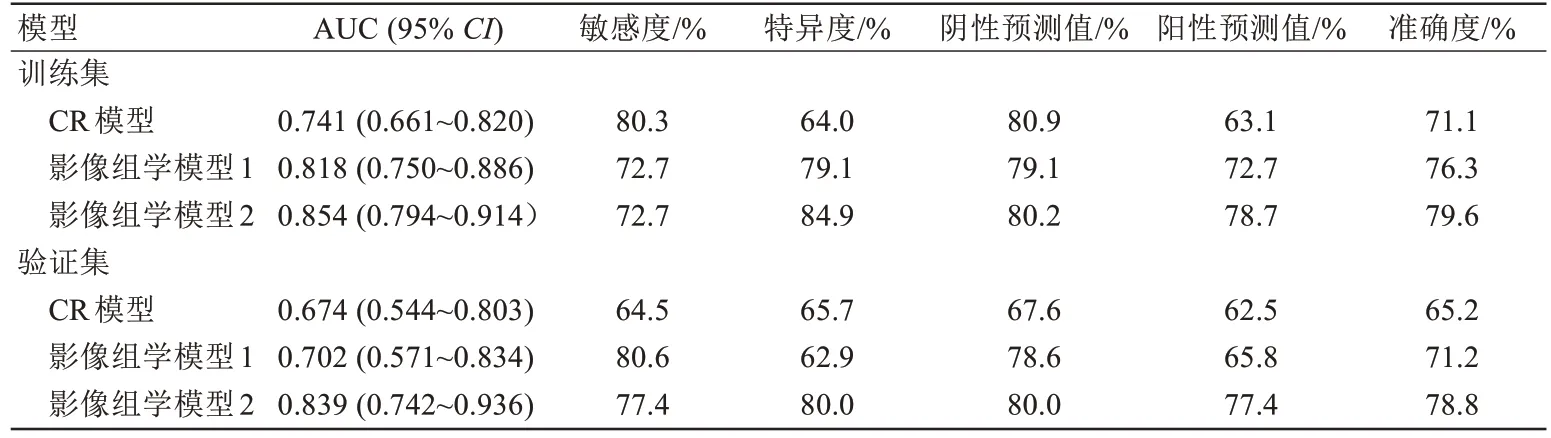
表2 不同模型术前预测胰腺导管腺癌淋巴结转移的效能Tab.2 The efficacy of different models in preoperative prediction of lymph node metastasis in pancreatic ductal adenocarcinoma
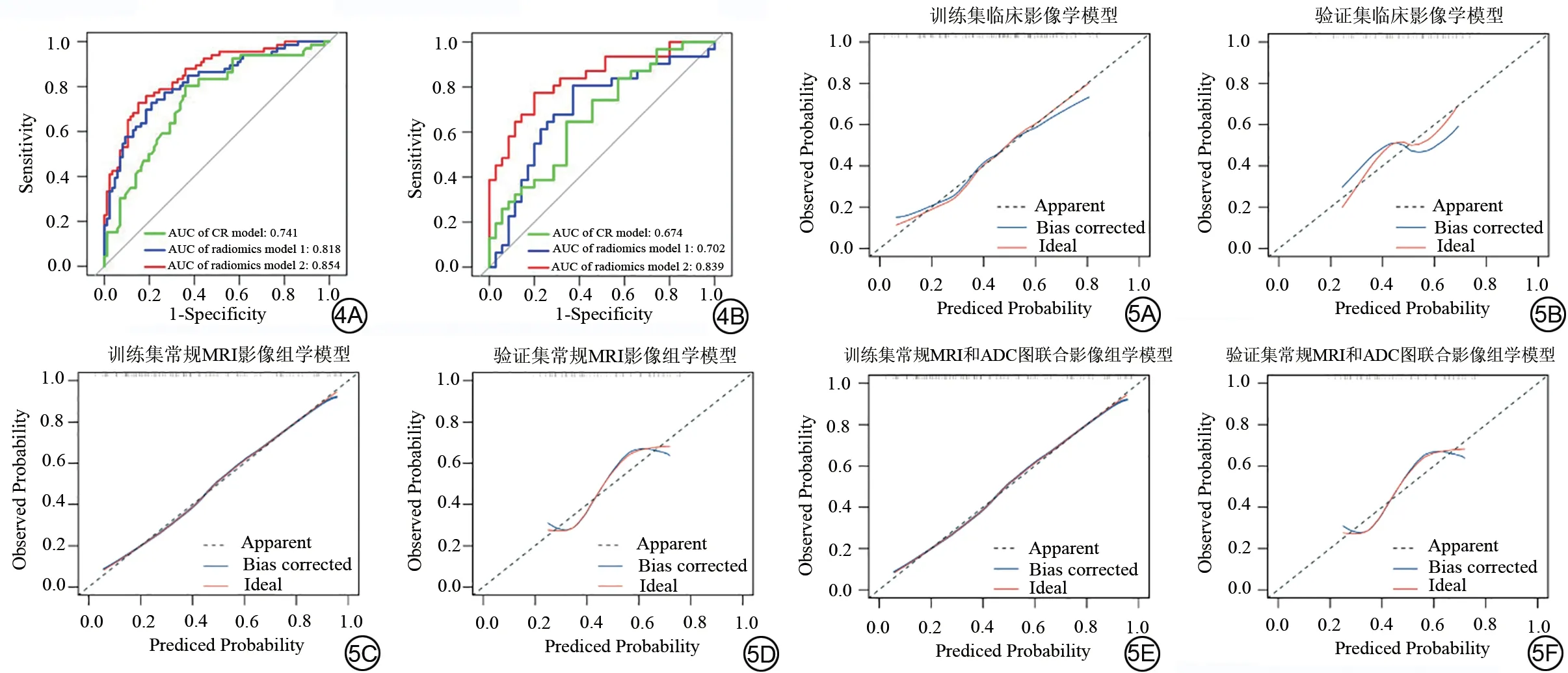
图4 不同模型术前预测胰腺导管腺癌淋巴结转移的受试者工作特征曲线。4A:训练集;4B:验证集。AUC:曲线下面积;CR model(CR 模型):临床及影像学模型;radiomics model 1(影像组学模型1):基于常规MRI影像组学特征建立的模型;radiomics model 2(影像组学模型2):联合常规MRI和表观扩散系数图影像组学特征建立的模型。图5 不同模型预测胰腺导管腺癌淋巴结转移的校准曲线图。ADC:表观扩散系数。Fig.4 Receiver operating characteristic curves of different models for preoperatively predicting lymph node metastasis in pancreatic ductal adenocarcinoma.4A:training set; 4B: validation set.AUC: area under the curve; CR model: clinical and radiological model; radiomics model 1: the model based on conventional MRI radiomics features; radiomics model 2: combined radiomics features of conventional MRI and apparent diffusion coefficientmap.Fig.5 Calibration curves of different models for predicting lymph node metastasis in pancreatic ductal adenocarcinoma.ADC: apparent diffusion coefficient.
校准曲线分析显示单个模型术前预测LNM 时预测概率的估计值和实际观察值之间均具有较好的一致性(图5)。三个模型预测LNM 的DCA 显示,训练集和验证集中的大部分阈值概率范围内,影像组学模型2 比影像组学模型1 和CR 模型具有更高的净效益(图6)。图7 显示一例PDAC 患者,病理诊断伴有LNM,影像组学模型2 评估正确,而影像组学模型1及CR模型评估错误。图8显示一例PDAC患者,病理不伴LNM,影像组学模型2、影像组学模型1 以及CR模型均评估正确。
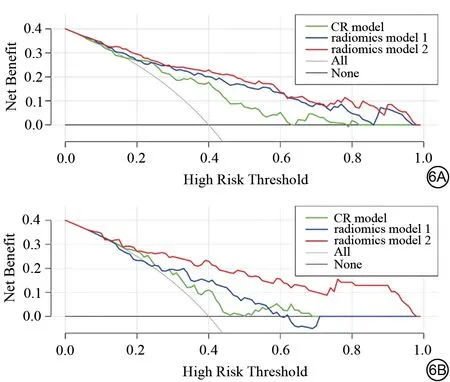
图6 不同模型术前预测胰腺导管腺癌淋巴结转移的决策曲线图。6A:训练集;6B:验证集。CR model(CR 模型):临床及影像学模型;radiomics model 1(影像组学模型1):基于常规MRI 影像组学特征建立的模型;radiomics model 2(影像组学模型2):联合常规MRI和表观扩散系数图影像组学特征建立的模型。Fig.6 Decision curves of different models for preoperatively predicting lymph node metastasis in pancreatic ductal adenocarcinoma.6A: training set; 6B: validation set.CR model: clinical and radiological model;radiomics model 1: the model based on conventional MRI radiomics features; radiomics model 2: combined radiomics features of conventional MRI and apparent diffusion coefficientmap.

图7 男,66岁,胰颈后部见稍长T2信号(7A,箭),动脉期低强化(7B,箭),扩散加权成像图像呈稍高信号(7C,箭),表观扩散系数图像呈稍低信号(7D,箭),肿瘤大小2.4 cm,病理诊断为胰腺导管腺癌,伴有淋巴结转移。联合常规MRI和表观扩散系数图影像组学特征建立的影像组学模型2预测淋巴结转移阳性,基于常规MRI影像组学特征建立的影像组学模型1和临床影像学模型预测淋巴结阴性。Fig.7 A 66-year-old male patient presented with slightly hyperintense T2 signal in the posterior part of the pancreatic neck (7A, arrow), hypoenhancement in the arterial phase (7B, arrow), slightly hyperintensity on diffusion-weighted imaging (7C, arrow), and slightly hypointensity on apparent diffusion coefficient images(7D, arrow).The tumor size was 2.4 cm.The tumor was pathologically diagnosed as pancreatic ductal adenocarcinoma with lymph node metastasis.Radiomics model 2 based on conventional MRI radiomics features and apparent diffusion coefficient map radiomics features predicted positive lymph node metastasis, and radiomics model 1 based on conventional MRI radiomics features and clinical and radiological model predicted negative lymph nodes.
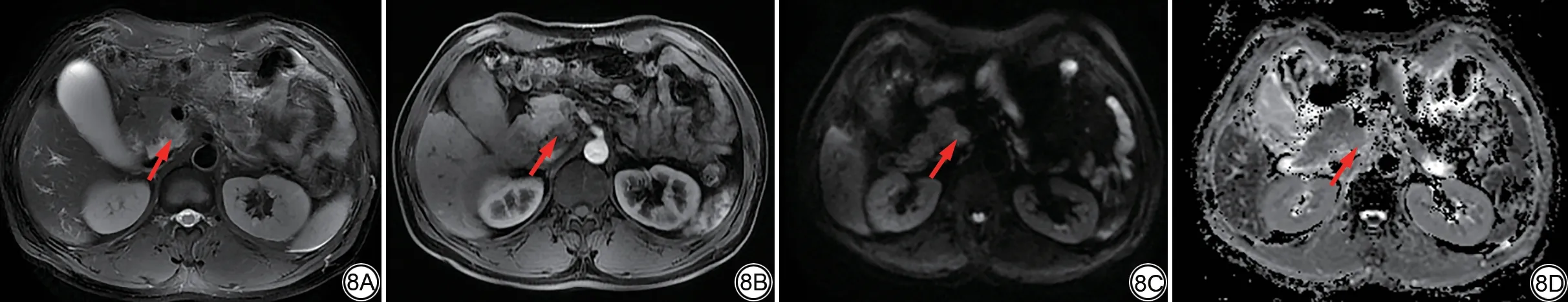
图8 男,47岁,胰头钩突见稍长T2信号(8A,箭),动脉期低强化(8B,箭),扩散加权成像图像呈高信号(8C,箭),表观扩散系数图像呈低信号(8D,箭),肿瘤大小2.2 cm,病理诊断胰腺导管腺癌,不伴有淋巴结转移。联合常规MRI和表观扩散系数图影像组学特征建立的影像组学模型2、基于常规MRI影像组学特征的影像组学模型1和临床影像学模型均预测为淋巴结阴性。Fig.8 A 47-year-old male patient presented with slightly hyperintense T2 signal in the uncinate process of pancreatic head (8A, arrow), hypoenhancement in the arterial phase (8B, arrow), hyperintensity on diffusion-weighted imaging (8C, arrow), and hypointensity on apparent diffusion coefficient images (8D, arrow).The tumor size was 2.2 cm.The tumor was pathologically diagnosed as pancreatic ductal adenocarcinoma without lymph node metastasis.Radiomics model 2 based on conventional MRI radiomics features and apparent diffusion coefficient map radiomics features, radiomics model 1 based on conventional MRI radiomics features,and clinical and radiological model predicted negative lymph nodes.
3 讨论
本研究发现联合常规MRI 及ADC 图影像组学特征构建的多参数MRI影像组学模型具有术前预测PDAC 患者LNM 的潜能,且其预测效能优于基于常规MRI 的影像组学模型和临床模型,可作为术前评估PDAC患者淋巴结状态的方法。
3.1 临床及影像学特征术前预测PDAC LNM
本研究中,肿瘤大小、术前CA19-9 升高、胰体尾萎缩及ADC 值是术前预测LNM 独立的预测因素。LNM 与原发肿瘤大小有关,原发肿瘤增大是LNM 的危险因素,这与报道的文献结果一致[8]。术前CA19-9 对LNM 预测有一定价值,但目前文献报道CA19-9预测LNM的截断值并不统一[9-10]。
LEE 等[11]测量胰腺癌区域淋巴结的ADC 值,发现转移性淋巴结的ADC值明显低于良性淋巴结。转移性淋巴结的肿瘤细胞数量和核质比的增加以及恶性肿瘤细胞外间隙的减少限制了水的扩散,导致ADC 减低。但是在实际临床工作中,测量淋巴结ADC 值来诊断LNM 难以操作。因为通常区域内有多发淋巴结,难以确定以测量哪个淋巴结为标准。其次转移淋巴结和正常淋巴结均较小,容易导致ADC 值测量可重复性差。LNM 已被证明与多种情况下原发肿瘤的组织学特征和影像学表现有关[12]。本研究是通过测量PDAC原发肿瘤的ADC值来预测LNM,发现伴有LNM 患者原发肿瘤ADC 值显著性低于不伴有LNM患者,与SHI等[13]研究一致。
3.2 影像组学术前预测PDAC LNM
目前一些研究表明,基于CT 的影像组学在预测PDAC 的LNM 方面有价值[14-17]。与CT 相比,MRI 无电离辐射暴露,提供了更好的软组织分辨率,在诊断早期PDAC 方面优于CT[18]。本研究勾画了整个肿瘤并从和多序列、多期MRI图像中提取影像组学特征,综合反映肿瘤异质性[19]。本研究提取常规MRI 图像的影像组学特征来构建影像组学模型,发现术前预测LNM 具有良好的准确性,训练集诊断准确度为76.3%,验证集诊断准确度为71.2%,这与既往研究[20-23]的研究结果一致。但SHI等[20]研究是将≤3枚阳性淋巴结定义为阴性LNM,>3 枚阳性淋巴结定义为阳性LNM。因此,他们建立的模型实际上是区分PDAC 的N0/N1 和N2 期LNM。本研究发现基于常规MRI 影像组学模型有助于无创地术前预测PDAC淋巴结状态,诊断效能高于本研究建立的CR 模型,但差异无统计学意义。
本研究提取ADC 图的影像组学特征,发现基于联合常规MRI 和ADC 功能图构建的影像组学模型对LNM 的预测能力最高,显著性高于基于常规MRI图像构建的影像组学模型和CR 模型,这进一步说明了ADC 对预测LNM 的重要价值。基于ADC 图的影像组学模型对LNM 的预测能力已在宫颈癌、直肠癌、子宫内膜癌及前列腺癌等肿瘤中得到验证[24-30]。WU 等[26]在研究影像组学评价宫颈鳞状细胞癌病理特征时发现,功能图对宫颈鳞状细胞癌的病理特征鉴别价值优于解剖图,ADC 图对LNM 的预测效能最好,与本研究一致。既往有研究构建基于DWI 图像影像组学特征来预测LNM[31-32]。本研究是提取ADC图的影像组学特征,而不是DWI 图像。这是考虑到DWI 的信号强度变化取决于组织的ADC 状态和运动敏感梯度。b 值的选择会显著影响DWI 图像的纹理分析[24]。ADC 目前已广泛运用于临床,ADC 影像组学特征有望将来在协助LNM评估中发挥作用。
3.3 局限性及展望
首先,本研究影像组学模型是单中心回顾性研究,仅进行了内部验证,未来可以进一步扩大样本量,纳入多中心的数据,进行外部验证以及前瞻性验证,增加模型的泛化性;其次,仅研究了ADC 图的影像组学特征,未来可以进一步探究体素内不相干运动、扩散峰度成像等功能成像的影像组学特征预测PDAC患者LNM 的价值;最后,本研究由于样本量较少,未进一步探索N1、N2 期分类以及N0、N1、N2 三分类模型;另外,目前胰腺影像组学研究病灶的勾画多是基于人工手动勾画,费时费力,未来准确的半自动或全自动分割方式使影像组学操作尽可能简化,增加影像组学在临床应用的可能性。
4 结论
综上所述,联合常规MRI 及ADC 图建立的多参数MRI 影像组学模型具有术前预测LNM 的潜能,且效能显著性优于常规MRI影像组学模型及CR 模型,为影像组学在胰腺癌的个性化综合治疗提供参考。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:袁慧书设计并实施本研究的方案,参与论文重要内容的修改,获得北京市自然科学基金项目资助;曾飘娥酝酿设计并实施研究,起草和撰写稿件,参与论文重要内容的修改,获取、分析和解释本研究的数据;曲超、崔晶晶、修典荣、刘剑羽获取、分析或解释本研究的数据,对论文重要内容进行了修改;全体作者都同意发表最后的修改稿,同意对本研究工作各方面的诚信问题负责。

