基于心脏磁共振晚期钆增强的心肌信号强度异质性对心肌炎患者预后价值的研究
刘方圆,高艳,王文先,史荣超,李莎,王锡明,*
0 引言
心肌炎是一种常见的心肌炎症疾病[1],可导致心肌收缩舒张功能障碍以及心律失常等。感染是心肌炎最常见的致病因素[2]。心肌炎的临床表现缺乏特异性,轻者可仅表现为呼吸困难或胸痛,无需特殊治疗即可缓解,严重者可出现心源性休克甚至死亡[3-4]。多达20%的心肌炎患者会发展为扩张型心肌病,并且心肌炎是职业运动员心源性猝死的主要原因[5-7]。心脏磁共振(cardiac magnetic resonance, CMR)是一种非侵入性成像技术,可以准确评估心脏功能,检测心肌水肿、充血、坏死和纤维化,对心肌炎的诊断和危险分层有重要的参考价值[8-9]。研究表明晚期钆增强(late gadolinium enhancement, LGE)够反映心肌坏死和纤维化,有助于对心肌炎患者进行危险分层[10-12]。然而,大多数LGE 的研究侧重于分析瘢痕的位置、形态、范围和分布,对左心室心肌整体,特别是非增强区域的评估存在局限性[13]。
左心室熵可以量化左心室心肌LGE 图像信号分布的异质性[14]。一个具有完全均匀信号的左心室LGE 图像的熵值为零,随着心肌LGE 信号复杂程度升高熵值也随之增加[13]。研究表明,左心室熵是肥厚型心肌病和室性心律失常患者发生主要心血管不良事件(major adverse cardiovascular events, MACE)的独立预测因子[14-16]。目前尚未有研究评估左心室熵在心肌炎患者中的预后价值。因此,本研究旨在探讨左心室熵对心肌炎患者MACE的预测价值,以期为临床预测和防治心肌炎患者MACE 的发生提供一定参考价值。
1 材料与方法
1.1 临床资料
回顾性分析自2015 年7 月至2023 年10 月在山东省立医院行CMR 检查且临床诊断为心肌炎患者56 例,其中男30(53.57%)例,女26(46.43%)例,年龄34.00(23.00~46.50)岁。收集患者心肌酶、心电图、实验室指标等资料并进行随访,中位随访时间为391(221~835)天。根据随访过程中是否出现MACE将患者分为预后不良组(n=14 例)和预后良好组(n=42 例)。MACE 包括:(1)全因死亡;(2)因心力衰竭再入院;(3)持续性室性心律失常;(4)心律转复除颤器植入(implantable cardioverter-defibrillator, ICD)治疗。本研究遵守《赫尔辛基宣言》,经山东省立医院伦理委员会批准,免除受试者知情同意,批准文号:2023-619。
纳入标准:(1)≥18周岁;(2)符合2013年欧洲心脏病学会专家共识诊断标准[17];(3)选择性冠脉造影或冠脉CTA 检查排除冠状动脉疾病。排除标准:(1)存在高血压性心脏病、冠心病、肥厚型心肌病等其他心脏疾病者;(2)患有自身免疫性疾病、恶性肿瘤或其他急性危重性疾病;(3)从出现心脏症状到入院的时间超过30 天;(4)CMR 图像质量欠佳者;(5)临床资料不完整;(6)失访的患者。
1.2 方法
1.2.1 扫描方案
所有患者均在3.0 T 磁共振扫描仪(MAGNETOM Prisma, Siemens Healthcare, Germany)使用18 通道心脏线圈进行检查。扫描序列包括:(1)电影序列,采用标准的平衡稳态自由进动(balanced steady-state free precession, bSSFP)序列采集心底至心尖短轴位及二腔心、三腔心、四腔心层面图像,翻转角80°,TR 3.26 ms,TE 1.43 ms,层厚7 mm;(2)LGE,在注射0.2 mmol/kg 钆喷酸葡胺(北京北陆药业股份有限公司,中国)10 min 后采用相位敏感反转恢复(phase-sensitive inversioin recovery, PSIR)序列进行采集,翻转角80°,TR 3.0 ms,TE 1.4 ms,层厚7 mm;(3)T1 mapping,采用模式的改良Look-Locker 反转恢复(modified look-locker inversion recovery, MOLLI)序列,分别在静脉注入钆喷酸葡胺前和15 min 后进行扫描,采集基底、中层及心尖3 个短轴层面的Native T1 mapping(翻转角35°,TR 2.77 ms,TE 1.15 ms,层厚8 mm)和Post T1 mapping (翻转角20°,TR 2.44 ms,TE 1.01 ms,层厚8 mm)图像。
1.2.2 图像分析
由两名具有10年以上工作经验的影像科主治医师分析图像。使用软件CVI42(version 5.12.1, Circle Cardiovascular Imaging Inc.)利用半自动方法逐层勾勒心肌心外膜和心内膜轮廓,计算心功能相关参数、LGE 占左心室质量百分比(心肌灰度阈值比正常心肌平均信号强度高5 个标准偏差判定为LGE 阳性区域)、native T1 mapping 值、post T1 mapping 值、细胞外体积(extracellular volume, ECV)值。使用软件Research Mass(MASS 5.1,Leiden University Medical Center, Leiden, the Netherlands)利用半自动方法勾勒LGE 短轴位全层图像的心肌心外膜和心内膜轮廓(图1),并按照公式(1)[13,18]自动计算左心室熵:
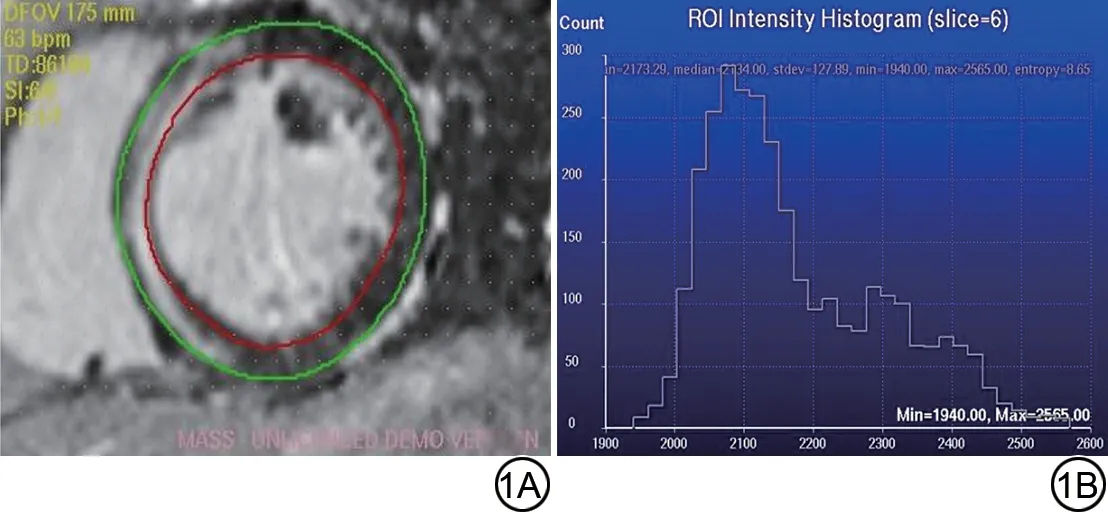
图1 基于心脏磁共振晚期钆增强图像测量左心室熵的示意图。左心室晚期钆增强图像短轴位(1A)及测量结果(1B)。红色:左心室心内膜线;绿色:左心室心外膜线。ROI:感兴趣区;Min:最小值;Max:最大值。Fig.1 Diagrams of left ventricular entropy measurement based on cardiac magnetic resonance late gadolinium enhancement images.Left ventricular late gadolinium enhancement short axis (1A) and measurement results (1B).Red: left ventricular endocardium line; Green: left ventricular epicardial line.ROI: region of interest; Min: minimum; Max: maximum.
其中,P(Xi)代表信号强度可能分布的概率,Xi代表信号强度,b代表选择基数(软件默认为2)。
1.3 统计学分析
采用SPSS 25.0软件和MedCalc 15.0软件进行统计学分析。采用Kolmogorov-Smirnov 检验对连续变量进行方差齐性检验,符合正态分布的变量以均数±标准差表示;不符合正态分布的变量则以中位数(四分位间距)表示,并采用Mann-WhitneyU检验进行比较分析。分类资料以例(百分比)表示,采用费舍尔精确检验比较两组间的差异性。采用生存函数分析(Kaplan-Meier法,K-M)绘制生存曲线,应用Log-rank检验K-M 曲线。通过受试者工作特征(receiver operator characteristic, ROC)曲线分析,计算曲线下面积(area under the curve, AUC)分析评估预测价值、特异度与敏感度,采用DeLong 检验对比AUC 的差异。采用组内相关系数(intra-class correlation coefficient, ICC)评估左心室熵在两个观察者内和观察者间测量的一致性,ICC>0.75 说明一致性较好。P<0.05为差异有统计学意义(双尾)。
2 结果
2.1 临床资料分析
经过391(221~835)天随访后,14 例患者发生MACE,其中1例院内死亡、3例行ICD治疗、6例发生心衰、4 例发生室性心动过速。预后不良组患者胸痛(P=0.037)和晕厥(P=0.044)的发生率较预后良好组患者更高。NT-proBNP 水平在预后良好组和预后不良组之间的差异具有统计学意义(P=0.004),其余实验室及心电图指标差异无统计学意义,见表1。

表1 两组患者的临床特征Tab.1 Baseline clinical characteristics of two groups
2.2 熵与心肌炎预后的关系
预后不良组较预后良好组有较高的LGE 占左心室百分比(P=0.044)、左心室熵值(P<0.001)、native T1 mapping 值(P=0.045)以及ECV 值(P=0.022),组间差异有统计学意义,见表2。

表2 两组患者的CMR特征Tab.2 Baseline CMR characteristics of two groups
2.3 熵对心肌炎不良预后的预测价值
ROC 曲线分析显示,左心室熵、LGE占左心室百分比、Native T1、ECV、NT-proBNP 预测心肌炎患者发生不良预后的AUC 分别为0.871、0.681、0.680、0.707、0.760,敏 感 度 和 特 异 度 分 别 为78.6% 和83.2%、78.6% 和33.4%、78.6% 和40.5%、92.9% 和40.5%、78.6%和57.2%,见图2。DeLong 检验显示左心室熵与LGE 占左心室百分比(P=0.045)、Native T1(P=0.039)、ECV(P=0.045)的AUC 值差异具有统计学意义,与NT-proBNP 的AUC 值差异无统计学意义(P=0.221)。以左心室熵预测心肌炎患者发生不良预后的ROC 曲线得出的最佳界值分类做K-M 生存曲线,左心室熵≥7.805 组总体生存率低于左心室熵<7.805 组(P<0.001),见图3A。以NT-proBNP 预测心肌炎患者发生不良预后的ROC曲线得出的最佳界值分类做K-M 生存曲线,NT-proBNP≥864.75 组总体生存率低于左心室熵<864.75组(P<0.001),见图3B。

图2 预测心肌炎患者不良预后的ROC 曲线。图3 左心室熵与心肌炎患者预后的K-M生存曲线。左心室熵心肌炎患者预后的K-M 生存曲线(3A)及NT-proBNP 心肌炎患者预后的K-M 生存曲线(3B)。ROC:受试者工作特征;LGE:晚期钆增强;ECV:细胞外体积;Native T1:增强前T1 值;K-M:生存函数分析;NT-proBNP:N末端B型利钠肽原。Fig.2 ROC curve for poor prognosis of patients with myocarditis.Fig.3 K-M survival curves based on left ventricular entropy for prognosis of patients with myocarditis.K-M survival curves based on left ventricular entropy (3A) and NT-proBNP (3B) for prognosis of patients with myocarditis.ROC: receiver operating characteristic; LGE: late gadolinium enhancemen; ECV: extracellular volume; Native T1: T1 value of unenhanced T1 mapping; K-M: Kaplan-Meier; NT-proBNP:N-Terminal pro-brain natriuretic peptide.
2.4 一致性评估
由两名具有10年以上工作经验的放射学诊断医师测量左心室熵,观察者内ICC=0.979(P<0.05)、观察者间ICC=0.968(P<0.05),表明在LGE 图像上测量左心室熵具有较高的可靠性和良好的重复性。
3 讨论
本研究采用回顾性研究的方法,探讨了基于CMR 成像LGE 的心肌信号强度异质性在心肌炎患者预后中的价值,结果显示:左心室熵较LGE 占左心室百分比、Native T1、ECV 能更加准确地预测心肌炎患者的预后,其敏感度和特异度可达78.5%、83.2%。这是国内首次通过左心室熵评估心肌炎患者预后的研究。左心室熵能协助临床预测心肌炎患者不良预后的发生,指导临床尽早做好防治措施,从而改善心肌炎患者的预后。
3.1 左心室熵与心肌炎患者MACE的相关性
左心室熵是CMR 的衍生参数,可以直接评估整个左心室心肌LGE 图像信号强度的分布情况[13]。一项对130例扩张型心肌病患者队列研究显示,左心室熵是其发生心律失常的独立预测因子,K-M 生存曲线分析显示,左心室熵值较高组的患者更需要接受ICD 治疗(P=0.03)[13]。一项回顾性研究发现,左心室熵值较高的心肌致密化不全的患者更容易发生主要心血管不良事件(P<0.001)[19]。本研究证实不良预后组的左心室熵值升高(P<0.001),左心室熵以7.805 为最佳界值,当左心室熵≥7.805 时心肌炎患者有更大的概率发生MACE(P<0.001),具有较高的临床应用价值,可指导临床预测心肌炎患者不良预后的发生,尽早做好防治措施。近期,ANTIOCHOS等[14]发现,左心室熵是室性心律失常患者不良预后的独立危险因素,并且在LGE 阴性的室性心律失常患者中,左心室熵仍对不良预后具有独立的预测价值,这表明左心室熵可识别心肌纹理中更细微的差异,能够对传统LGE量化方法进行补充。
3.2 左心室熵评估左心室心肌LGE 图像信号分布的异质性
左心室熵是半自动勾画LGE 图像的左心室心内膜和心外膜轮廓后由软件自动计算的,操作简单,不须设定阈值,并且可避免视觉判断的误差。本研究中左心室熵在观察者内和观察者之间的测量均有较好的一致性。LGE 能够反映心肌坏死和纤维化的位置和范围[20]。研究表明LGE 的存在以及LGE 占左心室质量百分比是心肌炎患者发生不良预后的独立预测因素,并且前室间隔LGE 与不良预后显著相关[21-23]。LGE 的量化方法主要包括2、3、4、5、6 或7 个标准差(SDs)阈值法、半最大值全宽度(full width at half maximum,FWHM)法和目视量化法[23]。然而,不同观察者间LGE 的目视结果会有差异,因此无法保证其准确性。此外,LGE 量化技术需要纤维化区域和正常心肌之间存在一定的对比度[24],部分心肌炎患者LGE 程度较低,若选取较高的标准差阈值,可能会低估LGE 的范围。本研究证明左心室熵对心肌炎患者发生MACE 有较好的预测价值,并且DeLong 检验显示左心室熵与LGE 占左心室百分比的AUC 值差异具有统计学意义(P=0.045)。Native T1 mapping和ECV 可以检测心肌弥漫性纤维化[25]。研究表明Native T1 mapping和 ECV 对心肌炎的诊断敏感性和特异性都很高[26-29]。Native T1 mapping可以监测心肌炎的愈合情况,有助于对心肌炎患者进行临床分期[30]。THAVENDIRANATHAN 等[31]对免疫检查点抑制剂相关心肌炎患者进行回顾分析,发现78%的免疫检查点抑制剂相关心肌炎患者的Native T1 mapping 值升高,且Native T1 mapping 升高的患者更容易发生MACE。但是,T1 mapping 的扫描层数有限且其图像质量极易受到运动伪影的影响[32-33]。此外,磁场强度、采集序列的选择和患者个人情况也会对T1 mapping 及ECV 产生影响[34]。与 T1 mapping和ECV相比,LGE的扫描时间更短,空间分辨率和精确度更高。左心室熵有助于补充Native T1 mapping和ECV在检测心肌纤维化方面的不足。
3.3 NT-proBNP与心肌炎患者MACE的相关性
脑钠肽前体(pro-brain natriuretic peptide, pro-BNP)主要由心室合成,可排钠、利尿及拮抗肾素-血管紧张素-醛固酮系统[35]。在心室扩张或超负荷时,pro-BNP的分泌量增加并入血分解成BNP、NT-proBNP。心肌炎患者心肌结构、功能以及能量供应的破坏,心室内血液积聚,心肌负荷加重,可引起NT-proBNP 水平增加[36-37]。在急性期暴发性心肌炎患儿的NT-proBNP明显升高,在恢复期其NT-proBNP明显降低[38]。另有研究表明NT-proBNP 是心血管病患者心血管事件及死亡的危险因素[39-40]。本研究结果中,预后不良组患者的NT-proBNP 水平较预后良好组患者高,且以864.75 为最佳界值,当NT-proBNP≥864.75 时心肌炎患者有更大的概率发生MACE(P<0.001),可用于对心肌炎患者进行动态监测,为后期治疗提供帮助。
3.4 局限性
本回顾性研究存在一些局限性:(1)样本量相对较小的单中心研究,需扩大样本量进一步研究,使研究方案更加完善、结果更有说服力;(2)在丹麦的一项大型队列研究中[41],AM 患者MACE 的发生率为21.6%,本研究中MACE 的发生率为25.0%,但由于预后不良组病例数量较低,存在过度拟合数据的可能,需扩大样本量进一步验证;(3)入组的心肌炎患者均是根据临床标准诊断的,未行心内膜心肌活检。
4 结论
综上所述,左心室熵是衡量心肌LGE 图像信号强度分布异质性的一种客观且有较高可重复性的方法,对心肌炎患者的预后评估有一定的参考价值,能够提示临床采取相应的临床决策,以降低心肌炎患者MACE的发生率。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:王锡明设计本研究的方案,对稿件重要内容进行了修改;刘方圆起草和撰写稿件,获取、分析并解释本研究的数据;高艳、王文先、史荣超、李莎获取、分析本研究数据,对稿件重要内容进行了修改;王锡明获得国家自然科学基金项目资助;全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

