金丝小枣全枣、枣皮、枣肉黄酮提取物的抗氧化活性和免疫活性
师仁丽,刘欣宜,张彩玉,徐志悦,桑亚新,于文龙,王向红
(河北农业大学 食品科技学院,河北 保定 071000)
枣是鼠李科(Rhamnaceae)枣属(ZiziphusJujubaMill.)植物的成熟果实,已有4 000 年的栽培历史[1]。红枣营养价值高,且有很高的食用价值,是营养和医疗保健的优质滋补果品,是很重要的食用材料和经济产品,享有“营养保健丸、木本粮食”的美誉[2-3]。由于其具有抗氧化、抗炎、抗癌、保护心肌等功能而被用作营养食品和传统药品[4-6]。金丝小枣广泛分布在河北沧州一带,具有果核细小、可食率达97%、含可溶性固形物40%~45%、制干率55% 左右、质脆细嫩、品质优良等特点[7-10]。
黄酮类化合物是植物产生的一类次生代谢产物,是一类重要的天然化合物,对人体健康起着重要的作用[11-13]。大量研究表明黄酮类物质具有降血压、降血脂、增大心脏血流量、增强心脏收缩、减少心脏搏动数、止咳祛痰、抗菌消炎的功效[14-16]。黄酮类化合物在植物中分布广泛,目前发现的黄酮类化合物已达5 000 种。黄酮类化合物的生物活性日益受到广泛关注,大量研究表明其具有抗氧化、降血糖血脂、调节内分泌、增强机体免疫力等生理活性[17-20]。其中对枣中黄酮类化合物的抗氧化活性和免疫活性研究较多,但以上研究仅限于枣中黄酮类化合物的粗提物,并且对金丝小枣中的黄酮类化合物的生物活性研究甚少。
因此本试验通过分别测定金丝小枣全枣、枣皮、枣肉的黄酮提取物清除DPPH·、ABTS+·、·OH 的能力和总还原力,以及对小鼠淋巴细胞增殖的影响,研究比较金丝小枣全枣、枣皮、枣肉黄酮抗氧化活性和免疫活性。
1 材料与方法
1.1 材料与试剂
金丝小枣:产地为山东省乐陵市;石油醚、无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、邻二氮菲、磷酸二氢钠、硫酸亚铁、三氯乙酸、氯化铁、二甲基亚砜(dimethyl sulfoxide,DMSO)(均为分析纯):天津科密欧化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)、2 ,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS ]、芦丁标准品(纯度为99.9%):上海源叶生物科技有限公司;无菌小白鼠20 日龄:河北大学医学部;RPMI-1640 培养基:美国赛默飞世尔科技公司;刀豆蛋白A(concanavalin A,ConA)、台盼蓝、Hank′s 液:美国Sigma 公司;原体新生牛血清、四甲基偶氮唑盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT]:浙江天杭生物科技有限公司。
1.2 仪器与设备
电热鼓风干燥箱(101-OAB):天津市泰斯特仪器有限公司;紫外可见风光光度计(UV-2008H):上海UNIC 公司;恒温水浴锅(DZWK-C):北京市光明医疗仪器厂;旋转蒸发仪(RE-52A):上海亚荣生化仪器厂;酶标仪(I500-823):美国赛默飞世尔科技公司;超净工作台(SW-CJ-1FD):苏州安泰空气技术有限公司;CO2培养箱(HF90):广州力康仪器有限公司。
1.3 试验方法
1.3.1 样品的制备
将金丝小枣分为全枣、枣皮、枣肉三部分,分别洗净烘干,取1 g 加10 mL 石油醚(60~90 ℃),超声(180 W,45 ℃)30 min,置于60 ℃恒温水浴锅中挥干,加入20 mL 70%乙醇,超声50 min,取上层清液,重复3 次,最后合并上清液,3 500 r/min,离心10 min,弃去沉淀,得到黄酮粗提液,参照优化后最佳的纯化工艺(上样液pH3,吸附流速为3 mL/min,上样浓度为0.35 mg/mL,洗脱剂为70%乙醇)将3 种粗提液进行纯化[21],冻干,置于干燥器中备用。
1.3.2 抗氧化能力的测定
1.3.2.1 DPPH·清除能力的测定
配制DPPH 溶液:准确称量DPPH 20 mg,置于100 mL 容量瓶中,用60%乙醇溶解并定容至刻度,得到的DPPH 溶液浓度为0.5 mmol/L,于4 ℃下备用。
将1.3.1 得到的提取物用95% 乙醇分别稀释为10、20、40、60、80、100 μg/mL,分别精密量取2 mL 与等体积的DPPH 溶液混合,振荡混匀,静置30 min,测定在517 nm 处的吸光度,记为Ai。将DPPH 溶液替换为60% 乙醇溶液,测得吸光度记为Aj,取DPPH 溶液2 mL 与等体积的60% 乙醇溶液混合,测得吸光度记为A0。60%乙醇溶液为空白对照,以Vc 为阳性对照,以上每个处理做3 个平行。DPPH·清除率(D,%)计算公式如下。
1.3.2.2 ABTS+·清除能力的测定
配制7.4 mmol/L 的ABTS 溶液和2.6 mmol/L 的过硫酸钾溶液,将两种溶液混合,在黑暗室温下放置12 h,为ABTS 储备液。使用前用95% 乙醇溶液稀释40~50 倍,在734 nm 处测得的吸光度约为0.70±0.02,得到ABTS 工作液。
将1.3.1 得到的提取物用95% 乙醇分别稀释为10、20、40、60、80、100 μg/mL,取1 mL 样品溶液,加入ABTS 工作液4 mL,漩涡振荡,静置6 min。以95%乙醇溶液作为空白对照,在734 nm 波长下测得吸光度,记为A。将1 mL 95%乙醇溶液代替样品溶液,测得吸光度记为A0,以VC为阳性对照。以上每个处理做3 个平行。ABTS+·清除率(B,%)计算公式如下。
1.3.2.3 ·OH 清除能力的测定
取2 mL 磷酸缓冲盐溶液(phosphate buffered saline,PBS)(pH7.4、150 mmol/L)与4 mL 蒸馏水混匀,作为空白管,在536 nm 处测定吸光度A0;2 mL PBS溶液与1 mL 邻二氮菲(1.5 mmol/L)、1 mL 硫酸亚铁(1.5 mmol/L)、2 mL 蒸馏水混匀,作为未损伤管,测定吸光度A1;2 mL PBS 溶液与1 mL 邻二氮菲、1 mL 硫酸亚铁溶液、1 mL 蒸馏水、1 mL 0.02%过氧化氢溶液混匀,作为损伤管,测定吸光度A2;2 mL PBS 溶液与1 mL样品溶液、3 mL 蒸馏水混匀,作为样品参比管,测定吸光度A3;2 mL PBS 溶液与1 mL 邻二氮菲、1 mL 硫酸亚铁溶液、1 mL 样品溶液、1 mL 过氧化氢溶液混匀,作为样品管,测定吸光度A4,以VC为阳性对照。在37 ℃恒温水浴锅中放置60 min,测定吸光度A。以上每个处理做3 个平行,计算平均值。·OH 清除率(O,%)计算公式如下。
1.3.2.4 总还原力的测定
采用铁氰化钾法测定总还原力。取1.3.1 所得提取物,用95% 乙醇分别稀释到含量为25、50、100、200、300、400 μg/mL,分别精密量取2 mL,加入2 mL PBS 溶液(pH6.6、0.2mol/L),再加入2 mL 1%铁氰化钾溶液,50 ℃孵育20 min,快速冷却,加入2 mL 10% 三氯乙酸溶液,3 500 r/min 离心10 min,取上清液5 mL,加5 mL 蒸馏水,再加入1 mL 0.1% 三氯化铁溶液,充分混匀,室温静置10 min,测定700 nm 处的吸光度。
1.3.3 免疫活性的测定
1.3.3.1 对小鼠T 淋巴细胞增殖的影响
小鼠脾细胞的制备:将试验小鼠眼球放血、脱颈、致死后,放置于75%酒精内,5 min 后转移至超净工作台内,解剖出小鼠脾脏,用Hank′s 液清洗,将钢网放置到培养皿中,研磨小鼠脾脏,把悬液转移到离心管中,用Hank′s 液清洗后离心(2 000 r/min,20 min),重复3 次,加入1 mL RPMI-1640 培养液重悬。调整细胞悬液最终浓度为5×106个/mL。
细胞增殖实验:将100 μL 细胞悬液加入到96 孔培养板中,分别加8 个孔,实验组加入50 μL 不同含量的样品溶液(5、10、25、50、100 μg/mL),10 μL 刀豆蛋白(ConA),40 μL RPMI-1640 培养液。对照组加入10 μL刀豆蛋白(ConA)、90 μL RPMI-1640 培养液。空白组加入100 μL RPMI-1640 培养液,测定570 nm 处吸光度,记为A0。将96 孔培养板置于CO2培养箱中培养,44 h 时加入MTT 10 μL,48 h 时终止培养,每孔弃去100 μL 上清液,加入100 μL 二甲基亚砜,在漩涡混匀器上振荡摇匀,室温放置30 min,测定吸光度A1。计算细胞的增殖率(Z,%)。
1.3.3.2 对小鼠B 淋巴细胞增殖的影响
操作同1.3.3.1,用脂多糖(lipopolysaccharides,LPS)替换刀豆蛋白(ConA)。计算细胞的增殖率。
1.4 数据处理
测试数据和图形处理分别采用Excel 2016 和Graphpad prism 9 软件,差异显著性分析采用SPSS 16.0 软件中Duncan 法评价,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 抗氧化能力的测定
2.1.1 DPPH·清除能力
金丝小枣全枣、枣皮、枣肉黄酮提取物对DPPH·的清除作用如图1 所示。
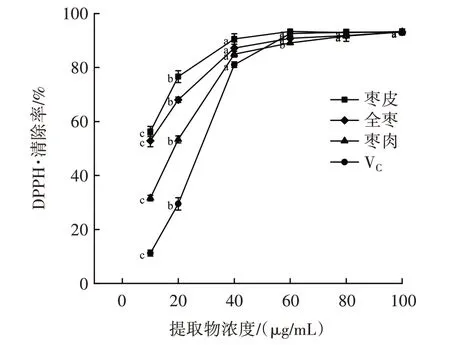
图1 金丝小枣全枣、枣皮、枣肉黄酮提取物对DPPH·的清除作用Fig.1 Effect of flavonoids extracted from the whole fruit,skin and flesh of Ziziphus Jujuba on DPPH·scavenging
由图1 可知,金丝小枣全枣、枣皮、枣肉的黄酮提取物对DPPH·均有清除作用,且含量在10~40 μg/mL时,随着黄酮含量的增加,DPPH·清除率逐渐增大,并呈现一定的剂量效应关系,全枣、枣皮、枣肉的清除率均高于VC,当含量大于60 μg/mL 时,增加趋势不明显,含量达到100 μg/mL 时,DPPH·清除率高于90%。经过统计学分析,10~40 μg/mL 范围内金丝小枣全枣、枣皮、枣肉DPPH·清除率存在显著差异(P<0.05)。80~100 μg/mL 时,差异不显著,在同一含量下,3 个部位提取液的DPPH·清除能力差异不明显,枣皮,全枣、枣肉提取液的DPPH·清除能力均高于VC。
2.1.2 ABTS+·清除能力
金丝小枣全枣、枣皮、枣肉黄酮提取物对ABTS+·的清除作用如图2 所示。
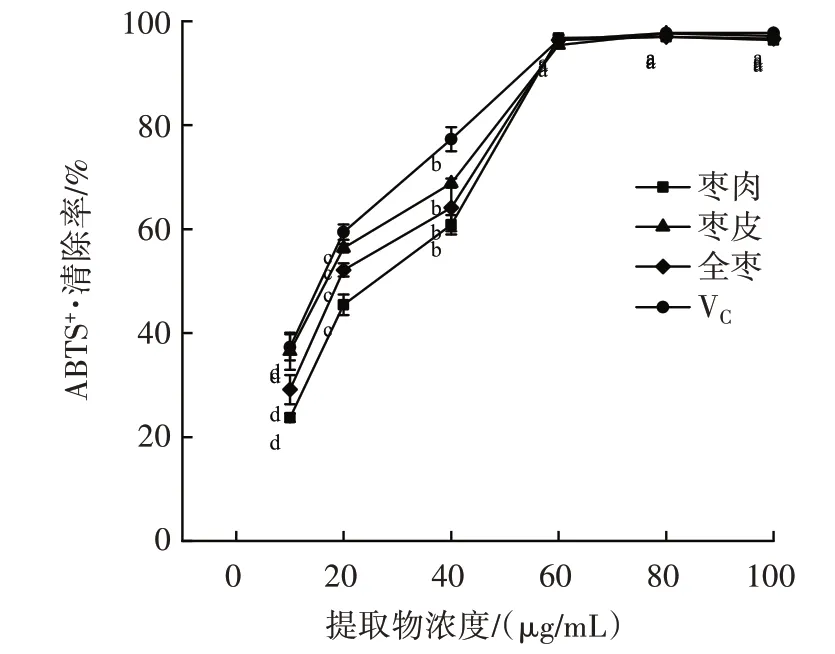
图2 金丝小枣全枣、枣皮、枣肉黄酮提取物对ABTS+·的清除作用Fig.2 Effect of flavonoids extracted from the whole,skin and flesh of Ziziphus Jujuba on ABTS+·scavenging
由图2 可知,金丝小枣全枣、枣皮、枣肉的黄酮提取物对ABTS+·均有清除作用,且10~60 μg/mL 时,随着黄酮含量增加,ABTS+·清除率也不断增大,呈现一定的剂量效应关系,并且差异显著(P<0.05),60~100 μg/mL,无增长趋势,无显著差异。ABTS+·清除活性顺序为枣皮>全枣>枣肉,最高ABTS+·清除率分别可达到97.17%、96.65%、96.38%,全枣、枣皮、枣肉ABTS+·清除率均低于VC。
2.1.3 ·OH 清除能力
金丝小枣全枣、枣皮、枣肉黄酮提取物对·OH 的清除作用如图3 所示。

图3 金丝小枣全枣、枣皮、枣肉黄酮提取物对·OH 的清除作用Fig.3 Effect of flavonoids extracted from the whole,peel and flesh of Ziziphus Jujuba on·OH scavenging
由图3 可知,金丝小枣全枣、枣皮、枣肉的黄酮提取物对·OH 的清除能力存在一定差异,黄酮含量为10~80 μg/mL 时,·OH 清除率随着黄酮含量的增加而增大,呈现一定的剂量效应关系;黄酮含量为80~100 μg/mL 时,·OH 清除率小幅度下降。·OH 清除能力顺序为枣皮>全枣>枣肉。表明枣皮中具有·OH 清除能力的成分含量较大,而枣肉中含量相对较低。·OH 最高清除率分别可达到86.15%、84.55%、69.47%,全枣、枣皮、枣肉的·OH 清除率均高于VC。
2.1.4 总还原力的测定结果
金丝小枣全枣、枣皮、枣肉黄酮提取物总还原力测定结果如图4 所示。
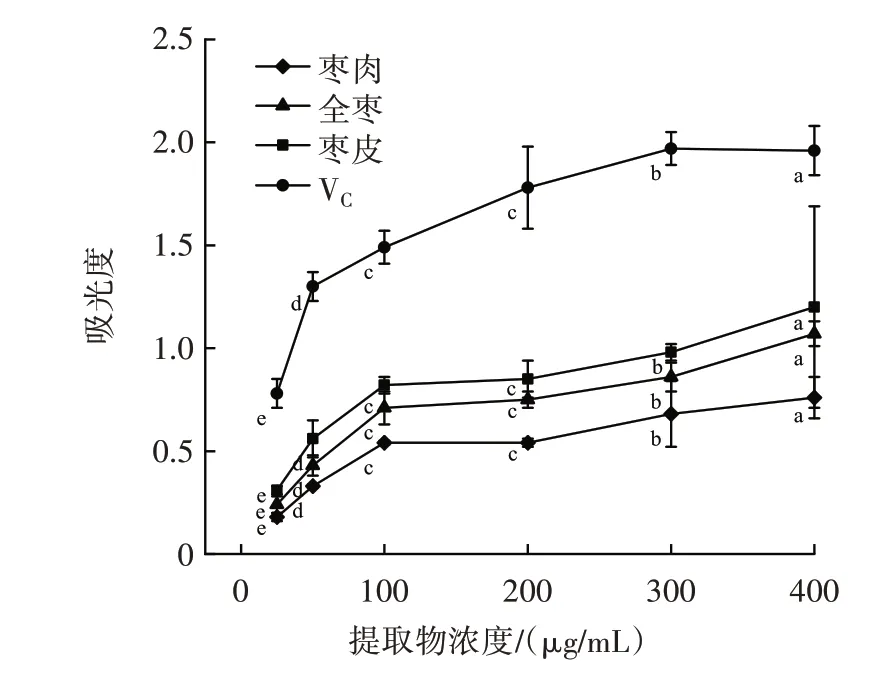
图4 金丝小枣全枣、枣皮、枣肉黄酮提取物总还原力测定结果Fig.4 Results of total reducing power of flavonoids extracted from the whole,skin and flesh of Ziziphus Jujuba
由图4 可知,随着黄酮含量的增加,各部位黄酮的吸光度也逐渐增大,且具有良好的剂量效应关系,但存在一定差异。除全枣与枣皮差异不明显,其它样品间差异明显,VC的吸光度明显高于3 种样品。当黄酮含量为400 μg/mL 时,枣皮的吸光度可达1.20,而枣肉仅为0.76。金丝小枣全枣、枣皮、枣肉的黄酮提取液均为良好的电子供应者,所提供的电子可使Fe3+还原为Fe2+,说明全枣、枣皮、枣肉均具有抗氧化潜力。
2.1.5 相关性分析
为了更进一步确定金丝小枣不同部位黄酮提取液与其抗氧化活性之间的关系,将各提取液对DPPH·、ABTS+·、·OH 的清除率作相关性分析,其相关系数和P值见表1。

表1 黄酮含量与其抗氧化活性的相关性分析Table 1 Correlation analysis between total flavonoid content and antioxidant activity
由表1 可知,各部位提取液的黄酮含量与其对DPPH·、ABTS+·、·OH 的清除率以及总还原力均呈极显著正相关(P<0.01),表明黄酮在抗氧化活性功能上发挥着重要作用且有很大的贡献。综上,黄酮含量可作为评价金丝小枣抗氧化活性的重要指标。此外,4 种抗氧化活性指标之间也存在极显著相关性(P<0.01),可能是因为它们具有相似的反应机理。
2.2 免疫活性的测定
2.2.1 对小鼠T 淋巴细胞增殖的影响结果
金丝小枣黄酮提取物对小鼠T 淋巴细胞增殖影响,如图5 所示。
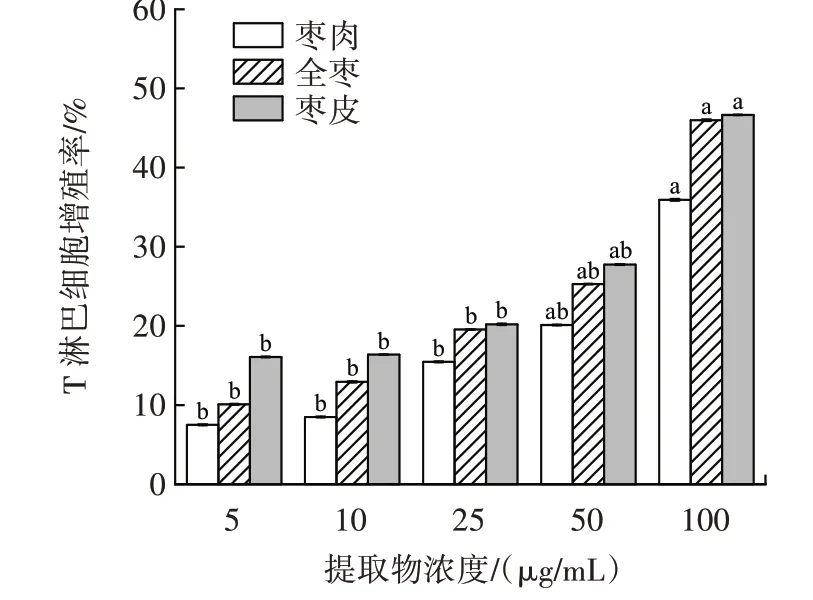
图5 金丝小枣黄酮提取物对小鼠T 淋巴细胞增殖影响Fig.5 Effect of total flavonoids of Ziziphus Jujuba on mouse T lymphocyte proliferation
由图5 可知,在ConA 诱导小鼠脾脏T 淋巴细胞增殖反应中,金丝小枣的全枣、枣皮、枣肉的黄酮提取物对T 淋巴细胞均具有促进作用,在5~100 μg/mL 范围内伴随黄酮含量的增加促进作用也逐渐增大。其中促进作用顺序为枣皮>全枣>枣肉。当含量为100 μg/mL时,增殖率分别达到46.64%、45.98%、34.36%。枣肉与枣皮、全枣黄酮对T 淋巴细胞的增殖率差异明显。
2.2.2 对小鼠B 淋巴细胞增殖的影响结果
金丝小枣黄酮提取物对小鼠B 淋巴细胞增殖影响如图6 所示。
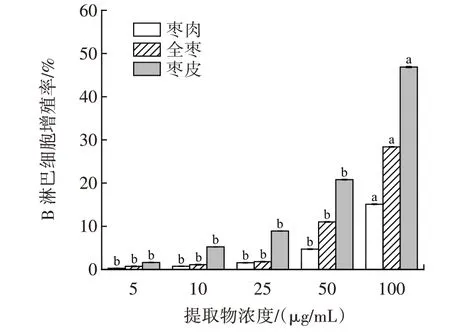
图6 金丝小枣黄酮提取物对小鼠B 淋巴细胞增殖影响Fig.6 Effect of total flavonoids of Ziziphus Jujuba on mouse B lymphocyte proliferation
由图6 可知,在LPS 诱导小鼠脾脏B 淋巴细胞增殖反应中,金丝小枣的全枣、枣皮、枣肉黄酮提取物对B 淋巴细胞均具有促进作用,在5~100 μg/mL 范围内伴随含量的增加促进作用也逐渐增大。其中促进作用顺序为枣皮>全枣>枣肉。当含量为100 μg/mL 时,增殖率分别能达到46.86%、28.37%、15.11%。枣肉与枣皮黄酮对B 淋巴细胞的增殖率差异明显。枣肉、枣皮黄酮含量5、10、25、50 μg/mL 间差异不显著,100 μg/mL与其他含量间差异显著(P<0.05)。
3 结论
对金丝小枣全枣、枣皮、枣肉的黄酮提取物的抗氧化活性和免疫活性进行研究。通过对DPPH·、ABTS+·、·OH 自由基清除能力和总还原力的测定,发现枣皮、枣肉、全枣均具有较强的抗氧化活性,其中枣皮的抗氧化活性最强,枣肉最弱。在DPPH·和·OH 的清除试验中,各样品清除率均高于VC,而ABTS+·清除活性和总还原力低于VC。各提取液黄酮含量与其DPPH·、ABTS+·、·OH 的清除率以及总还原力均呈显著正相关(P<0.01)。细胞增殖实验结果表明,全枣、枣皮、枣肉的黄酮提取物对小鼠T 淋巴细胞、B 淋巴细胞的增殖均具有较强的直接促进作用,强弱顺序为枣皮>全枣>枣肉。综上所述,金丝小枣是一种具有开发前景的天然抗氧化剂,全枣、枣皮、枣肉的黄酮提取物均可以达到提高机体免疫力的作用。

