高能电子束辐照对黄精品质的影响
唐艺文,黄敏,付孟,刘靓,王钢,王丹,陈谦*
(1.西南科技大学 生命科学与工程学院,四川 绵阳 621010;2.四川省原子能研究院,四川 成都 610101;3.辐照保藏四川省重点实验室,四川 成都 610101)
黄精(Polygonatirhizoma),百合科黄精属(Polygonatum),2020 年版《中国药典》中收载了3 种黄精,分别为黄精、多花黄精和滇黄精[1]。黄精属植物分布广泛,我国约有79 种[2]。作为川产道地药材之一[3],黄精中含有大量有益人体的营养成分,其中黄精多糖具有免疫调节、防治糖尿病、抗骨质疏松、改善心肌细胞损伤等作用[4];皂苷具有降血糖、抗肿瘤等作用[5];黄精中黄酮在人体中可以发挥抗炎、抗氧化等作用[6]。随着人们健康生活观念的增强,对中药材也更加关注,黄精作为一种药食同源药材[7],其市场也在逐渐扩大,现已广泛应用于食品、药品、化妆品等领域。
据统计,2020 年黄精产量在11 561 t 左右,2021 年产量约为14 963 t,林下规范种植黄精,每公顷单位产量为1 500 kg 干品,每公顷的年产值可达112 500 元[8],有着良好的经济效益。同时,“加强新食品原料、食药同源食品开发和应用”是国家重点关注的发展方向[9]。四川作为中国十大道地药材产区之一,当地政府对中药材市场的发展也十分重视。四川省人民政府办公厅发布相关文件以提升川字号中药材品质与数量,培育一批在全国有影响力的川产道地药材大品种[10],为促进中药材产业发展,四川省制定了2025 年中药材产业的发展目标:中药材种植面积达850 万亩、年总产值达300 亿元以上[11]。黄精作为一种川产道地的药食同源中药材,其发展有良好的政策支撑。
然而黄精含有大量的黄精多糖,易在贮藏过程中发生虫蛀、霉变等现象[12],会对其食用价值、药用价值产生影响,故需运用贮藏养护技术进行处理。中药材贮藏中的传统养护技术有物理贮藏养护技术和化学养护技术,其中如干燥、气调等的物理养护技术,在过程中存在耗时长、加热不均匀、操作繁琐等缺点;而用磷化铝、硫磺等化学试剂对药材进行熏蒸的贮藏养护技术,易在药材中造成化学物质的残留,不仅影响药效,还可能对人体造成损伤。在我国也已发布“要消除磷化铝熏蒸现象,防止在中药材产地加工与仓储期间滥用硫磺熏蒸”相关文件[13]。辐照灭菌技术作为一种“冷杀菌技术”,具有绿色、安全、卫生、经济、高效的特点,相较于传统贮藏养护方法具有明显优势。目前,辐照技术在食品灭菌和贮藏处理中的应用已十分广泛,如鲜切蔬菜[14]、水果[15-16]、泡椒凤爪[17]、肉类[18-19]等;在中药材方面,对辐照技术应用的研究也已经逐步展开,如天麻[20]、川芎[21]、大黄[22]、枸杞[23]等,有研究发现经一定剂量的辐照处理,可以降低药材中微生物含量,其主要活性成分没有明显变化[24],是一种延长中药材贮藏期的有效方法[25]。有相关研究发现黄精经0.5~6.0 kGy的60Co-γ 射线辐照后,其微生物显著减少,表明在中药材的贮藏养护中辐照技术能够发挥有效作用[12]。相较于60Co-γ 射线辐照技术,高能电子束辐照具有处理效率高、能耗低、处理过程安全可控等优点,然而电子束辐照技术在中药材保藏加工中的应用研究仍然较少。
本研究采用电子加速器对黄精进行高能电子束辐照处理,测定辐照前后多项指标(微生物含量、活性成分、指纹图谱等)的变化情况,评价高能电子束辐照技术对黄精品质的影响,以期为电子束辐照技术在黄精贮藏中的应用提供一定的参考。
1 材料与方法
1.1 材料与试剂
黄精:四川省中兴药业有限公司;D-葡萄糖、薯蓣皂苷元、芦丁(纯度均为98%):成都埃法生物科技有限公司;胰酪大豆胨琼脂培养基、沙氏葡萄糖琼脂培养基:北京奥博星生物技术有限责任公司;甲醇、乙腈(均为色谱纯):赛默飞世尔科技(中国)有限公司;亚硝酸钠、硝酸铝、氢氧化钠、冰醋酸、高氯酸、香草醛、无水乙醇(均为分析纯):成都市科隆化学品有限公司。
1.2 仪器与设备
UltiMate 3000 双三元、二维液相色谱仪:美国赛默飞世尔公司;RHCX-350 超声波清洗仪:济宁荣汇超声波设备有限公司;GE60DA 高压蒸汽灭菌锅:美国致微公司;NH300 色度仪:深圳市三恩时科技有限公司;SPECORD 200 PLUS 紫外可见光分光光度计:德国Analytik Jena 公司;VF-ProAcc-10/20 电子加速器:山东蓝孚高能物理技术股份有限公司;重铬酸银剂量计:四川省原子能研究院实验室自制。
1.3 方法
1.3.1 辐照剂量选择
基于“中药辐照灭菌技术指导原则(2015 年第86号)”中“中药最大总体平均辐照剂量原则上不超过10 kGy”的要求,本研究设定了2、4、6、8 kGy 4 个剂量组和0 kGy 对照组(CK)。
1.3.2 药材处理
采用复合材料(20 cm×30 cm,30 丝)对黄精原材料进行真空密封包装,各剂量分别包装3 袋(每袋200 g),高能电子加速器(能量10 MeV,功率20 kW)按设定的辐照剂量进行处理,以辐照剂量0 kGy 作为对照组(CK),用重铬酸银剂量计测定黄精的实际吸收的辐照剂量,测得实际吸收的辐照剂量为2.15、4.05、6.88、8.62 kGy。后文均以设定剂量表示。将辐照后的黄精进行粉碎,过三号筛备用。
1.3.3 活性成分含量测定
1.3.3.1 黄精多糖含量测定
按2020 年版《中国药典》黄精中的方法测定,以葡萄糖(C6H12O6)为对照品,计算样品中黄精多糖含量。
1.3.3.2 总皂苷含量测定
以薯蓣皂苷元作为对照品,采用比色法测定,参照尤新军等[26]方法略作修改。按照1∶20(g/mL)的料液比,称取0.2 g 黄精样品,加入4 mL 80%乙醇,在60 ℃的温度下超声提取30 min,重复提取2 次,过滤,合并滤液,定容至10 mL,为供试液。取供试液5 mL,80 ℃水浴加热挥尽溶剂,加入0.2 mL 现配的5%香草醛-冰醋酸溶液,冰水浴条件下加入0.8 mL 高氯酸,摇匀后在60 ℃保温15 min,取出置于冰水浴中2 min,加入冰醋酸至5 mL,静置30 min,在波长530 nm 下进行吸光度测定。
1.3.3.3 总黄酮含量测定
以芦丁作为对照品,采用铝盐显色法,参照龙杰凤等[27]的方法进行测定。黄精样品采用80% 乙醇溶液按照1∶5(g/mL)的料液比在70 ℃下超声45 min 进行提取,冷却,过滤,取滤液2 mL 于10 mL 试管中,加0.4 mL 5% NaNO2溶液,混匀静置6 min,加0.4 mL 10% Al(NO3)3,混匀静置6 min,加入4 mL 40% NaOH混匀,加水至刻度,静置15 min,在波长512 nm 处测定吸光度。
1.3.4 微生物含量测定
测定各辐照剂量下黄精中的需氧菌总数、霉菌和酵母菌总数。具体方法参照2020 年版《中国药典》中1105 非无菌产品微生物限度检查:微生物计数法。
1.3.5 高效液相色谱(high performance liquid chromatography,HPLC)法测定指纹图谱
1.3.5.1 供试品溶液的制备
精密称取辐照后的黄精样品粉末,按照料液比1∶20(g/mL)加入甲醇,称重,室温下超声30 min,称重,用甲醇补足质量,过滤后,取滤液,为供试品溶液。
1.3.5.2 色谱条件
色谱柱:ZORBOX SB-C18(250 mm×4.6 mm,5 μm);流动相:水为流动相A,乙腈为流动相B,按表1 进行梯度洗脱;流速:0.8 mL/min;柱温:30 ℃;进样体积:10 μL;指纹图谱检测波长:210 nm。

表1 流动相时间程序Table 1 Time program of mobile phase
1.3.5.3 指纹图谱采集
按上述方法制备对照品和供试品溶液并进行检测,得到黄精的HPLC 指纹图谱。
1.3.6 色泽测定
参照李占明等[28]的方法,通过色度仪测定黄精样品的色泽,记录亮度值L*值、红绿值a*值、黄蓝值b*值,并按下列公式计算饱和度(C)和总色差(∆E)。
1.4 数据处理
采用SPSS 22.0 软件对3 次重复试验测得的数据进行显著性和相关性分析;采用中药色谱指纹图谱相似度评价系统2012 版进行HPLC 指纹图谱分析,Origin 2021 软件进行指纹图谱的绘制。
2 结果与分析
2.1 电子束辐照对黄精微生物数量的影响
各辐照剂量下的微生物数量测定结果见表2。

表2 电子束辐照处理对黄精微生物总数的影响Table 2 Effect of electron beam irradiation on total microbial count of Polygonati rhizoma
由表2 可知,未经辐照的黄精样品的微生物数量大于限量标准,不符合《中国药典》要求。当电子束辐照剂量达到2 kGy 时,微生物数量均降低至检测限以下,表明在辐照剂量为2 kGy 时,高能电子束辐照能明显降低黄精药材中的微生物含量,使得黄精中的需氧菌总数、霉菌和酵母菌总数符合《中国药典》中规定的微生物限量标准。黄赵刚等[12]利用60Co-γ 射线辐照黄精后发现当辐照剂量为0.5~6.0 kGy 时,黄精中微生物显著减少,与本研究结果较为一致。通过电子束辐照处理后能够有效控制中药材中的微生物含量,使其达到《中国药典》的相关规定。
2.2 电子束辐照对黄精中活性物质含量影响
黄精多糖、总皂苷和黄酮是黄精主要活性成分,其含量是评价黄精品质的重要指标。经不同剂量电子束辐照处理后,测得黄精中黄精多糖、总皂苷和黄酮的含量如表3 所示,辐照剂量与黄精多糖、总皂苷、总黄酮的相关性如表4 所示。

表3 电子束辐照对黄精活性成分的影响Table 3 Effect of electron beam irradiation on active ingredients of Polygonati rhizoma
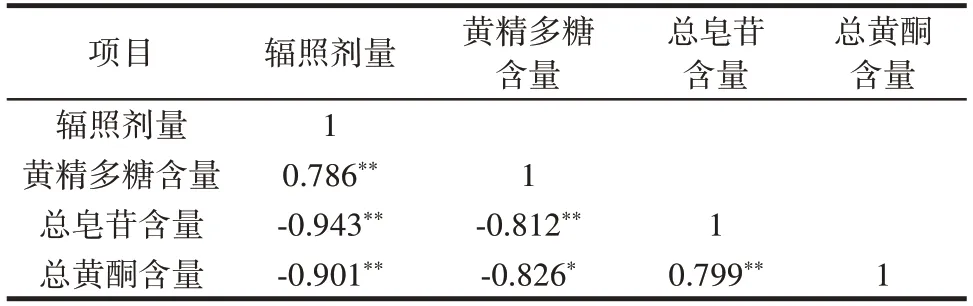
表4 辐照剂量与黄精多糖含量、总皂苷含量、总黄酮含量的相关性Table 4 Correlation among irradiation dose,polysaccharides,total saponins,and total flavonoids of Polygonati rhizoma
由表3、表4 可知,辐照前后黄精的黄精多糖含量范围为7.87%~9.92%,符合《中国药典》中规定的黄精多糖含量不小于7.0%要求。黄精多糖在辐照剂量为2 kGy 时,与CK 组相比无显著性差异(P>0.05),并与辐照剂量之间呈现极显著性正相关(P<0.01),即当辐照剂量较高时,会增加样品中的黄精多糖含量,周鑫等[29]研究发现当辐照剂量超过5 kGy 时,白芷中的粗多糖含量会呈现上升趋势,与本文结果一致。本研究方法测定的是黄精中的水溶性多糖,多糖作为大分子物质,其本身不易溶于水,辐照能够使糖苷键断裂,使多糖发生降解,从而降低多糖的平均分子量[30],并使得羧基数量增加[31]。羧基作为亲水基团,它的增加能够提高多糖在水中的溶解度。同时,Wang 等[32]研究发现,辐照会使山药淀粉的结构发生改变,支链淀粉含量增加,山药粉的溶解度从15.59%显著增加到30.05%。由此可见,辐照会使多糖结构发生改变,提高溶解度,使黄精多糖含量增加。
总皂苷含量范围在7.43%~8.44%,随着辐照剂量的升高,总皂苷含量整体呈现逐渐降低的趋势,与CK组相比,2 kGy 辐照剂量电子束辐照处理后,样品中总皂苷含量未出现显著变化(P>0.05),在4、6、8 kGy 辐照剂量下总皂苷含量显著降低(P<0.05),与辐照剂量之间呈现极显著的负相关性(P<0.01)。研究发现辐照会造成皂苷结构的改变和降解,从而使其含量减少[21]。研究发现,人参经辐照后,其中的人参皂苷Rf 和人参皂苷Rb3 随辐照剂量的增加而减少[33]。人参皂苷Rf属于四环三萜类衍生物,人参皂苷Rb3 是一种天然三萜皂苷,三萜皂苷类是黄精总皂苷的主要成分之一,可推测辐照对黄精中的三萜皂苷类成分产生降解作用,使得其含量减少。
随着辐照剂量的升高,黄精中总黄酮含量呈现逐渐降低的趋势。与CK 组相比,经2、4 kGy 辐照剂量电子束辐照处理后,样品中总黄酮含量未出现显著性差异(P>0.05),在6、8 kGy 辐照剂量下总黄酮含量呈现显著性差异(P<0.05),徐胜等[6]研究发现黄精中黄酮含量随辐照剂量的增大而减少,与本研究结果一致。有研究表明辐照会促进羟基自由基的产生[34],并与辐照剂量呈正相关,进一步说明在辐照过程中可能会引起抗氧化物质的降解,从而造成总黄酮含量的降低。
2.3 电子束辐照对黄精指纹图谱的影响
指纹图谱可整体描述和评价中药材的品质,是中药质量控制的常用方法,在中药领域已取得广泛的应用。采用Origin 2021 软件进行指纹图谱的绘制,以未辐照(CK)黄精作为参照图谱,进行多点校正、自动匹配(时间窗宽度为0.01),同时峰面积占总峰面积的1%的峰参与匹配,并标记11 个共有峰作为黄精的特征峰,得到黄精的HPLC 指纹图谱,如图1 所示,计算得黄精HPLC 指纹图谱相似度,如表5 所示。
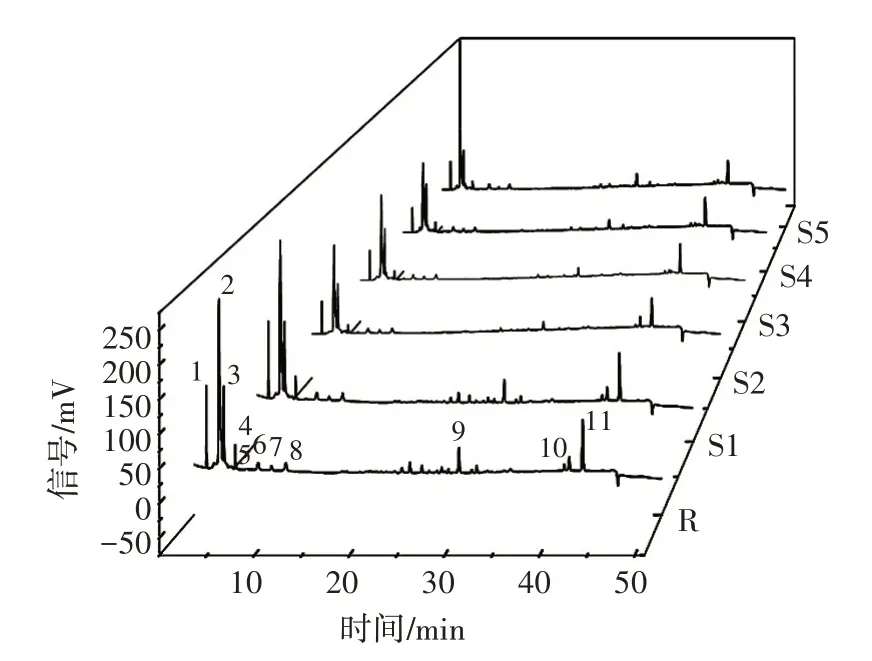
图1 黄精的HPLC 指纹图谱Fig.1 HPLC fingerprint of Polygonati rhizoma

表5 黄精HPLC 指纹图谱相似度Table 5 Similarity of HPLC fingerprints of Polygonati rhizoma
由图1 可知,以1 号为参比峰(令其相对保留时间和相对峰面积为1),计算其余各11 个共有峰的相对保留时间的相对标准偏差(relative standard deviation,RSD)范围为0.02%~2.96%,表明各辐照剂量下,黄精中成分大致保持一致;由表5 可知,采用“中药色谱指纹图谱相似度评价系统2012 版”软件测得指纹图谱相似度均大于0.9,这与徐远芳等[35]对山银花进行HPLC指纹图谱研究的结果较为一致,表明经不同辐照剂量的电子束辐照处理后黄精的指纹图谱整体仍较为一致且稳定,处于可接受范围内。
2.4 色泽
色泽是判断药材品质的直观因素之一。黄精辐照前后各剂量下各色泽指标的测定结果见表6,指标间相关性见表7。

表6 电子束辐照对黄精色泽的影响Table 6 Effect of electron beam irradiation on color of Polygonati rhizoma

表7 辐照剂量与色泽的相关性Table 7 Corrlation between irradiation dose and color
由表6、表7 可知,与CK 组相比,当辐照剂量为2、4 kGy 时,L*值未发生显著变化(P>0.05),当辐照剂量升高至6、8 kGy 时,L*值显著增大(P<0.05),色彩呈现更加亮眼。经相关性分析,发现L*值与辐照剂量呈极显著正相关性(P<0.01)。
红绿值a*值的测定结果均为正值,即黄精偏红。对比于CK 组,发现经2 kGy 处理后的黄精,其a*值无显著变化(P>0.05);随着辐照剂量增大,a*值呈现显著性变化(P<0.05)。总体趋势为随辐照剂量的增大,a*值减少,a*值与辐照剂量呈显著负相关性(P<0.05)。
黄蓝值b*值结果均为正值,黄精主要呈现黄色,相较于CK 组,2 kGy 处理的黄精,其b*值无显著变化(P>0.05),辐照剂量增大后,b*值发生显著性变化(P<0.05),总体呈现增大趋势。经相关性分析,b*值与所选辐照剂量之间存在极显著正相关性(P<0.01),随辐照剂量的增加,黄精黄色加深。
与CK 组相比,色彩饱和度C值在辐照剂量为2 kGy 时无显著变化(P>0.05),随着辐照剂量增大,C值发生显著性变化(P<0.05),整体上呈现增大的趋势,黄精呈现出更加浓厚的色泽,并与所选辐照剂量之间存在极显著正相关性(P<0.01)。
ΔE值表示黄精颜色的差异,值越大表示颜色差异越明显。各剂量辐照下,ΔE值的范围为2.05~11.39。2、4 kGy 辐照剂量下的ΔE值无显著变化(P>0.05)且小于6,说明经2、4 kGy 剂量辐照后,黄精颜色无显著性差异。随着辐照剂量增大,ΔE值显著增大(P<0.05),与辐照剂量之间呈现极显著正相关性(P<0.01)。因此,当辐照剂量为2、4 kGy 时,对黄精的色泽影响相对较小。
随着辐照剂量的增加,黄精整体呈现更加强烈浓重的亮黄色。辐照过程中样品中的多糖物质可与蛋白质发生美拉德反应[36]。结合上述活性物质含量的变化,推测原因可能是辐照过程中黄精中增多的多糖物质和蛋白质发生美拉德反应,使得黄精呈现更加强烈的色彩。
2.5 水分含量、总灰分及醇溶性浸出物
水分、总灰分和浸出物是反映药材品质的重要指标。2020 年版《中国药典》中规定黄精水分含量不得超过18.0%,总灰分不得超过4.0%,醇溶性浸出物含量不得少于45.0%[1]。电子束辐照后黄精中水分、总灰分及浸出物的测定结果见表8,辐照剂量与黄精水分、总灰分和浸出物的相关性见表9。

表8 电子束辐照对黄精水分、总灰分及浸出物的影响Table 8 Effect of electron beam irradiation on moisture,total ash,and extracts of Polygonati rhizoma

表9 辐照剂量与黄精水分含量、总灰分含量和浸出物含量的相关性Table 9 Correlation among irradiation dose,moisture content,total ash content,and extracts contentof Polygonati rhizoma
由表8、表9 可知,辐照前后黄精中水分含量为10.90%~11.36%,总灰分含量为2.18%~2.73%,醇溶性浸出物含量为70.95%~72.28%,且均与CK 组均无显著性差异(P>0.05)。各辐照剂量下黄精的水分、总灰分和醇溶性浸出物含量均符合《中国药典》规定。
3 结论
本研究通过分析不同剂量电子束辐照处理对黄精微生物含量、黄精多糖含量、总黄酮含量、总皂苷含量及指纹图谱等指标的影响,发现当电子束辐照的剂量达到2 kGy 及以上时能有效降低黄精中的微生物含量至可接受范围。综合评价水分、总灰分、浸出物、色泽及活性成分在辐照前后的变化情况,得出当电子束辐照处理的剂量为2 kGy 时,既可以有效降低黄精中的微生物含量,又能在一定程度上保证其品质。综上,高能电子束辐照技术在黄精的储藏加工中具有较广阔的应用前景。

