臭氧处理对猕猴桃采后抗氧化系统的影响
王燕,牛耀星,叶力瑕,罗安伟
(西北农林科技大学 食品科学与工程学院,陕西 咸阳 712100)
猕猴桃富含丰富的营养物质,尤其是抗坏血酸含量远高于其他水果,具有抗氧化功效[1]。然而,由于猕猴桃是典型的呼吸跃变型水果,在采摘之后,它们很快就会过熟变质,从而使其品质大幅度降低。臭氧(O3)由于其具有易于分解和无残留的特性,已作为一种比传统技术更好的物理保鲜方法,来保持收获后的水果和蔬菜的品质。研究发现,臭氧对猕猴桃在内的多种水果具有良好的保鲜效果[2-3]。
臭氧处理可能导致氧化应激。臭氧处理后细胞中过多的活性氧可能对植物有毒,并增加机械损伤和微生物污染的易感性[4]。因此,维持一个平衡的氧化系统对植物细胞的正常代谢至关重要。许多研究表明,线粒体代谢与水果在贮藏期间受到的各种胁迫相关[5]。线粒体是呼吸作用及能力转换的重要场所,是内源性活性氧(reactive oxygen species,ROS)的主要来源,也是ROS 诱导氧化损伤的主要靶点。线粒体状态不仅反映出果实的抗氧化情况,而且反映果实的衰老情况。植物线粒体中存在抗氧化系统,可以调节控制活性氧的产生,修补活性氧对大分子造成的损伤,其中抗氧化系统包括抗坏血酸、谷胱甘肽途径和谷胱甘肽过氧化物酶途径等[6]。谷胱甘肽和抗坏血酸还在细胞氧化还原缓冲起着关键性的调节作用。此外,植物体内酶促防御系统保护植物免受过氧化伤害的防御机制,由过氧化氢酶、超氧化物歧化酶、过氧化物酶等组成。Piechowiak 等[3,7]研究表明臭氧处理可以提高面临过度氧化胁迫的抗氧化酶的活性,从而影响水果的氧化还原状态。但以往研究只考虑了抗氧化酶,难以全面评估ROS 和ROS 清除系统。
本研究为确定臭氧处理对猕猴桃果实冷藏期间线粒体及其抗氧化系统的影响。在探索臭氧处理的猕猴桃的抗氧化能力基础上,不仅对酶清除ROS 系统包括超氧化物歧化酶、过氧化物酶、过氧化氢酶等进行测定,还对线粒体内抗氧化系统包括谷胱甘肽、抗坏血酸、谷胱甘肽过氧化物酶等进行研究,对线粒体微观状态进行观察。本研究为猕猴桃采后贮藏提供了理论参考,也为后续活性氧代谢相关基因的功能研究奠定了良好的基础。
1 材料与方法
1.1 材料与试剂
“海沃德”猕猴桃产自陕西梅县,成熟均匀,无机械损伤。
氢氧化钠、盐酸羟胺、对氨基苯磺酸、α-萘胺、硫代巴比妥酸、三氯乙酸、四氯化钛、浓氨水、愈创木酚、氮蓝四唑、甲硫氨酸、乙二胺四乙酸(均为分析纯):广东光华科技股份有限公司;核黄素、过氧化氢、邻苯二酚、磷酸、无水乙醇、三氯化铁、二硫代硝基苯甲酸、戊二醛、醋酸双氧、柠檬酸铅、还原型谷胱甘肽、二硫苏糖醇(均为分析纯):北京索莱宝科技有限公司。
1.2 仪器与设备
HC-3018R 高速冷冻离心机:安徽中科中佳科学仪器有限公司;T-7001 红外CO2分析仪:北京华仪通泰科技有限公司;T-203 电子天平:北京科普尔科技发展有限公司;spark 酶标仪:奥地利Tecan 股份有限公司;N6000 紫外分光光度计:上海佑科仪器仪表有限公司;DK-98-11-A 电热恒温水浴锅:天津市泰斯特仪器有限公司;Leica UC7 型超薄切片机:徕卡仪器有限公司;HT7800 透射电子显微镜:日立高新技术公司
1.3 试验方法
1.3.1 猕猴桃臭氧处理及呼吸速率、腐烂率测定
将果实随机分为两组:臭氧处理组(HC)和对照组(HD)。猕猴桃在低温条件(温度0~1 ℃,相对湿度90%~95%)下保存,每隔15 d 取样一次。HC 组采用臭氧发生器进行臭氧处理,处理浓度为45 mg/m3。臭氧处理在贮藏后持续7 d,间隔12 h。
采用红外CO2分析仪检测呼吸速率。每组取3 kg猕猴桃,将3 kg 分为3 份,为3 个重复,将每份猕猴桃轻轻放入干燥器中,上面放置红外CO2分析仪,再将密封盖盖严。等系统稳定30 min 后开始计时读数,1 h后再读一次数。呼吸速率单位为mg CO2/(kg·h)。
每组取20 个果实用于测定腐烂率。采用计数法测定果实腐烂的速率。按照下式计算每组果实的腐烂率(X,%)。每个试验重复3 次。
式中:X为腐烂率,%;m为腐烂果实数量,个;M为果实总数,个。
1.3.2 过氧化氢含量、丙二醛含量、超氧阴离子含量检测
超氧阴离子(superoxide anion,O2-)含量根据曹建康等[8]描述的方法进行测定。取猕猴桃1.0 g,用5.0 mL磷酸盐缓冲液(50 mmol/L,pH7.8)冰浴研磨,然后4 ℃、8 000 r/min 离心30 min,得到上清液。取1.0 mL 上清液,依次加入1.0 mL 磷酸缓冲液和1.0 mL 1 mmol/L盐酸羟胺溶液,混匀后置于25 ℃保持60 min,后依次加入1.0 mL 17 mmol/L 的对氨基苯磺酸和1.0 mL 7 mmol/L 的α-萘胺溶液,然后混合液于25 ℃反应20 min,待反应结束,在530 nm 处测定溶液吸光度。O2-含量以每千克样品中超氧阴离子产生的物质量表示,单位为mmol/kg。
丙二醛(malondialdehyde,MDA)含量根据Xu 等[9]的方法测定。取1.0 g 猕猴桃果肉加入5.0 mL 100 g/L三氯乙酸溶液研磨成浆,之后于4 ℃、8 000 r/min 下离心30 min 得上清液。取2.0 mL 上清液加入2.0 mL 6.7 g/L 的硫代巴比妥酸溶液,沸水浴保温20 min。8 000 r/min 离心20min 后,分别测定OD450、OD532和OD600。重复3 次,单位为μmol/kg。
过氧化氢(hydrogen peroxide,H2O2)含量的测定方法参照曹建康等[8]的方法。称取猕猴桃1.0 g,在4 ℃条件下用预冷丙酮提取H2O2。研磨后于4 ℃、3 000 r/min离心30 min,取上清液1.0 mL 加入0.1 mL 10% 的四氯化钛-浓盐酸溶液,接着加入0.2 mL 浓氨水,在4 ℃的条件下12 000 r/min 离心30 min,再向沉淀中加入3.0 mL 2 mol/L H2SO4溶解沉淀。测定412 nm 处吸光度,重复3 次。猕猴桃果肉中H2O2含量以mmol/kg表示。
1.3.3 抗氧化酶活性测定
抗氧化酶[超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)]活性测定参考文献[10-12]方法。将1.0 g 猕猴桃果肉加入5.0 mL 50 mmol/L 磷酸缓冲液中,冰浴均质。将混合好的均质溶液放入离心管,在4 ℃、8 000 r/min 下,经过20 min 的离心,获得的上层溶液即为酶提取液。
POD 活性:采用愈创木酚法测定POD 活性。2.0 mL 0.1 mol/L 醋酸缓冲液、1.0 mL 0.25%愈创木酚溶液、0.05 mL 酶提取液和0.1 mL 0.75% H2O2溶液按顺序加入试管中,并将其混合均匀,室温下放置5 min,470 nm 波长处测量其吸光度。1 个过氧化物酶活性单位(U)以每分钟引起吸光度(470 nm)变化0.01 的量表示,POD 活性单位表示为U/kg。
SOD 活性:采用氮蓝四唑法测定SOD 活性。反应液由54.0 mL 14.5 mmol/L 甲硫氨酸、2.0 mL 3 μmol/L的乙二胺四乙酸、2.0 mL 2.25 mmol/L 的氮蓝四唑和2.0 mL 75 μmol/L 核黄素组成。取3.0 mL 反应液加入50 μL 酶提取液,在25 ℃、11 W 的荧光灯下光照10 min,立即测定560 nm 处的吸光度,重复3 次。一个SOD 活性单位(U)被定义为抑制氮蓝四唑光还原50%所需的量。SOD 活性单位表示为U/kg。
CAT 活性:将0.1 mL 酶提取液与2.9 mL 20 mmol/L过氧化氢混合,并使用蒸馏水作为参比,在反应15 s时记录240 nm 处吸光度,每隔30 s 测量一次,最终总计测量6 个点,并且重复测量3 次。CAT 活性单位(U)定义为吸光度每分钟降低0.01。CAT 活性单位表示为U/kg。
1.3.4 抗坏血酸、谷胱甘肽过氧化物酶、谷胱甘肽、脱氢抗坏血酸含量的测定
谷胱甘肽(glutathione,GSH)含量的测定:采用Su等[13]的方法建立测定GSH 的反应系统。称量1.0 g 果实样品,加入1.0 mL 经过4°C 预冷的50 g/L 三氯乙酸溶液(含5 mmol/L EDTA-Na2)。冰浴研磨后8 000 r/min离心20 min 得到上清液,上清液用于测定GSH 含量。根据GSH 和二硫代硝基苯甲酸的颜色反应,用分光光度计在412 nm 处测量了反应系统的吸光度。通过对标准曲线中吸光度进行比较,计算出每克果实组织中GSH 含量的降低。GSH 含量单位表示为mmol/kg。
抗坏血酸(ascorbic acid,ASA)含量的测定:根据ASA 具有较强还原力,参考曹建康等[8]的方法测定。1.0 g 果肉放入研钵内,加入2.0 mL 50 g/L 三氯乙酸溶液,在冰浴中进行研磨,12 000 r/min 条件下离心25 min,即可获得用于脱氢抗坏血酸(dehydroascorabate,DHA)和ASA 测定的上清液。向1.0 mL 的上清液中添加1.0 mL 5%TCA,再将无水乙醇、0.5 mL 0.4%的磷酸-乙醇、1.0 mL 0.5%的邻苯二酚-乙醇和0.5 mL 0.03%的三氯化铁-乙醇混合,并将混合物放置于30 ℃进行60 min的保温处理,最终在534 nm 处测量吸光度,计算出ASA 含量。ASA 含量单位表示为g/kg。
脱氢抗坏血酸(dehydroascorbic acid,DHA)含量的测定:采取Chumyam 等[15]方法,利用二硫苏糖醇将DHA还原成ASA 来进行DHA 定量分析。取1.0 mL 上清液与0.5 mL 60 mmol/L 二硫苏糖醇混合,并用0.2 mol/L 磷酸氢二钠-氢氧化钠调节至pH7~8,室温反应10 min。加入0.5 mL 20% 三氯乙酸,pH 值调节为1~2 以测定总抗坏血酸。DHA 含量为总抗坏血酸含量减去ASA含量。DHA 单位为g/kg。
谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)活性测定:GPX 活性采用试剂盒测定。取上清液0.4 mL,分别加入酶管和非酶管中,并将非酶管加热使酶失活,加入1.0 mmol/L GSH 0.4 mL 和经37 ℃预热的0.2 mL 1.5 mmol/L H2O2,立即于37 ℃下反应3 min。再向2 支试管中加入1.67% 偏磷酸沉淀液4.0 mL,2 000 r/min离心10 min,保留上清液。最后向空白管和测定管中加入0.32 mol/L Na2HPO42.5 mL 和二硫代对二硝基苯甲酸0.5 mL,反应5 min,在412 nm 处读取OD 值。酶活单位(U)定义为在25 ℃反应条件下,每克样本每分钟氧化1 nmol GSH。GPX 活性单位为U/g。
1.3.5 微观结构变化
采用透射电子显微镜在3 个不同的时间点(第0天、第75 天和第135 天)观察猕猴桃(包括线粒体和细胞壁)的微观结构。将果实去皮后,用双面刀片从表面切割出2 mm3的立方体,然后固定在含有磷酸盐缓冲液和2.5%戊二醛的溶液中16 h。用0.1 mol/L 磷酸盐缓冲液(pH7.2)冲洗果肉中残留的戊二醛3 次。然后将样品固定在1.0%渗透酸和0.1 mol/L 磷酸盐缓冲液的混合物中。随后用50 mL 30%、50%、70%、80%、90%和100%的乙醇溶液冲洗梯度洗脱。随后样品在55 ℃烘箱用树脂渗透、聚合48 h。使用超薄切片机,将样品精确地分割成薄片,然后进行铀铅双染(醋酸双氧铀和柠檬酸铅)染色处理。最后,用透射电子显微镜观察和拍摄样品。
1.4 统计分析
数据结果用平均值±标准差表示。使用SPSS 软件22.0 分析数据,并使用Origin 绘制图形。采用T检验分析对照组与处理组的差异(P<0.05)。
2 结果
2.1 臭氧处理对呼吸速率和腐烂率的影响
猕猴桃在贮藏过程中呼吸速率和腐烂率的变化见图1。
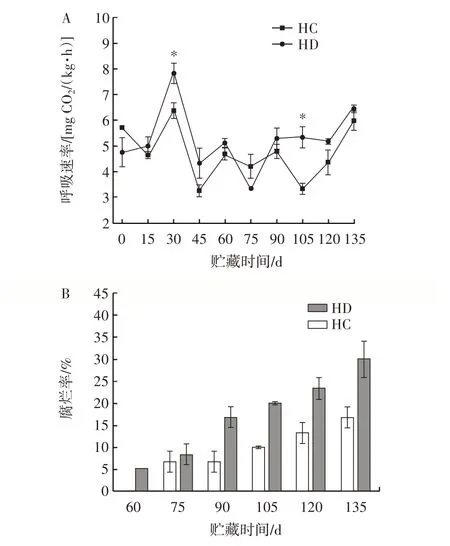
图1 臭氧处理对猕猴桃冷藏期间呼吸速率及腐烂率的影响Fig.1 Effect of ozone treatment on respiration rate and decay rate of kiwifruit during cold storage
由图1A 可知,果实呼吸速率贮藏至30 d 达到峰值,对照组和处理组差异显著(P<0.05)。对照组是处理组的1.23 倍。在贮藏期间,臭氧处理组的呼吸速率总体低于对照组。因此,臭氧处理能够降低猕猴桃的呼吸速率。如图1B 所示,猕猴桃果实贮藏过程中臭氧处理组及对照组的腐烂率都呈现逐渐上升的趋势。在前60 d,对照组及臭氧处理组没有果实腐烂。贮藏60 d,对照组的猕猴桃开始出现腐烂现象,腐烂率为5.0%。结束贮藏时,对照组的腐烂率达30.0%,而臭氧处理组的腐烂率则为16.7%。研究结果显示,臭氧处理能够有效地延缓猕猴桃在贮藏过程中的衰老。
2.2 臭氧处理对H2O2、O2-、MDA 含量及抗氧化酶活性的影响
猕猴桃在收获后出现的氧化应激是猕猴桃保质期缩短的原因之一。活性氧主要包括H2O2和O2-,容易导致脂质中的不饱和脂肪酸过氧化,造成一些毒性和对细胞的损害[16]。猕猴桃在贮藏过程中超氧阴离子含量、过氧化氢含量、丙二醛含量的变化见图2。
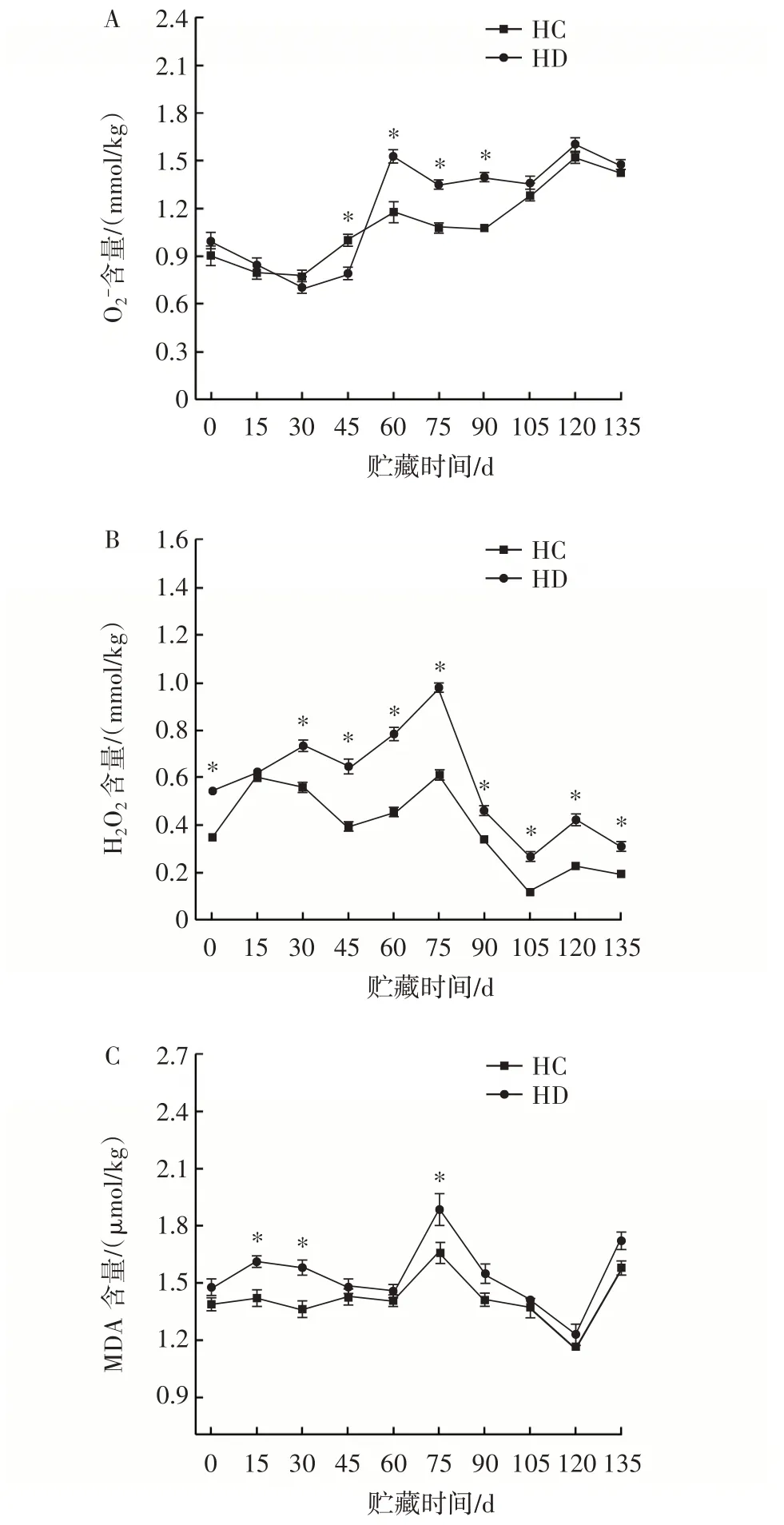
图2 臭氧处理对猕猴桃超氧阴离子含量、过氧化氢含量、丙二醛含量的影响Fig.2 Effect of ozone treatment on superoxide anion content,H2O2 content,and MDA content of kiwifruit
由图2A 和图2B 可知,贮藏期间,经过臭氧处理的猕猴桃的O2-和H2O2水平明显低于对照组,特别是在贮藏60 d 之后。和对照组相比,臭氧处理组的O2-含量在45、60、75、90 d 差异显著(P<0.05)。H2O2含量在75 d 时,对照组是臭氧处理组的1.6 倍,差异达到最大。结果表明,臭氧处理抑制了猕猴桃中ROS 的积累,并将H2O2水平保持在较低水平。另外,ROS 的广泛产生导致膜损伤和脂质过氧化,导致MDA 的产生。MDA 作为植物的脂质过氧化指数,反映了水果收获后的氧化程度。猕猴桃贮藏期间MDA 含量呈先上升后下降再上升趋势(图2 C),臭氧处理组样品MDA 含量低于对照组,且在15、30、75 d 差异显著(P<0.05)。结果表明,臭氧处理可抑制MDA 含量积累,从而延缓果实衰老。
猕猴桃在贮藏过程中过氧化氢酶、超氧化物歧化酶、过氧化物酶活性的变化见图3。

图3 臭氧处理对猕猴桃过氧化氢酶、超氧化物歧化酶、过氧化物酶的影响Fig.3 Effect of ozone treatment on CAT activity,SOD activity,and POD activity of kiwifruit
同时,植物拥有SOD、POD 和CAT 等酶促防御系统,酶促抗氧化系统有助于消除过量的ROS,保护植物细胞免受氧化应激[17]。由图3A 可知,CAT 酶活性在贮藏75~120 d 时,对照组和臭氧处理组差异显著(P<0.05)。在贮藏时期内,臭氧处理组和对照组的SOD 活性总体上逐渐增加(图3B),其中45~75、120 d 差异显著(P<0.05)。SOD 活性在120 d 时达到最大值,臭氧处理组是对照组的1.13 倍。此外,贮藏45 d 后,臭氧处理组猕猴桃的POD 活性显著高于对照组(P<0.05),105 d 达到峰值,臭氧处理组的POD 活性与对照组相比提高9.2%(图3C)。结果表明,贮藏过程中,臭氧处理下猕猴桃的抗氧化酶活性总体上高于对照组的样品,臭氧处理有助于提高猕猴桃果实中抗氧化酶的活性。
2.3 臭氧处理对氧化还原状态及GPX 的影响
ASA 和GSH 有助于维持果实细胞的氧化还原状态[18]。抗坏血酸-谷胱甘肽(ASA-GSH)循环是植物抗氧化代谢的重要途径[18]。谷胱甘肽过氧化物酶是ASAGSH 循环的关键酶,也是线粒体抗氧化系统关键酶。GPX 酶能够有效地防止氧化应激对生物体造成的损害。猕猴桃在贮藏过程中抗坏血酸含量,脱氢抗坏血酸含量、谷胱甘肽含量、谷胱甘肽过氧化物酶活性的变化见图4。
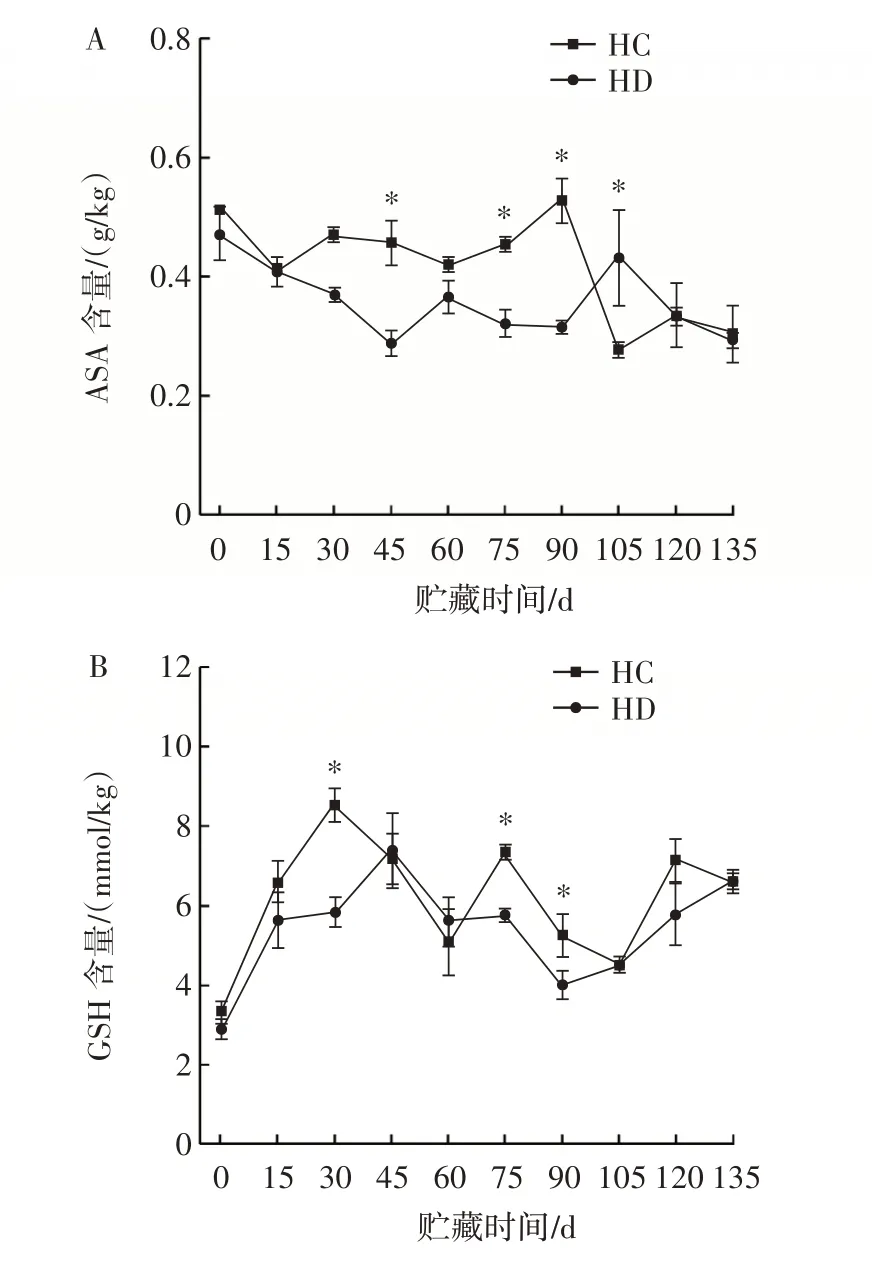
图4 臭氧处理对猕猴桃抗坏血酸含量、谷胱甘肽含量、脱氢抗坏血酸含量、谷胱甘肽过氧化物酶活性的影响Fig.4 Effect of ozone treatment on ASA content,GSH content,DHA content,and GPX activityof kiwifruit
由4A 可知,臭氧处理后贮藏期间猕猴桃ASA 含量总体上高于对照组,其中45、75、90、105 d 两组间差异显著(P<0.05)。臭氧处理组在90 d ASA 含量最高,是对照组的1.67 倍。由4B 可知,在整个贮藏期间,臭氧处理组和对照组的GSH 含量都呈现波动的趋势。臭氧处理组猕猴桃的GSH 含量整体高于对照组。与对照组相比,臭氧处理组在30、75 d 时使GSH 含量分别提高了46.3%、27.0%。结果表明,臭氧处理可使猕猴桃在贮藏过程中保持较高的氧化还原状态。脱氢抗坏血酸是反映细胞氧化状态的另一个重要指标。臭氧处理组样品及对照组样品的DHA 含量波动,总体上臭氧处理组高于对照组,贮藏135 d 时,臭氧处理组DHA含量是对照组的1.26 倍(图4C)。贮藏结束时,臭氧处理组及对照组的GPX 活性相比贮藏开始时低。在贮藏15、45、60、90、120、135 d 时,臭氧处理组活性显著高于对照组(P<0.05)。贮藏135 d 时,臭氧处理组GPX 活性比对照组高19.4%(图4D)。在贮藏过程中,臭氧通过提高猕猴桃中GPX 的活性以及DHA 含量,维持了猕猴桃中ASA 和GSH 的高氧化还原状态,从而增强了ASA-GSH 循环。这些抗氧化成分可以保护植物免受氧化损伤,降低线粒体内ROS 积累。
2.4 臭氧处理对猕猴桃微观结构的影响
臭氧处理后猕猴桃在贮藏过程中超微结构的变化见图5。
在猕猴桃收获后的初期,对比臭氧处理组和对照组的猕猴桃果肉细胞的超微结构没有明显的差异。初期,处理组和对照组果实细胞壁表现出明显的明-暗-明分层结构,其结构完整而清晰可见。暗层为高电子密度的胞间层,膜结构完整,细胞质与内含物被挤成一薄层,紧贴细胞壁(图5A-1、图5B-1)。随着果实的后熟,中期处理组和对照组胞间层都已分解,中间“暗”分区消失(图5A-2、图5B-2)。对照组细胞壁已经开始松弛,胞内物质开始分散。臭氧处理组细胞壁较对照组细胞壁物质结构更加致密。由图5A-3 和图5B-3 可知,果实贮藏后期,对照组和处理组细胞壁周围细胞质与内含物出现降解。结果表明,臭氧处理延缓了采后贮藏期间细胞壁的降解,延缓了猕猴桃的后熟衰老。
线粒体影响果实生长发育,负责进行呼吸和能量转换,并且与果实的衰老过程密切相关[19]。根据图5C-1和图5C-2 可见,在贮藏初期,臭氧处理组的果实线粒体结构清晰可见,没有出现任何破损现象。随着果实的后熟,中期臭氧处理组线粒体较完整,对照组线粒体完整性结构被破坏(图5C-2、图5D-2)。果实贮藏后期,对照组线粒体内含物与原生质互溶,严重空泡化,处理组线粒体内部开始分解,结构相对完整(图5C-3、图5D-3)。结果表明,臭氧处理后猕猴桃内线粒体降解受到抑制。臭氧处理通过调节线粒体发生的呼吸和能量代谢转换和清除线粒体内ROS 来延缓猕猴桃的衰老进程。
3 讨论
采后衰老直接影响水果的感官和营养品质。与传统化学防腐剂相比,臭氧处理不会对产品造成额外的污染,具有高效的保鲜作用,能有效延长果蔬的货架期与贮藏期[20-21]。但臭氧处理容易产生活性氧(ROS)。过量的ROS 在细胞中会发生氧化应激,对植物产生毒性,导致营养价值降低及水果采后保质期缩短[4]。因此,研究臭氧处理后猕猴桃抗氧化状态和氧化应激标志物水平的影响十分必要。在本研究中,低温臭氧处理后猕猴桃ROS 水平的增加显著延缓。此外,臭氧处理通过抑制采后猕猴桃中MDA 的积累,减少了猕猴桃的氧化损伤,延长了猕猴桃的贮藏时间。这一结果与臭氧处理后的草莓和浆果的现象一致[22-24],说明臭氧氧化过程激活了果实在贮藏过程中抗氧化应激的保护机制。
呼吸作用是活性氧产生的主要来源之一[25]。ROS过量可刺激线粒体脂质过氧化,从而对线粒体功能产生不利影响。因此,抑制ROS 的产生和线粒体膜损伤对于延缓衰老和延长货架是必不可少的。O2-是在呼吸复合物I、II 和III 中的氧气电子还原过程中产生的[26]。在臭氧处理后,SOD 作为植物抵御ROS 攻击的第一道防线,使O2-发生歧化反应,转化为O2-和H2O2[27],再由POD 和CAT 进一步将H2O2催化分解成H2O 和O2-,从而减少ROS 的积累[28]。同时,产生的H2O2可以在GSH 存在下被GPX 反应生成H2O[29]。臭氧处理导致ROS 的增加,又会提高抗氧化应激机制相关酶的活性,有助于维持线粒体功能。这与透射电镜观察结果相一致。透射电镜结果发现,在整个贮藏周期,与臭氧相比,对照组果实细胞壁变薄,线粒体的空泡化更加严重。细胞壁结构的变化表明臭氧处理显著抑制了ROS积累,对线粒体内ROS 起到清除作用,不仅减轻线粒体蛋白氧化损伤,且减轻果实细胞膜脂过氧化程度,从而延缓果实衰老,延长贮藏期。
本研究中,臭氧处理果实具有较高的CAT、SOD、GPX 活性,说明酶促抗氧化系统被激活。臭氧处理的果实产生O2-和H2O2的能力显著低于对照样品,这是由于活性氧解毒系统的活性更高。之前报道的臭氧处理诱导抗氧化酶表达并增强抗氧化系统活性的研究一致[18,30]。臭氧可能通过调节ROS 的水平来改变细胞中的氧化还原状态,增加线粒体的活性,诱导编码抗氧化酶和参与抗氧化剂生物合成的酶的基因的表达,导致果实组织具有更高的抗氧化潜力。
4 结论
臭氧处理激活了猕猴桃冷藏过程中抗氧化应激的保护机制。臭氧处理增强了酶促抗氧化代谢相关酶SOD、POD、CAT、GPX 的活性,调控了采后猕猴桃的氧化还原状态(GSH、ASA),从而有效抑制了H2O2、O2-等活性氧的过量产生和MDA 的生成。同时臭氧处理导致ROS 积累的增长,这又激活了对果实氧化应激的防御机制,维持了线粒体功能完整性,提高了采后猕猴桃的抗氧化能力,延迟了采后猕猴桃的成熟老化。本研究结果为进一步研究臭氧技术在猕猴桃品质保鲜和采后贮藏方面的应用提供了理论基础。为了充分解释臭氧化过程后果实中发生的机制,后续研究需要再进一步重视分子水平上的研究,阐明相关基因的功能和机制。

