丙氨酸氨基转移酶≤2倍正常上限值且HBeAg阴性乙型肝炎肝纤维化无创预测模型的建立
陈闪闪,黄海军
(1.蚌埠医科大学 研究生院,安徽 蚌埠 233030;2.浙江省人民医院 感染病科,浙江 杭州 310014)
乙型肝炎病毒(HBV)感染仍然是最严重和最普遍的全球性公共卫生问题之一。全世界大约有20亿人曾感染HBV,其中3.5亿人是慢性感染者[1-2]。HBV慢性感染可能导致持续性或间歇性肝脏损伤,这也增加了其发展为肝硬化、肝细胞癌、终末期肝病和死亡的风险[3-4]。慢性乙型肝炎(CHB)治疗的主要目的是最大限度地长期抑制HBV复制,减轻肝细胞炎症坏死及纤维组织增生,从而降低HBV的传染性和致病性[5]。多个指南推荐丙氨酸氨基转移酶(ALT)≥2倍正常上线值(2ULN)或存在显著肝脏病理改变的CHB病人需抗病毒治疗。因此,早期识别肝纤维化的分期,及时合理的抗病毒治疗可以有效地抑制病毒复制,从而防止疾病进展及并发症的发生[6-7]。
目前,肝活检仍然是评估肝组织学的“金标准”[8]。然而,因其疼痛、出血、感染等相关并发症的出现和取样误差、病人依从性差、组织学动态评估有限等局限性的存在,在临床应用中受到一定的限制[9],因此,寻找用于评估肝纤维化的非侵入性方法受到广泛关注。基于常规实验室参数对肝脏组织学的评估主要集中在无创模型,如天门冬氨酸氨基转移酶(AST)与血小板(PLT)的比率指数APRI[10],基于年龄、ALT、AST和PLT的FIB-4指数[11]等。这些非侵入性预测模型在评估肝纤维化方面具有一定的准确性。 然而,对ALT≤2(2ULN)且HBeAg阴性的乙型肝炎肝纤维化严重程度评估的报道较少。故本研究对ALT≤2ULN且HBeAg阴性的乙型肝炎肝纤维化病人进行研究,分析与肝纤维化相关的独立危险因素,并建立无创预测模型,从而评估肝纤维化的严重程度,为早期合理的抗病毒治疗提供参考依据。
1 资料与方法
1.1 一般资料
收集2014年10月至2020年12月浙江省人民医院感染病科收治入院的ALT≤2ULN且HBeAg阴性的295例CHB病人的临床资料,其中男184例,女111例,年龄(42.8±9.3)岁。所有病人乙型肝炎表面抗原(HBsAg)阳性超过6个月。CHB诊断符合中华医学会2019年《慢性乙型肝炎防治指南(2019更新版)》诊断标准[12]。排除标准:(1)其他形式的慢性病毒性肝炎(丙型肝炎病毒感染、丁型肝炎病毒或人类免疫缺陷病毒合并感染)和其他慢性肝病(自身免疫性肝病、药物性肝损伤、酒精性肝病和非酒精性脂肪肝等);(2)合并有肝肿瘤;(3)肝活检标本不足及临床常规血清生化指标缺失。本研究通过浙江省人民医院伦理委员会审批(审批号:2020QT322),所有病人均签署知情同意书。
1.2 肝活检
所有病人均接受了超声引导下经皮肝穿刺活检,肝活检采用18G活检针进行。活检标本用甲醛溶液固定,常规石蜡包埋,并用苏木精-伊红(HE)染色。标本长度至少为1.5 cm和至少包含6个完整的门静脉束。肝组织病理标本由浙江省人民医院3名病理学专家查阅,均不了解病人的特征。对肝脏坏死性炎症活动(G0~G4)进行组织学分级,对肝纤维化(S0~S4)进行分期。将所有病人分为纤维化轻度组(S≤1)和显著组(S≥2)。根据APASL实践指南,对显著组病人需进行抗病毒治疗[13]。
1.3 实验室检测
肝活检前收集病人实验室指标,包括白细胞(WBC)、PLT、凝血酶原时间(PT)、国际标准化比率(INR)、白蛋白(ALB)、球蛋白(GLB)、ALT、 AST、谷氨酰转肽酶(GGT)、碱性磷酸酶(ALP)、血清总胆红素(TBIL)。应用全自动化学发光免疫分析仪(美国雅培)检测HBsAg、HBeAg及核心抗体(抗-HBC)。用实时聚合酶链反应系统(ABI7300;加利福尼亚州福斯特市应用生物系统)检测血清HBV-DNA水平。其中ALT正常值为≤40 U/L。
1.4 统计学方法
采用t检验和χ2检验,采用logistic回归分析进行多因素分析并构建回归模型,采用受试者工作特征曲线(ROC)评估模型的诊断价值。
2 结果
2.1 一般资料的单因素分析
295例病人中肝组织纤维化轻度组(S≤1)94例,显著组(S≥2)201例,单因素分析发现,年龄、PT、PLT、GGT、INR、WBC、TBIL、ALB、GLB、ALP组间差异均无统计学意义(P>0.05)。ALT、AST、抗-HBC和HBV-DNA水平显著组均高于轻度组,差异有统计学意义(P<0.05~P<0.01)(见表1)。

表1 一般资料的单因素分析
2.2 CHB肝纤维化多因素分析
将单因素分析具有统计学意义的变量(ALT、AST、抗-HBC和HBV-DNA)纳入多因素logistic回归分析。因变量赋值为轻度=0,显著=1。结果发现AST和抗-HBC与显著纤维化有关。AST和抗-HBC水平升高可能是ALT≤2ULN且HBeAg阴性的肝纤维化病人的独立危险因素。将筛选出的独立预测指标建立回归模型:Y=0.042×AST+0.435×抗-HBC-4.835(见表2)。
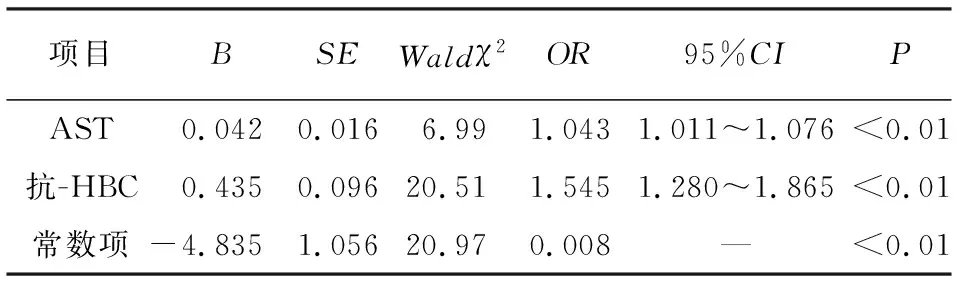
表2 ALT≤2ULN且HBeAg阴性的CHB病人显著肝纤维化的多因素logistic回归分析
2.3 ROC曲线评估模型的诊断性能
结果显示,该预测模型的AUC为0.721(95%CI:0.660~0.782,P<0.01)。在约登指数最大点处,该无创模型诊断显著肝纤维化的敏感性为60.0%,特异性为74.5%(见图1)。该模型的AUC值高于各独立预测因素AST(AUC=0.645,95%CI:0.577~0.714)和抗-HBC(AUC=0.684,95%CI:0.618~0.749)(P<0.01)(见表3)。该无创预测模型对ALT≤2ULN且HBeAg阴性的乙型肝炎显著肝纤维化的诊断性能优于独立预测指标。


表3 ALT≤2ULN且HBeAg阴性的CHB病人显著肝纤维化独立预测因素与模型的ROC曲线分析
3 讨论
长期HBV感染可以引起一系列肝脏疾病,肝纤维化是疾病进展的重要病理生理过程。肝纤维化也进一步增加了发展为肝硬化、肝细胞癌和终末期肝病的风险[3-4,6,14],因此,准确评估肝纤维化的严重程度对控制疾病进展及预后至关重要。近年来,多数非侵入性模型已被建立,常用于肝纤维化和肝硬化的评估[15-17]。在本研究中,我们通过建立一个无创性模型来预测ALT≤2ULN且HBeAg阴性肝纤维化的严重程度,以指导此类病人尽早行抗病毒治疗。
根据美国肝病学会实践指南,HBV-DNA≥2 000 IU/mL且ALT≤2ULN的HBeAg阴性病人应接受抗病毒治疗[13]。早期及时的抗病毒治疗可以使肝纤维化得到改善和逆转[12,18]。虽然肝穿刺活检是评估肝脏组织学的“金标准”,但由于其本身是一种侵入性检查,在临床应用中受到限制[9,19]。另有研究[20]显示,血脂水平也会影响肝纤维化的评估,对于不能行病理检查的病人应注意检测血脂水平,因此,很多学者试图通过血清学指标建立可以准确、快速评估肝纤维化程度的无创性方法。目前普遍用于预测显著肝纤维化的无创模型为APRI,敏感度为65.1%,特异度为77.8%,AUC为0.720[10]。
本研究基于常规血清学标志物构建一个非侵入性、可重复性的模型,用于预测ALT≤2ULN且HBeAg阴性的CHB病人肝纤维化的严重程度。通过logistic回归分析发现,AST和抗-HBC是ALT≤2ULN且HBeAg阴性的乙型肝炎肝纤维化的独立预测因素。基于这2项指标构建一个非侵入性预测模型,并经ROC曲线进行验证,其AUC为0.721(95%CI:0.660~0.782,P<0.01)。在约登指数最大点,该无创模型诊断显著肝纤维化的预测效果优于AST和抗-HBC两个独立指标。
有研究[16]报道,AST水平作为预测显著纤维化的独立危险因素,随肝纤维化程度的加重AST水平也随之升高,本研究与其一致。另有研究[21- 22]显示,AST水平的升高与晚期肝纤维化有关。在本研究中,AST水平比ALT水平能更好地预测显著纤维化,且随纤维化程度的加重,AST水平也显著升高。
抗-HBC作为HBV感染的一种血清学标志物,对评估显著肝纤维化及重度肝脏炎症具有较高的诊断价值[23-24]。本研究发现抗-HBC是ALT≤2ULN且HBeAg阴性CHB病人显著肝纤维化的独立预测因子,在显著肝纤维化病人中抗-HBC水平更高。有研究[21]同样发现,随着肝纤维化程度的加重,抗-HBC的水平逐渐升高。血清抗-HBC是HBV感染史上较为敏感的标志物,HBV感染初期HBsAg出现后,很快血清中就会检测出抗-HBC抗体[23],但其在肝纤维化中的作用仍需进一步研究。
本研究具有一定的局限性。首先,本研究是一项单中心回顾性研究,病例数相对较少,未对多中心病例进行验证。其次,本研究结果未与其他无创方法进行比较,应结合其他方法对不同肝纤维化分期的病例进行比较验证,确认该无创预测模型的诊断准确性以及评估对抗病毒治疗的有效性,从而减少临床肝活检的需要。最后,经多变量分析出的独立预测因素在肝纤维化中的作用机制并未进行进一步的研究。
综上所述,本研究发现AST和抗-HBC是ALT≤2 ULN且HBeAg阴性的CHB肝纤维化的影响因素,基于两项指标构建的无创预测模型对识别显著肝纤维化具有较高的诊断价值。

