绝经后女性不同部位骨密度及FRAX®预测值与BMI的相关性分析
吴 婉,郦忆文,梁 冰,王 旸,曹玉茹,王 涛
(蚌埠医科大学第一附属医院1.全科医学科,2.风湿免疫科,安徽 蚌埠 233004)
骨质疏松症(OP)是一种以骨量低,骨组织微结构损坏,导致骨脆性增加,易发生骨折为特征的全身性骨病[1]。根据我国首次居民OP流行病学调查研究[2]发现,女性OP的患病率高于同龄男性,50岁以上女性人群OP患病率为32.1%,而65岁以上女性人群中,OP患病率达51.6%,OP已经成为影响我国居民骨骼健康的重要问题。骨质疏松性骨折(OF)是OP病人发展到一定阶段的并发症,是指受到轻微创伤或日常活动中即发生的骨折[1],是骨强度下降和骨脆性增加导致的后果,其中最常见的是椎体骨折,最严重的则是髋部骨折。OP的诊断主要依赖于骨密度(BMD)测定(即骨密度降低程度达到或超过同性别、同种族健康成人的骨峰均值2.5个标准差),但是BMD仅能反映大约70%的骨强度。有研究[3]发现,大多数骨折发生在骨量减少人群中,甚至骨量正常人群中也可发生骨折。仅基于BMD的干预阈值并不能以骨折高风险人群为最佳目标[4-6],但是这却为开发骨折风险评估工具提供了基础。其中,骨折风险评估工具(FRAX®)是目前应用最为广泛的骨折风险预测工具。FRAX®是由英国谢菲尔德大学骨骼疾病代谢中心开发建立的骨折预测模型,用于评估研究对象的骨折概率。本研究通过比较绝经后女性不同部位的BMD及FRAX®预测值与体质量指数(BMI)的相关性及在不同BMI分组之间的差异,探讨FRAX®评估我国绝经后女性骨折风险的预测价值,为国内OP的防治提供一定的参考价值。
1 对象与方法
1.1 研究对象
纳入2020年9月至2021年8月于蚌埠医科大学第一附属医院就诊并行双能X线骨密度仪(DXA)检查的绝经后女性人群作为研究对象。纳入标准:自然绝经>1年的女性;自愿参加本次研究。排除标准:已接受有效抗骨质疏松治疗的人群;各种疾病终末期病人;精神障碍,无法配合者。本研究均取得研究对象的知情同意权。经筛选,本研究共纳入研究对象313例。
1.2 研究方法
1.2.1 一般临床资料的收集 收集所有研究对象的一般临床资料,包括姓名、年龄、身高、体质量及临床危险因素(CRFs)。其中CRFs包括脆性骨折史、父母髋部骨折史、目前是否抽烟、过量饮酒史(每日乙醇摄取量超过3个单位,每个单位乙醇量相当于10 mL或8 g纯乙醇)、应用肾上腺糖皮质激素史(如果该研究对象目前正口服肾上腺糖皮质激素,或曾经口服过肾上腺糖皮质激素超过3个月以上,并且每日波尼松龙剂量≥5 mg或同等剂量其他肾上腺糖皮质激素)、类风湿关节炎病史以及其他继发性骨质疏松病史(1型糖尿病、成年成骨不全症、未治疗的长期甲状腺机能亢进、性腺机能减退或绝经年龄<45岁、慢性营养不良或吸收不良以及慢性肝病)。
1.2.2 BMI分组 根据中国人标准对受试者进行分组:BMI<18.5 kg/m2为体质量过轻组,18.5~<24.0 kg/m2为体质量正常组,24.0~<28.0 kg/m2为超重组,≥28.0 kg/m2为肥胖组。
1.2.3 BMD检测 所有研究对象均采用美国Hologic公司生产的Discovery-Wi型DXA测定股骨颈、全髋及腰椎(L1~4)BMD,并记录相应的T值,T值=(BMD所测值-BMD正常青年人群参考值)÷SD正常青年人群参考值(该机器参考数据库:White Female)。对于绝经后女性,根据WHO推荐的诊断标准,基于DXA测量的中轴骨(腰椎、股骨颈或全髋):T值≥-1 SD表示骨量正常;>-1~<-2.5 SD表示骨量减少;≤-2.5 SD或>-2.5 SD但有脆性骨折史表示OP;≤-2.5 SD伴脆性骨折史表示严重OP。
1.2.4 FRAX®骨折风险评估 登录http://www.shef.ac.uk/FRAX,使用亚洲-中国大陆模式,录入CRFs和股骨颈T值(可选的输入变量),测评系统将自动生成主要骨质疏松性骨折(脊椎、前臂、髋骨或肩部骨折)的概率(PMOF)和髋部骨折的概率(PHF) 。根据2017原发性OP诊疗指南,PHF≥3%或PMOF≥20%,为OP高危人群[1]。
1.3 统计学方法
采用单因素方差分析和最小显著性差异法(LSD)检验、非参数(Kruskal Wallis)检验、Pearson相关性分析和Pearman相关性分析。
2 结果
2.1 一般资料
共纳入研究对象313例,平均年龄(63.4±10.2)岁,平均身高(154.7±6.3)cm,平均体质量(57.8±10.1)kg,平均BMI(24.1±3.6)kg/m2。既往骨折史69例(22.0%),父母髋部骨折史18例(5.8%),目前正在吸烟7例(2.2%),应用糖皮质激素史60例(19.2%),类风湿关节炎65例(20.8%),过量饮酒史4例(1.3%),继发性骨质疏松50例(16%)。其中过早绝经43例,慢性肝病7例,双侧卵巢切除5例。
股骨颈、全髋、腰椎3个部位的平均BMD、T值及OP诊断率见表1,联合股骨颈T值的FRAX®预测值和未联合股骨颈T值的FRAX®预测值及骨折高危人群的诊断率见表2。

表1 不同部位的BMD及OP诊断率(n=313)
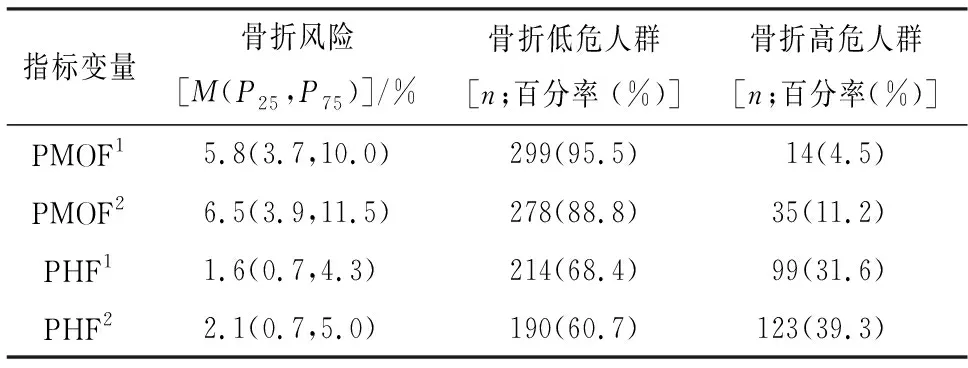
表2 FRAX®预测值及评估骨折高危人群的诊断率
2.2 不同部位的BMD、T值及FRAX®预测值与BMI的相关性
2.2.1 不同BMI分组的股骨颈、全髋及腰椎3个部位的BMD、T值差异及与BMI的相关性分析 绝经后女性人群,股骨颈、全髋及腰椎3个部位BMD及T值均有随着BMI等级的增加而增加(P<0.01)(见表3)。3个部位BMD、T值与BMI的相关性分析显示,二者与BMI均呈正相关(r=0.289、0.357、0.340、0.290、0.365、0.346,P<0.01)。

表3 不同BMI组间不同部位的BMD及T值的比较
2.2.2 FRAX®预测值(PMOF和PHF)在不同BMI分组间的差异 PMOF1中,超重组和肥胖组的骨折风险低于体质量过轻组(P<0.05);PMOF2中,肥胖组骨折风险低于体质量正常组(P<0.05);PHF1中,体质量正常组、超重组、肥胖组的骨折风险均低于体质量过轻组(P<0.05);PHF2中,超重组、肥胖组的骨折风险均低于体质量过轻组和体质量正常组(P<0.05)。体质量过轻组中,未联合股骨颈T值的FRAX®预测值>联合股骨颈T值的FRAX®预测值;体质量正常组和超重组中,联合股骨颈T值的FRAX®预测值>未联合股骨颈T值的FRAX®预测值;肥胖组中,二者预测值相似(见表4)。

表4 不同BMI组间的FRAX®预测值比较[M(P25,P75)]
2.2.3 FRAX®预测值与股骨颈T值及BMI的相关性分析 FRAX®预测值在联合或不联合股骨颈T值的情况下与BMI均呈较低强度的负相关(P<0.01),与股骨颈T值呈中高度的负相关(P<0.01)(见表5)。

表5 BMI、股骨颈T值与FRAX®预测值相关性(rs)
2.3 与BMI相关的FRAX®在不同T值情况下计算的10年骨折概率
假设受试者参数:绝经后女性,身高为160 cm,年龄65岁,无骨折危险因子。根据BMI和T值进行分组研究。通过对模拟人型进行分析,发现随着T值的下降,骨折风险呈指数增长。当T值≤-2.5 SD时,PMOF不一定>20%,PHF不一定>3%;因此,按照PMOF≥20%或PHF≥3%,作为干预阈值,低估了我国人群的骨折风险(见表6)。

表6 FRAX®计算的在不同T值情况下与BMI相关的10年骨折发生率(%)
3 讨论
FRAX®测评系统的开发是根据人口数量,通过对来自欧洲、北美、亚洲和澳大利亚的病人的研究而开发形成的,将骨折概率与多种临床危险因子以及股骨颈的BMD相结合。此系统模型的建立是基于被调查人口的真实股骨颈密度数据,FRAX®所得T指数是基于20~29岁高加索女性股骨颈BMD的参考数据,T指数会随着测试技术和测试位置的不同而变化[7-8]。输入股骨颈BMD时,该模型可以自动生成一个对应的T值,而相同的BMD数值在不同部位及不同性别中所得出的T值是不同的。本研究中的T值是Hologic机器参考白人女性数据库自动生成的。T值是根据受检者的BMD与正常青年人群的 BMD 均值和标准差计算获得的,所以基于DXA的T值取决于选用的参考数据库,这可能会影响OP的诊断结果。
研究发现BMD及T值与BMI呈正相关,高BMI人群通常具有更高的BMD。与栗敏等[9]研究结果相似。体质量作为一种长期机械负荷,增加对骨骼、肌肉的刺激,有助于促进骨重建,进而增加BMD,减少骨质疏松发生率。其机制可能是:高BMI可以增加骨骼应力,骨骼承受的机械负荷一方面通过Wnt/β-catenin信号通路,促进成骨细胞增殖分化,从而刺激成骨[10];另一方面通过调节核因子-kB(NF-kB)受体激活物配基(RANKL)/护骨素(OPG)系统,抑制破骨细胞分化,从而减少骨吸收[11]。
本研究发现腰椎BMD>全髋BMD>股骨颈BMD,而全髋T值>股骨颈T值>腰椎T值,与王丽萍等[12 -13]研究结果相似。通过对BMI进行分组发现,肥胖组全髋T值>腰椎T值>股骨颈T值。可能由于肥胖人群腹主动脉钙化、骨质增生等因素,导致腰椎T值偏高。所以联合非股骨颈部位BMD进行FRAX®计算,其预测值可能会出现一定的偏差,建议代入T值进行比较分析。
未联合股骨颈T值的FRAX®预测值低于联合股骨颈T值的FRAX®预测值。将BMI分组比较发现,体质量过轻组中,未联合股骨颈T值的FRAX®预测值得出的骨折风险更高。体质量正常组和超重组中,联合股骨颈T值的FRAX®预测值得出的骨折风险更高。肥胖组中,二者得出的骨折风险相似。其原因可能如下:未联合股骨颈T值的FRAX®预测值与BMI的相关性显著,而联合股骨颈T值的FRAX®预测值与BMD的相关性更为显著。通过对FRAX®模型进行数值模拟时发现:该模型可能存在一个默认的BMD数值,该数值与BMI、年龄、性别相关。由于实测BMD值与默认BMD值可能存在一定的差异,并且随着差异程度的不同,其占比权重也不相同。当实测BMD值高于默认BMD值时,BMD是保护因素,FRAX®计算出的骨折风险降低,反之,BMD是一种危险因素,FRAX®计算出的骨折风险随之增加。并且随着BMD的下降,其骨折风险呈指数增长。
当T值≤-2.5 SD时,PMOF不一定>20%,PHF不一定>3%,因此,按照PMOF≥20%或PHF≥3%,作为干预阈值,难以筛选出低骨量高危骨折人群,并且严重低估了发生PMOF的风险,国内多项研究[14-21]也表明FRAX®低估了我国人群的骨折风险。赵啸等[18]认为其原因是由于PMOF是根据瑞典人的椎体和髋部比例得出的,亚洲人椎体骨折患病率最高,而白种人髋部骨折患病率最高,由于比例倒置,低估了亚洲人群发生PMOF的风险[22]。笔者认为可以在DXA仪器缺乏地区,使用不联合T值的FRAX®模型,得出的数值与联合T=-2.5 SD的FRAX®预测值比较,超过该数值可认为骨折高危人群,及时进行干预。目前,国内尚没有这方面的研究,下一步的计划按照此方向开展研究,探索其可行性及应用价值。
本研究为回顾性研究,收集的研究对象临床危险因子(父母髋部骨折史、激素服用史)可能存在回忆性障碍,记忆不清的均选择否;本研究人群一部分来自风湿科,患有类风湿关节炎、系统性红斑狼疮、强直性脊柱炎等风湿疾病,并且长期应用激素,使得本研究人群BMD较国内其他研究数值偏低,得出的骨折风险相对较高。以及样本量不足等是该研究的不足之处。
综上所述,体质量过低的人群BMD通常较低,使用FRAX®评估其发生骨折的风险相对较高[23-24]。按照我国骨质疏松指南推荐的干预阈值,FRAX®模型难以筛选出低骨量骨折高危人群,并且严重低估了发生PMOF的风险。我国应尽快完善OF的大样本流行病学研究,制定适合我国国情的干预阈值。

