动脉瘤性蛛网膜下腔出血患者TGF-β/Smads 信号转导通路与认知功能障碍的关系
黄 毅 ,黄永健 ,麦 玲 ,罗 婷
(1)崇左市人民医院神经外科;2)手术麻醉科;3)供给室,广西 崇左 532200)
动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)是脑血管疾病常见并发症,具有较高致残率、病死率,据相关资料显示,aSAH 病死率高达45%,约30%幸存患者中伴有不同程度的认知功能障碍,严重影响患者生命健康、生活质量[1-3]。转化生长因子β(transforming growth factor β,TGF-β)/苏氨酸激酶受体(aerinethreonine kinase receptors,Smads)信号转导通路可调控多种细胞生长分化、凋亡、周期等生物学过程,对维持机体正常发育、动态平衡具有重要作用[4-5]。既往研究显示,TGF-β1 与aSAH 发生发展密切相关,并与患者慢性脑积水形成显著有关[6],但关于TGF-β/Smads 信号转导通路对患者认知功能障碍的研究尚未报道。本研究通过选取崇左市人民医院100 例aSAH 患者,检测患者外周血内TGF-β/Smads 信号转导通路相关因子表达,并分析其与认知功能障碍的关系,旨在为临床研究aSAH 提供参考。
1 资料与方法
1.1 临床资料
纳入标准[7]:经CT、MRI 等检查确诊aSAH;均为单个病灶;均为首次发生蛛网膜下腔出血;临床资料详细完整。排除标准:aSAH 前即存在认知功能障碍者;合并颅内占位病变;血液系统疾病;严重肝肾等功能衰竭;近1 a 内服用过认知功能障碍药物。本研究经崇左市人民医院医学伦理委员会审核批准(201802012)。
根据上述纳入、排除标准回顾性选取2018年10 月至2022 年3 月崇左市人民医院收治的100 例aSAH 患者的临床资料进行研究,其中男57 例,女43 例;年龄21~83(53.99±13.80)岁;动脉瘤大小2.5~9.3(6.48±1.43)mm;基础疾病:10 例糖尿病,26 例高血压;19 例烟酒史;Hunt-Hess 分级[8]:1~2 级86 例,3~4 级14 例;改良FISHER 分级[9]:1~2 级71 例,3~4 级29 例;动脉瘤位置:前循环87 例,后循环13 例。
1.2 认知功能障碍评估标准
出血后3 个月,由经过专业培训的神经科医师采用蒙特利尔认知评估量表(montreal cognitive assessment acale,MoCA)评估患者认知功能[10],主要包括执行功能、记忆力、语言、视功能技能、抽象思维、注意力、计算和定向力8 个领域,总分30 分,≥26 分为正常,即无认知功能障碍(n=46);<26 分存在认知功能障碍(n=54)。
1.3 实时荧光定量PCR 法检测TGF-β、Smad1、Smad3、Smad7 mRNA 水平
入组时,取2 组患者静脉血,与1 mL TRIzol试剂(赛默飞世尔)混合,用于抽提总RNA,检测其浓度、纯度,利用Prime Script RT 试剂盒(赛默飞世尔)合成cDNA,并以cDNA 为模板,用Premix Ex Taq 试剂盒(赛默飞世尔)于ABI 7 500 PCR 仪(赛默飞世尔)上进行扩增反应,反应体系为5.0 µL SYBR Green Mix,1.0 µL cDNA,上、下游引物各0.8 µL,ddH2O 补足至20.0 µL。采用2-ΔΔCT法计算TGF-β、Smad1、Smad3、Smad7 mRNA表达水平。引物由上海吉玛设计合成,序列见表1。

表1 引物序列Tab.1 Primer sequences
1.4 观察指标
(1)统计2 组临床资料,包括性别、年龄、受教育年限、糖尿病、高血压、烟酒史、Hunt-Hess 分级、改良FISHER 分级、动脉瘤大小与位置、治疗方式、术后血性脑脊液引流方式及并发症发生率;(2)比较2 组患者外周血TGF-β、Smad1、Smad3、Smad7 mRNA 表达水平;(3)分析 TGF-β、Smad1、Smad3、Smad7 mRNA 与aSAH 患者认知功能障碍的关系;(4)采用受试者工作特征曲线(receiver operating characteristic,ROC)分析TGF-β、Smad1、Smad3、Smad7 mRNA对aSAH 患者认知功能障碍的预测价值。
1.5 统计学处理
所有数据采用Excel 2016 收集整理,并用统计学SPSS 24.0 软件处理,计数资料用n(%)表示,χ2检验;符合正态分布的计量资料用()表示,2 组间比较采用独立样本t检验;Logistic 进行多因素分析;采用ROC 曲线评估TGF-β、Smad1、Smad3、Smad7 mRNA 对aSAH 患者认知功能障碍的预测价值。P<0.05 为差异有统计学意义。
2 结果
2.1 2 组临床资料比较
2 组性别、年龄、受教育年限、糖尿病、高血压、烟酒史、Hunt-Hess 分级、改良FISHER分级、动脉瘤大小与位置、治疗方式、术后血性脑脊液引流方式及并发症发生率比较,差异无统计学意义(P>0.05),见表2。
表2 2 组临床资料比较[()/n(%)](1)Tab.2 Comparison of clinical data between the two groups[()/n(%)](1)
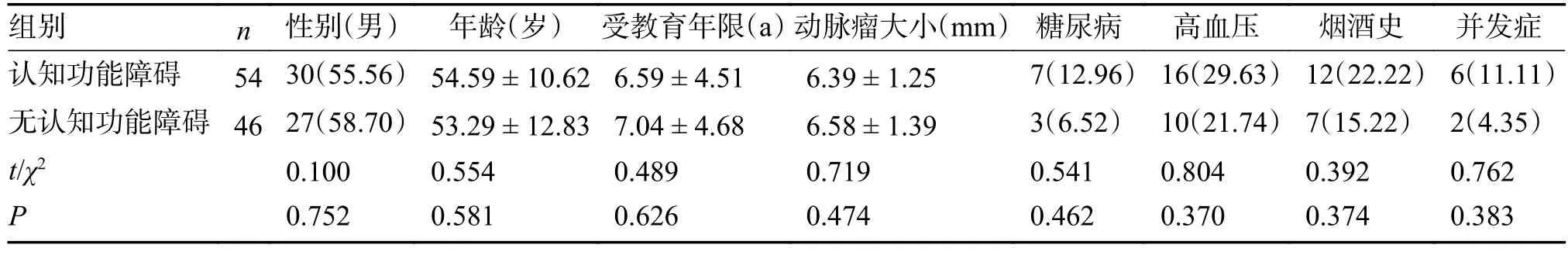
表2 2 组临床资料比较[()/n(%)](1)Tab.2 Comparison of clinical data between the two groups[()/n(%)](1)
表2 2 组临床资料比较[()/n(%)](2)Tab.2 Comparison of clinical data between the two groups[()/n(%)](2)

表2 2 组临床资料比较[()/n(%)](1)Tab.2 Comparison of clinical data between the two groups[()/n(%)](1)
表2 2 组临床资料比较[()/n(%)](3)Tab.2 Comparison of clinical data between the two groups[()/n(%)](3)
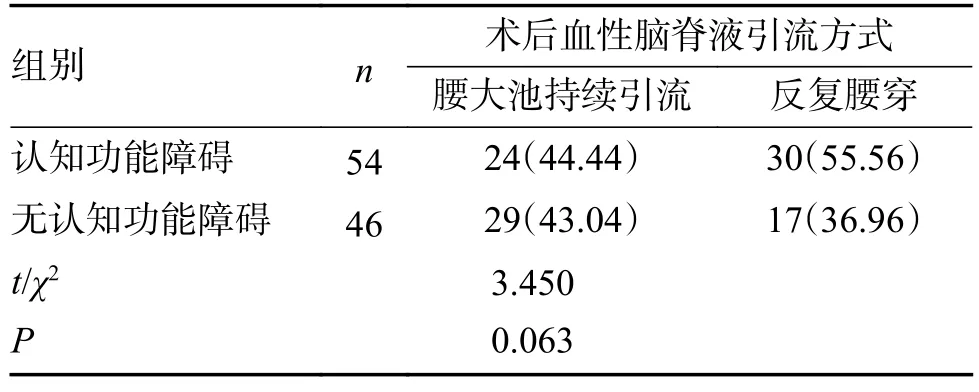
表2 2 组临床资料比较[()/n(%)](1)Tab.2 Comparison of clinical data between the two groups[()/n(%)](1)
2.2 2 组TGF-β/Smads 信号转导通路相关因子表达比较
认知功能障碍组患者外周血TGF-β、Smad1、Smad3、Smad7 mRNA 表达水平较无认知功能障碍组高,差异有统计学意义(P<0.05),见表3。
表3 2 组TGF-β/Smads 信号转导通路相关因子表达比较()Tab.3 Comparison of expression of factors related to TGF-β/Smads signaling pathway between the two groups()
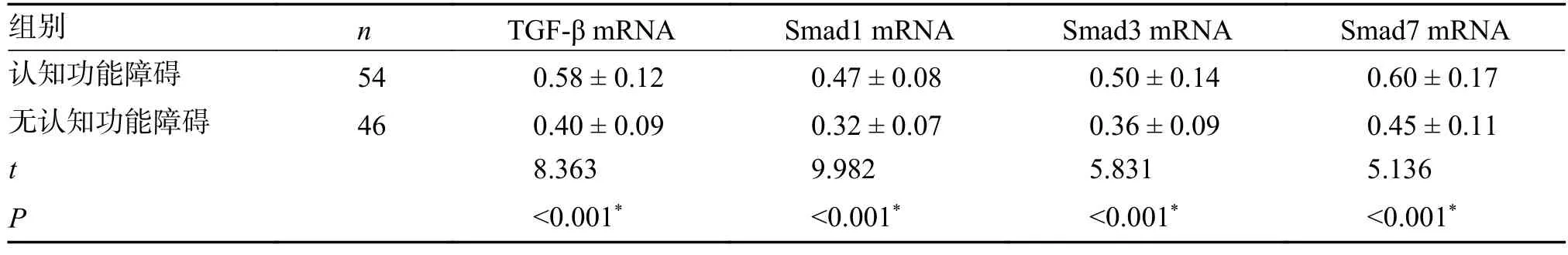
表3 2 组TGF-β/Smads 信号转导通路相关因子表达比较()Tab.3 Comparison of expression of factors related to TGF-β/Smads signaling pathway between the two groups()
*P <0.05。
2.3 TGF-β/Smads 信号转导通路相关因子与aSAH 患者认知功能障碍的关系
以aSAH 患者有无认知功能障碍为因变量,TGF-β、Smad1、Smad3、Smad7 mRNA 为自变量,赋值情况见表4,Logistic 回归分析显示,TGF-β、Smad1、Smad3、Smad7 mRNA 与aSAH 患者认知功能障碍独立相关(P<0.05),见表5。

表4 赋值量表Tab.4 Assignment Scale

表5 TGF-β/Smads 信号转导通路相关因子与aSAH 患者认知功能障碍的关系Tab.5 Relationship between factors related to TGF-β/Smads signaling pathway and cognitive dysfunction in patients with aSAH
2.4 TGF-β/Smads 信号转导通路相关因子预测aSAH 患者认知功能障碍的ROC 曲线
绘制TGF-β/Smads 信号转导通路相关因子预测aSAH 患者认知功能障碍的ROC 曲线,TGFβ、Smad1、Smad3、Smad7 mRNA 单独预测aSAH 患者认知功能障碍的曲线下面积(Area under the curve,AUC)值分别为0.704、0.817、0.738、0.706,联合预测AUC 为0.918,P均 <0.001,见表6、图1;进一步对各预测方案预测价值比较显示,TGF-β/Smads 信号转导通路相关因子TGFβ、Smad1、Smad3、Smad7 mRNA 联合预测的AUC 明显优于单独指标,P均 <0.05,见表7。

图1 TGF-β/Smads 信号转导通路相关因子预测aSAH患者认知功能障碍的ROC 曲线Fig.1 ROC curves of TGF-β/Smads signaling pathwayrelated factors predicting cognitive dysfunction in patients with aSAH
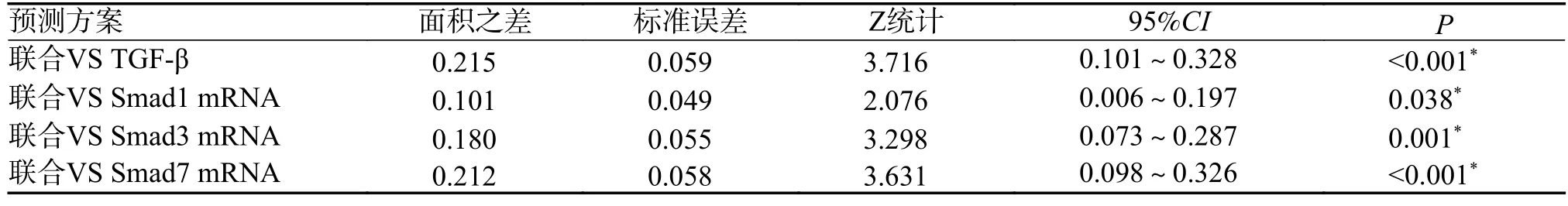
表7 TGF-β/Smads 信号转导通路相关因子联合与单独预测方案预测价值比较Tab.7 Comparison of predictive value of TGF-β/Smads signaling pathway-related factors in combination with separate prediction schemes
3 讨论
研究发现,aSAH 存在不同程度的认知功能障碍,其发生机制可能与脑水肿、颅内压升高、脑部缺血缺氧、脑血流灌注压降低、脑血流速度降低等有关,患者脑部组织生理病理性改变可引起海马组织微循环障碍,导致海马神经元细胞坏死、凋亡,进而影响患者认知功能[11-12]。本研究显示,100 例aSAH 患者认知功能障碍发生率为54.0%,这高于温玉东等[13]研究结果,可能与患者年龄、样本量、Hunt-Hess 分级、改良FISHER分级等有关。
研究表明,TGF-β/Smads 信号转导通路可参与中枢神经系统、脑血管等疾病发生[14-15]。TGFβ 是细胞因子超家族成员,广泛存在哺乳动物体内,目前已被发现有6 个亚型,包括TGF-β1、TGF-β2、TGF-β3、TGF-β1β2、TGF-β4 及TGF-β5,而各种亚型具有高度同源性,功能作用形似,可介导参与多种细胞增殖分化、凋亡、自噬、纤维化和炎症反应等[16]。TGF-β 是该信号转导通路的关键因子,可激活下游丝裂原活化蛋白激酶、细胞外信号调节激酶、磷脂酰肌醇激酶、氨基末端激酶及Smad 等因子,进而参与细胞生物学过程[17-19]。Smad 是TGF-β 下游蛋白,正常情况下TGF-β 以失活形式存在细胞质内,在一些因素刺激下(如脂多糖),神经细胞可激活TGF-β 聚合形成异四聚体,TGF-β 发生磷酸化,通过招募Smad 形成复杂的复合物进入细胞核内,从而抑制或激活目的基因转录,参与疾病发展[20]。研究显示,中枢神经细胞损伤后,可激活海马神经细胞、小胶质细胞,促进大量炎症因子生成,TGF-β1 表达增高,加重机体神经功能损伤,导致机体认知功能障碍[21]。动物研究发现,通过构建蛛网膜下腔出血大鼠模型,发现大鼠脑组织TGF-β1 蛋白表达上调,加重大鼠神经功能缺损、增加血脑屏障通透性,并促进神经细胞凋亡[22]。本研究发现,认知功能障碍组患者外周血内TGFβ mRNA 表达水平高于无认知功能障碍,且TGFβ mRNA 与aSAH 患者认知功能障碍密切相关,故笔者推测TGF-β 变化可能与aSAH 患者认知功能障碍有关,考虑其作用机制可能为外周血内TGF-β mRNA 表达水平升高,导致患者脑组织局部缺血缺氧,促进神经细胞发生炎症反应,加重神经组织损伤,进而参与aSAH 发展,但该结果仅为推测,有待临床进一步研究证实。
Smad 蛋白家族成员众多,在神经系统疾病、脑血管疾病激活TGF-β/Smads 信号转导通路,可减轻神经元细胞损伤,从而提高机体抗炎、抗凋亡作用[23-24]。研究发现,Smad3 基因缺陷帕金森病模型内,可促进炎症因子聚集在小鼠神经元细胞、星形胶质细胞,并表现出小鼠海马功能障碍[25]。本研究发现,认知功能障碍患者外周血内Smad1、Smad3、Smad7 mRNA 表现趋势与TGFβ mRNA 表现一致,表明 Smad1、Smad3、Smad7 可参与aSAH 患者认知功能障碍进展。可能是因为外周血内TGF-β mRNA 表达水平升高,激活下游Smad1、Smad3、Smad7 mRNA 表达水平,进而加重神经细胞损伤,引起患者神经功能障碍,可共同参与aSAH 发展,但具体机制尚不明确,有待进行下一步探究。
本研究通过绘制ROC 曲线,发现TGF-β/Smads 信号转导通路相关因子联合预测aSAH 患者认知功能障碍的AUC 优于单独预测,具有一定诊断效能,提示各相关因子联合预测aSAH 患者认知功能障碍的效能优于单独预测。
综上可知,aSAH 患者外周血内TGF-β/Smads信号转导通路相关因子高表达,提示该通路可能与患者认知功能障碍有关,可用于辅助临床预测aSAH 术后认知功能障碍。本研究尚存在一定局限性,仅分析该信号通路转录层面的数据,未进行蛋白、因子等分析,有待临床扩大样本量,做进一步研究证实。

